- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Осадительное титрование презентация
Содержание
- 1. Осадительное титрование
- 2. Осадительное титрование серебра: Ag+ + Br-
- 3. Осадительное титрование Аргентометрия Ag+ +
- 4. Осадительное титрование Аргентометрия Метод Мора
- 5. Осадительное титрование Аргентометрия Метод Мора
- 6. Осадительное титрование Аргентометрия Метод Фольгарда
- 7. Осадительное титрование Аргентометрия Метод Фаянса-Ходакова
- 8. Осадительное титрование Аргентометрия Метод Фаянса-Ходакова
- 9. Осадительное титрование Меркурометрия Hg22+
- 10. Осадительное титрование Меркурометрия Индикаторы: 3Hg22+
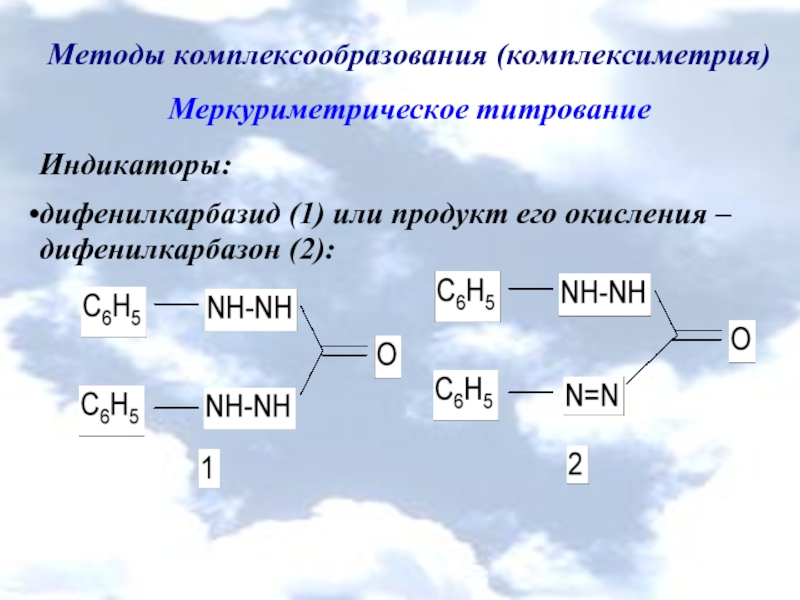
- 11. Методы комплексообразования (комплексиметрия) Меркуриметрическое титрование
- 12. Методы комплексообразования (комплексиметрия) Меркуриметрическое титрование
- 13. Методы комплексообразования (комплексиметрия) Меркуриметрическое титрование
- 14. Методы комплексообразования (комплексиметрия) Меркуриметрическое титрование
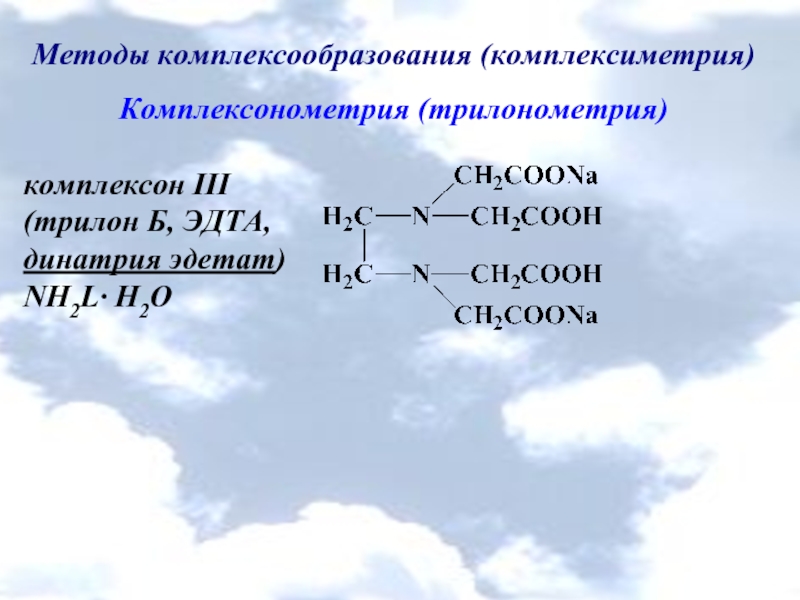
- 15. Методы комплексообразования (комплексиметрия) Комплексонометрия (трилонометрия) Нитрилотриуксусная
- 16. Методы комплексообразования (комплексиметрия) Комплексонометрия (трилонометрия)
- 17. Методы комплексообразования (комплексиметрия) Комплексонометрия (трилонометрия)
- 18. Методы комплексообразования (комплексиметрия) Комплексонометрия (трилонометрия)
- 19. Методы комплексообразования (комплексиметрия) Комплексонометрия (трилонометрия)
- 20. Методы комплексообразования (комплексиметрия) Комплексонометрия (трилонометрия)
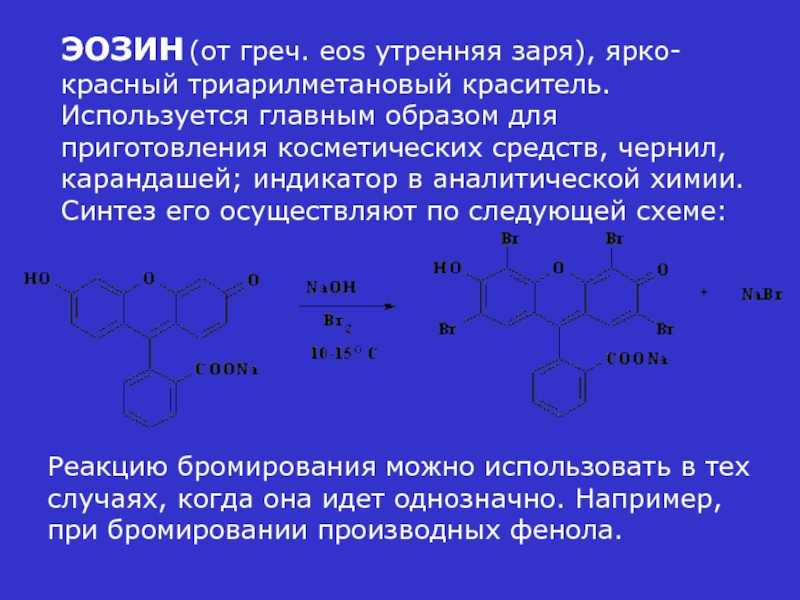
- 21. ЭОЗИН (от греч. eos утренняя заря), ярко-красный
Слайд 2Осадительное титрование
серебра:
Ag+ + Br- → AgBr↓
ртути:
Hg22+ + 2Cl- → Hg2Cl2↓
бария:
Ba2+ +
свинца:
Pb2+ + CrO42- → PbCrO4↓
цинка:
3Zn2+ 2K+ + 2[Fe(CN)6]2- → Zn3K2[Fe(CN)6]2↓
Слайд 4Осадительное титрование
Аргентометрия
Метод Мора
Hal- + Ag+ → AgHal↓ (белый)
ПР(AgCl) = 1,78·10-10 S(AgCl)
CrO42- + 2Ag+→ Ag2CrO4↓ (кирпично-красный)
ПР(Ag2CrO4) = 2,1·10-12 S(Ag2CrO4) = 8,1·10-5 моль/л.
Слайд 5Осадительное титрование
Аргентометрия
Метод Мора
Условия титрования:
2Ag2CrO4↓ + 2Н+ → 4Ag+ + Cr2O7 2-
Ag+ + OH- → AgOH↓
2AgOH↓ → Ag2O↓ + H2O
Возможности метода:
NH+ + H2O ↔ NH3·H2O + H+
Слайд 6Осадительное титрование
Аргентометрия
Метод Фольгарда
(тиоцианатометрия, роданометрия)
Ag+ + NCS– → AgNCS↓
Fe3+ + 3NCS– →
Условия титрования:
Fe3+ + H2O ↔ FeOH2+ + H+
2Fe3+ + 2I– → 2Fe2+ + I2
AgCl↓ + NCS– → AgNCS↓ + Cl–
Слайд 7Осадительное титрование
Аргентометрия
Метод Фаянса-Ходакова
HInd ↔ H+ + Ind–
Ag+ + I– → AgI↓
первичный
m[AgI]·nI–
вторичный (внешний) адсорбционный слой:
{m[AgI]·nI– ·(n – x)K+}x–
Слайд 8Осадительное титрование
Аргентометрия
Метод Фаянса-Ходакова
первичный адсорбционный слой:
m[AgI]·nAg+
вторичный (внешний) адсорбционный слой:
{m[AgI]·nAg+ ·(n – x)NO3-}x+
Слайд 9Осадительное титрование
Меркурометрия
Hg22+ + 2Cl- → Hg2Cl2↓
Hg22+ + 2Br- → Hg2Br2↓
Hg22+ + 2I- → Hg2I2↓
Титрант метода:
Hg2+ + Hg → Hg22+
Слайд 10Осадительное титрование
Меркурометрия
Индикаторы:
3Hg22+ + 2[Fe(NCS)3] → 3[Hg(NCS)2] + 2Fe3+
дифенилкарбазон (1%-ный раствор в
C6H5-NH-NH-C-N=N-C6H5
║
O
Слайд 11Методы комплексообразования (комплексиметрия)
Меркуриметрическое титрование
Hg2+ + 2Cl– → [HgCl2]
Индикаторы:
Na2[Fe(CN)5NO] → 2Na+
Hg2+ + [Fe(CN)5NO]2– → Hg[Fe(CN)5NO]↓
Слайд 12Методы комплексообразования (комплексиметрия)
Меркуриметрическое титрование
Индикаторы:
дифенилкарбазид (1) или продукт его окисления – дифенилкарбазон
Слайд 13Методы комплексообразования (комплексиметрия)
Меркуриметрическое титрование
Определение хлорид- и бромид-ионов:
Hg2+ + Cl- → [HgCl]+
[HgCl]+
Hg2+ + [HgCl2] → 2[HgCl]+
Определение йодид-ионов:
Hg2+ + 4I– → [HgI4]2–
[HgI4]2– + Hg2+ → 2HgI2
Слайд 14Методы комплексообразования (комплексиметрия)
Меркуриметрическое титрование
Определение тиоционат-ионов:
2NCS– + Hg2+ → [Hg(NCS)2]
3Hg22+ + 2[Fe(NCS)3]
Определение солей ртути (ІІ):
Hg2+ + 2NCS– → [Hg(NCS)2]
Fe3+ + 3NCS– → [Fe(NCS)3]
Слайд 15Методы комплексообразования (комплексиметрия)
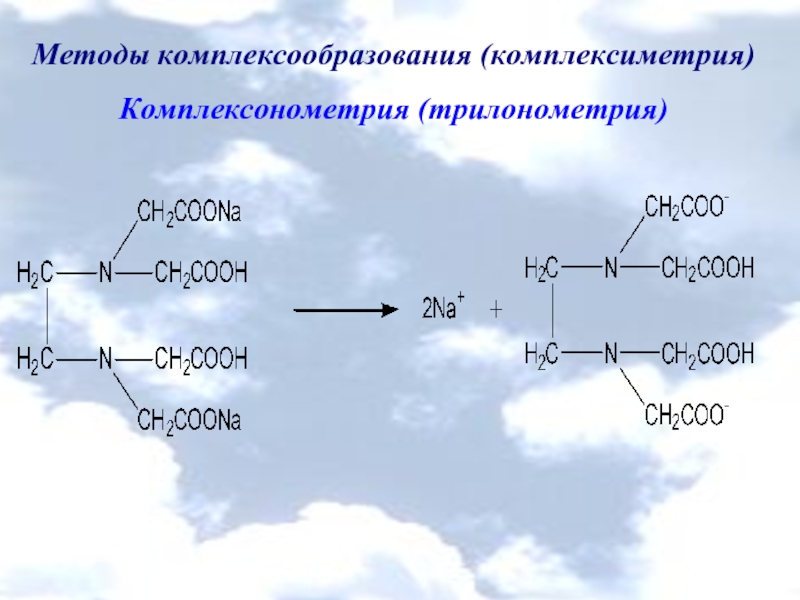
Комплексонометрия (трилонометрия)
Нитрилотриуксусная кислота
комплексон І (H3L)
Этилендиаминтетрауксусная кислота
комплексон ІІ (H4L)
Слайд 16Методы комплексообразования (комплексиметрия)
Комплексонометрия (трилонометрия)
комплексон ІІІ
(трилон Б, ЭДТА,
динатрия эдетат)
NH2L∙ H2O
Слайд 19Методы комплексообразования (комплексиметрия)
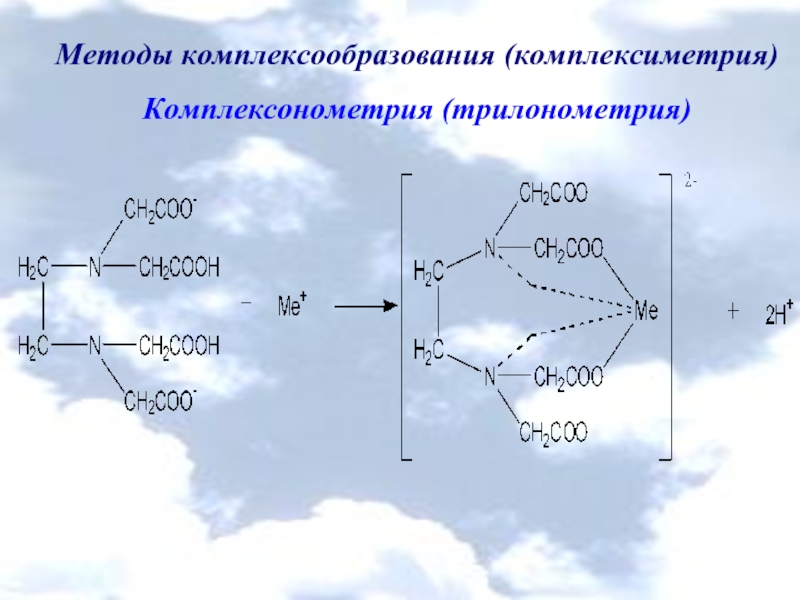
Комплексонометрия (трилонометрия)
H2L2- + Me2+ → [MeL]2- + 2H+
H2L2- +
H2L2- + Me4+ → [MeL] + 2H+
Me2+ + H2Ind- → [MeInd]- + 2H+
[MeInd]- + H2L2- → [MeL]2- + H2Ind-
Слайд 20Методы комплексообразования (комплексиметрия)
Комплексонометрия (трилонометрия)
Обратное титрование:
Me2+ + H2L2- → [MeL]2- + 2H+
Изб.
Заместительное титрование:
Me2+ + [MgL]2- → [MeL]2- + Mg2+
Me2+ + [H2L]2- → [MgL]2- + 2H+
Слайд 21ЭОЗИН (от греч. eos утренняя заря), ярко-красный триарилметановый краситель. Используется главным
Реакцию бромирования можно использовать в тех случаях, когда она идет однозначно. Например, при бромировании производных фенола.





![Осадительное титрованиеАргентометрияМетод Фольгарда(тиоцианатометрия, роданометрия)Ag+ + NCS– → AgNCS↓ Fe3+ + 3NCS– → [Fe(NCS)3]Условия титрования:Fe3+ + H2O](/img/tmb/3/247589/bf25090fdf8712b58b1c7e15ce7ff221-800x.jpg)
![Осадительное титрованиеАргентометрияМетод Фаянса-ХодаковаHInd ↔ H+ + Ind–Ag+ + I– → AgI↓первичный адсорбционный слой:m[AgI]·nI–вторичный (внешний) адсорбционный](/img/tmb/3/247589/904248fe6d9a3c7afda173e118d626d0-800x.jpg)
![Осадительное титрованиеАргентометрияМетод Фаянса-Ходаковапервичный адсорбционный слой:m[AgI]·nAg+вторичный (внешний) адсорбционный слой:{m[AgI]·nAg+ ·(n – x)NO3-}x+](/img/tmb/3/247589/e0180f31f509a3fac5164150855421d3-800x.jpg)

![Осадительное титрованиеМеркурометрияИндикаторы:3Hg22+ + 2[Fe(NCS)3] → 3[Hg(NCS)2] + 2Fe3+дифенилкарбазон (1%-ный раствор в 95%-ном этаноле)C6H5-NH-NH-C-N=N-C6H5 ║](/img/tmb/3/247589/bfa94937858d5f3d18d6b489cf18c933-800x.jpg)
![Методы комплексообразования (комплексиметрия)Меркуриметрическое титрованиеHg2+ + 2Cl– → [HgCl2]Индикаторы: Na2[Fe(CN)5NO] → 2Na+ + [Fe(CN)5NO]2–Hg2+ + [Fe(CN)5NO]2–](/img/tmb/3/247589/2b11e0f555826e6575c6a327628b4c05-800x.jpg)
![Методы комплексообразования (комплексиметрия)Меркуриметрическое титрованиеОпределение хлорид- и бромид-ионов:Hg2+ + Cl- → [HgCl]+[HgCl]+ + Cl- → [HgCl2]Hg2+](/img/tmb/3/247589/8be9caf4d5fcb76fecdfbbcba582f223-800x.jpg)
![Методы комплексообразования (комплексиметрия)Меркуриметрическое титрованиеОпределение тиоционат-ионов:2NCS– + Hg2+ → [Hg(NCS)2]3Hg22+ + 2[Fe(NCS)3] → 3[Hg(NCS)2] + 2Fe3+Определение](/img/tmb/3/247589/fb5ac1f79df67d797bd3de0f1a47836d-800x.jpg)

![Методы комплексообразования (комплексиметрия)Комплексонометрия (трилонометрия)H2L2- + Me2+ → [MeL]2- + 2H+H2L2- + Me3+ → [MeL]- +](/img/tmb/3/247589/9911315462699b81e9cef55d47dfcf1c-800x.jpg)
![Методы комплексообразования (комплексиметрия)Комплексонометрия (трилонометрия)Обратное титрование:Me2+ + H2L2- → [MeL]2- + 2H+Изб. H2L2- + Mg2+ →](/img/tmb/3/247589/be0997cbf4b7140c1ddabe313da60b6d-800x.jpg)