На капителях колонн и лабиринтах исполинской люстры, свисающей с почерневшего потолка, шуршали нетопыри и летучие собаки. С ними Модест Матвеевич боролся. Он поливал их скипидаром и креозотом, опы-лял дустом, опрыскивал гексахлораном, они гибли ты-сячами, но возрождались десятками тысяч.
Стругацкие А. и Б.
Понедельник начинается в субботу.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Органическая химия презентация
Содержание
- 1. Органическая химия
- 2. Органическая химия – это химия соединений углерода
- 3. Производные углеводородов Содержат кроме
- 4. Галогенпроизводные углеводородов производные углеводовородов,
- 5. Этапы изучения Классификация Строение Номенклатура Изомерия Физические свойства Химические свойства Получение Применение
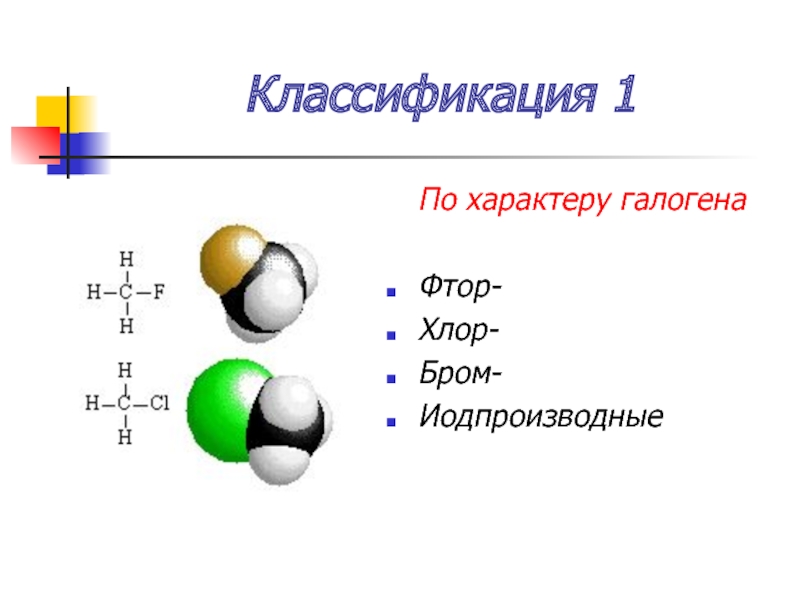
- 6. Классификация 1 По характеру галогена Фтор- Хлор- Бром- Иодпроизводные
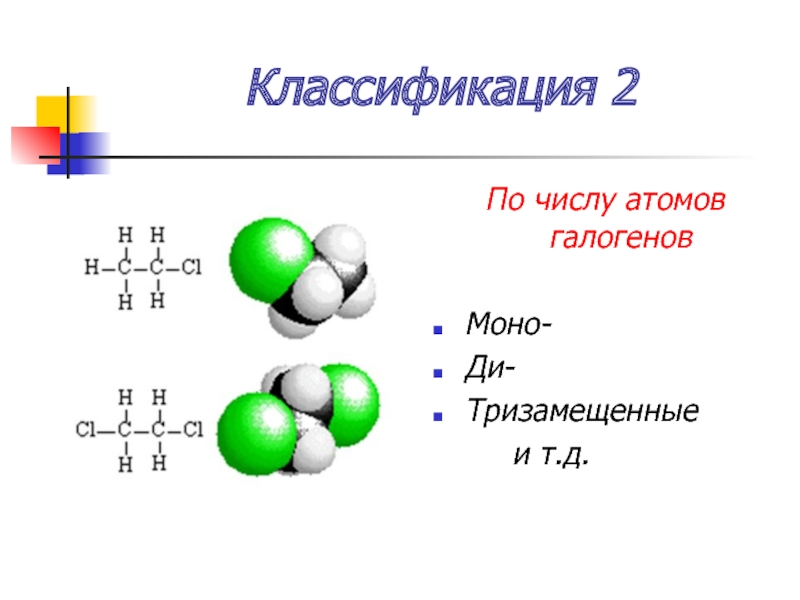
- 7. Классификация 2 По числу атомов галогенов
- 8. Классификация 3 По природе углеводородного радикала Алифатические (предельные и непредельные) Алициклические Ароматические
- 9. Общая формула Углеводород СxHy
- 10. Классификация 4 для производных алканов По характеру
- 11. Классификация 5 по химической активности Алкилгалогениды
- 12. Строение хлорэтана
- 13. Строение хлорэтана Хлор обладает
- 14. Строение винилхлорида
- 15. Строение винилхлорида Более прочная связь С
- 16. Строение винилхлорида
- 17. Строение винилхлорида
- 18. Строение аллилхлорида
- 19. Строение аллилхлорида В чем причина
- 20. Строение аллил-катиона
- 21. Строение аллил-катиона
- 22. Номенклатура Систематическая (заместительная) Локант
- 23. Номенклатура 3-хлорпропен (зам)
- 24. Номенклатура Задание: Назовите вещество по систематической номенклатуре
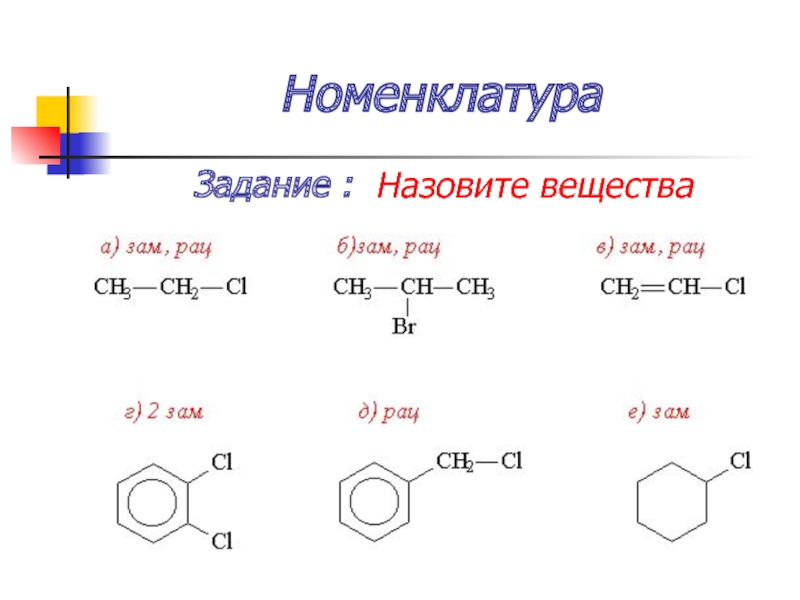
- 25. Номенклатура Задание : Назовите вещества
- 26. Изомерия Структурная А) характерная для углеводородов
- 27. Изомерия Задание Составьте формулы всех возможных изомеров
- 28. Изомерия монобромпроизводных алканов Изомерия углеродного скелета
- 29. Изомерия пространственная Какие классы галогенпроизводных могут существовать
- 30. Изомерия пространственная Задание: Определите простейшее монохлорпроизводное, способное существовать в виде цис-транс-изомеров
- 31. Изомерия пространственная Задание: Определите простейшее дихлорпроизводное, способное существовать в виде цис-транс-изомеров
- 32. Изомерия структурная Задание: Определите вещество, являющееся для
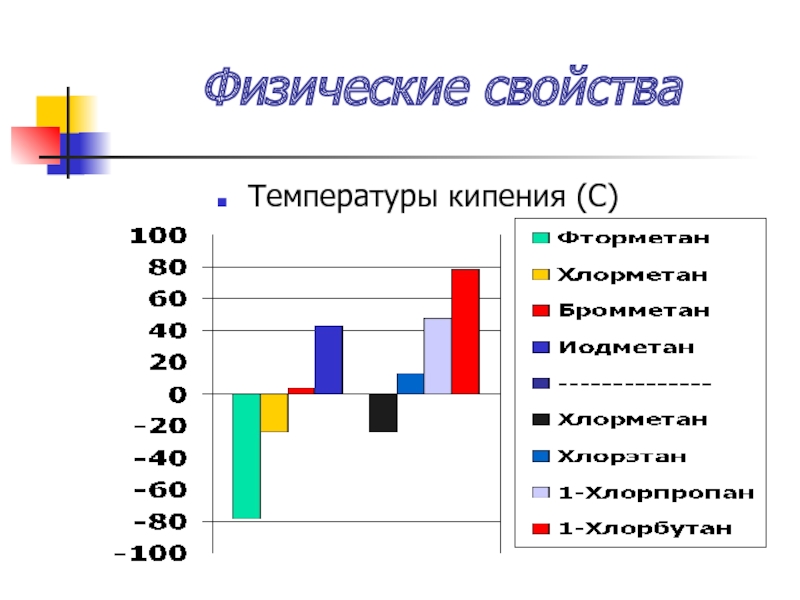
- 33. Физические свойства Температуры кипения (С)
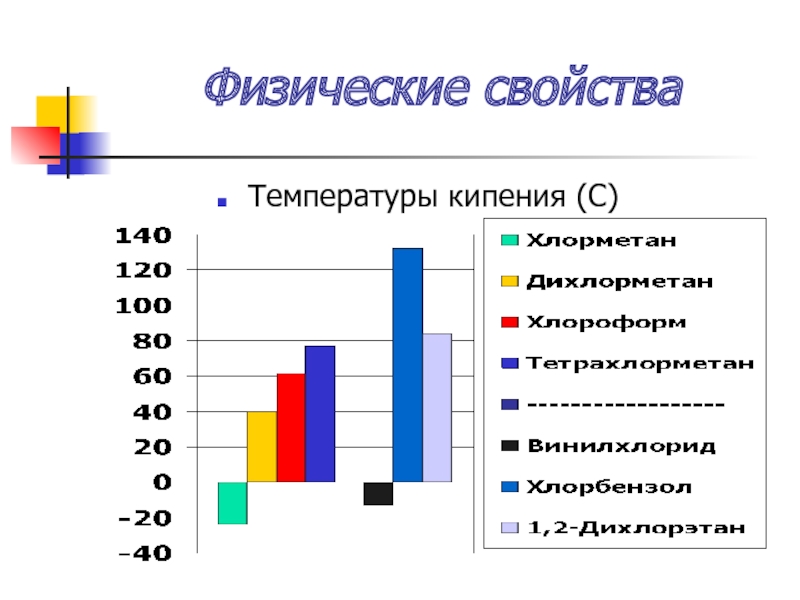
- 34. Физические свойства Температуры кипения (С)
- 35. Физические свойства Температуры кипения увеличиваются: А) с
- 36. Физиологическое действие Почти все токсичны (гексахлоран, ДДТ
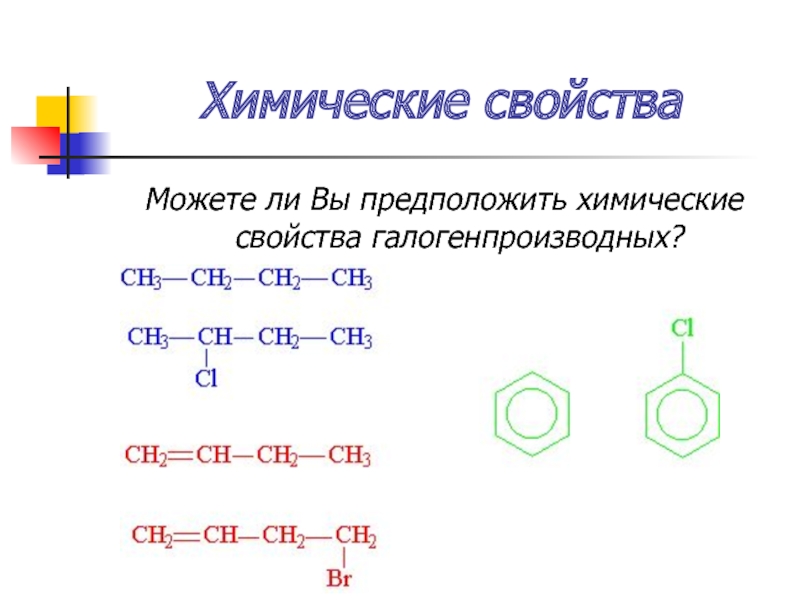
- 37. Химические свойства Можете ли Вы предположить химические свойства галогенпроизводных?
- 38. Химические свойства А) реакции углеводородных радикалов Те
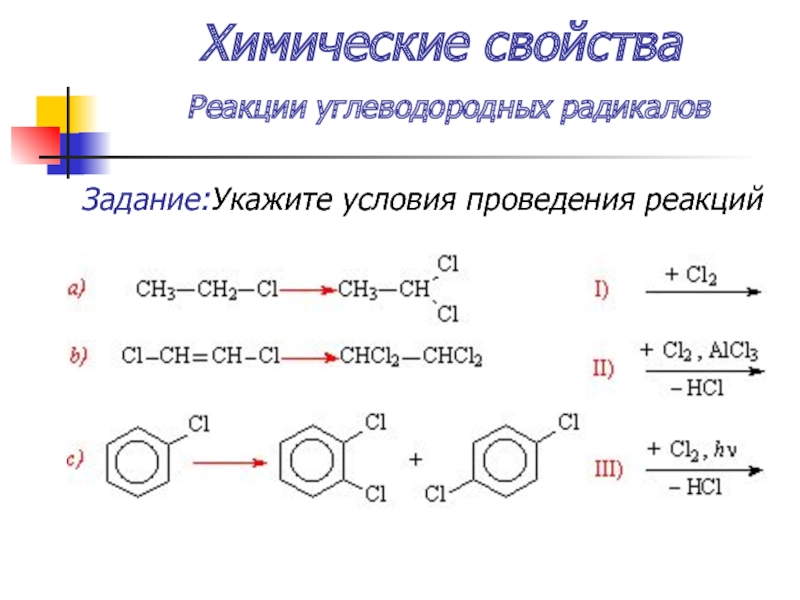
- 39. Химические свойства Реакции углеводородных радикалов Задание:Укажите условия проведения реакций
- 40. Химические свойства Реакции с участием галогена Активность
- 41. Химические свойства Механизм р-ции нуклеофильного замещения (SN)
- 42. Химические свойства
- 43. Химические свойства
- 44. Химические свойства SN1: 1) двухстадийный процесс и рацемизация
- 45. Химические свойства замещение (SN) Гидролиз А) алкилгалогенидов
- 46. Химические свойства замещение (SN) Гидролиз Б) винилгалогенидов
- 47. Химические свойства замещение (SN) Гидролиз моногалогенпроизводных –
- 48. Химические свойства замещение (SN) Предположите продукты реакций
- 49. Химические свойства
- 50. Химические свойства замещение (SN) Гидролиз дигалогенпроизводных –
- 51. Химические свойства замещение (SN) Предположите продукты реакций
- 52. Химические свойства замещение (SN) Гидролиз тригалогенпроизводных –
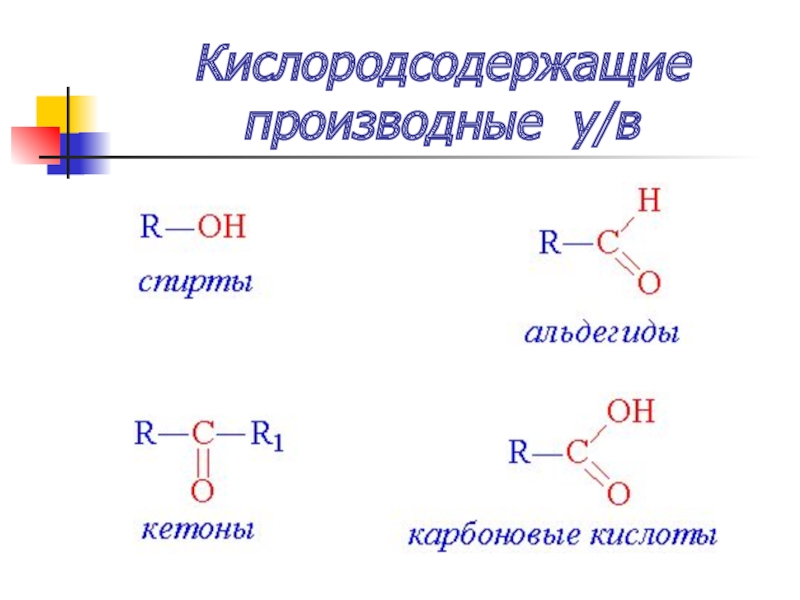
- 53. Кислородсодержащие производные у/в
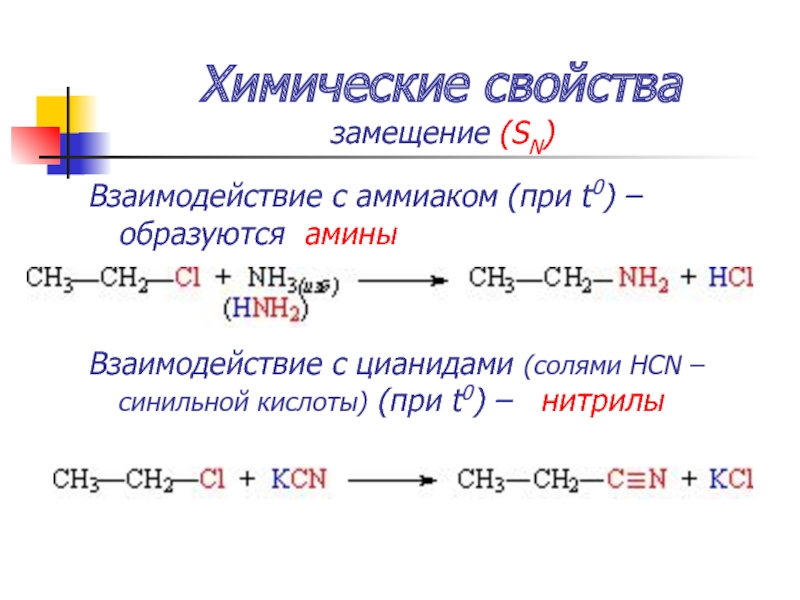
- 54. Химические свойства замещение (SN) Взаимодействие с аммиаком
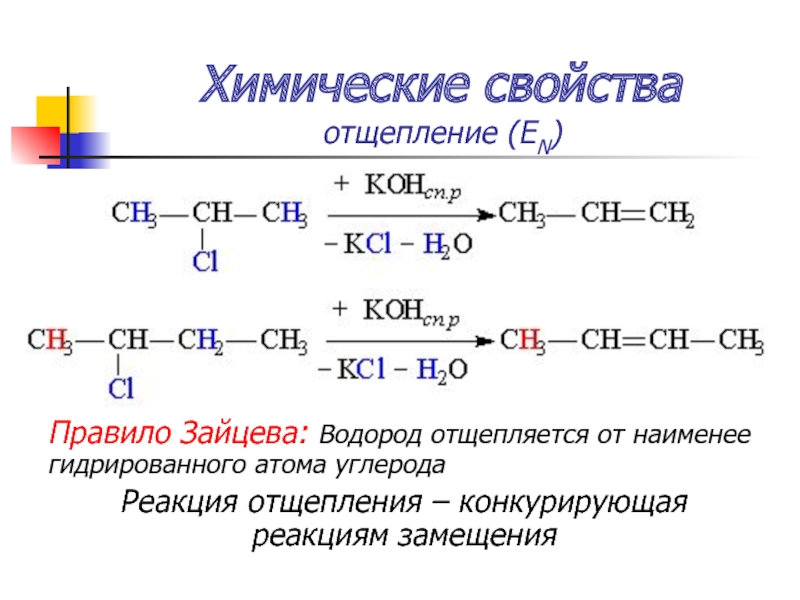
- 55. Химические свойства отщепление (ЕN) Задание: Составьте
- 56. Химические свойства отщепление (ЕN) Правило Зайцева:
- 57. Химические свойства окисление Горят плохо,
- 58. Получение Из алканов и циклоалканов Из алкенов
- 59. Применение Анестезия С2H5Cl и наркоз CF3CHClBr (ранее
- 60. Получение Задание: Составьте уравнения возможных реакций образования
Слайд 1Все, чему мне случилось быть здесь свидетелем, не было мне совершенно
незнакомым, о подоб-ных случаях я где-то что-то читал и теперь вспомнил…
Стругацкие А. и Б.
Понедельник начинается в субботу.
Слайд 2Органическая химия – это химия соединений углерода
Органическая химия – это химия
углеводородов и их производных
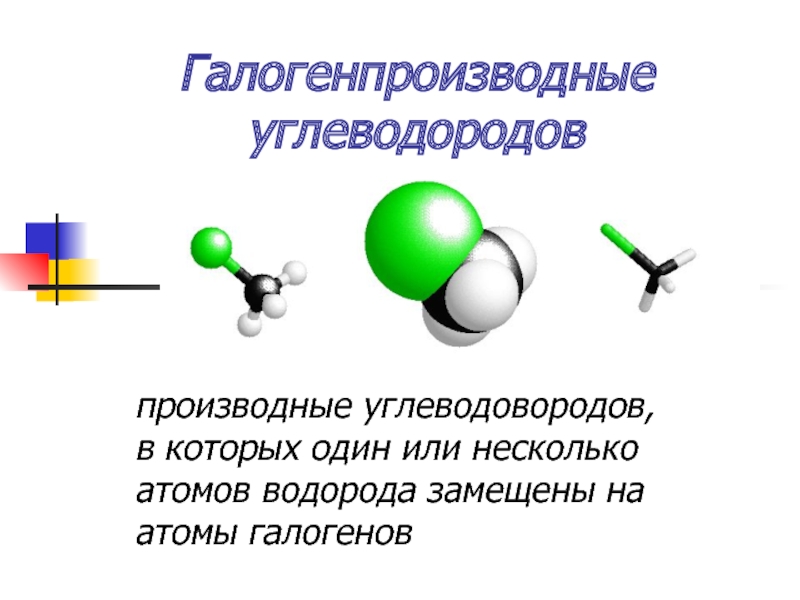
Слайд 4Галогенпроизводные
углеводородов
производные углеводовородов, в которых один или несколько атомов водорода замещены
на атомы галогенов
Слайд 5Этапы изучения
Классификация
Строение
Номенклатура
Изомерия
Физические свойства
Химические свойства
Получение
Применение
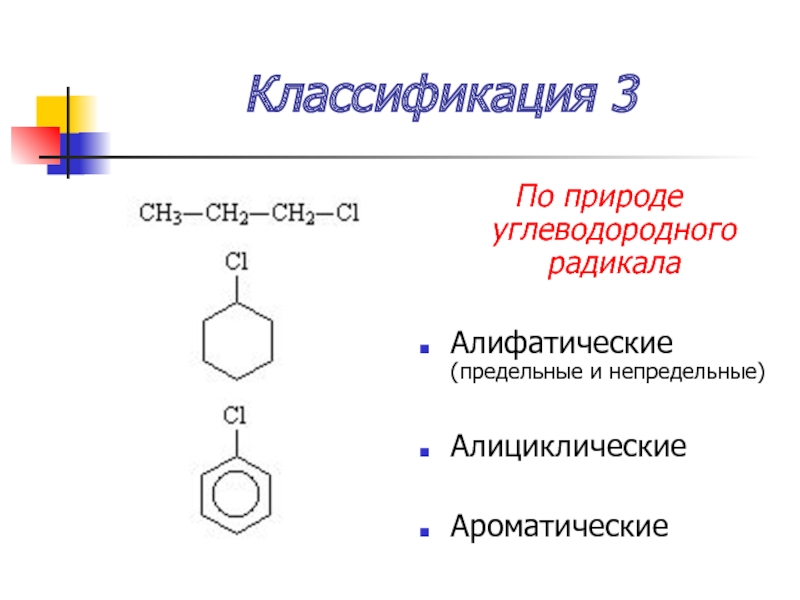
Слайд 8Классификация 3
По природе углеводородного радикала
Алифатические (предельные и непредельные)
Алициклические
Ароматические
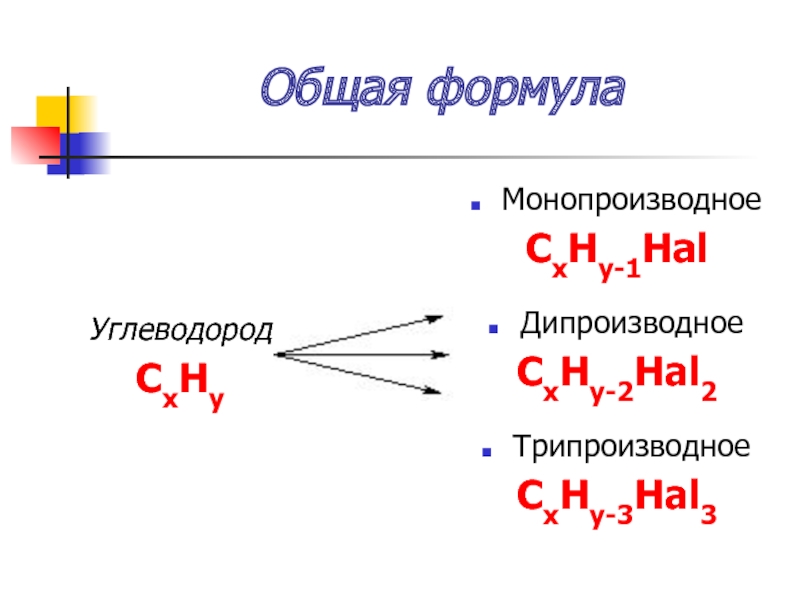
Слайд 9Общая формула
Углеводород
СxHy
Монопроизводное
СxHy-1Hal
Дипроизводное
СxHy-2Hal2
Трипроизводное
СxHy-3Hal3
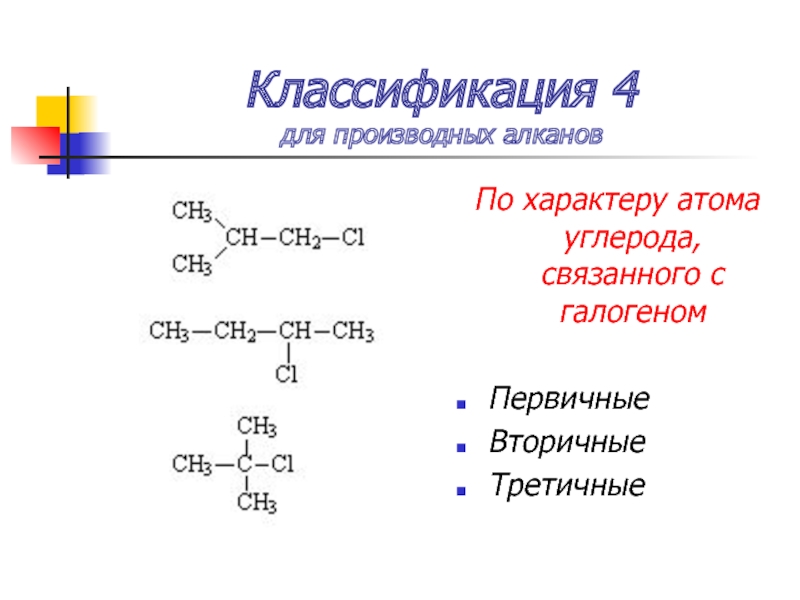
Слайд 10Классификация 4
для производных алканов
По характеру атома углерода, связанного с галогеном
Первичные
Вторичные
Третичные
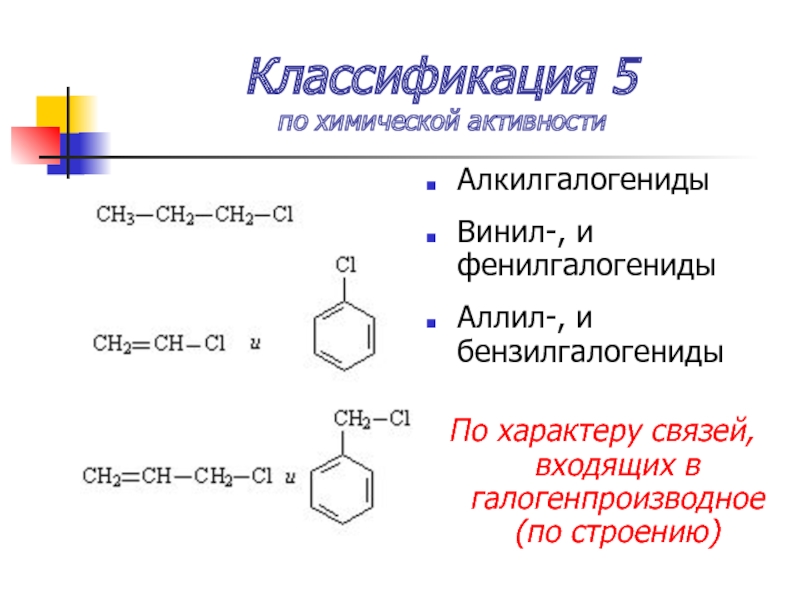
Слайд 11Классификация 5
по химической активности
Алкилгалогениды
Винил-, и фенилгалогениды
Аллил-, и бензилгалогениды
По характеру связей, входящих
в галогенпроизводное (по строению)
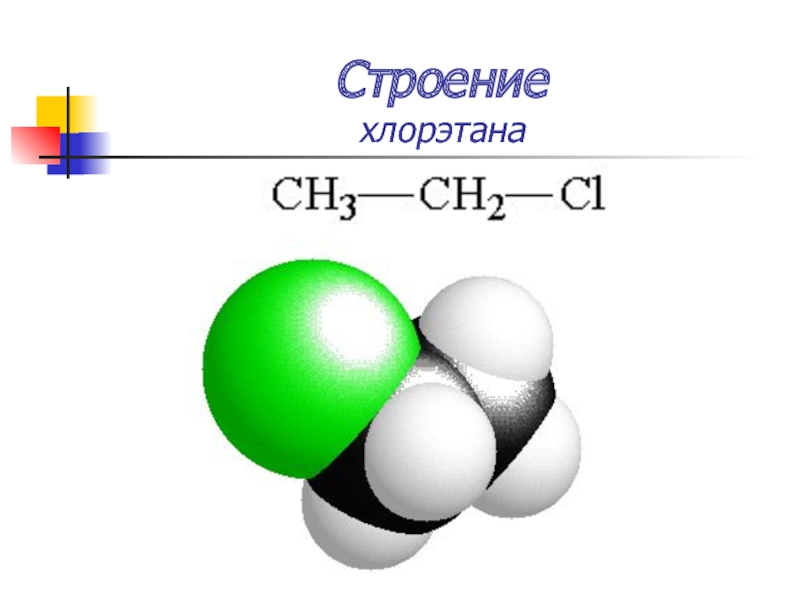
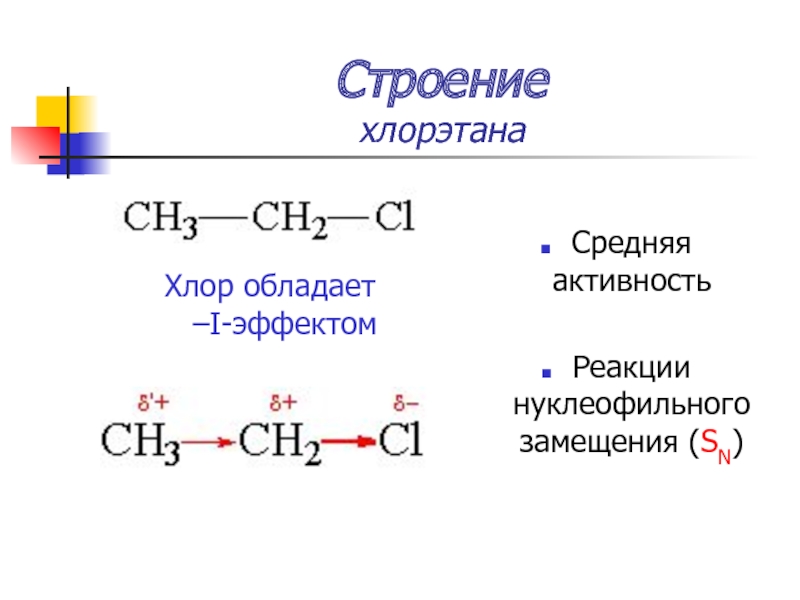
Слайд 13Строение
хлорэтана
Хлор обладает –I-эффектом
Средняя активность
Реакции нуклеофильного замещения (SN)
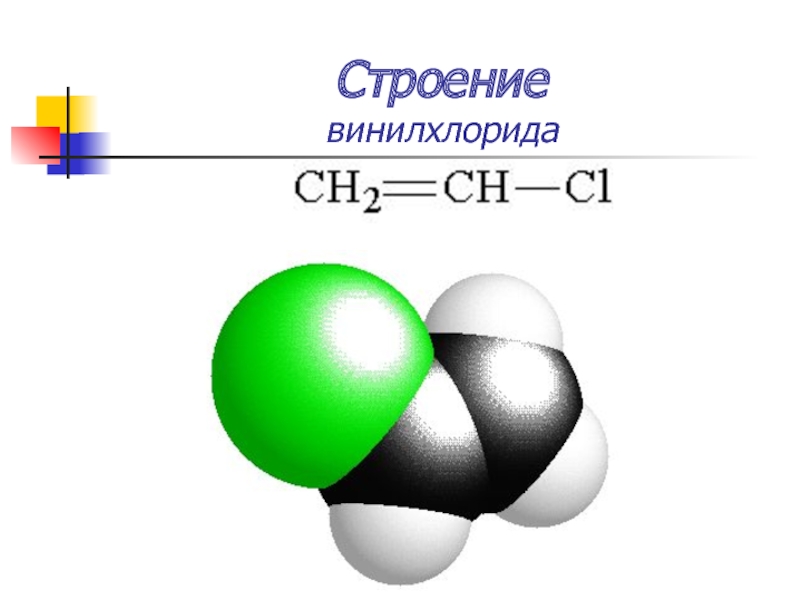
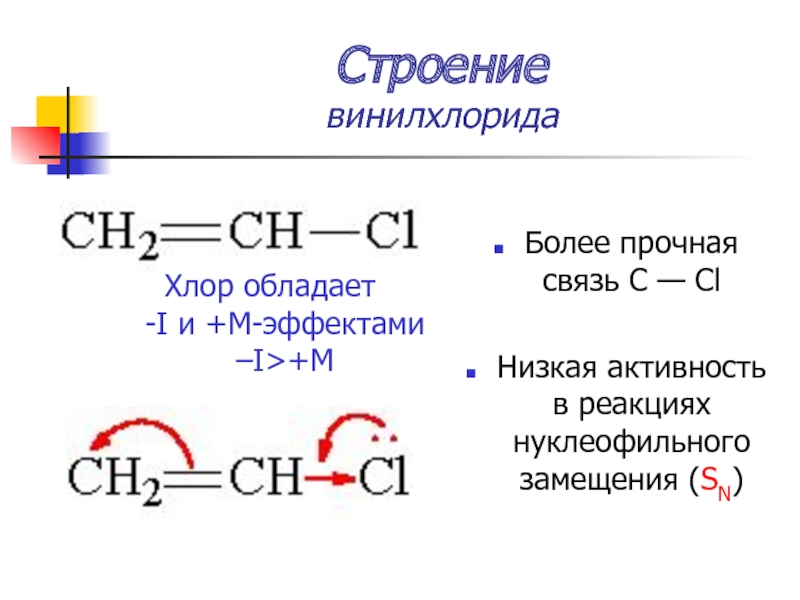
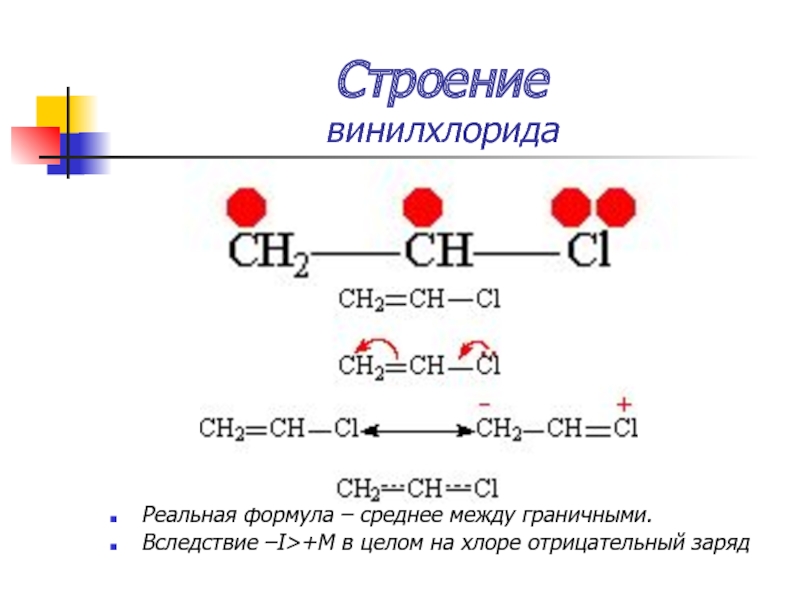
Слайд 15Строение
винилхлорида
Более прочная связь С — Cl
Низкая активность в реакциях нуклеофильного
замещения (SN)
Хлор обладает -I и +М-эффектами –I>+M
Слайд 17Строение
винилхлорида
Реальная формула – среднее между граничными.
Вследствие –I>+M в целом на хлоре
отрицательный заряд
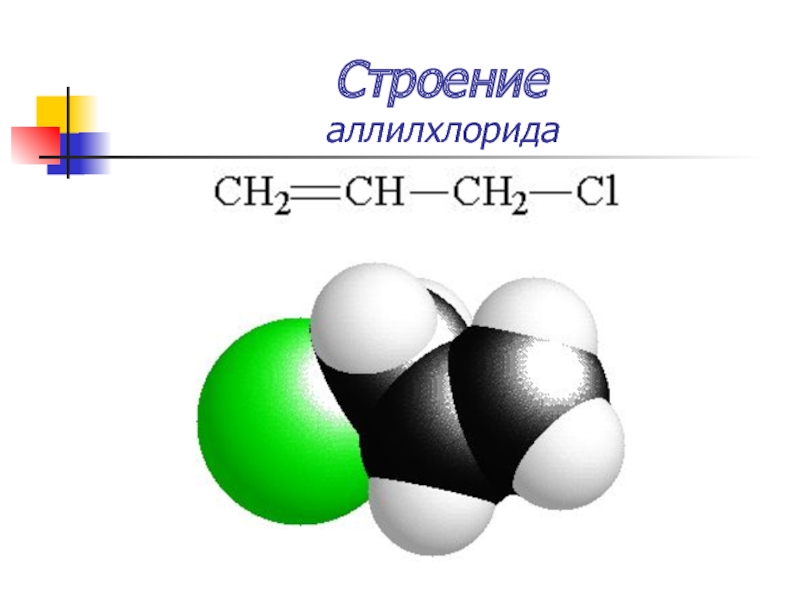
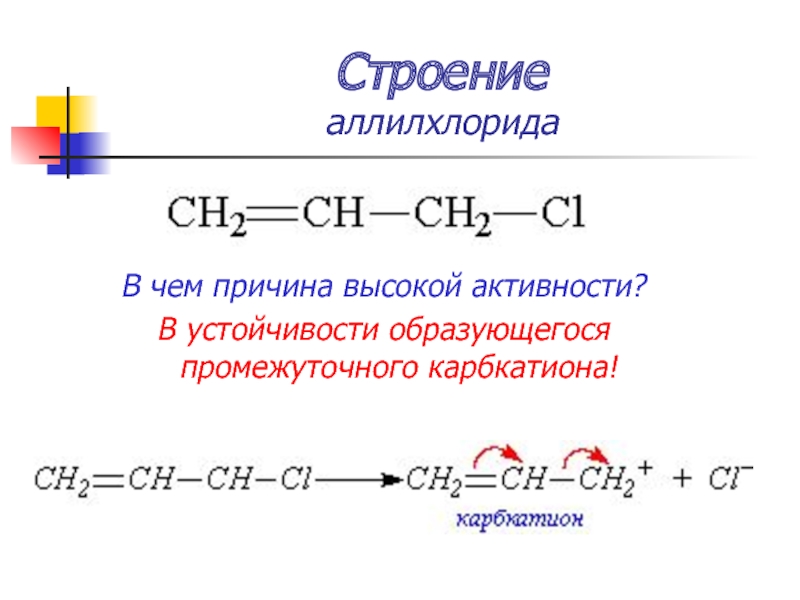
Слайд 19Строение
аллилхлорида
В чем причина высокой активности?
В устойчивости образующегося промежуточного карбкатиона!
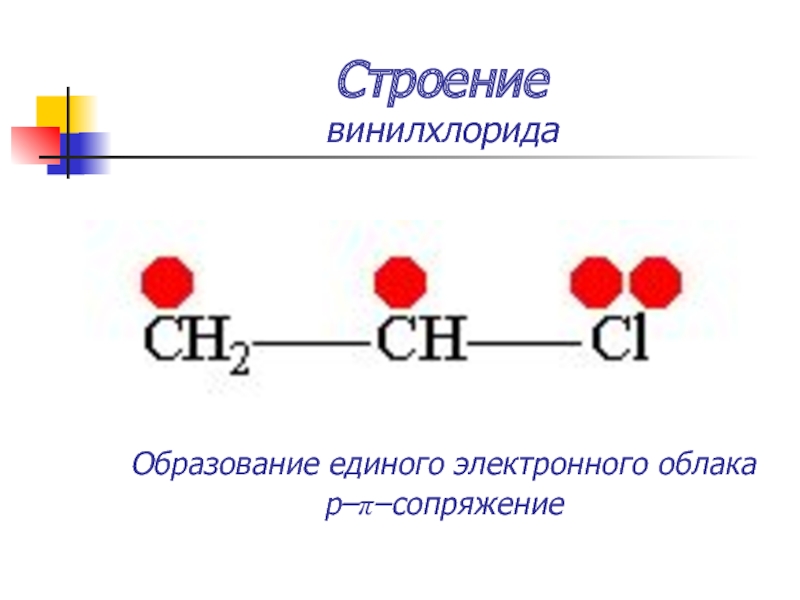
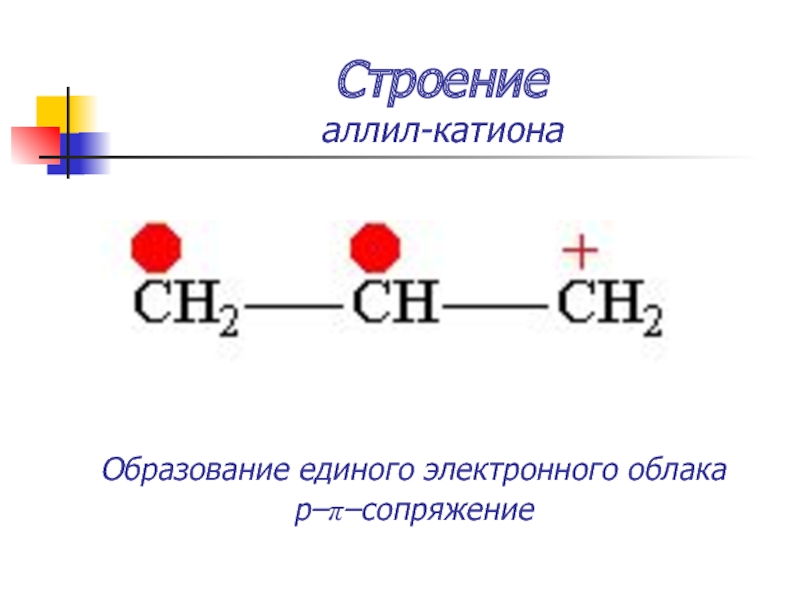
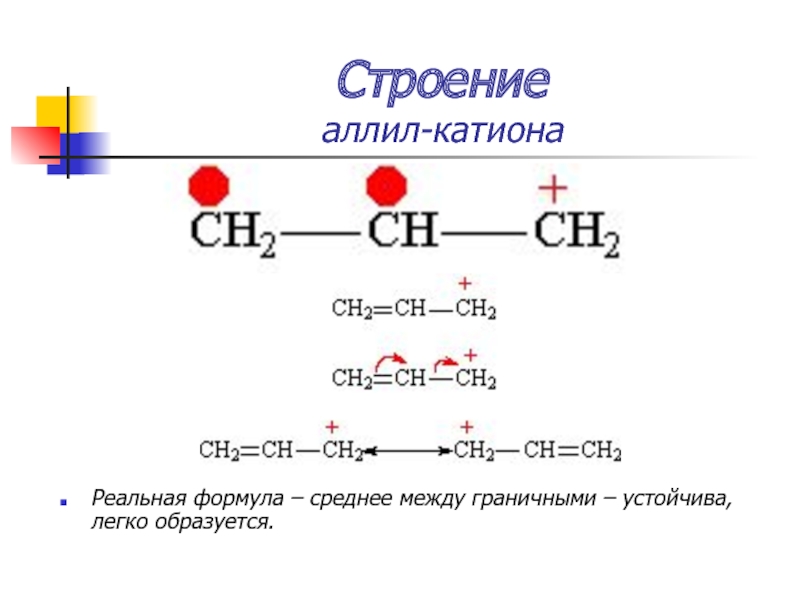
Слайд 20Строение
аллил-катиона
Образование единого электронного облака
p–π–сопряжение
Образование единого электронного облака
p–π–сопряжение
Слайд 21Строение
аллил-катиона
Реальная формула – среднее между граничными – устойчива, легко образуется.
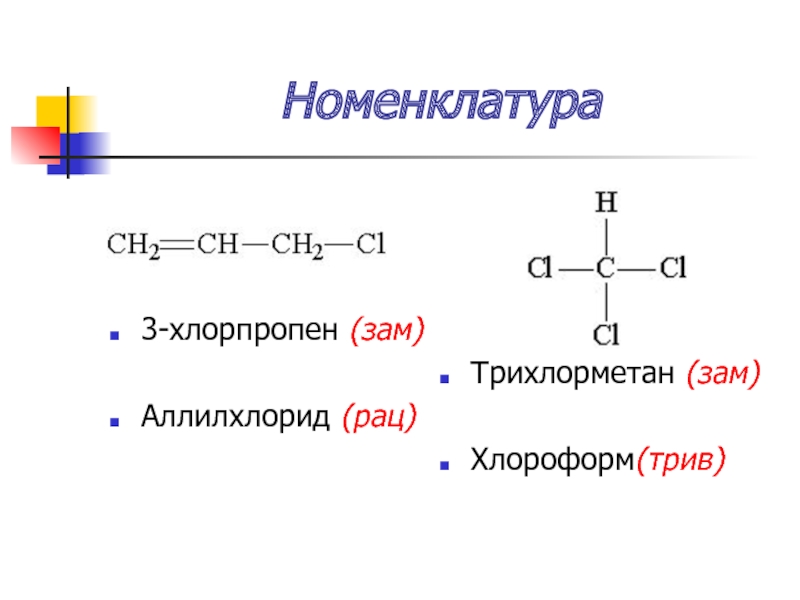
Слайд 22Номенклатура
Систематическая (заместительная)
Локант (№) + галоген + углеводород
Рациональная
радикал + галогенид
Тривиальная (исторически сложившаяся)
Тривиальная (исторически сложившаяся)
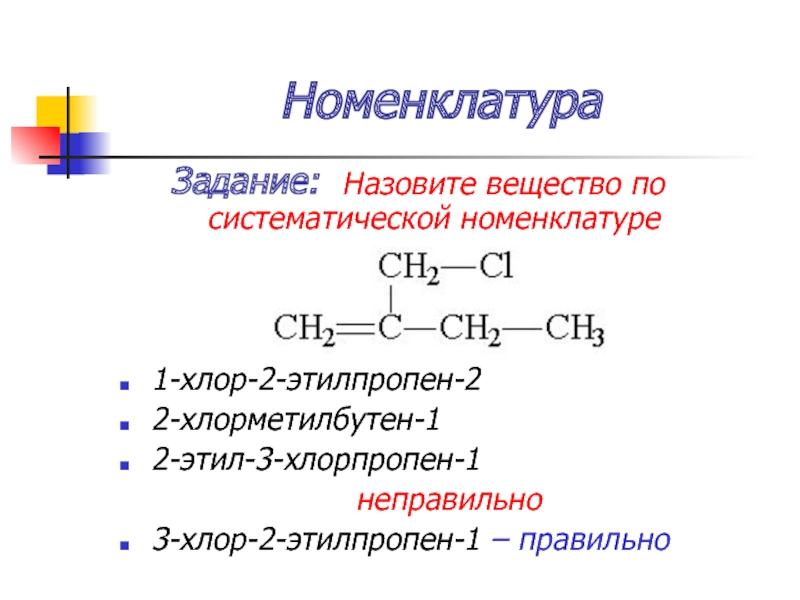
Слайд 24Номенклатура
Задание: Назовите вещество по систематической номенклатуре
1-хлор-2-этилпропен-2
2-хлорметилбутен-1
2-этил-3-хлорпропен-1
неправильно
3-хлор-2-этилпропен-1 – правильно
Слайд 26Изомерия
Структурная
А) характерная для углеводородов
+
Б) положения заместителя
Пространственная
Если характерна для углеводородов, от которого
образовано галогенпроизводное
Слайд 27Изомерия
Задание
Составьте формулы всех возможных изомеров состава С4Н9Вr.
Укажите виды изомерии, характерные для
этих соединений.
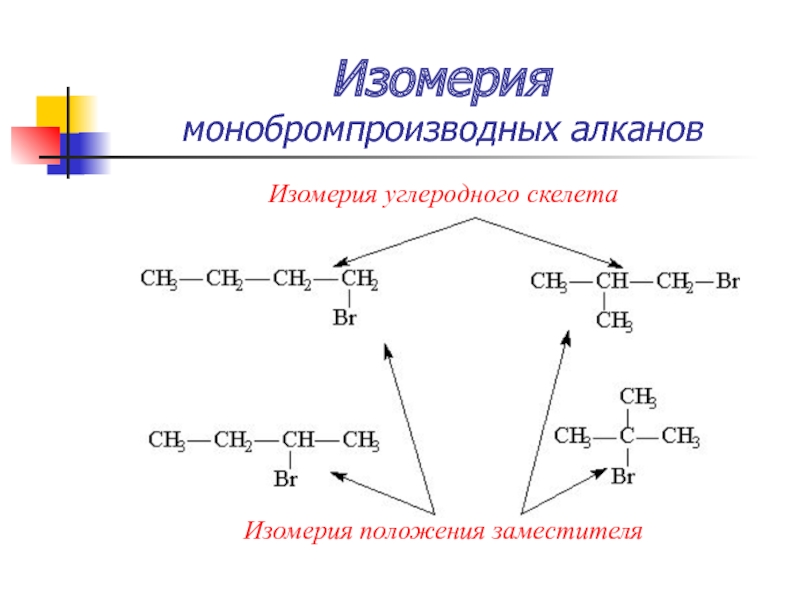
Слайд 28Изомерия
монобромпроизводных алканов
Изомерия углеродного скелета
Изомерия положения заместителя
Слайд 29Изомерия
пространственная
Какие классы галогенпроизводных могут существовать в виде цис-транс-изомеров?
Существует ли винилхлорид в
виде цис-транс-изомеров?
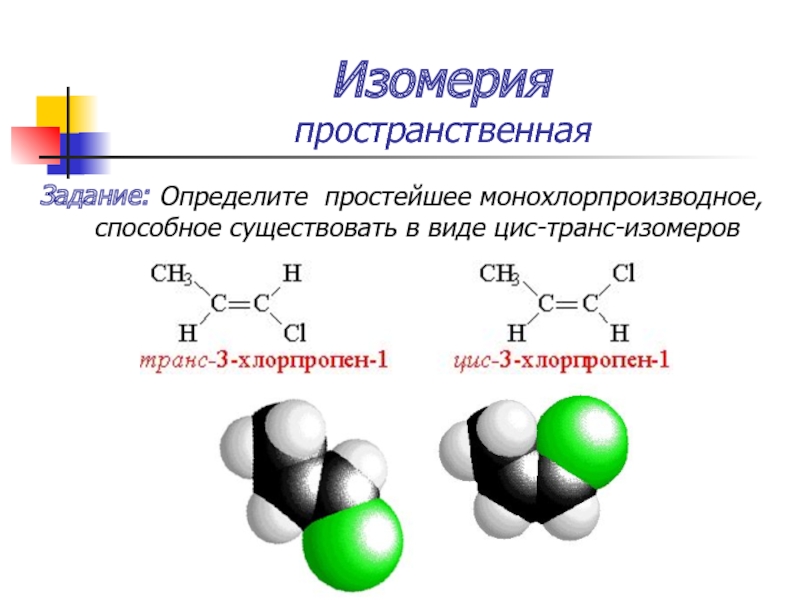
Слайд 30Изомерия
пространственная
Задание: Определите простейшее монохлорпроизводное, способное существовать в виде цис-транс-изомеров
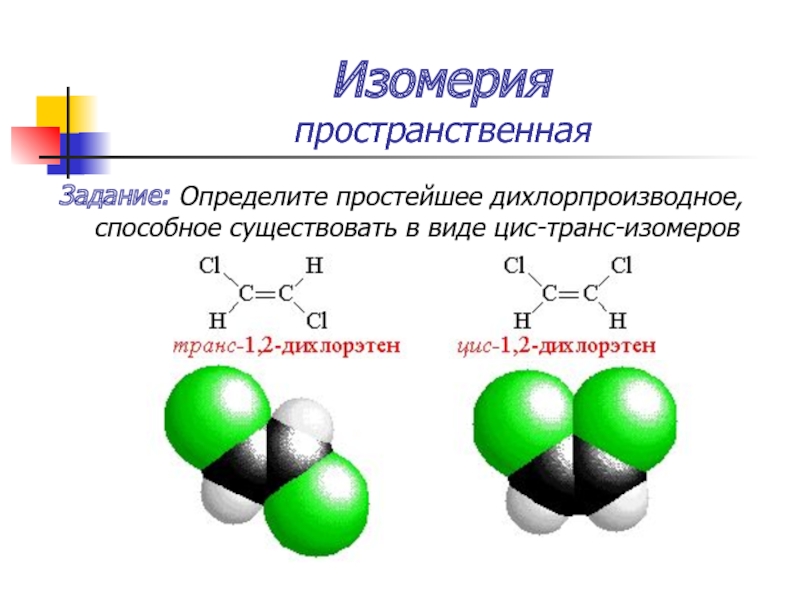
Слайд 31Изомерия
пространственная
Задание: Определите простейшее дихлорпроизводное, способное существовать в виде цис-транс-изомеров
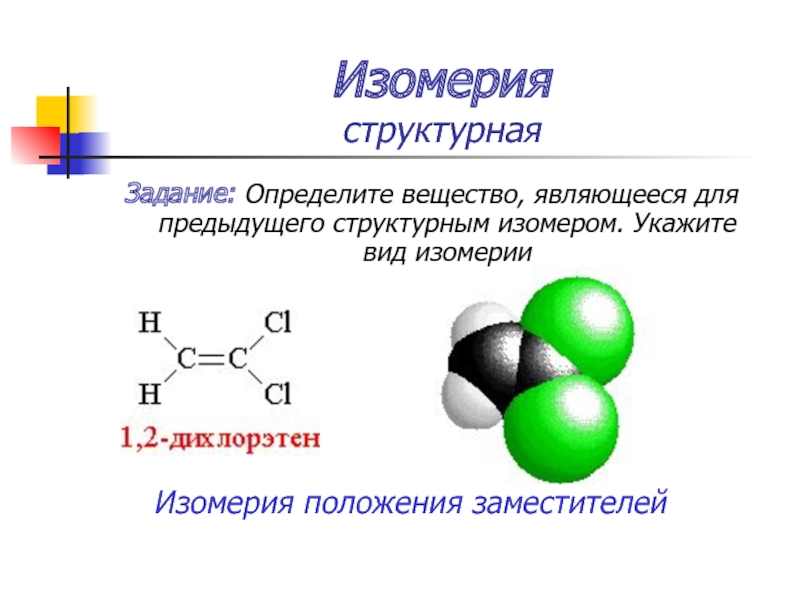
Слайд 32Изомерия
структурная
Задание: Определите вещество, являющееся для предыдущего структурным изомером. Укажите вид изомерии
Изомерия
положения заместителей
Слайд 35Физические свойства
Температуры кипения увеличиваются:
А) с увеличением порядкового номера галогена
Б) с увеличением
углеводородного радикала
В) с увеличением числа атомов галогенов
Простейшие – газы, далее б/ц жидкости с характерным запахом, нерастворимы в воде, растворимы в орг. растворителях
Плотность увеличивается
Б) с увеличением числа атомов галогенов
А) с увеличением порядкового номера галогена
В) с увеличением числа атомов галогенов
Простейшие – газы, далее б/ц жидкости с характерным запахом, нерастворимы в воде, растворимы в орг. растворителях
Плотность увеличивается
Б) с увеличением числа атомов галогенов
А) с увеличением порядкового номера галогена
Слайд 36Физиологическое действие
Почти все токсичны (гексахлоран, ДДТ - ядохимикаты), кроме фторпроизводных (тефлон,
фреоны)
Многие обладают наркотическим воздействием (хлороформ и др.)
Слезоточивое действие – лакриматор (бензилхлорид и др.)
Многие обладают наркотическим воздействием (хлороформ и др.)
Слезоточивое действие – лакриматор (бензилхлорид и др.)
Слайд 38Химические свойства
А) реакции углеводородных радикалов
Те же что и у соответствующих у/в
предельные – замещение (SR)
непредельные – присоединие (АЕ)
ароматические – замещение (SЕ)
Б) реакции с участием галогенов
замещение (SN)
отщепления (элиминирования) (ЕN)
непредельные – присоединие (АЕ)
ароматические – замещение (SЕ)
Б) реакции с участием галогенов
замещение (SN)
отщепления (элиминирования) (ЕN)
Слайд 39Химические свойства
Реакции углеводородных радикалов
Задание:Укажите условия проведения реакций
Слайд 40Химические свойства
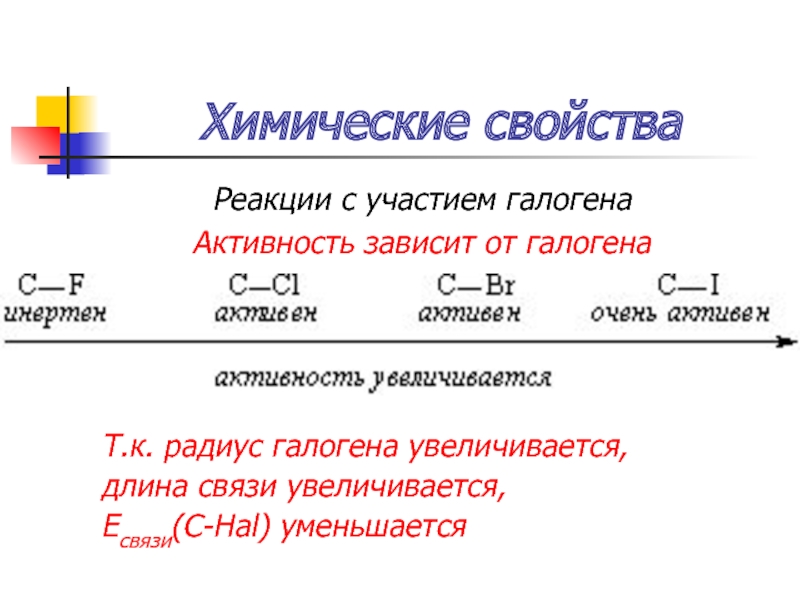
Реакции с участием галогена
Активность зависит от галогена
Т.к. радиус галогена увеличивается,
длина
связи увеличивается,
Есвязи(С-Hal) уменьшается
Есвязи(С-Hal) уменьшается
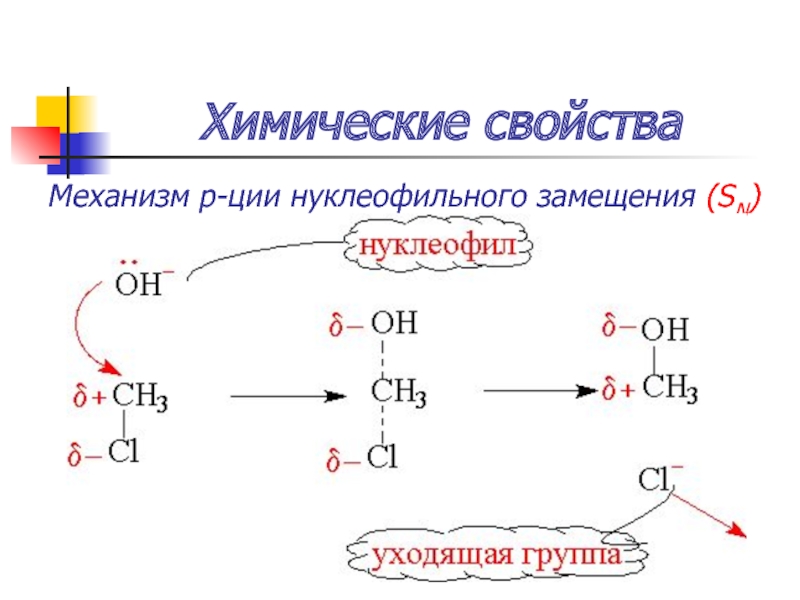
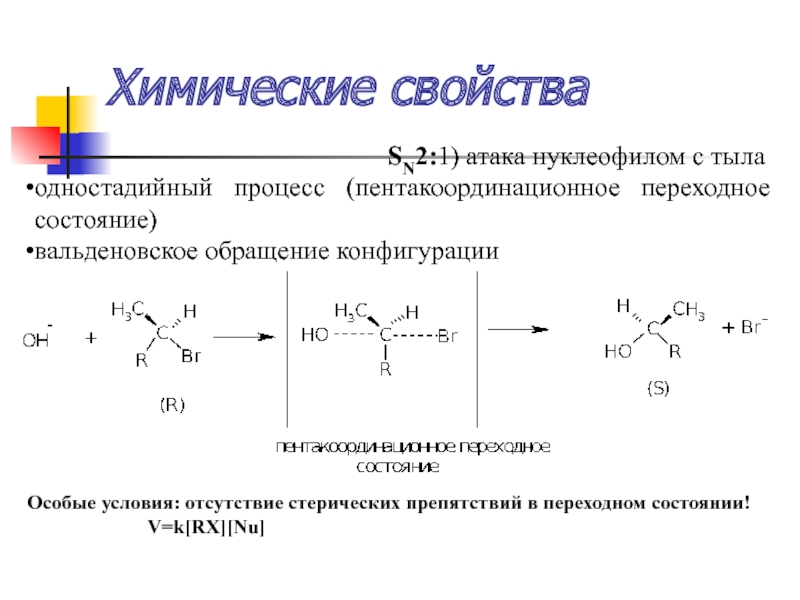
Слайд 43Химические свойства
SN2:1) атака нуклеофилом с тыла
одностадийный процесс (пентакоординационное переходное состояние)
вальденовское обращение конфигурации
одностадийный процесс (пентакоординационное переходное состояние)
вальденовское обращение конфигурации
Особые условия: отсутствие стерических препятствий в переходном состоянии!
V=k[RX][Nu]
Слайд 44Химические свойства
SN1: 1) двухстадийный процесс и рацемизация в процессе реакции.
Особые условия: образование
стабильного карбкатиона
V=k[RX]
V=k[RX]
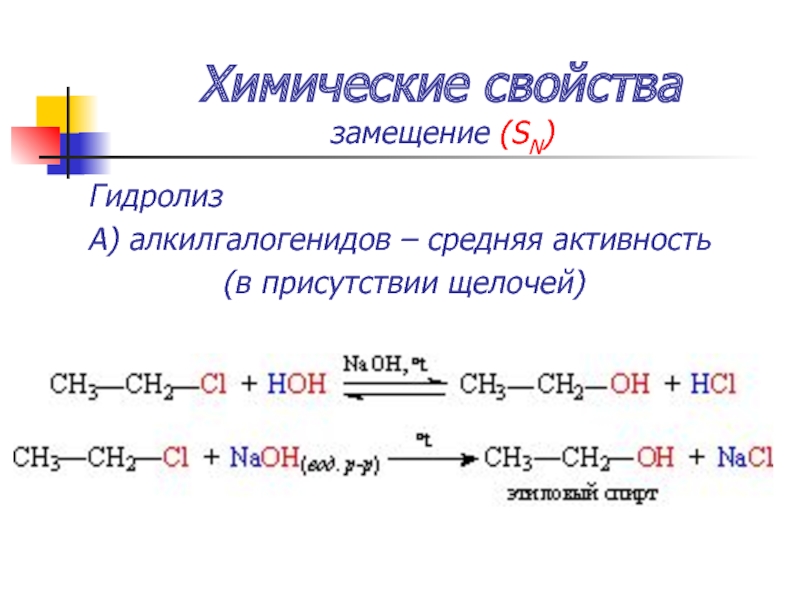
Слайд 45Химические свойства
замещение (SN)
Гидролиз
А) алкилгалогенидов – средняя активность
(в присутствии щелочей)
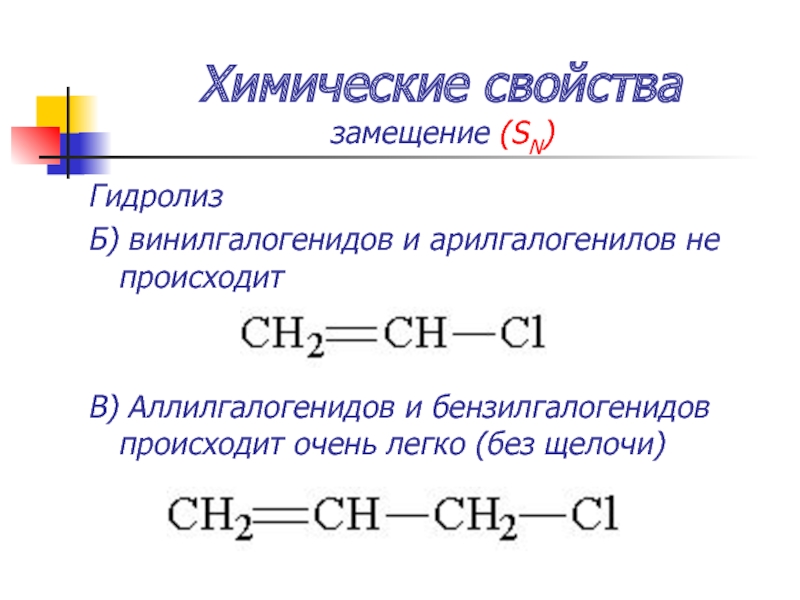
Слайд 46Химические свойства
замещение (SN)
Гидролиз
Б) винилгалогенидов и арилгалогенилов не происходит
В) Аллилгалогенидов и бензилгалогенидов
происходит очень легко (без щелочи)
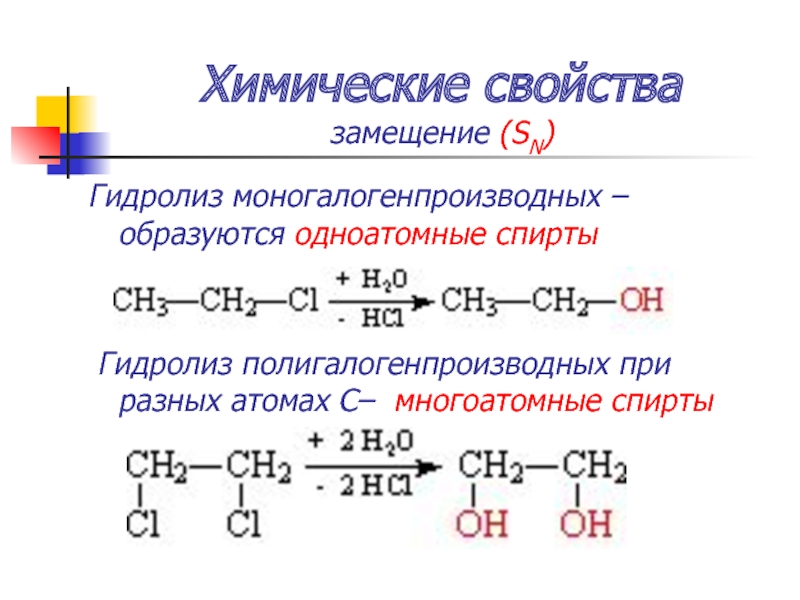
Слайд 47Химические свойства
замещение (SN)
Гидролиз моногалогенпроизводных – образуются одноатомные спирты
Гидролиз полигалогенпроизводных при
разных атомах С– многоатомные спирты
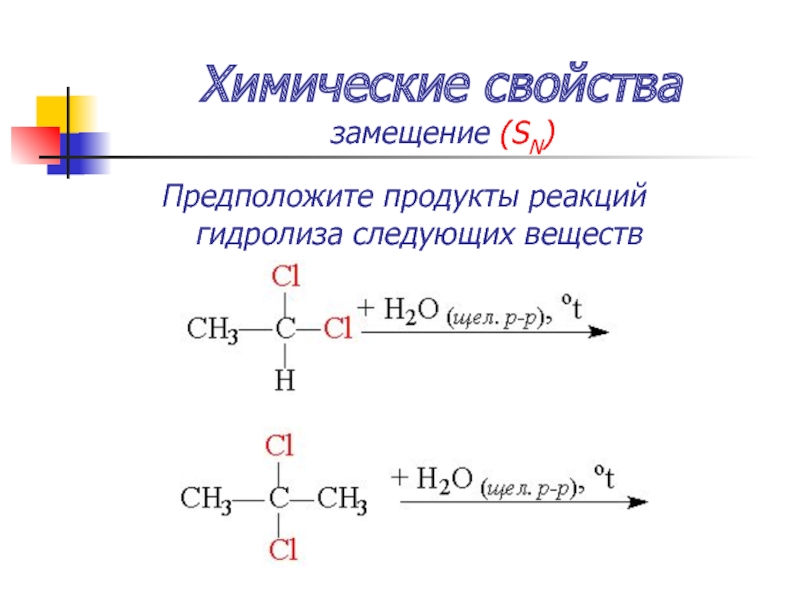
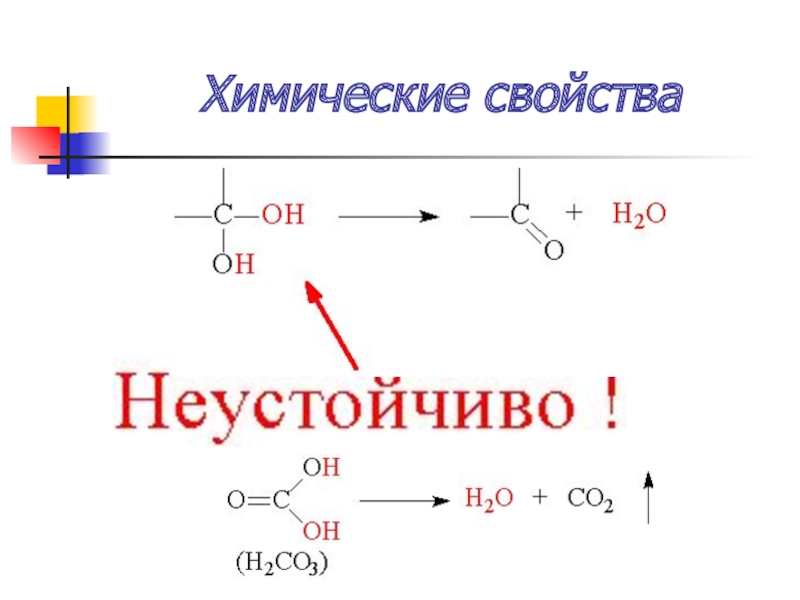
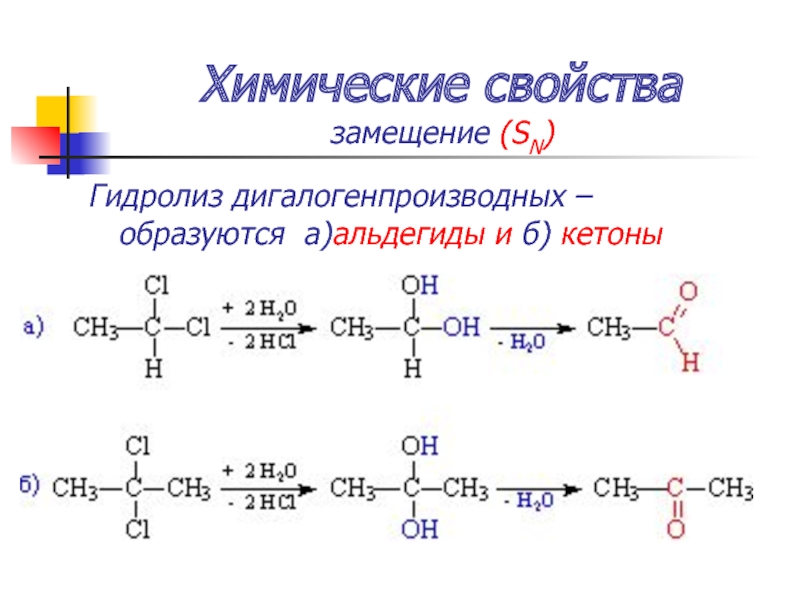
Слайд 50Химические свойства
замещение (SN)
Гидролиз дигалогенпроизводных – образуются а)альдегиды и б) кетоны
Слайд 52Химические свойства
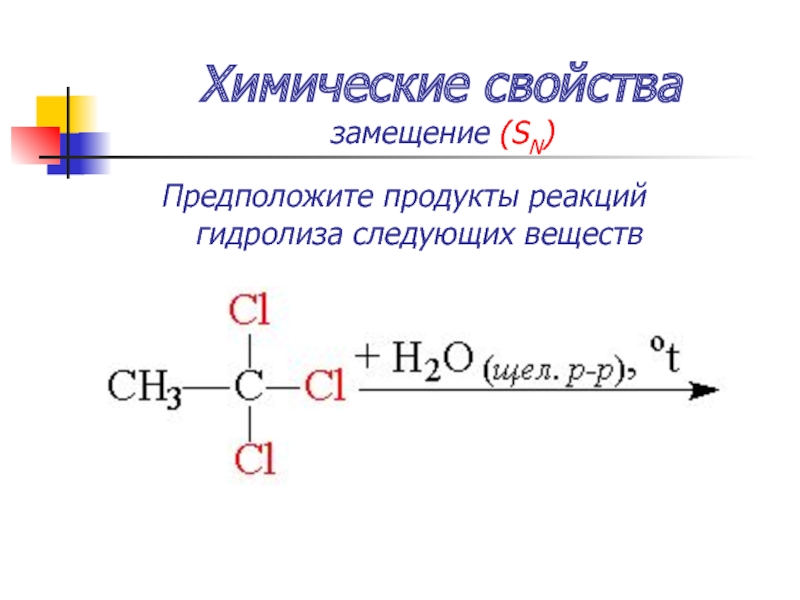
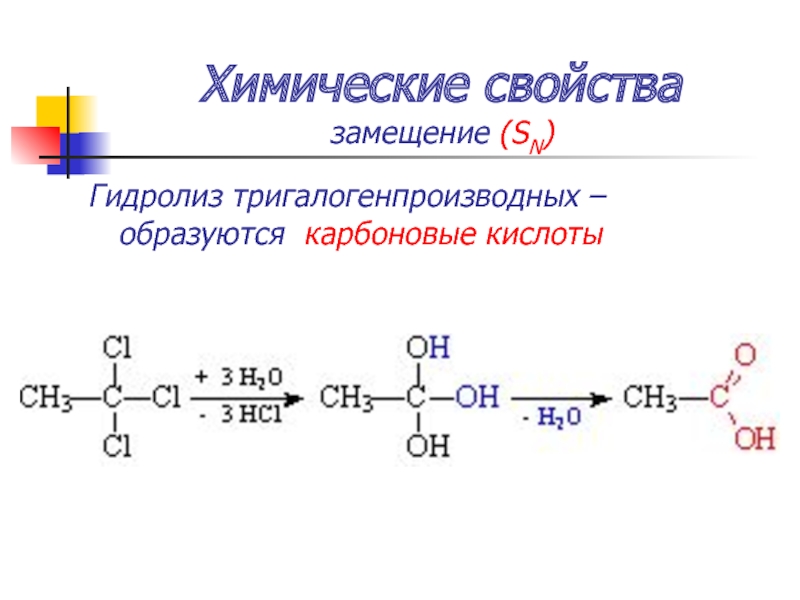
замещение (SN)
Гидролиз тригалогенпроизводных – образуются карбоновые кислоты
Слайд 54Химические свойства
замещение (SN)
Взаимодействие с аммиаком (при t0) – образуются амины
Взаимодействие с
цианидами (солями HCN – синильной кислоты) (при t0) – нитрилы
Слайд 55Химические свойства
отщепление (ЕN)
Задание:
Составьте уравнения реакций отщепления хлороводорода при нагревании со
спиртовым раствором щелочи
А) 2-хлорпропана
Б) 2- хлорбутана
А) 2-хлорпропана
Б) 2- хлорбутана
Слайд 56Химические свойства
отщепление (ЕN)
Правило Зайцева: Водород отщепляется от наименее гидрированного атома углерода
Реакция
отщепления – конкурирующая реакциям замещения
Слайд 57Химические свойства
окисление
Горят плохо,
выделяя ядовитые соединения (!!!) (например хлороводород HCl), или не горят вовсе.
Качественная реакция на Сl, Br, I: Окрашивание пламени в зеленый цвет медной проволочкой, смоченной в галогенпроизводном
Качественная реакция на Сl, Br, I: Окрашивание пламени в зеленый цвет медной проволочкой, смоченной в галогенпроизводном
Слайд 58Получение
Из алканов и циклоалканов
Из алкенов и алкинов
Из аренов
Из спиртов
Из альдегидов и
кетонов
Слайд 59Применение
Анестезия С2H5Cl и наркоз CF3CHClBr (ранее СНCl3) и др.
Растворители CCl4 ,
CH2ClCH2C и др.
Фреоны (хладагенты) CF2Cl2 и др.
Антисептик СНI3
Тушение пожаров CCl4 и др.
Полимеры из СН2=СН-Сl, СF2=СF2 и др.
Ядохимикаты: гексахлоран, ДДТ и др.
и др.
Фреоны (хладагенты) CF2Cl2 и др.
Антисептик СНI3
Тушение пожаров CCl4 и др.
Полимеры из СН2=СН-Сl, СF2=СF2 и др.
Ядохимикаты: гексахлоран, ДДТ и др.
и др.










![Химические свойства SN1: 1) двухстадийный процесс и рацемизация в процессе реакции.Особые условия: образование стабильного карбкатиона V=k[RX]](/img/tmb/4/349221/3ece0f8fa5f3a8b792dbcf9d45bddf81-800x.jpg)