Лекция 5
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Оптическая изомерия презентация
Содержание
- 1. Оптическая изомерия
- 2. Оптическая изомерия.
- 3. Оптической активностью обладают вещества, которые представляют
- 4. ХИРАЛЬНОСТЬ свойство молекулы быть несовместимой со
- 5. В органических молекулах хиральным объектом является amом
- 6. Якоб Хендрик Вант-Гофф (1852—1911) Был первым Нобелевским
- 7. Если молекула имеет один такой атом, то
- 8. зеркало
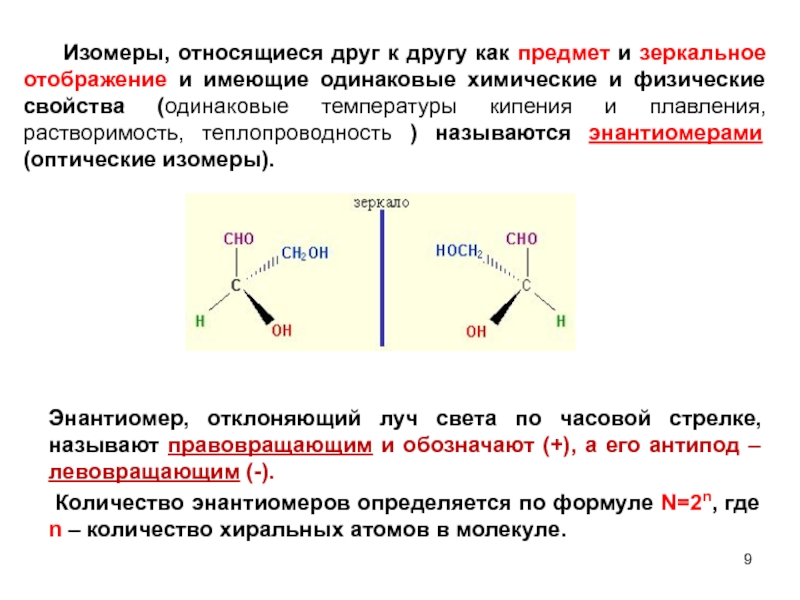
- 9. Изомеры, относящиеся друг к другу как предмет
- 10. Право (+) – и лево (-) –
- 12. Оптическая изомерия гидроксикислот 2
- 13. Для изображения оптических изомеров на плоскости используют
- 14. Правовращающая L(+)-молочная кислота открыта Либихом
- 15. Чистая левовращающая молочная D(-) кислота может быть
- 16. Принципиальное различие между синтезами органических веществ,
- 17. Способы разделения рацемической смеси: Биохимический
- 18. Оптическая изомерия гидроксикислот 2- гидроксибутандиовая (α
- 19. Формулы Фишера для энантиомеров яблочной кислоты.
- 20. Яблочная кислота- один из важных промежуточных продуктов
- 21. Применение яблочной кислоты Применяется как пищевая добавка
- 22. Оптическая изомерия гидроксикислот – 2,3-дигидроксибутандиовая – дигидроксиянтарная
- 23. Формулы Фишера для оптически активных изомеров винной
- 24. Образуется мезовинная кислота при продолжительном кипячении всех
- 25. Применение винной кислоты В пищевой промышленности в
- 26. Виноградная кислота - рацемическая смесь винных кислот
- 27. Виноградная кислота - рацемическая смесь винных кислот
- 28. (-) энантиомер остается неизменным.
- 29. Виноградная кислота получается длительным нагреванием водных растворов
- 30. Механизм действия биологически активных веществ обычно заключается
- 31. Структуры
- 32. У большинства лекарственных препаратов существует тесная взаимосвязь
- 33. Многие синтетические лекарственные препараты существуют в виде
- 34. Основная фармакологическая активность рацемических лекарственных препаратов обычно
- 35. Левовращающий морфин (растительное сырье) – сильный анальгетик.
- 36. (-)-5-(1,3-диметилбутил)-5-этилбарбитуровая кислота проявляет обычное для барбитуратов успокаивающее
- 37. ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
- 38. В течение нескольких последних десятилетий велись интенсивные
- 39. Нобелевская премия 2001года Открытия ученых в
- 40. Гидроксикислоты - гетерофункциональные соединения
- 41. Схема введения 2-ой функциональной группы в карбоновую
- 42. Гомологический ряд гидроксикислот: Гидроксикислоты. Гидроксиметановая кислота Гидроксимуравьиная
- 43. 2-гидроксипропановая α-гидроксипропионовая молочная кислота 3 -
- 44. Гидроксибутановая (гидроксимасляная) кислота существует в виде трех
- 45. 2 – метоксипропановая (простой эфир) 2
- 46. Химические реакции СООН гр. кислотные свойства
- 47. Специфические реакции α,β,γ, - гидроксикарбоновых кислот при
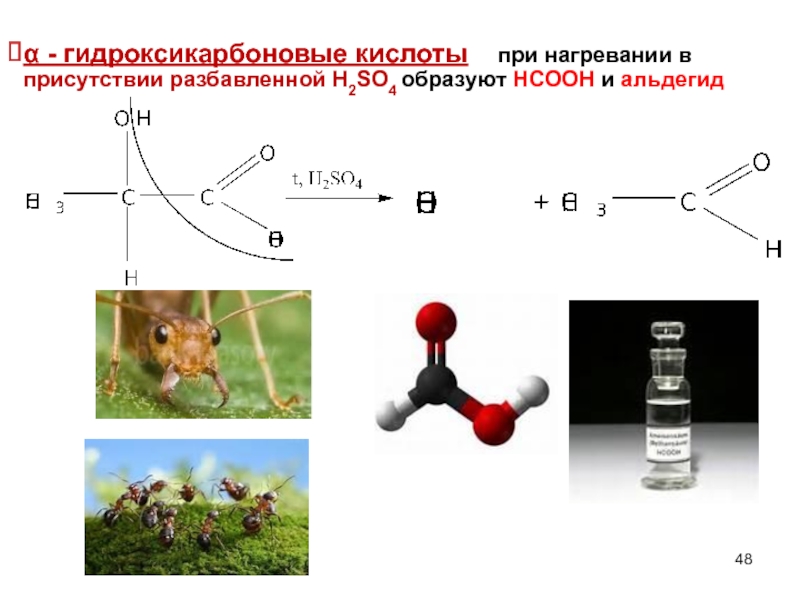
- 48. α - гидроксикарбоновые кислоты при нагревании в присутствии разбавленной Н2SO4 образуют НСООН и альдегид
- 50. γ - и δ - гидроксикарбоновые
- 51. Одно из основных веществ в человеческом рационе
- 52. Химические свойства винной кислоты Винная кислота –
- 53. Образование солей тартрата калия-натрия (Сегнетова соль)
- 54. Свойства 2-х гидроксильных ОН - образование соли
- 55. Качественные реакции обнаружения альдегидной группы с помощью реактива Фелинга (реакция медного зеркала)
- 56. Качественные реакции обнаружения альдегидной группы в углеводах с помощью реактива Фелинга 4 2 +
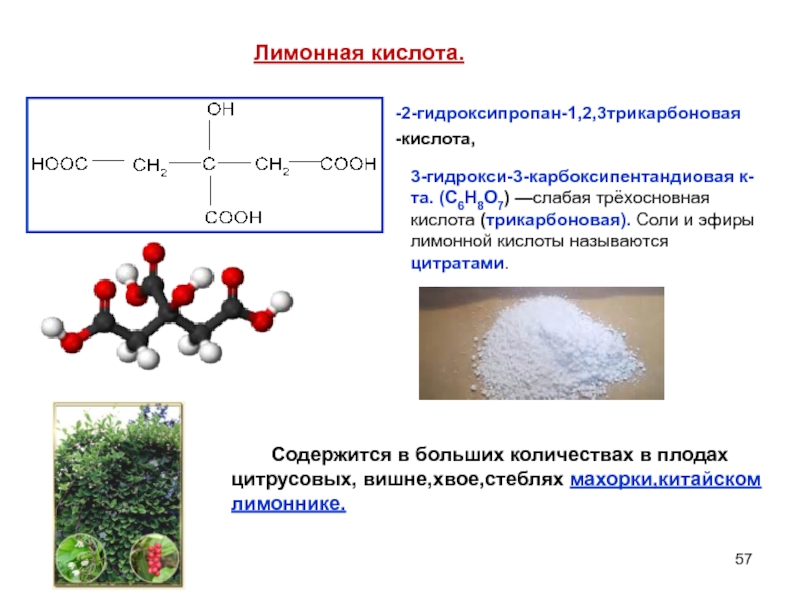
- 57. Лимонная кислота. 2-гидроксипропан-1,2,3трикарбоновая кислота, 3-гидрокси-3-карбоксипентандиовая к-та.
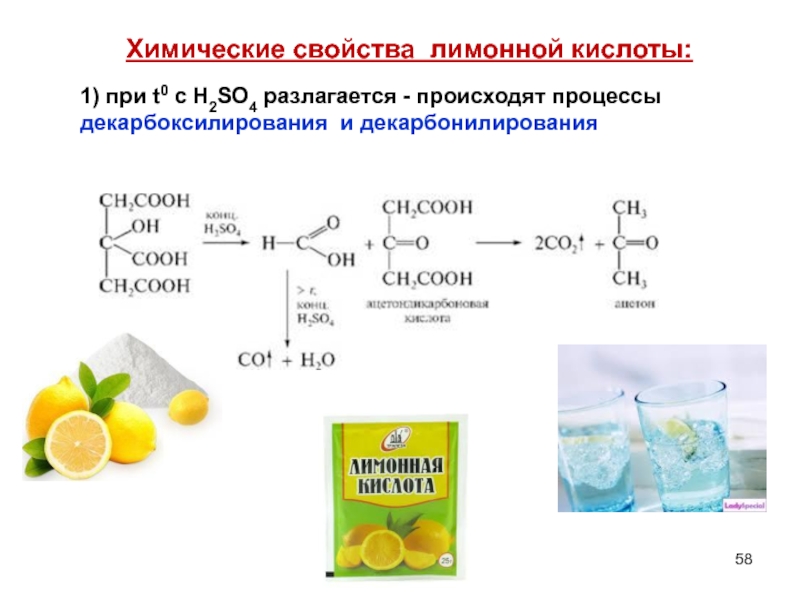
- 58. Химические свойства лимонной кислоты: 1) при
- 59. Получение лимонной кислоты Лимонную кислоту раньше получали
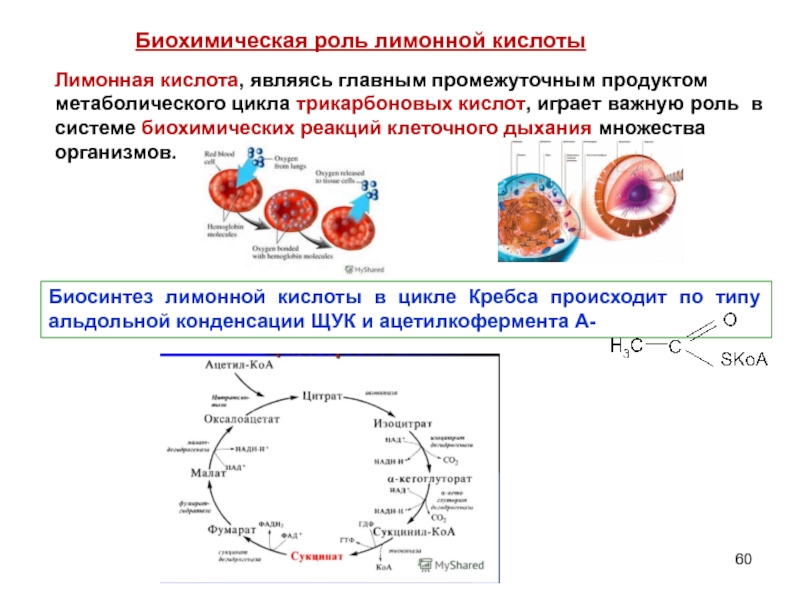
- 60. Лимонная кислота, являясь главным промежуточным продуктом метаболического
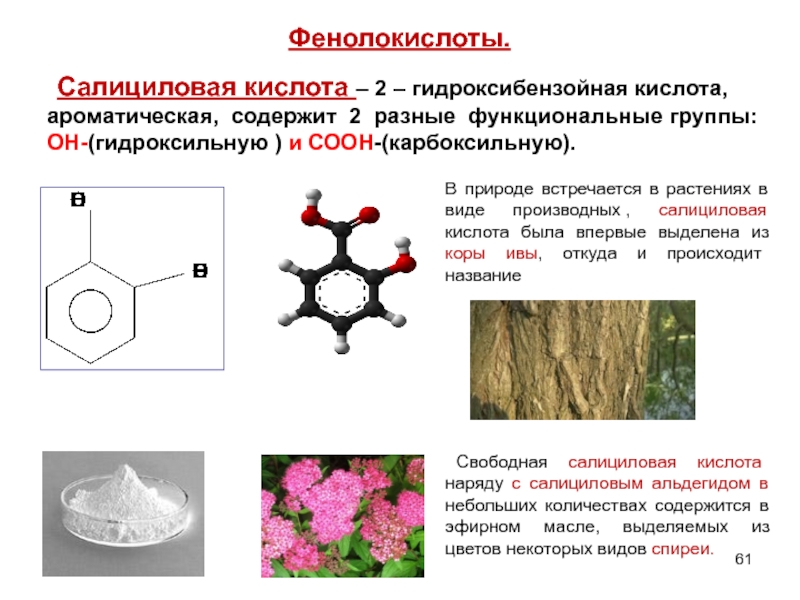
- 61. Фенолокислоты. Салициловая кислота – 2 – гидроксибензойная
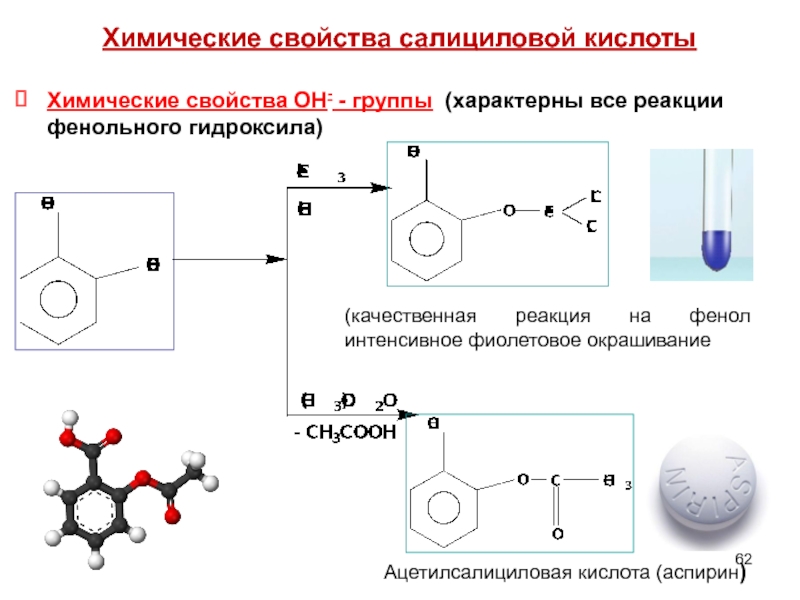
- 62. Химические свойства салициловой кислоты Химические свойства
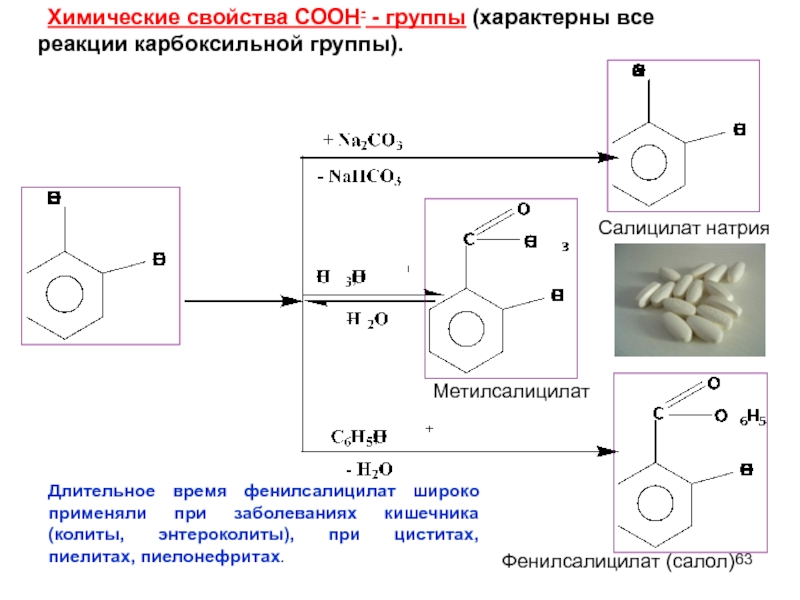
- 63. Химические свойства СООН- - группы (характерны все
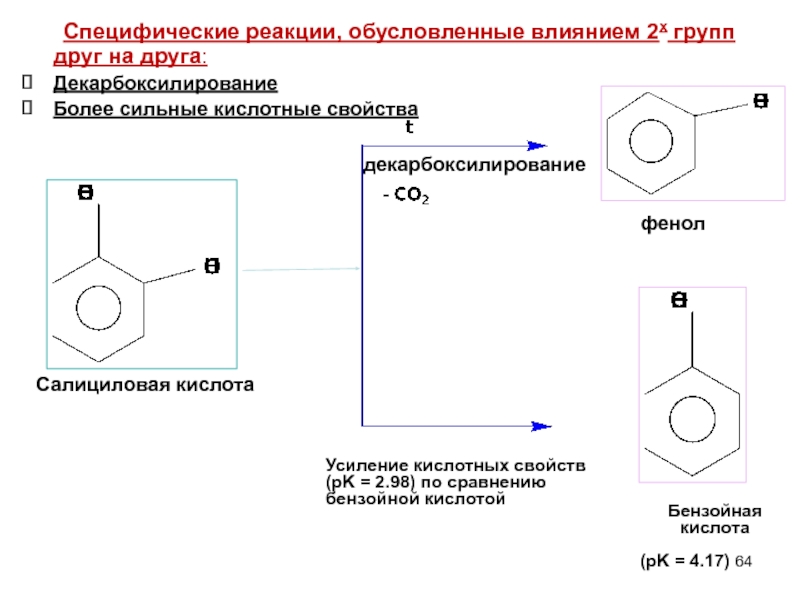
- 64. (pK = 4.17) Специфические реакции, обусловленные
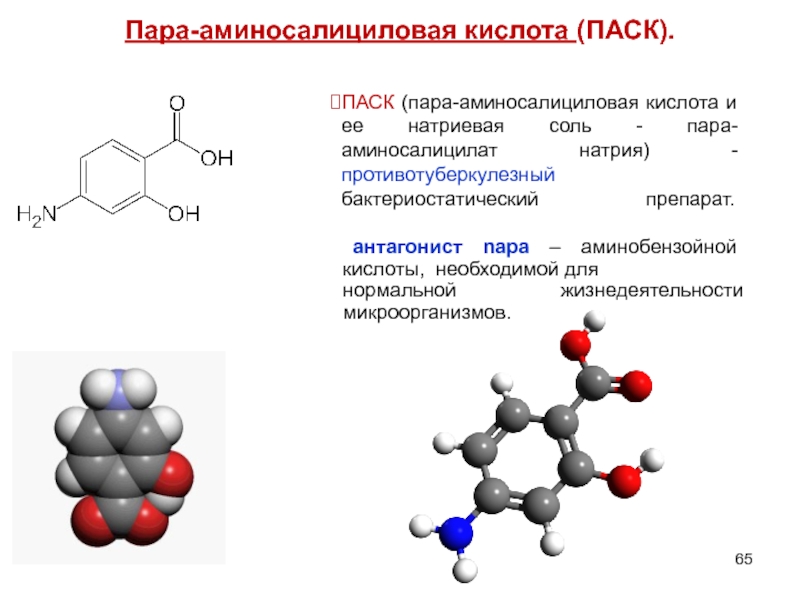
- 65. Пара-аминосалициловая кислота (ПАСК). ПАСК (пара-аминосалициловая кислота
- 66. ОКСОКИСЛОТЫ кизил
- 67. Оксокислоты. Оксокислоты –
- 69. Альдегидокислоты
- 70. С использованием глиоксалевой кислоты производится
- 71. Кетонокислоты являются более устойчивыми, чем альдегидокислоты. Значительную
- 72. 2-оксопропановая
- 73. Cпособы получения пировиноградной кислоты: 1). Окисление молочной
- 74. 3). Гидролиз (щелочной) дигалогенокислот: Cпособы получения пировиноградной
- 75. Химические свойства оксокислот: >С=О
- 76. 1) Реакция >С=О - AN
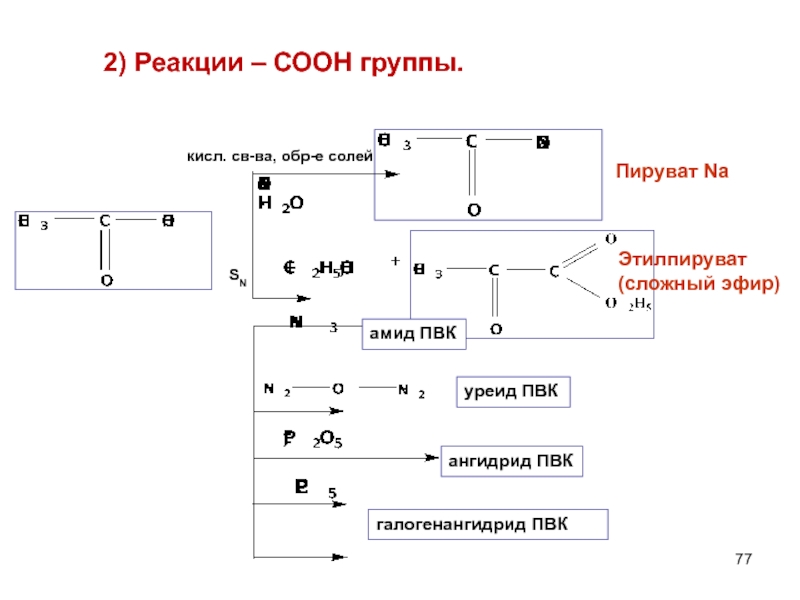
- 77. 2) Реакции – СООН группы.
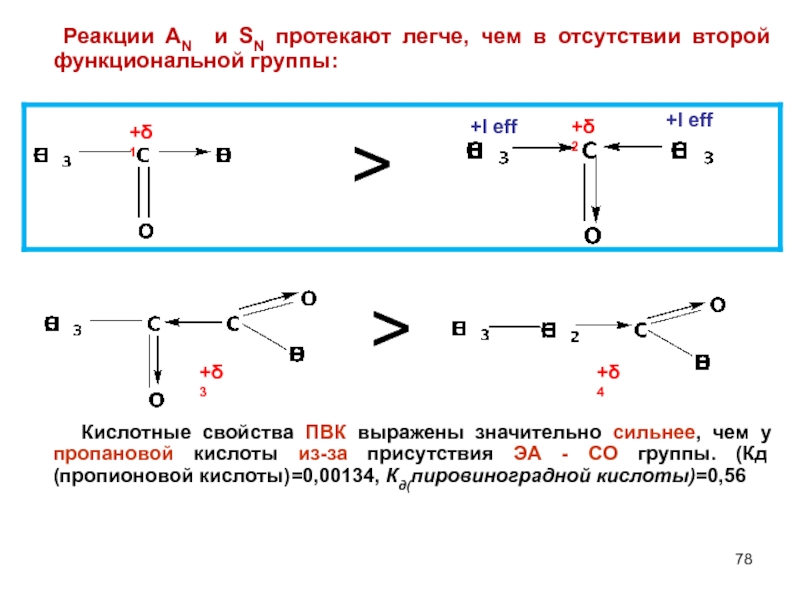
- 78. Реакции AN и SN протекают легче, чем
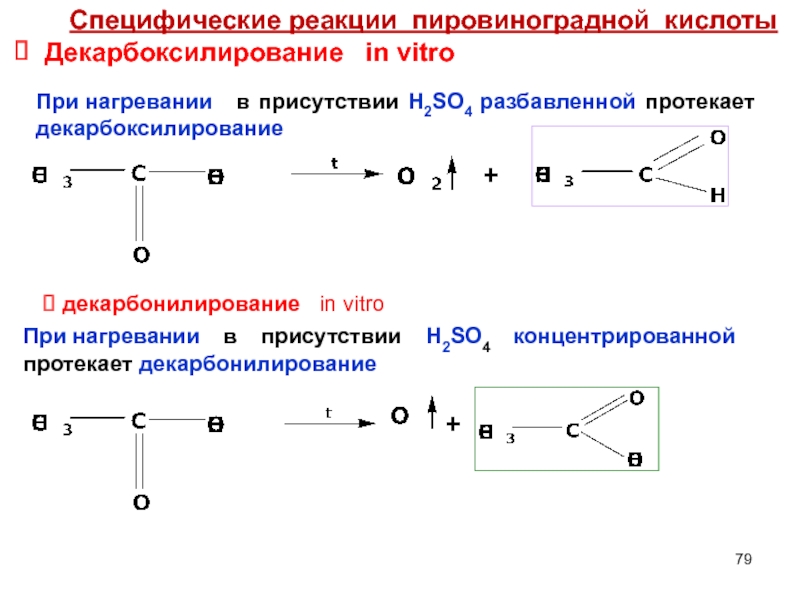
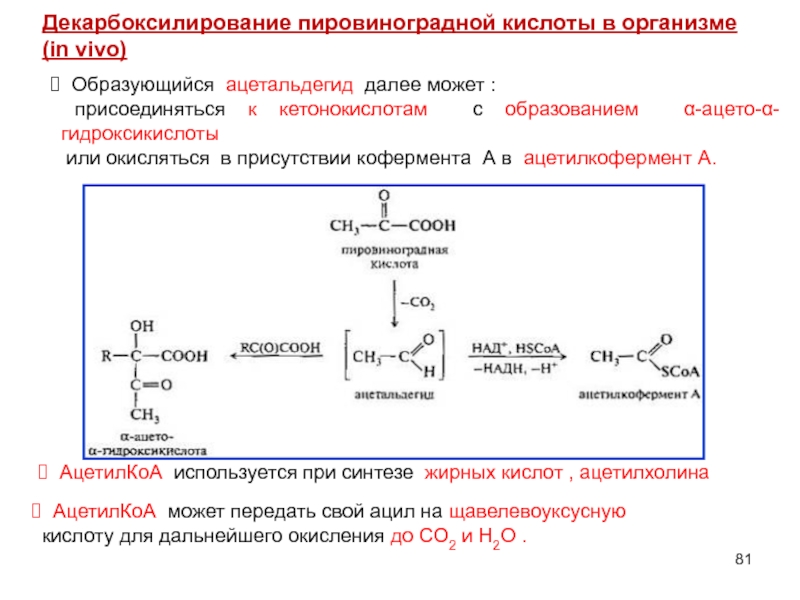
- 79. Специфические реакции пировиноградной кислоты Декарбоксилирование
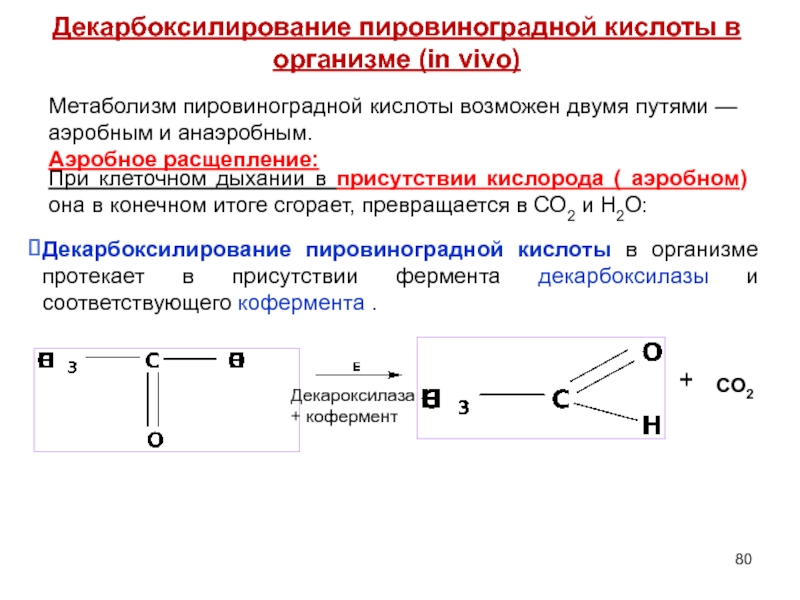
- 80. Метаболизм пировиноградной кислоты возможен двумя путями — аэробным
- 81. Образующийся ацетальдегид далее может :
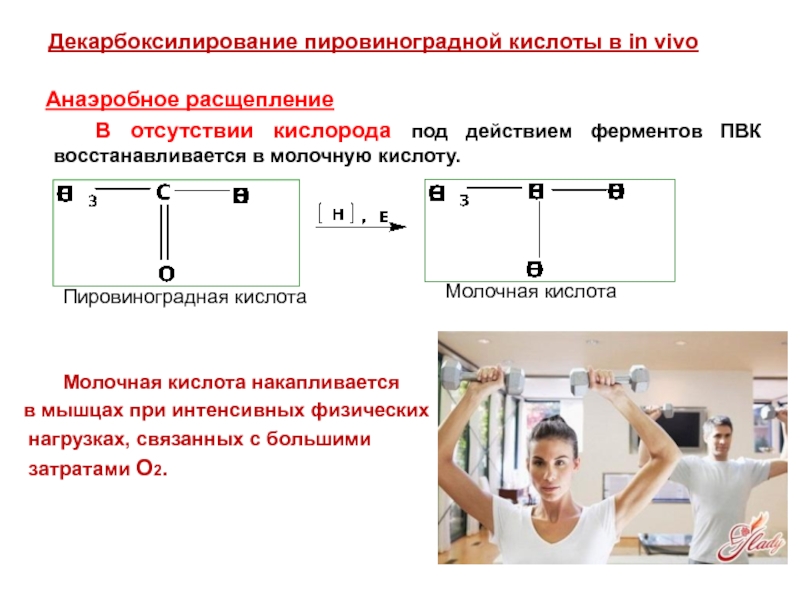
- 82. Анаэробное расщепление
- 84. Ацетоуксусная кислота 3 - оксобутановая кислота β-
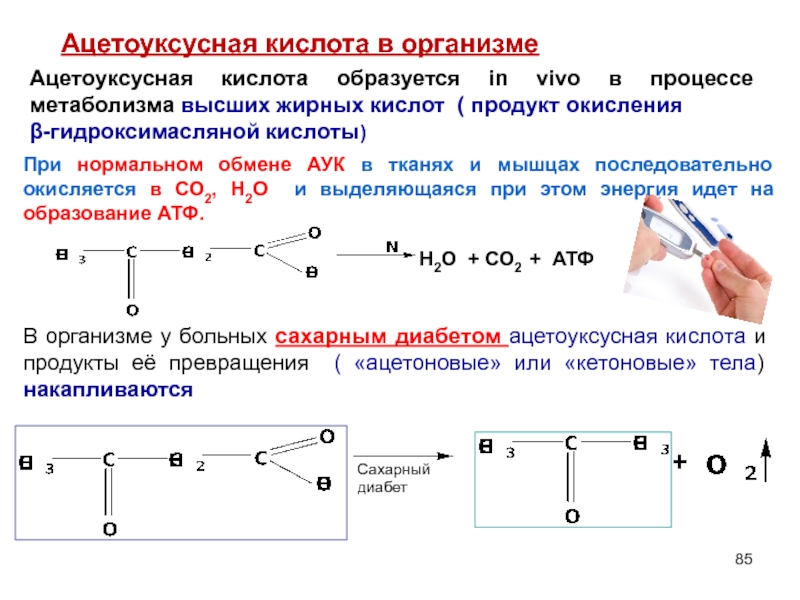
- 85. Ацетоуксусная кислота в организме При нормальном обмене
- 86. Ацетоновые тела: ацетон, ацетоуксусную кислоту, соли ацетоуксусной
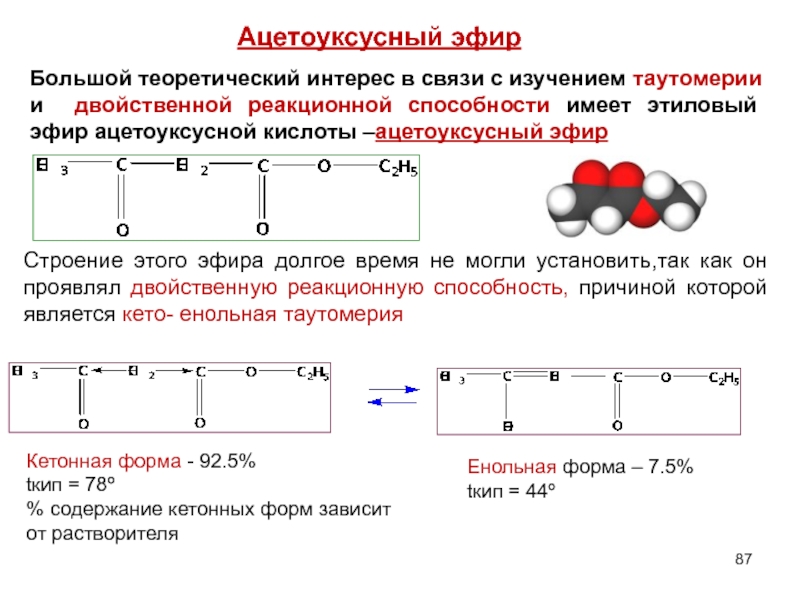
- 87. Большой теоретический интерес в связи с изучением
- 88. Енольная форма стабилизируется за счет сопряжения двойной
- 89. Как енол ацетоуксусный эфир
- 90. При добавлении избытка FeCl3 появляется фиолетовая окраска
- 91. Кето-енольная таутомерия Кнорр, Людвиг (2 декабря
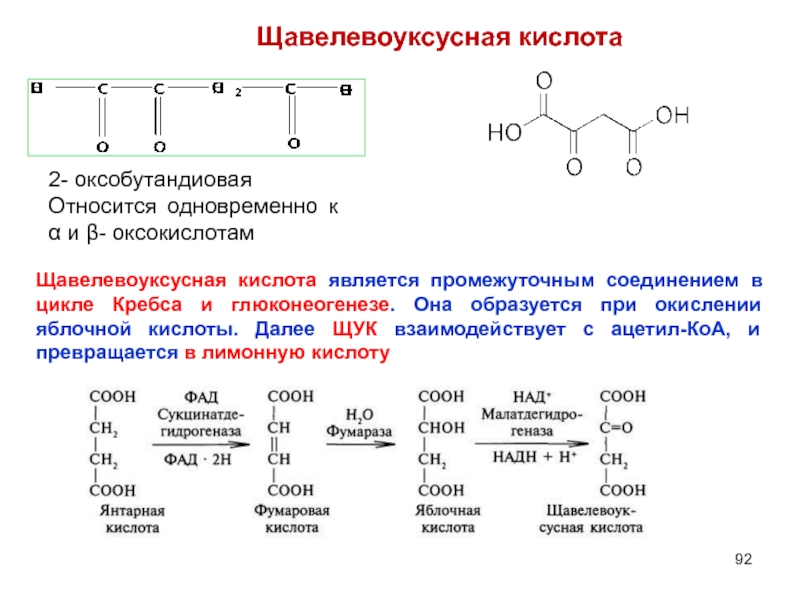
- 92. Щавелевоуксусная кислота Щавелевоуксусная кислота является промежуточным соединением
- 93. Для щавелевоуксусной кислоты характерна кето-енольная таутомерия,
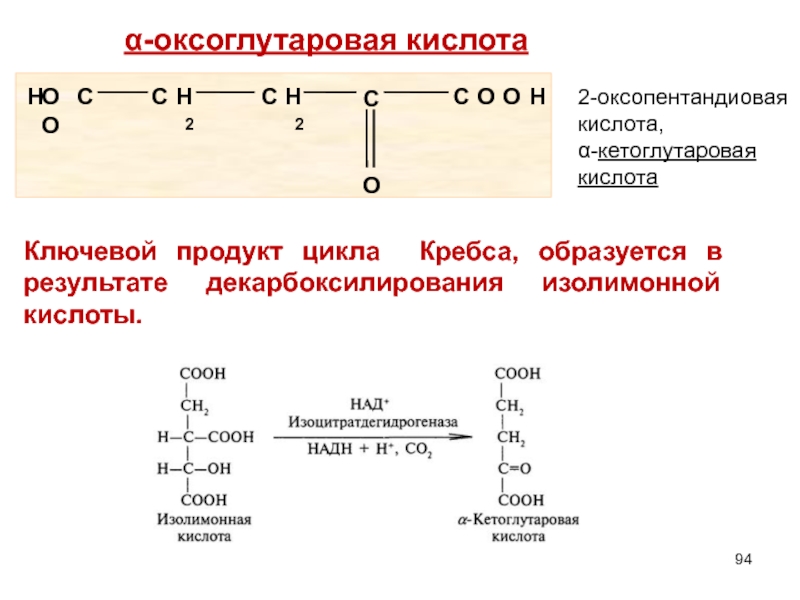
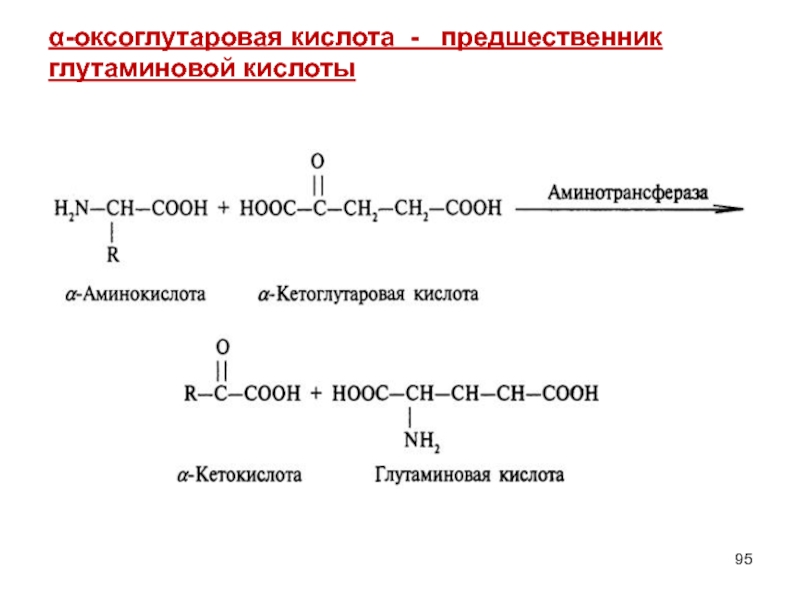
- 94. α-оксоглутаровая кислота 2-оксопентандиовая кислота, α-кетоглутаровая кислота
- 95. α-оксоглутаровая кислота - предшественник глутаминовой кислоты
- 96. Спектроскопия ядерного магнитного резонанса
- 97. ЯМР Спектроскопия ядерного магнитного резонанса (ЯМР) является
- 98. В органической химии наибольшее распространение получили: Спектроскопия
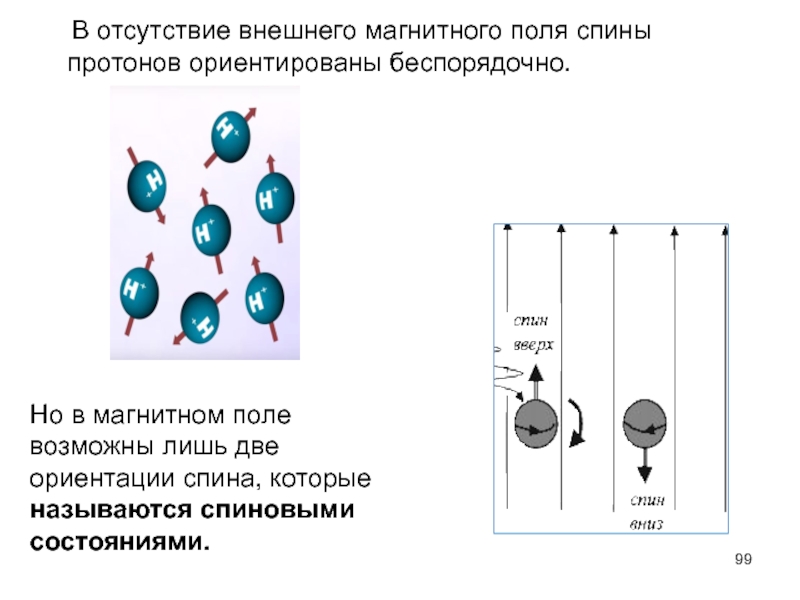
- 99. В отсутствие внешнего магнитного поля спины
- 100. При помещении вещества в сильное магнитное поле
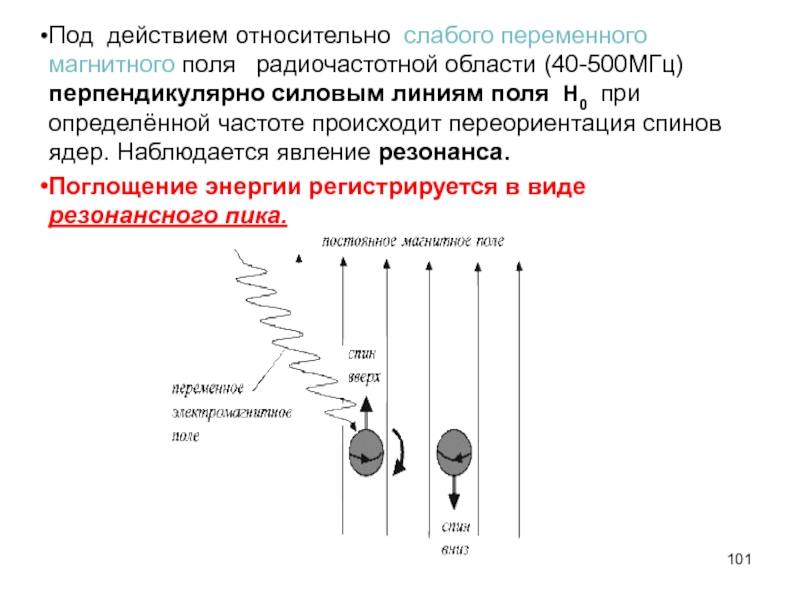
- 101. Под действием относительно слабого переменного магнитного поля
- 102. Спектроскопия ЯМР Атомы водорода в молекуле находятся
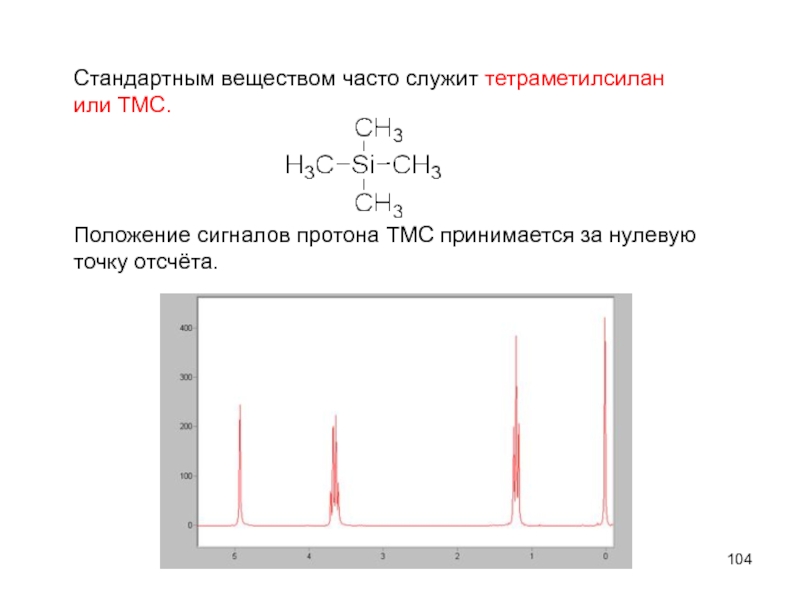
- 104. Стандартным веществом часто служит тетраметилсилан или ТМС.
- 105. Химический сдвиг в ЯМР Шкала химических сдвигов
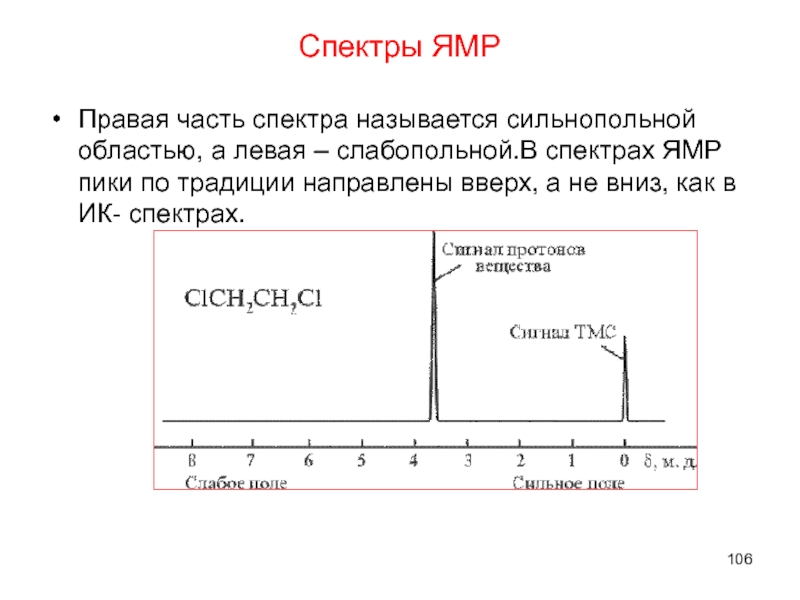
- 106. Спектры ЯМР Правая часть спектра называется сильнопольной
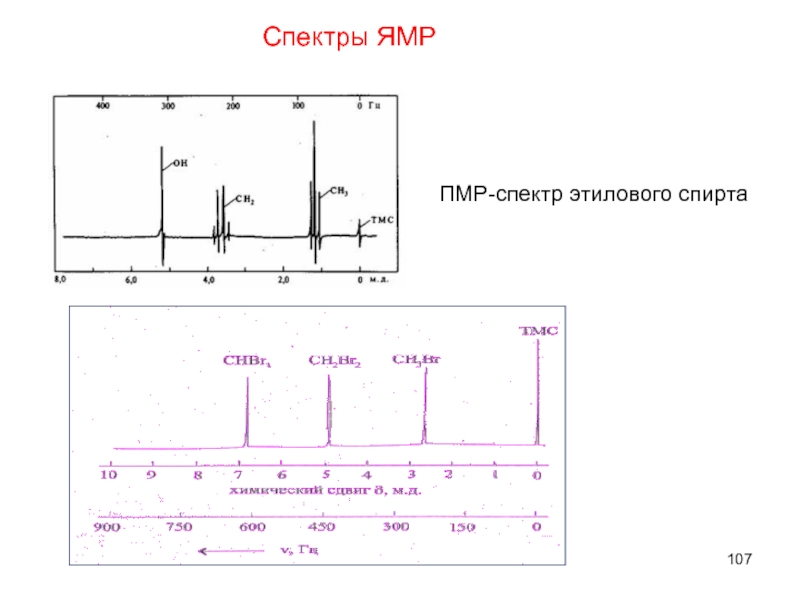
- 107. ПМР-спектр этилового спирта Спектры ЯМР
- 108. Спектры ЯМР Для интерпретации спектра и получения
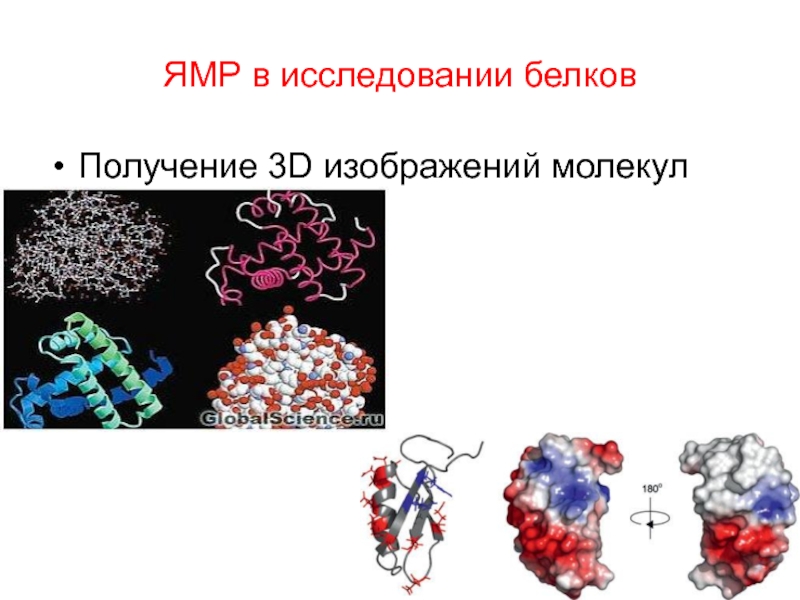
- 109. ЯМР в исследовании белков Получение 3D изображений молекул
- 110. Использование ЯМР в медицине
- 111. Метод ядерного магнитного резонанса При воздействии на
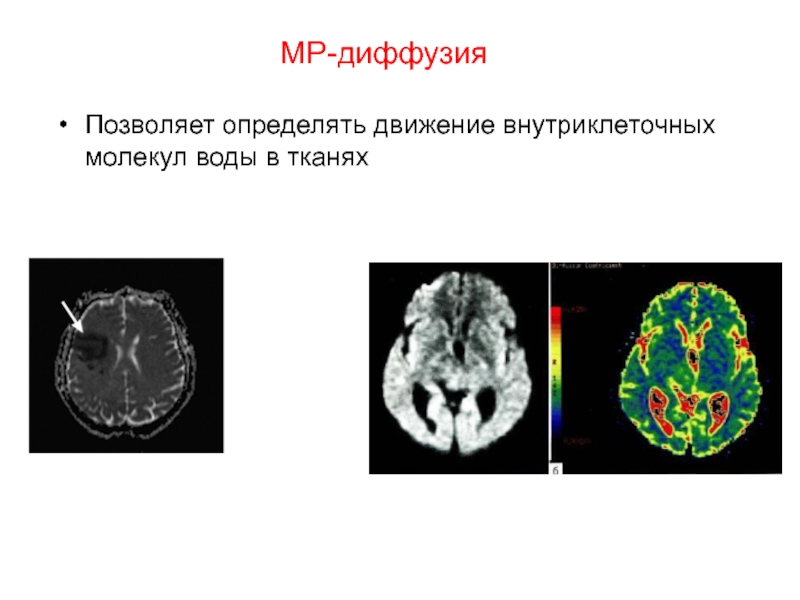
- 112. МР-диффузия Позволяет определять движение внутриклеточных молекул воды в тканях
- 113. МР-перфузия Метод позволяющий оценить прохождение крови через ткани организма.
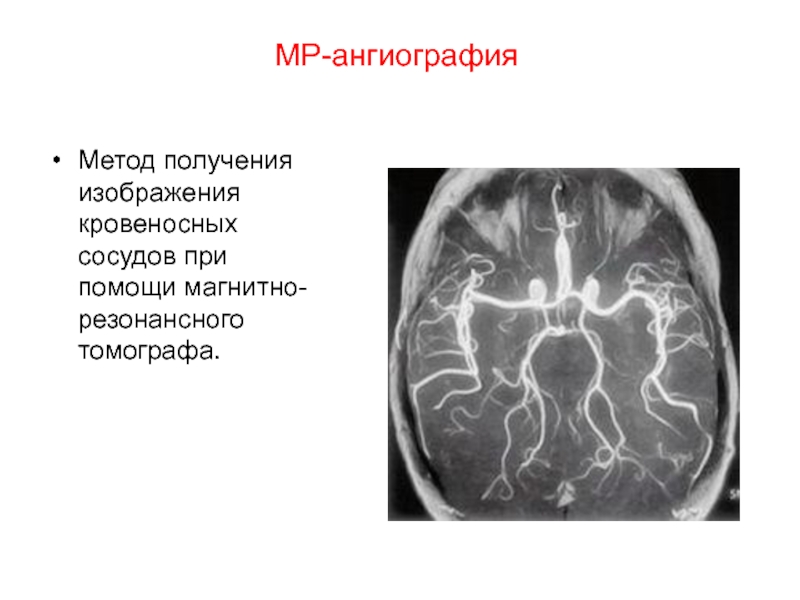
- 114. МР-ангиография Метод получения изображения кровеносных сосудов при помощи магнитно-резонансного томографа.
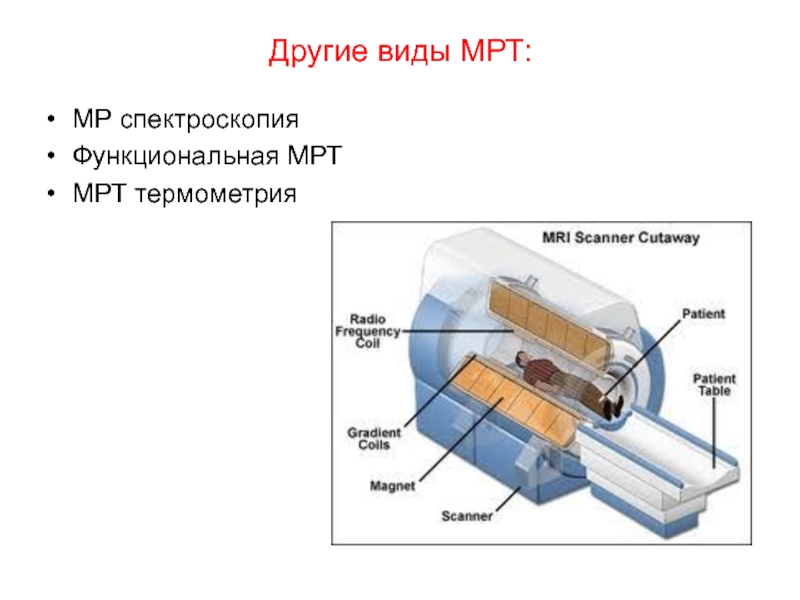
- 115. Другие виды МРТ: МР спектроскопия Функциональная МРТ МРТ термометрия
- 116. Спасибо за внимание!
Слайд 1Оптическая изомерия.
Гидрокси – и оксокислоты.
Спектроскопия ядерного магнитного резонанса
Кафедра общей и
Слайд 2Оптическая изомерия.
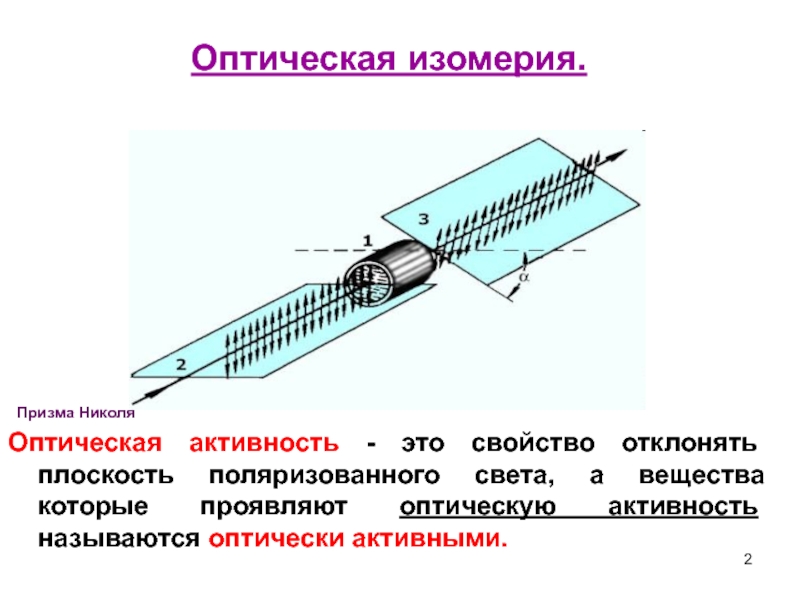
Оптическая активность - это свойство отклонять плоскость поляризованного света,
Призма Николя
Слайд 3
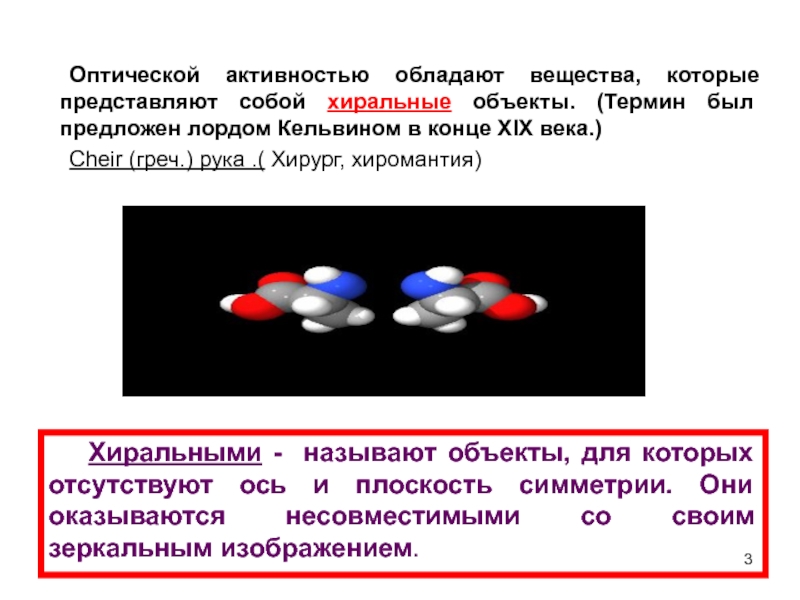
Оптической активностью обладают вещества, которые представляют собой хиральные объекты. (Термин был
Cheir (греч.) рука .( Хирург, хиромантия)
Хиральными - называют объекты, для которых отсутствуют ось и плоскость симметрии. Они оказываются несовместимыми со своим зеркальным изображением.
Слайд 4ХИРАЛЬНОСТЬ
свойство молекулы быть несовместимой со своим зеркальным отражением любой комбинацией вращений
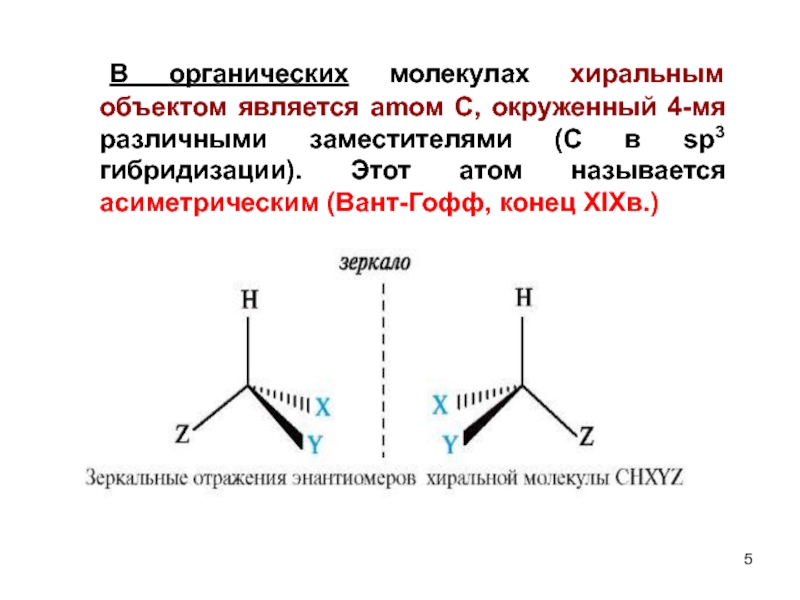
Слайд 5 В органических молекулах хиральным объектом является amом С, окруженный 4-мя различными
Слайд 6Якоб Хендрик Вант-Гофф (1852—1911)
Был первым Нобелевским лауреатом(1901) по химии за открытие
Лорд Кельвин
(Вильям Томсон)
(1824 - 1907)
В круг научных интересов Томсона входили термодинамика, гидродинамика, электромагнетизм, теория упругости, теплота, математика, техника.
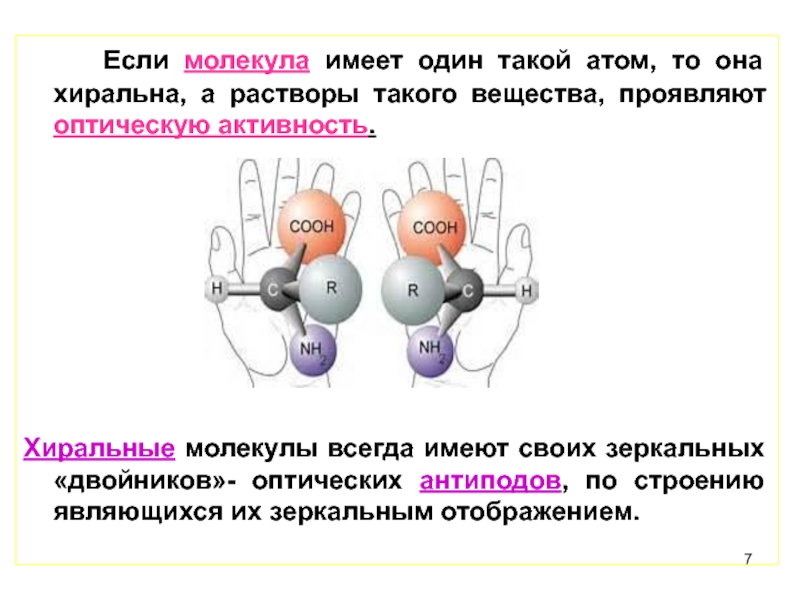
Слайд 7 Если молекула имеет один такой атом, то она хиральна, а растворы
Хиральные молекулы всегда имеют своих зеркальных «двойников»- оптических антиподов, по строению являющихся их зеркальным отображением.
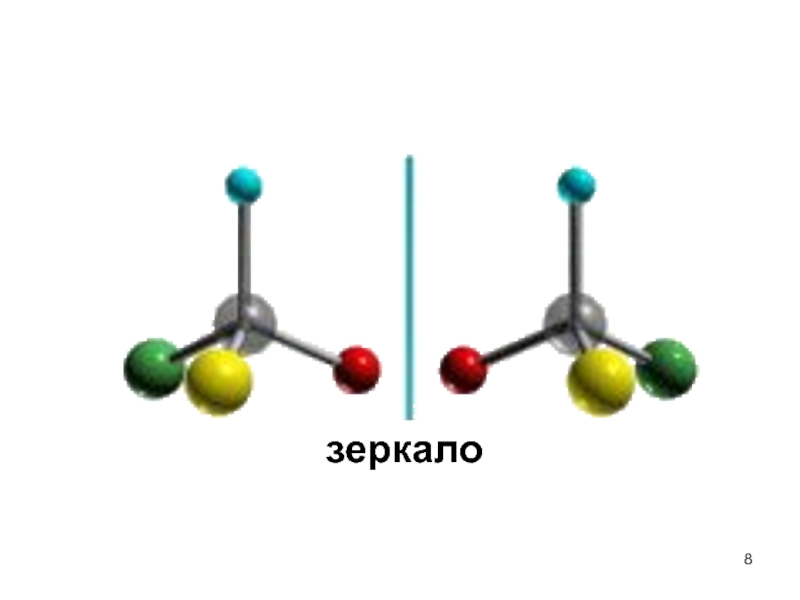
Слайд 9 Изомеры, относящиеся друг к другу как предмет и зеркальное отображение и
Энантиомер, отклоняющий луч света по часовой стрелке, называют правовращающим и обозначают (+), а его антипод – левовращающим (-).
Количество энантиомеров определяется по формуле N=2n, где n – количество хиральных атомов в молекуле.
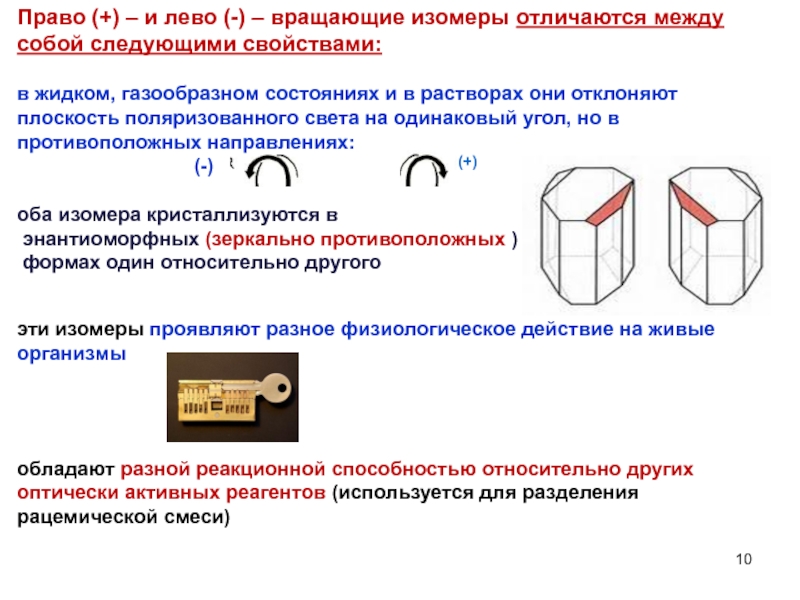
Слайд 10Право (+) – и лево (-) – вращающие изомеры отличаются между
оба изомера кристаллизуются в
энантиоморфных (зеркально противоположных )
формах один относительно другого
эти изомеры проявляют разное физиологическое действие на живые организмы
обладают разной реакционной способностью относительно других оптически активных реагентов (используется для разделения рацемической смеси)
(+)
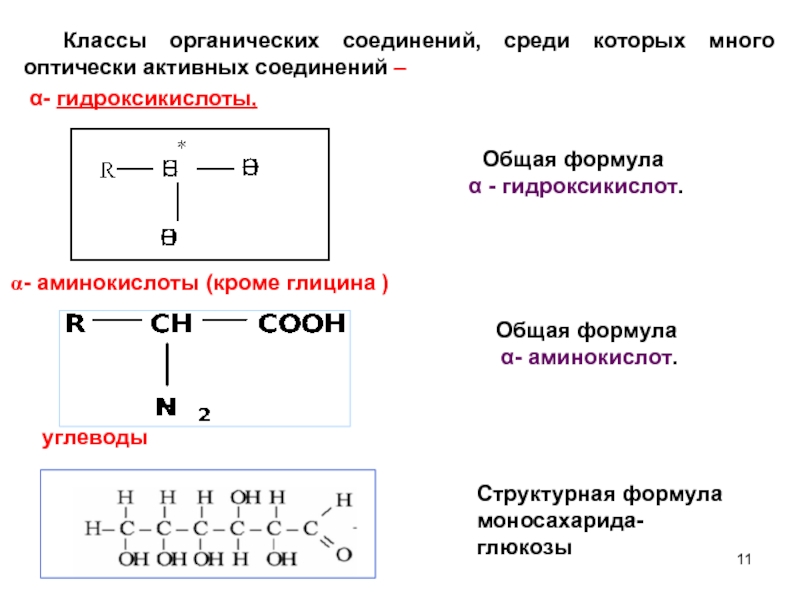
Слайд 11
Общая формула
α - гидроксикислот.
Классы органических соединений, среди которых много
α- гидроксикислоты,
- аминокислоты (кроме глицина )
углеводы
Общая формула
α- аминокислот.
Структурная формула моносахарида-глюкозы
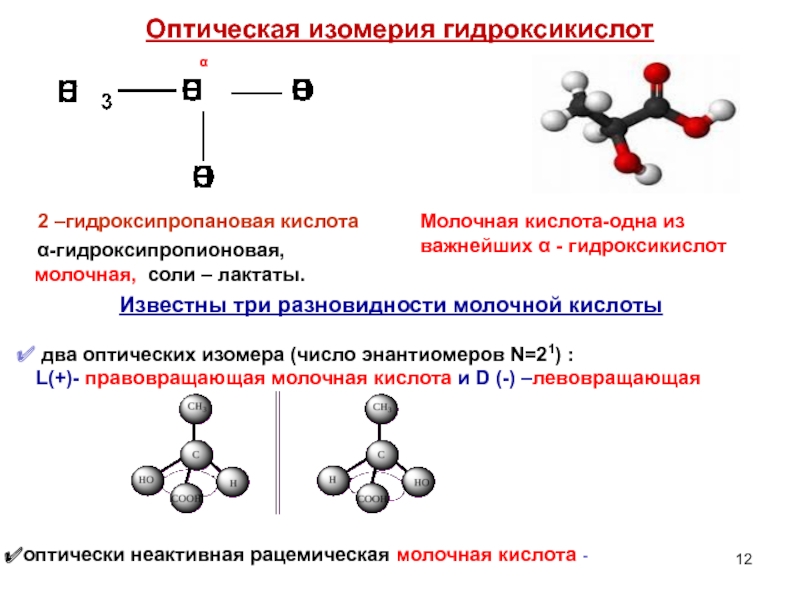
Слайд 12Оптическая изомерия гидроксикислот
2 –гидроксипропановая кислота
α
Молочная кислота-одна из важнейших α - гидроксикислот
Известны три разновидности молочной кислоты
два оптических изомера (число энантиомеров N=21) :
L(+)- правовращающая молочная кислота и D (-) –левовращающая
оптически неактивная рацемическая молочная кислота -
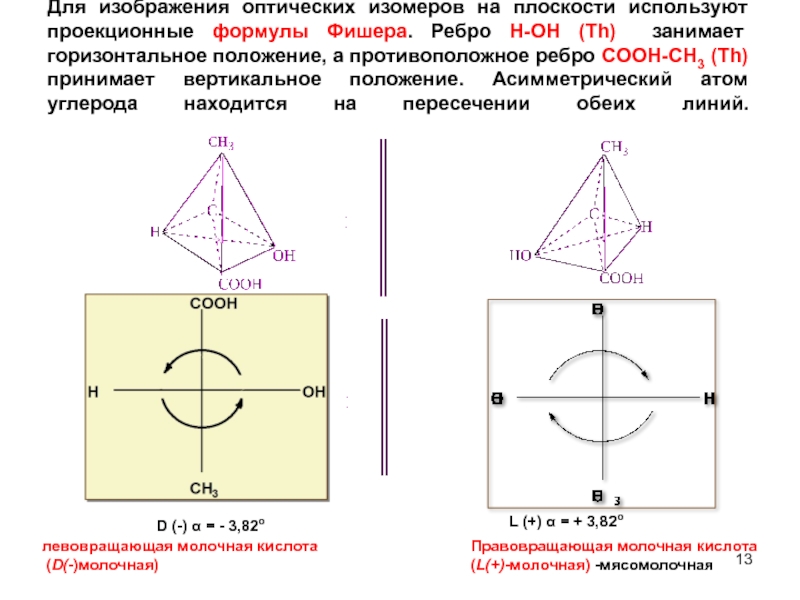
Слайд 13Для изображения оптических изомеров на плоскости используют проекционные формулы Фишера. Ребро
D (-) α = - 3,82о
L (+) α = + 3,82о
левовращающая молочная кислота
(D(-)молочная)
Правовращающая молочная кислота (L(+)-молочная) -мясомолочная
Слайд 14
Правовращающая L(+)-молочная кислота открыта Либихом (1847) и получила название мясомолочной
Она всегда присутствует в организме человека, является конечным продуктом гликолиза – распада глюкозы с образованием молочной кислоты и источника энергии – АТФ.
Образуется в мышцах при физической нагрузке.
Молочная кислота – это показатель обмена углеводов, отражающий степень насыщения мышц и тканей кислородом
Слайд 15Чистая левовращающая молочная D(-) кислота может быть получена брожением сахаристых веществ
Рацемическая молочная кислота - оптически неактивная, не вращает плоскость поляризации, так как она состоит из смеси равных количеств двух зеркальных изомеров.Один из них вызывает правое вращение, второй - на такой угол-левое.
Такой является молочная кислота, полученная под действием молочнокислых бактерий при скисании молока, квашении капусты, солении огурцов, помидоров.
Слайд 16
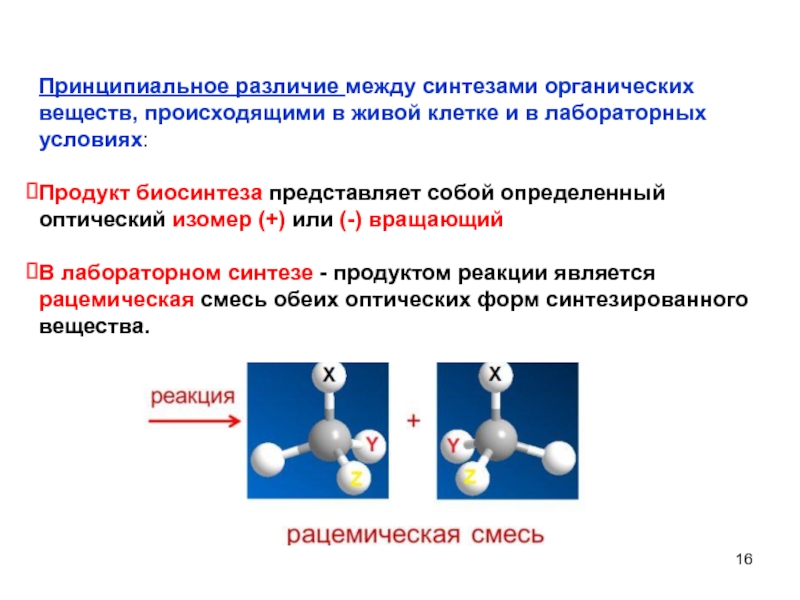
Принципиальное различие между синтезами органических веществ, происходящими в живой клетке и
Продукт биосинтеза представляет собой определенный оптический изомер (+) или (-) вращающий
В лабораторном синтезе - продуктом реакции является рацемическая смесь обеих оптических форм синтезированного вещества.
Слайд 17Способы разделения рацемической смеси:
Биохимический – (+) и (-) антиподы оказывают разное
Хроматографический – расщепление рацематов на оптически активных сорбентах (афинная хроматография).
Химический - основан на химической реакции антипода с оптически деятельным веществом.
Механический – отбор кристаллов по внешнему виду (кристаллы имеют зеркально-скошенные грани).
Слайд 18Оптическая изомерия гидроксикислот
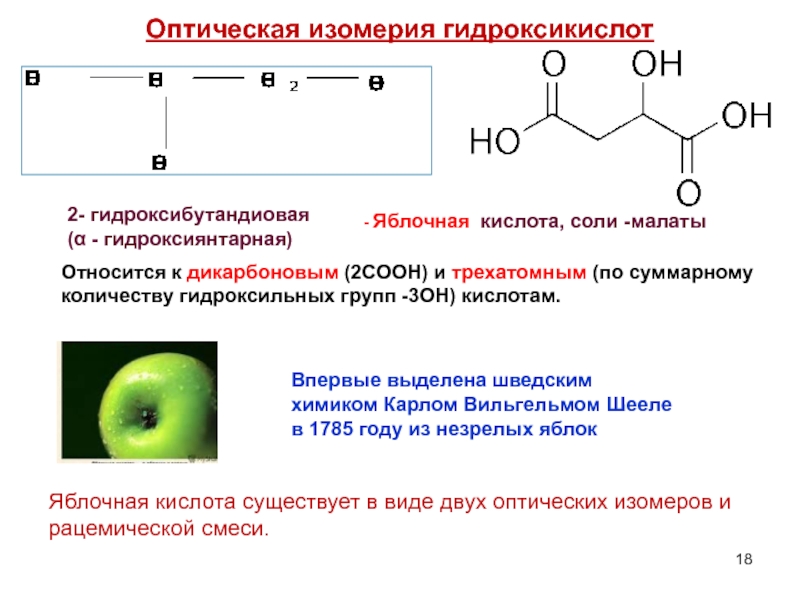
2- гидроксибутандиовая
(α - гидроксиянтарная)
- Яблочная кислота, соли -малаты
Впервые
Яблочная кислота существует в виде двух оптических изомеров и рацемической смеси.
Относится к дикарбоновым (2СООН) и трехатомным (по суммарному количеству гидроксильных групп -3ОН) кислотам.
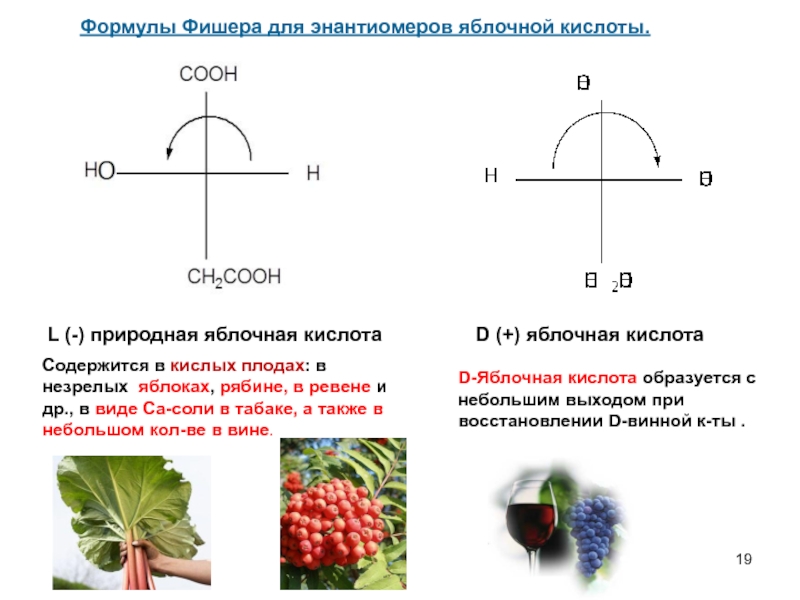
Слайд 19Формулы Фишера для энантиомеров яблочной кислоты.
L (-) природная яблочная кислота
D (+)
Содержится в кислых плодах: в незрелых яблоках, рябине, в ревене и др., в виде Са-соли в табаке, а также в небольшом кол-ве в вине.
D-Яблочная кислота образуется с небольшим выходом при восстановлении D-винной к-ты .
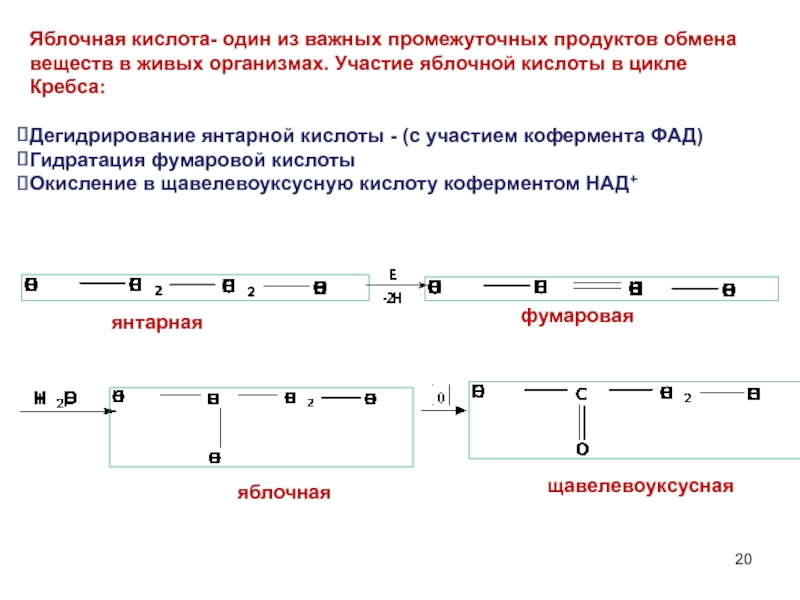
Слайд 20Яблочная кислота- один из важных промежуточных продуктов обмена веществ в живых
Дегидрирование янтарной кислоты - (с участием кофермента ФАД)
Гидратация фумаровой кислоты
Окисление в щавелевоуксусную кислоту коферментом НАД+
янтарная
фумаровая
яблочная
щавелевоуксусная
Слайд 21Применение яблочной кислоты
Применяется как пищевая добавка (Е296) при изготовлении фруктовых вод
В медицине для производства слабительного и лекарств от хрипоты;
Один из компонентов косметических препаратов.
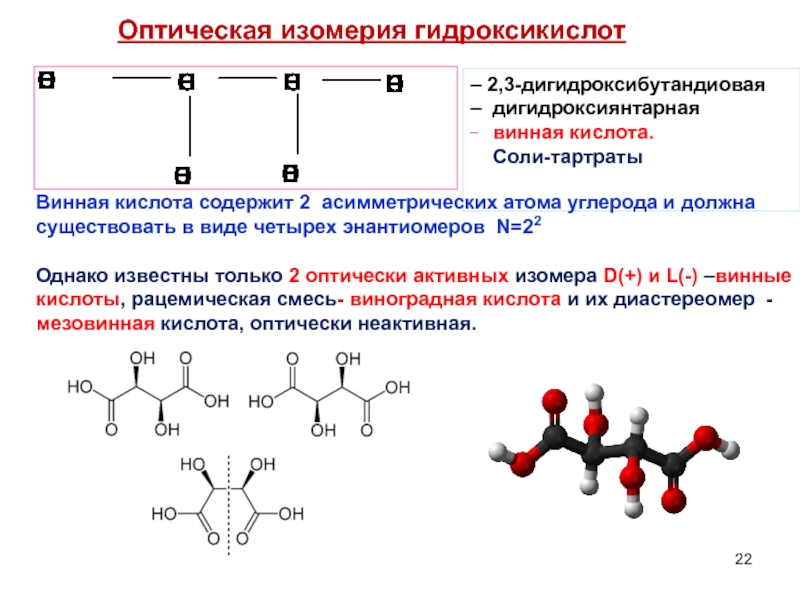
Слайд 22Оптическая изомерия гидроксикислот
– 2,3-дигидроксибутандиовая
– дигидроксиянтарная
_ винная кислота.
Соли-тартраты
Винная кислота
Однако известны только 2 оптически активных изомера D(+) и L(-) –винные кислоты, рацемическая смесь- виноградная кислота и их диастереомер - мезовинная кислота, оптически неактивная.
Слайд 23Формулы Фишера для оптически активных изомеров винной кислоты
D (+) [α]20 =
L (-) [α]20 = -12о , tпл. = 170о
Природная винная кислота
L (-) винная кислота) не встречается самостоятельно в природе;
химические свойства - точное повторение свойств D(+)
. Отличается, отношением к низшим организмам и к органическим основаниям, обладающим оптической деятельностью
В значительном количестве D(+)-винная кислота содержится в винограде,рябине. При изготовлении и выдержке виноградных вин в бочках осаждается винный камень (гидротартрат калия)-
НOOC-СН(ОН)-СН(ОН)-СООК.
энантиомеры
HHOHOO
HO
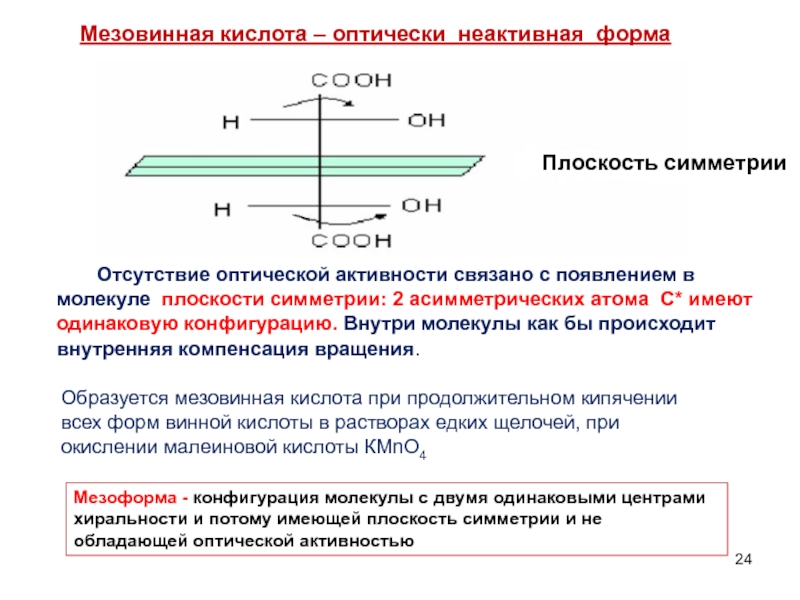
Слайд 24Образуется мезовинная кислота при продолжительном кипячении всех форм винной кислоты в
Мезовинная кислота – оптически неактивная форма
Отсутствие оптической активности связано с появлением в молекуле плоскости симметрии: 2 асимметрических атома С* имеют одинаковую конфигурацию. Внутри молекулы как бы происходит внутренняя компенсация вращения.
Плоскость симметрии
Мезоформа - конфигурация молекулы с двумя одинаковыми центрами хиральности и потому имеющей плоскость симметрии и не обладающей оптической активностью
Слайд 25Применение винной кислоты
В пищевой промышленности в качестве консерванта и подкислителя вкуса(Е334)
Является компонентом многих кремов и лосьонов для тела и лица;
В фармацевтической промышленности, где ее широко применяют при производстве различных растворимых медикаментов, а также шипучих таблеток и некоторых других лекарств;
В аналитической химии – для обнаружения альдегидов и сахаров.
Слайд 26Виноградная кислота - рацемическая смесь винных кислот
Виноградная кислота была открыта в
В 1830 году Берцелиус установил, что она имеет тот же элементный состав, что и винная кислота.
.
Йенс Якоб Берцелиус (1779-1848)
экспериментально подтвердил закон кратных отношений разработал современную химическую нотацию, электрохимическую теорию сродства, открыл церий селен, торий и впервые выделил в чистом виде кремний,титан ,тантал и цирконий.
Слайд 27Виноградная кислота - рацемическая смесь винных кислот
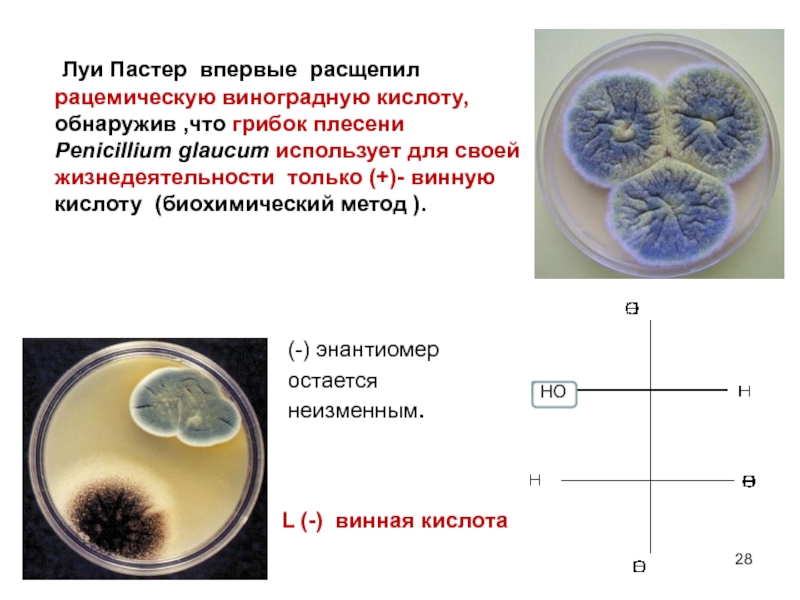
Луи Пастер (Louis Pasteur) (1822
Луи Пастером были проведены классические исследования с виноградной и винной кислотами .
Он выяснил природу рацемических соединений .
Разработал методы их разделения на составляющие их оптические изомеры.
Слайд 28(-) энантиомер
остается
неизменным.
Луи Пастер
HO
L (-) винная кислота
Слайд 29Виноградная кислота получается длительным нагреванием водных растворов D - или L-винной
В промышленных масштабах виноградную кислоту выделяют из отходов виноделия: винного камня, виннокислой извести, сушёных винных дрожжей.
Свойства виноградной кислоты отличаются от свойств чистых оптических изомеров винной кислоты t пл.=2050С. Очевидно, что это не просто смесь изомеров, а молекулярное соединение (рацемическое).
Виноградная кислота - рацемическая смесь винных кислот
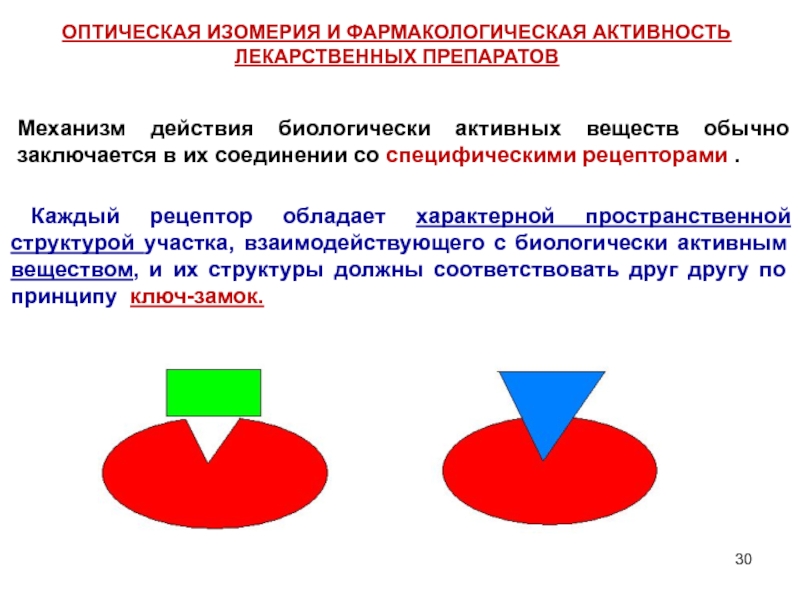
Слайд 30Механизм действия биологически активных веществ обычно заключается в их соединении со
Каждый рецептор обладает характерной пространственной структурой участка, взаимодействующего с биологически активным веществом, и их структуры должны соответствовать друг другу по принципу ключ-замок.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Слайд 31
Структуры взаимодействующих соединений должны соответствовать друг другу по
ключ – замок.
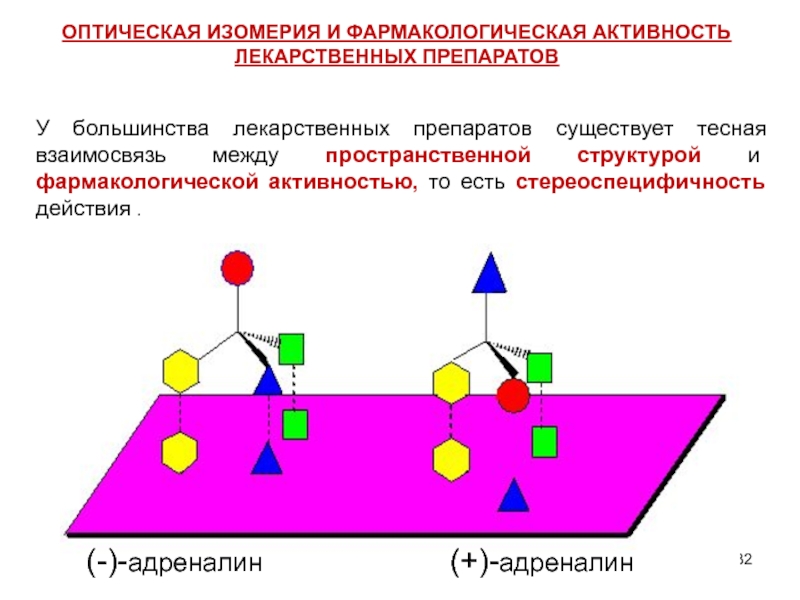
Слайд 32У большинства лекарственных препаратов существует тесная взаимосвязь между пространственной структурой и
(-)-адреналин
(+)-адреналин
ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
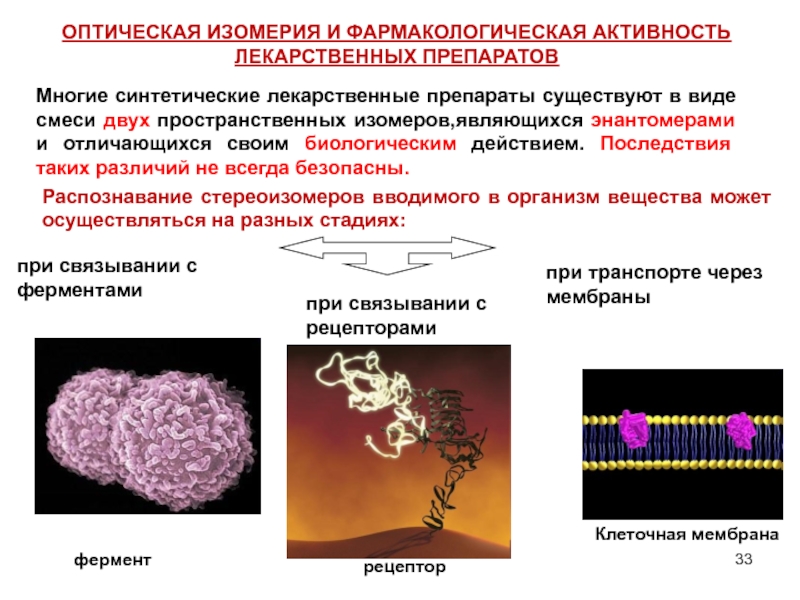
Слайд 33Многие синтетические лекарственные препараты существуют в виде смеси двух пространственных изомеров,являющихся
фермент
рецептор
Распознавание стереоизомеров вводимого в организм вещества может осуществляться на разных стадиях:
Клеточная мембрана
при связывании с ферментами
при связывании с рецепторами
при транспорте через мембраны
ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Слайд 34Основная фармакологическая активность рацемических лекарственных препаратов обычно связана с действием лишь
Известны примеры использования в терапевтической практике рацемических препаратов, когда один из стереоизомеров обладал сильным токсическим эффектом. Это приводило к трагическим случаям.
(+)Талидомид вызывал недоразвитие конечностей у новорожденных
(-)Талидомид - мощный транквилизатор
ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
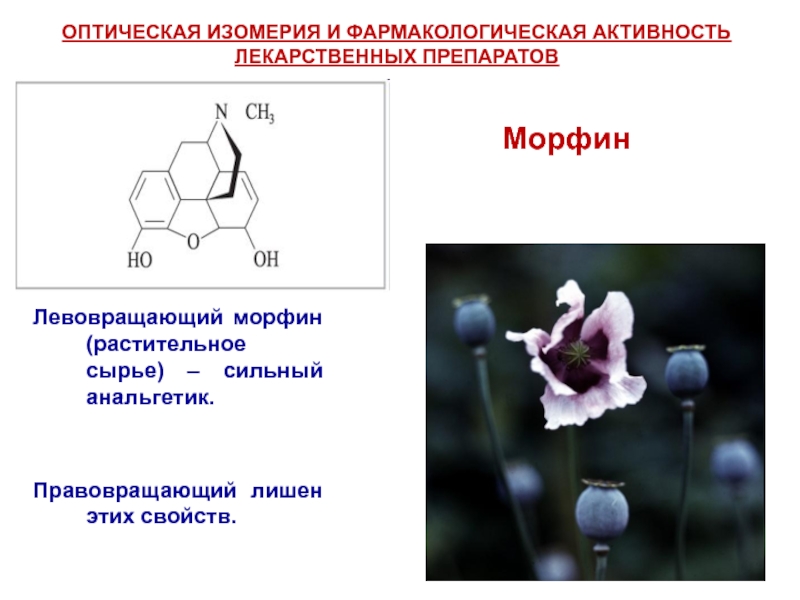
Слайд 35Левовращающий морфин (растительное сырье) – сильный анальгетик.
Правовращающий лишен этих свойств.
Морфин
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
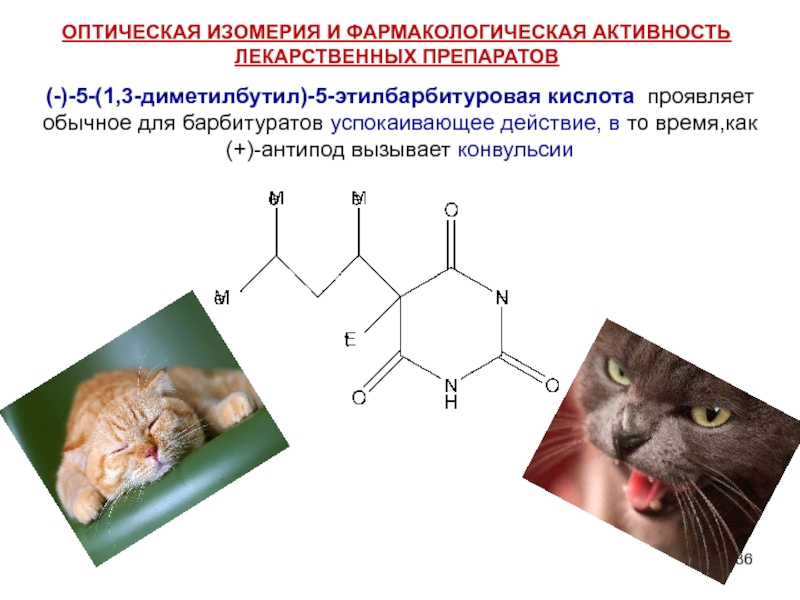
Слайд 36(-)-5-(1,3-диметилбутил)-5-этилбарбитуровая кислота проявляет обычное для барбитуратов успокаивающее действие, в то время,как
ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
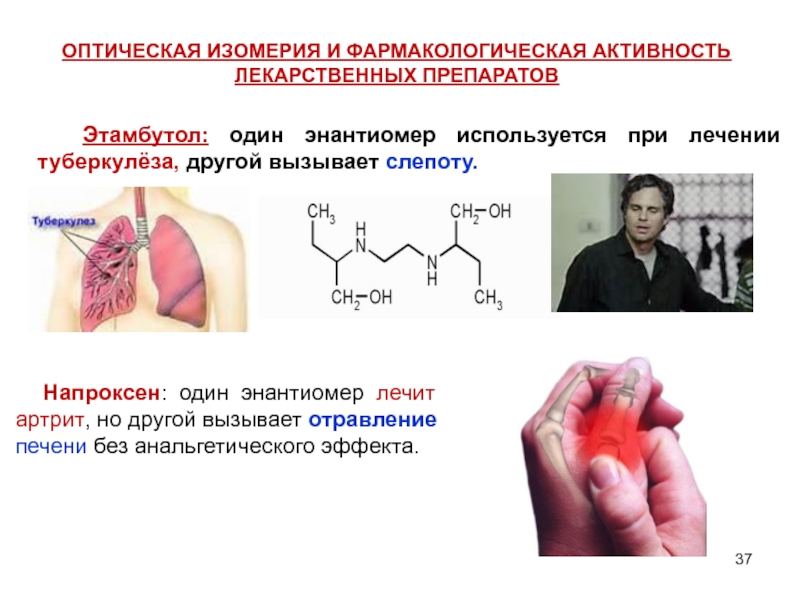
Слайд 37ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Напроксен: один
Этамбутол: один энантиомер используется при лечении туберкулёза, другой вызывает слепоту.
Слайд 38В течение нескольких последних десятилетий велись интенсивные исследования по развитию методов
В 2001 году Нобелевская премия была присуждена японскому ученому Риоджи Нойори, и двум американским – Уильяму Ноулзу и Бэрри Шарплессу. Ученые разработали хиральные катализаторы для двух важных классов реакций органической химии: гидрирования и окисления.
Нобелевские луреаты сделали возможным промышленный синтез таких фармакологических продуктов, как антибиотики, противовоспалительные и сердечные средства, а также других веществ, среди которых кондитерские отдушки, подсластители и инсектициды
ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Слайд 39Нобелевская премия 2001года
Открытия ученых в области хиральных катализаторов позволили наладить производство
Риоджи Нойори
Уильям Нойлес
Барри Шарплесс
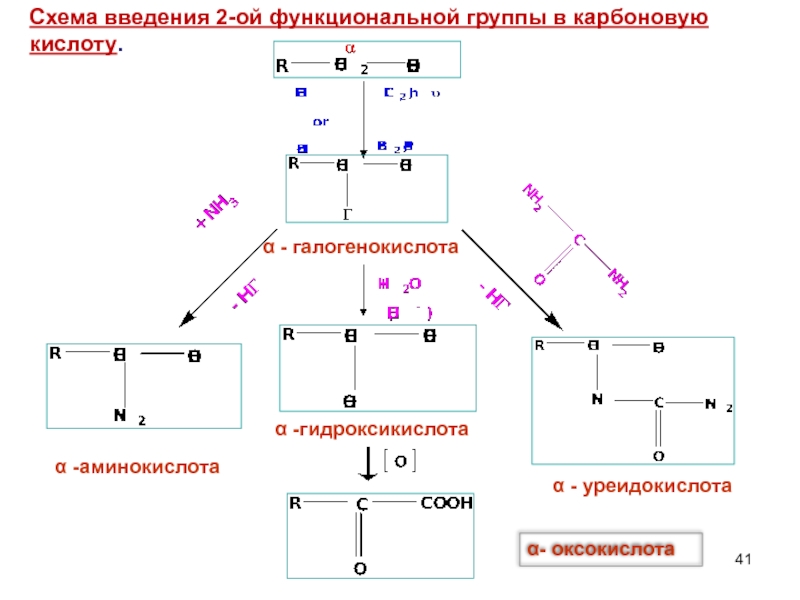
Слайд 41Схема введения 2-ой функциональной группы в карбоновую кислоту.
α - галогенокислота
α -аминокислота
α
α- оксокислота
α - уреидокислота
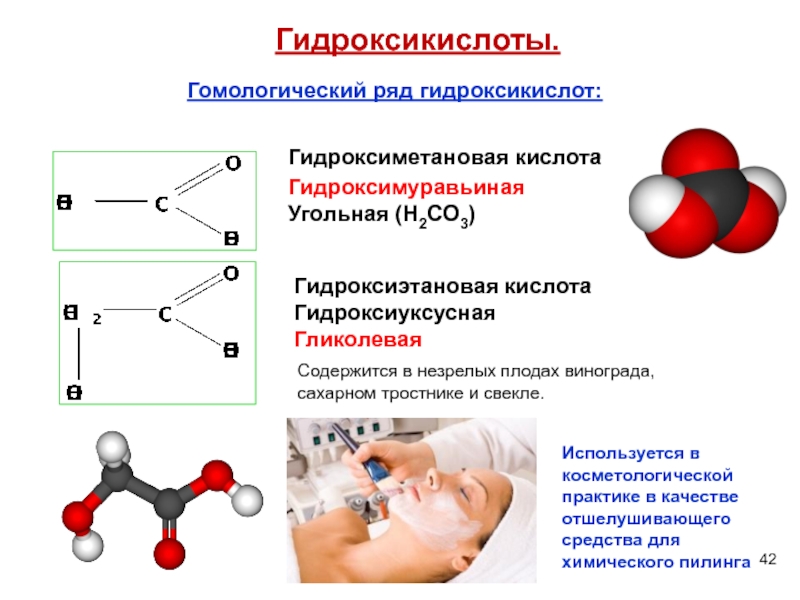
Слайд 42Гомологический ряд гидроксикислот:
Гидроксикислоты.
Гидроксиметановая кислота
Гидроксимуравьиная
Угольная (H2CO3)
Гидроксиэтановая кислота
Гидроксиуксусная
Гликолевая
Содержится в незрелых плодах винограда,
Используется в косметологической практике в качестве отшелушивающего средства для химического пилинга
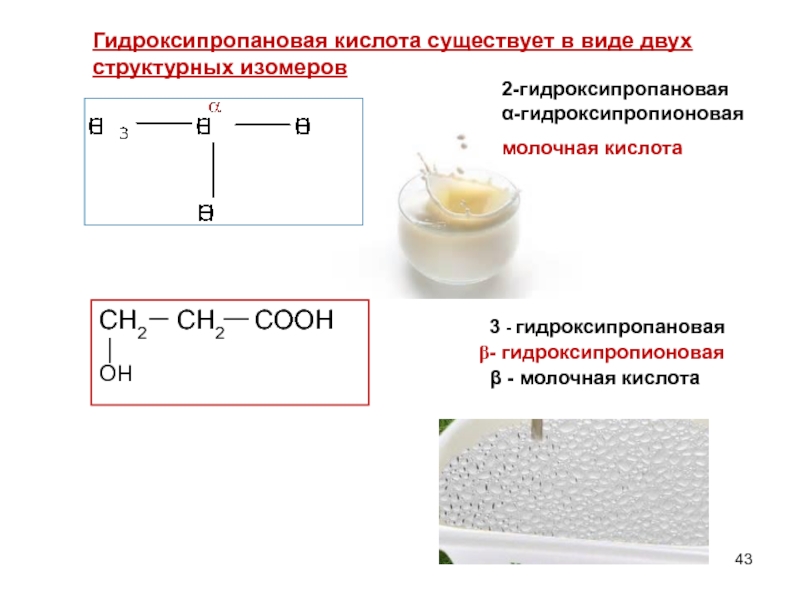
Слайд 432-гидроксипропановая α-гидроксипропионовая
молочная кислота
3 - гидроксипропановая
- гидроксипропионовая
β - молочная кислота
Гидроксипропановая
СН2 СН2 СООН
ОН
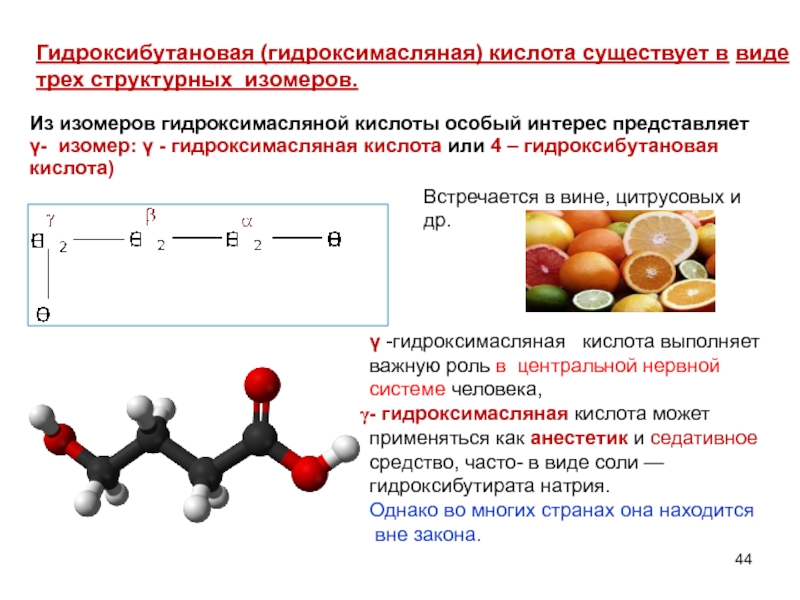
Слайд 44Гидроксибутановая (гидроксимасляная) кислота существует в виде трех структурных изомеров.
Из изомеров гидроксимасляной
γ- изомер: γ - гидроксимасляная кислота или 4 – гидроксибутановая кислота)
γ -гидроксимасляная кислота выполняет важную роль в центральной нервной системе человека,
- гидроксимасляная кислота может применяться как анестетик и седативное средство, часто- в виде соли — гидроксибутирата натрия.
Однако во многих странах она находится
вне закона.
Встречается в вине, цитрусовых и др.
Слайд 452 – метоксипропановая
(простой эфир)
2 - хлорпропановая к-та
пировиноградная
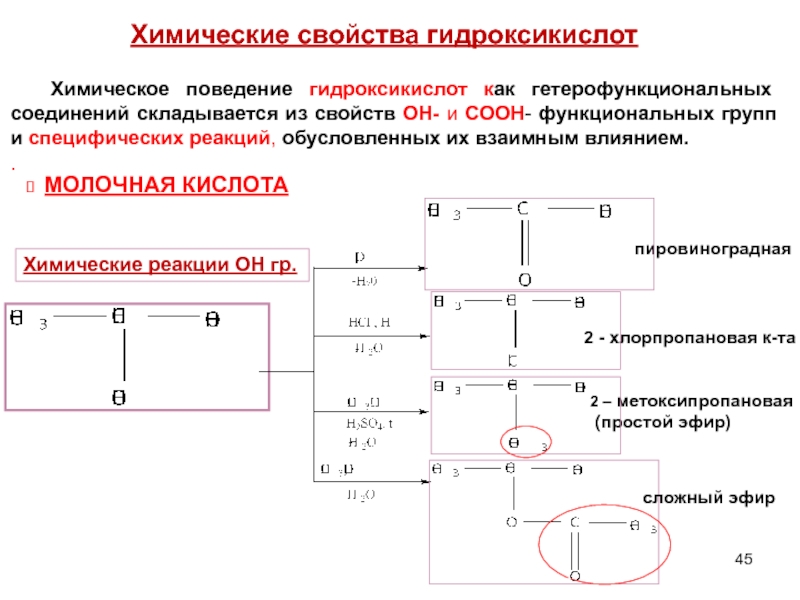
Химические свойства гидроксикислот
Химическое поведение
.
Химические реакции ОН гр.
МОЛОЧНАЯ КИСЛОТА
сложный эфир
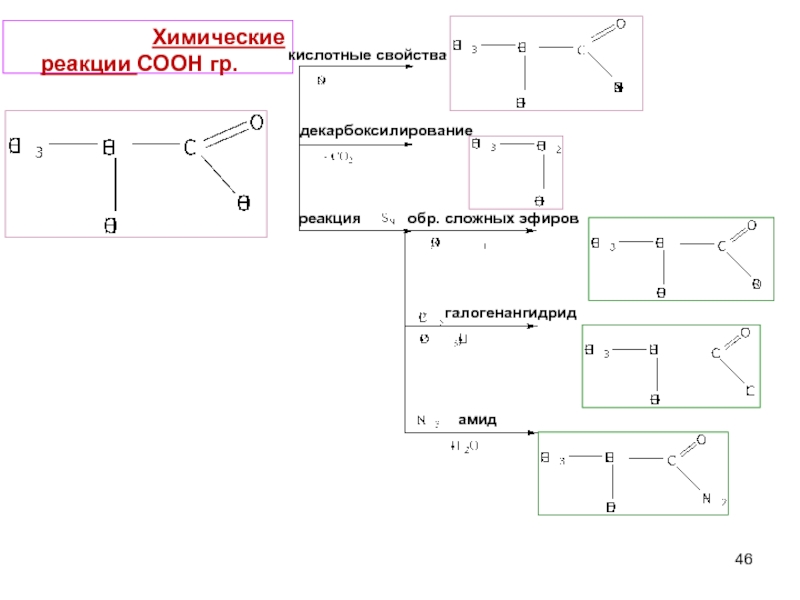
Слайд 46 Химические реакции СООН гр.
кислотные свойства
декарбоксилирование
реакция
обр. сложных эфиров
галогенангидрид
амид
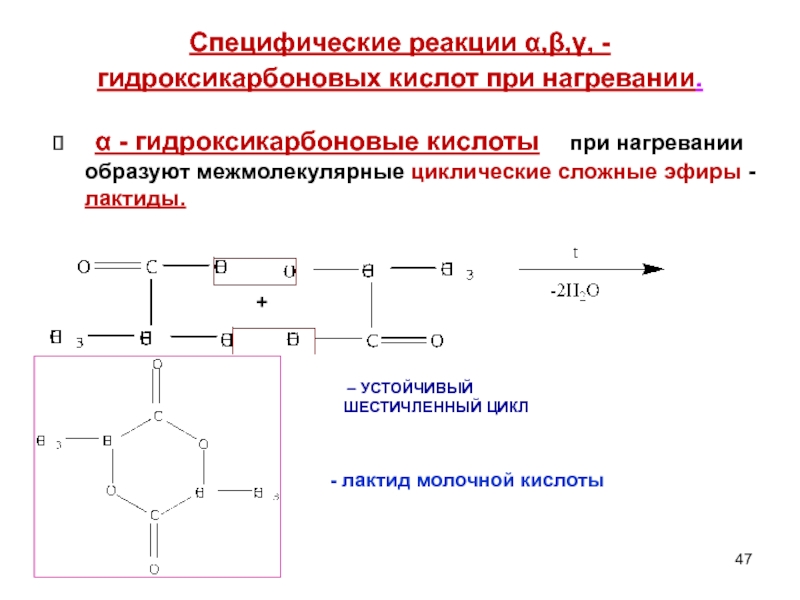
Слайд 47Специфические реакции α,β,γ, - гидроксикарбоновых кислот при нагревании.
α - гидроксикарбоновые
+
– УСТОЙЧИВЫЙ ШЕСТИЧЛЕННЫЙ ЦИКЛ
- лактид молочной кислоты
Слайд 48α - гидроксикарбоновые кислоты при нагревании в присутствии разбавленной Н2SO4
Слайд 49
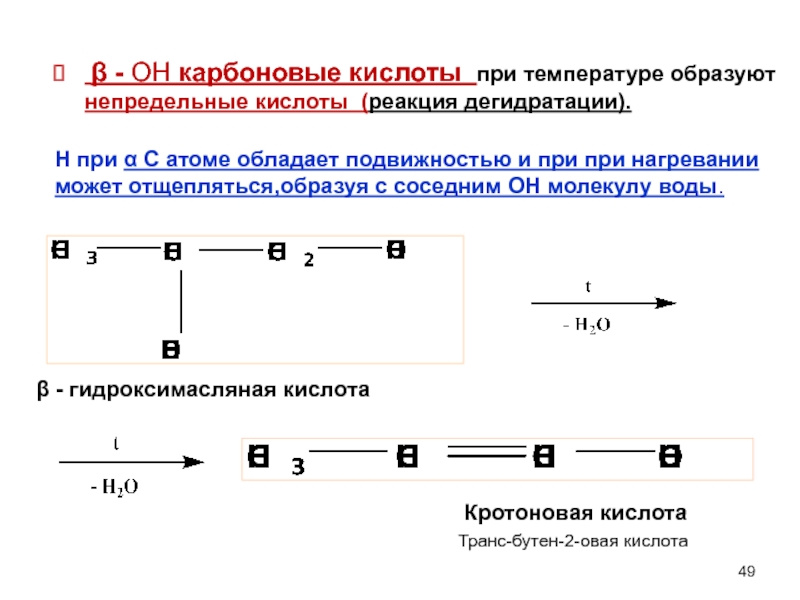
β - ОН карбоновые кислоты при температуре образуют непредельные кислоты (реакция дегидратации).
β - гидроксимасляная кислота
Кротоновая кислота
Н при α С атоме обладает подвижностью и при при нагревании может отщепляться,образуя с соседним ОН молекулу воды.
Транс-бутен-2-овая кислота
Слайд 50
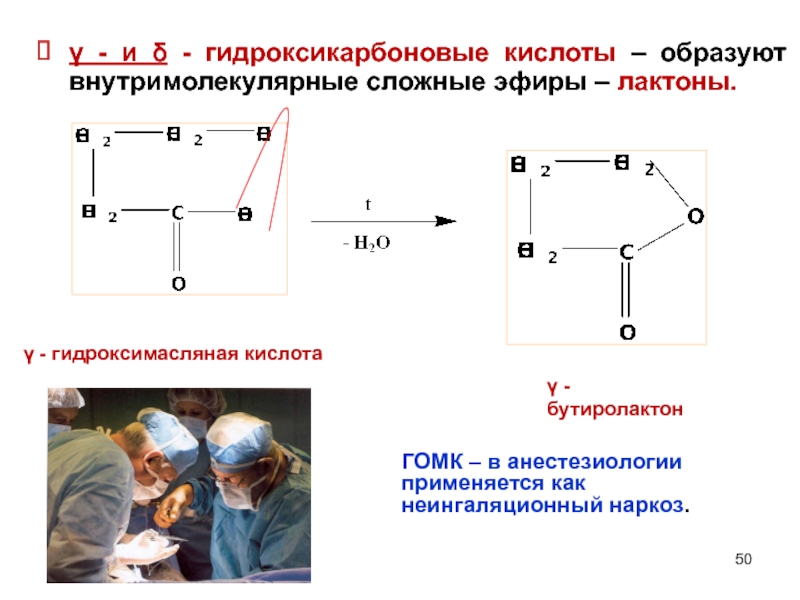
γ - и δ - гидроксикарбоновые кислоты – образуют внутримолекулярные сложные
ГОМК – в анестезиологии применяется как неингаляционный наркоз.
γ - гидроксимасляная кислота
γ - бутиролактон
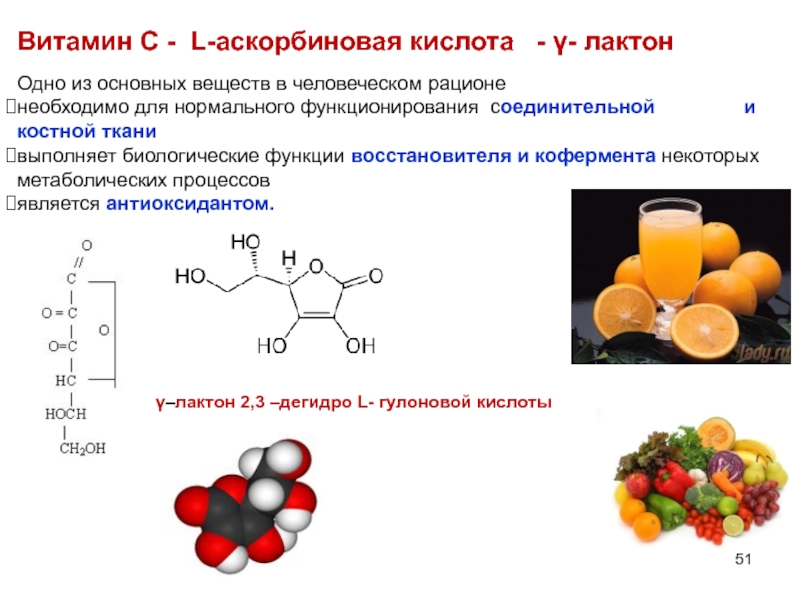
Слайд 51Одно из основных веществ в человеческом рационе
необходимо для нормального функционирования соединительнойтельной
выполняет биологические функции восстановителя и кофермента некоторых метаболических процессов
является антиоксидантом.
Витамин С - L-аскорбиновая кислота - γ- лактон
γ–лактон 2,3 –дегидро L- гулоновой кислоты
Слайд 52Химические свойства винной кислоты
Винная кислота – дигидроксиянтарная кислота содержит
Кроме двух
Свойства СООН –групп - все характерные для карбоновых кислот
1.Наиболее интересные - образование солей :
калия (гидротартрата К)
+
KOH
+ Н2О
нерастворимый осадок (качественная реакция на К +).
Винный камень имеет тот же химический состав
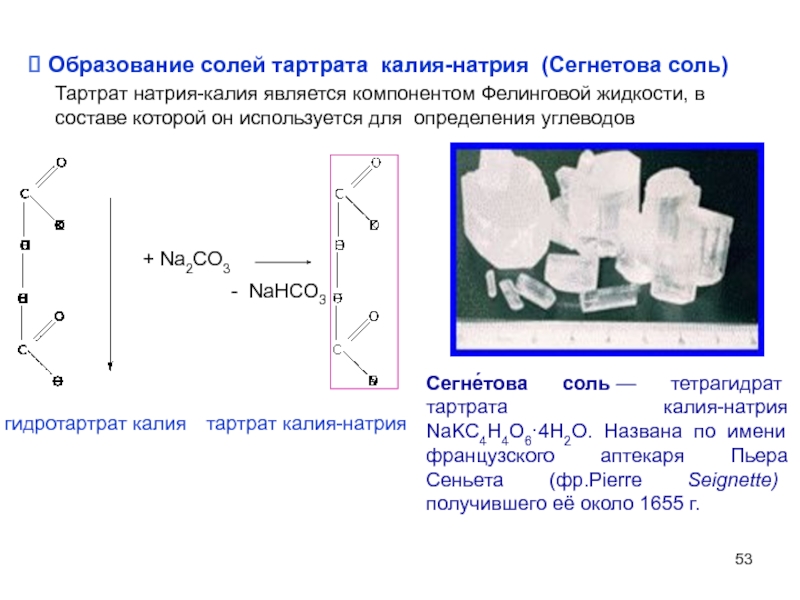
Слайд 53 Образование солей тартрата калия-натрия (Сегнетова соль)
Тартрат натрия-калия является компонентом Фелинговой
+ Na2CO3
- NaHCO3
гидротартрат калия
тартрат калия-натрия
Сегне́това соль — тетрагидрат тартрата калия-натрия NaKC4H4O6·4H2O. Названа по имени французского аптекаря Пьера Сеньета (фр.Pierre Seignette) получившего её около 1655 г.
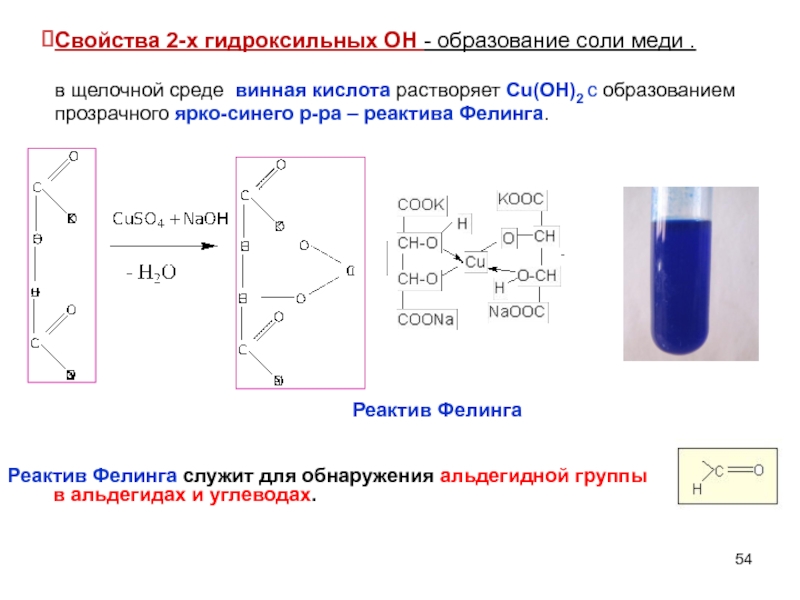
Слайд 54Свойства 2-х гидроксильных ОН - образование соли меди .
в щелочной среде
Реактив Фелинга
Реактив Фелинга служит для обнаружения альдегидной группы в альдегидах и углеводах.
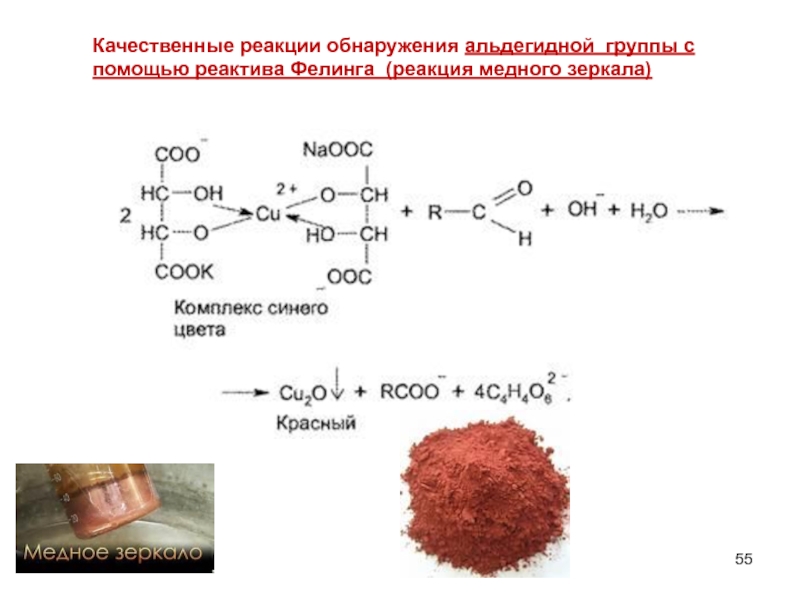
Слайд 55Качественные реакции обнаружения альдегидной группы с помощью реактива Фелинга (реакция медного
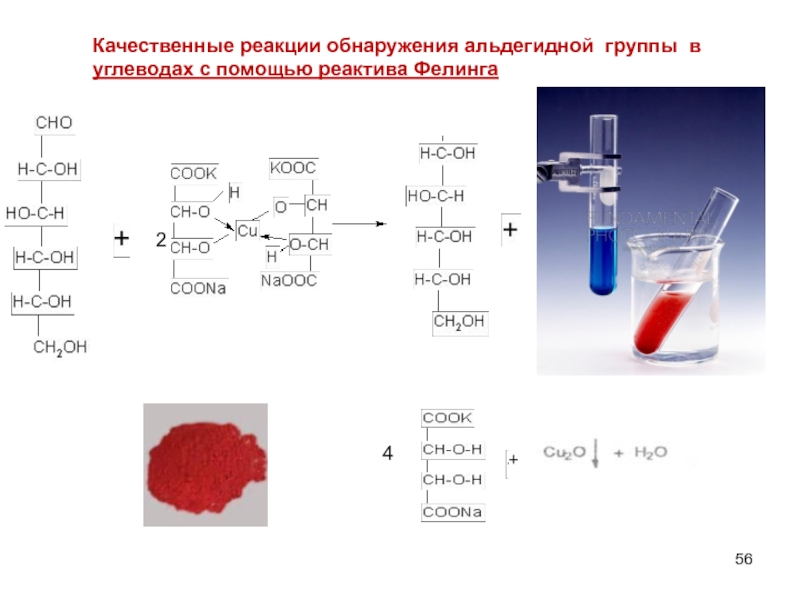
Слайд 56Качественные реакции обнаружения альдегидной группы в углеводах с помощью реактива Фелинга
4
2
+
Слайд 57Лимонная кислота.
2-гидроксипропан-1,2,3трикарбоновая
кислота,
3-гидрокси-3-карбоксипентандиовая к-та. (C6H8O7) —слабая трёхосновная кислота (трикарбоновая). Соли и эфиры
Содержится в больших количествах в плодах цитрусовых, вишне,хвое,стеблях махорки,китайском лимоннике.
Слайд 58Химические свойства лимонной кислоты:
1) при t0 с Н2SО4 разлагается - происходят
Слайд 59Получение лимонной кислоты
Лимонную кислоту раньше получали из сока лимона и биомассы
В настоящее время основной путь промышленного производства —биосинтез из сахара или сахаристых веществ (меласса) промышленными штаммами плесневого гриба Aspergillus niaer
Слайд 60Лимонная кислота, являясь главным промежуточным продуктом метаболического цикла трикарбоновых кислот, играет
Биосинтез лимонной кислоты в цикле Кребса происходит по типу альдольной конденсации ЩУК и ацетилкофермента А-
Биохимическая роль лимонной кислоты
Слайд 61Фенолокислоты.
Салициловая кислота – 2 – гидроксибензойная кислота, ароматическая, содержит 2 разные
В природе встречается в растениях в виде производных , салициловая кислота была впервые выделена из коры ивы, откуда и происходит название
Свободная салициловая кислота наряду с салициловым альдегидом в небольших количествах содержится в эфирном масле, выделяемых из цветов некоторых видов спиреи.
Слайд 62Химические свойства салициловой кислоты
Химические свойства ОН- - группы (характерны все реакции
(качественная реакция на фенол интенсивное фиолетовое окрашивание
Ацетилсалициловая кислота (аспирин)
Слайд 63 Химические свойства СООН- - группы (характерны все реакции карбоксильной группы).
Салицилат натрия
Метилсалицилат
Фенилсалицилат
Длительное время фенилсалицилат широко применяли при заболеваниях кишечника (колиты, энтероколиты), при циститах, пиелитах, пиелонефритах.
Слайд 64(pK = 4.17)
Специфические реакции, обусловленные влиянием 2х групп друг на
Декарбоксилирование
Более сильные кислотные свойства
Усиление кислотных свойств (pK = 2.98) по сравнению бензойной кислотой
Салициловая кислота
фенол
декарбоксилирование
Бензойная кислота
Слайд 65Пара-аминосалициловая кислота (ПАСК).
ПАСК (пара-аминосалициловая кислота и ее натриевая соль - пара-аминосалицилат
антагонист nара – аминобензойной кислоты, необходимой для нормальной жизнедеятельности микроорганизмов.
Слайд 67
Оксокислоты.
Оксокислоты – карбоновые кислоты, СОДЕРЖАЩИЕ ОКСО группу:
кетокислоты
Альдегидокислоты - органические соединения, совмещающие в себе свойства альдегидов и кислот из-за присутствия в их молекуле как альдегидной, так и карбоксильной групп.
Альдегидокислот известно немного.
Слайд 68
Простейший представитель - глиоксалевая (глиоксиловая) кислота.
В природе содержится в винограде, сахарной свекле, сахарном тростнике,кизиле и др.
Она обладает всеми свойствами альдегида и одноосновной кислоты
Глиоксиловая кислота часто содержится в недозрелых фруктах, по мере их созревания она постепенно исчезает.
кизил
Слайд 69 Альдегидокислоты . Химические свойства
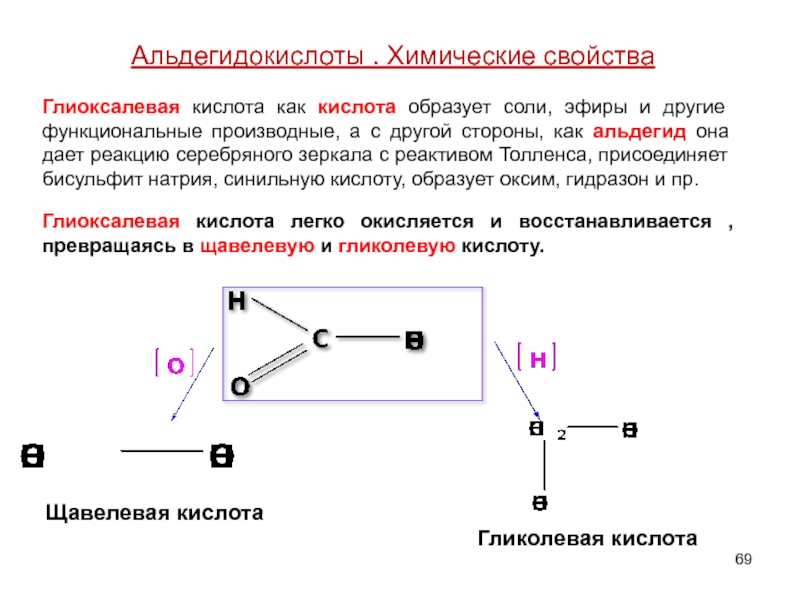
Глиоксалевая
Глиоксалевая кислота легко окисляется и восстанавливается ,превращаясь в щавелевую и гликолевую кислоту.
Щавелевая кислота
Гликолевая кислота
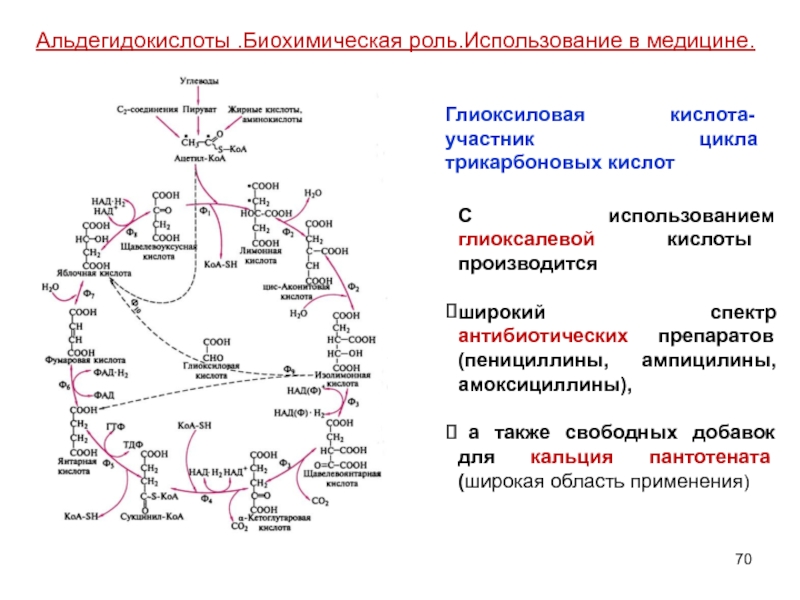
Слайд 70С использованием глиоксалевой кислоты производится
широкий спектр антибиотических препаратов (пенициллины, ампицилины,
а также свободных добавок для кальция пантотената (широкая область применения)
Альдегидокислоты .Биохимическая роль.Использование в медицине.
Глиоксиловая кислота-участник цикла трикарбоновых кислот
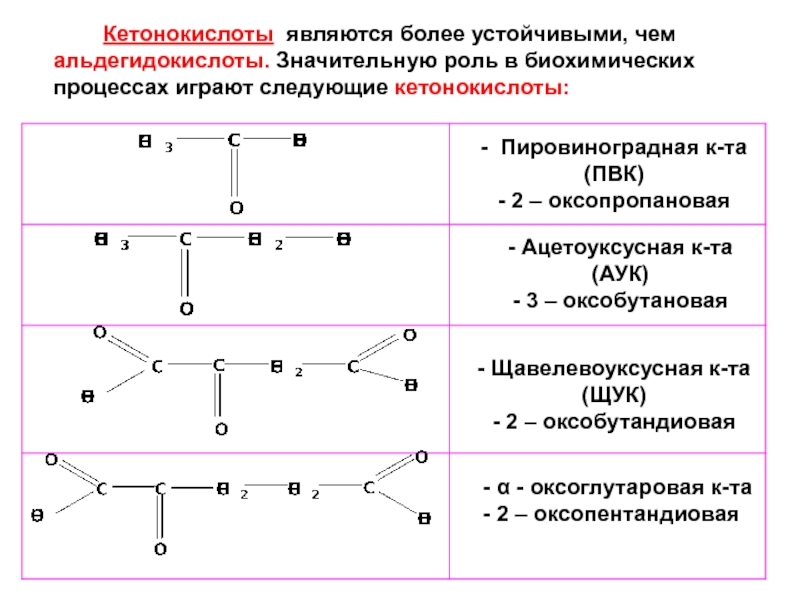
Слайд 71 Кетонокислоты являются более устойчивыми, чем альдегидокислоты. Значительную роль в биохимических процессах
- Пировиноградная к-та (ПВК)
- 2 – оксопропановая
- Ацетоуксусная к-та (АУК)
- 3 – оксобутановая
- Щавелевоуксусная к-та (ЩУК)
- 2 – оксобутандиовая
- α - оксоглутаровая к-та
- 2 – оксопентандиовая
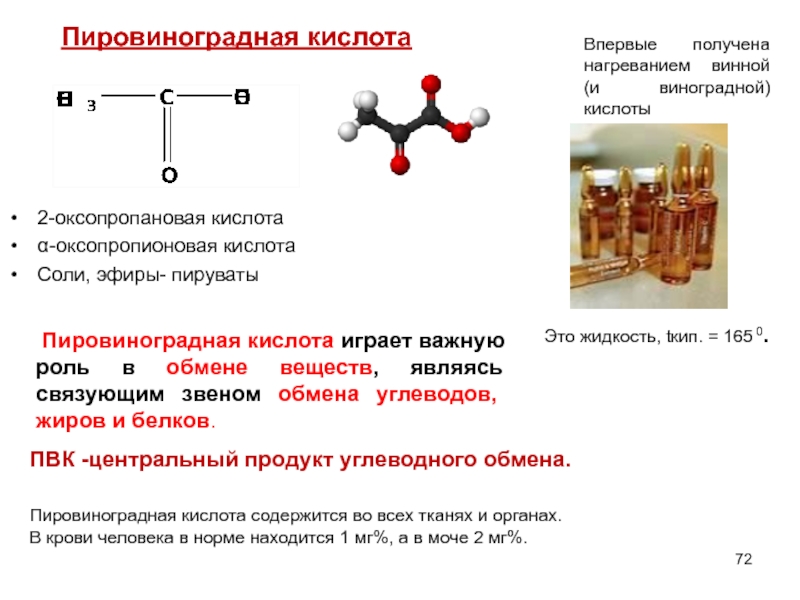
Слайд 72
2-оксопропановая кислота
α-оксопропионовая кислота
Соли, эфиры- пируваты
Пировиноградная к9 (ПВК)
Пировиноградная кислота
Впервые получена нагреванием винной (и виноградной) кислоты
ПВК -центральный продукт углеводного обмена.
Пировиноградная кислота играет важную роль в обмене веществ, являясь связующим звеном обмена углеводов, жиров и белков.
Пировиноградная кислота содержится во всех тканях и органах.
В крови человека в норме находится 1 мг%, а в моче 2 мг%.
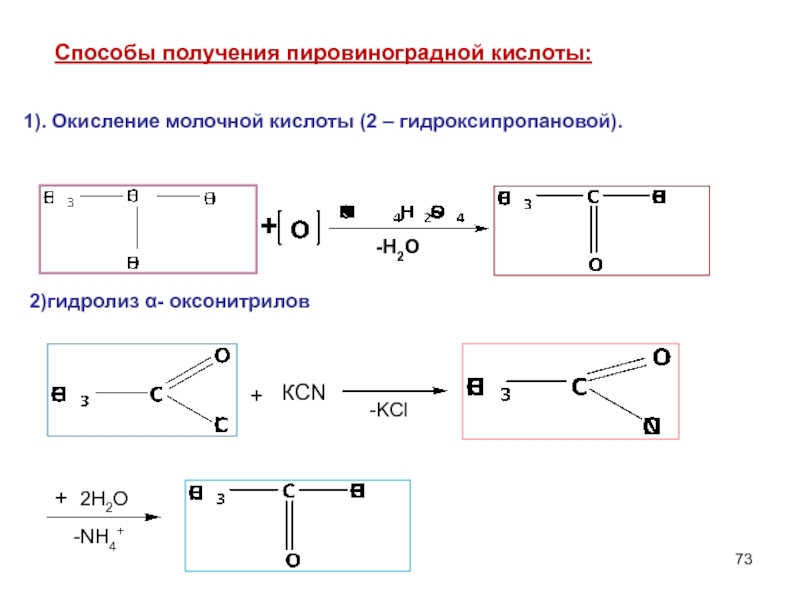
Слайд 73Cпособы получения пировиноградной кислоты:
1). Окисление молочной кислоты (2 – гидроксипропановой).
+
-H2O
2)гидролиз α-
КCN
+
+
2Н2О
-NH4+
-KCl
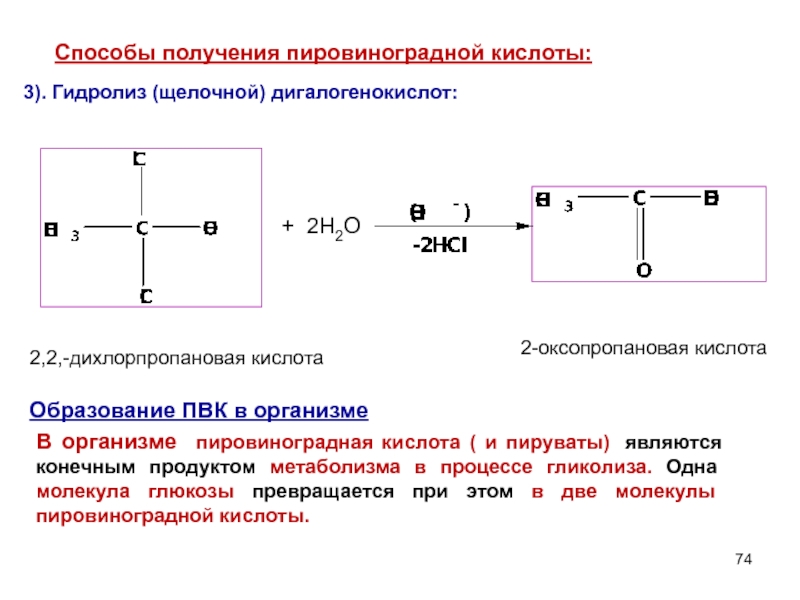
Слайд 743). Гидролиз (щелочной) дигалогенокислот:
Cпособы получения пировиноградной кислоты:
+
2Н2О
2,2,-дихлорпропановая кислота
2-оксопропановая кислота
В организме пировиноградная
Образование ПВК в организме
Слайд 75Химические свойства оксокислот:
>С=О
-СООН
Химические свойства оксокислот определяются наличием 2-х различных
Реакции декарбоксилирования протекают легче,чем в карбоновых кислотах
Для карбонильной группы характерны реакции АN, восстановления.
Для карбоксильной группы характерны реакции SN, образования солей.
Более сильные кислотные свойства, чем у карбоновых кислот.
Специфические реакции – обусловлены взаимным влиянием 2х групп:
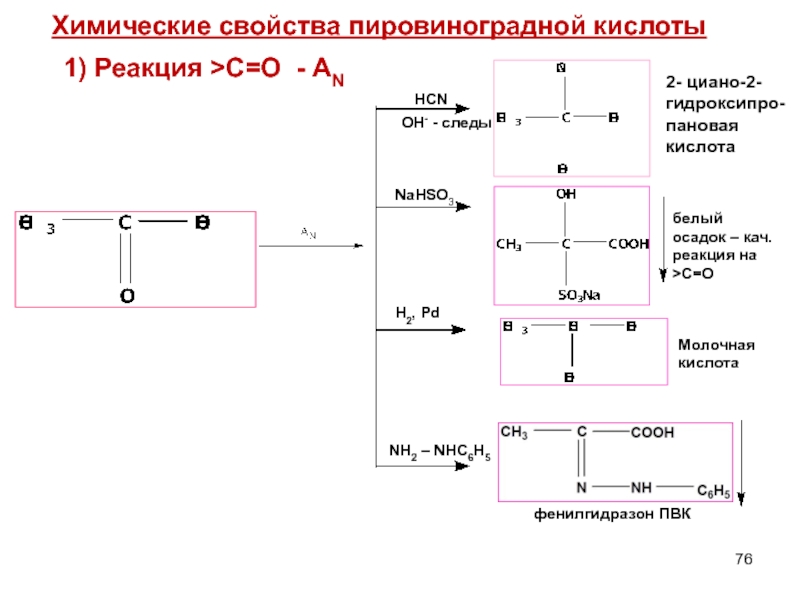
Слайд 76 1) Реакция >С=О - AN
HCN
OH- - следы
NaHSO3
H2, Pd
NH2 –
2- циано-2- гидроксипро-
пановая кислота
белый осадок – кач. реакция на >C=O
Молочная кислота
фенилгидразон ПВК
Химические свойства пировиноградной кислоты
Слайд 77 2) Реакции – СООН группы.
SN
кисл. св-ва, обр-е солей
ангидрид ПВК
галогенангидрид
уреид ПВК
амид ПВК
Пируват Na
Этилпируват (сложный эфир)
Слайд 78 Реакции AN и SN протекают легче, чем в отсутствии второй функциональной
Кислотные свойства ПВК выражены значительно сильнее, чем у пропановой кислоты из-за присутствия ЭА - СО группы. (Кд (пропионовой кислоты)=0,00134, Кд(пировиноградной кислоты)=0,56
>
+δ1
+I eff
+I eff
+δ2
+δ3
+δ4
>
Слайд 79Специфические реакции пировиноградной кислоты
Декарбоксилирование in vitro
При нагревании в присутствии
+
При нагревании в присутствии H2SO4 концентрированной протекает декарбонилирование
+
декарбонилирование
in vitro
Слайд 80Метаболизм пировиноградной кислоты возможен двумя путями — аэробным и анаэробным.
Аэробное расщепление:
При клеточном
Декарбоксилирование пировиноградной кислоты в организме протекает в присутствии фермента декарбоксилазы и соответствующего кофермента .
Декароксилаза
+ кофермент
+
CO2
Декарбоксилирование пировиноградной кислоты в организме (in vivo)
Слайд 81 Образующийся ацетальдегид далее может :
присоединяться к кетонокислотам с образованием
или окисляться в присутствии кофермента А в ацетилкофермент А.
АцетилКоА используется при синтезе жирных кислот , ацетилхолина
АцетилКоА может передать свой ацил на щавелевоуксусную кислоту для дальнейшего окисления до CO2 и H2O .
Декарбоксилирование пировиноградной кислоты в организме (in vivo)
Слайд 82
Анаэробное расщепление
В отсутствии кислорода под действием ферментов
Пировиноградная кислота
Молочная кислота накапливается
в мышцах при интенсивных физических
нагрузках, связанных с большими
затратами О2.
Молочная кислота
Декарбоксилирование пировиноградной кислоты в in vivo
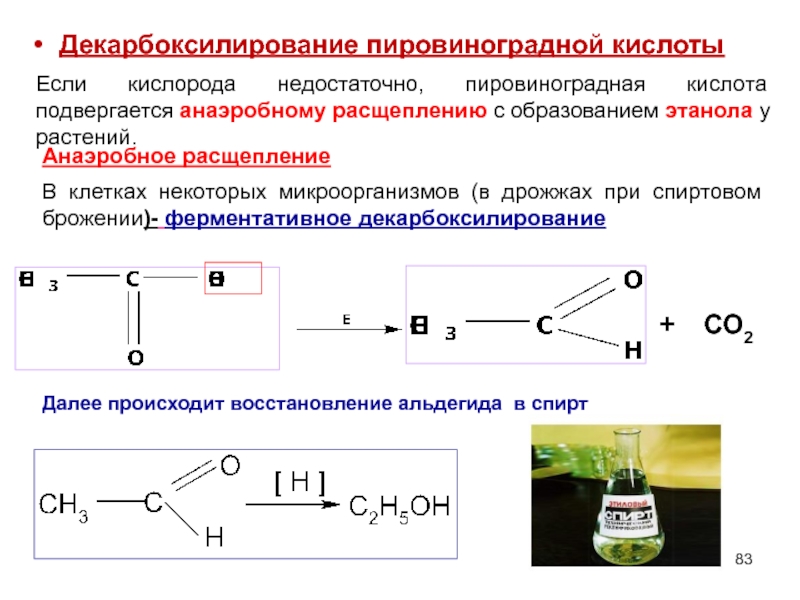
Слайд 83
+
CO2
Далее происходит восстановление альдегида в спирт
Декарбоксилирование пировиноградной кислоты
Если кислорода
В клетках некоторых микроорганизмов (в дрожжах при спиртовом брожении)- ферментативное декарбоксилирование
Анаэробное расщепление
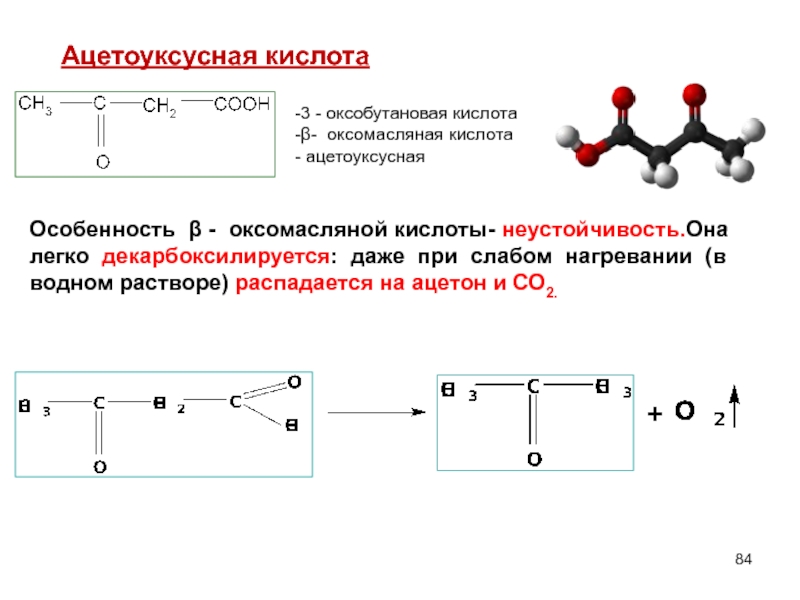
Слайд 84Ацетоуксусная кислота
3 - оксобутановая кислота
β- оксомасляная кислота
ацетоуксусная
Особенность β - оксомасляной
+
Слайд 85Ацетоуксусная кислота в организме
При нормальном обмене АУК в тканях и мышцах
Ацетоуксусная кислота образуется in vivo в процессе метаболизма высших жирных кислот ( продукт окисления
β-гидроксимасляной кислоты)
В организме у больных сахарным диабетом ацетоуксусная кислота и продукты её превращения ( «ацетоновые» или «кетоновые» тела) накапливаются
Н2О + СО2 + АТФ
+
Сахарный диабет
Слайд 86Ацетоновые тела: ацетон, ацетоуксусную кислоту, соли ацетоуксусной кислоты, которые могут содержаться
Слайд 87Большой теоретический интерес в связи с изучением таутомерии и двойственной реакционной
Ацетоуксусный эфир
Строение этого эфира долгое время не могли установить,так как он проявлял двойственную реакционную способность, причиной которой является кето- енольная таутомерия
Кетонная форма - 92.5%
tкип = 78º
% содержание кетонных форм зависит от растворителя
Енольная форма – 7.5%
tкип = 44º
Слайд 88Енольная форма стабилизируется за счет сопряжения двойной углерод-углеродной связи с карбонильной
Ацетоуксусный эфир
Как кетон ацетоуксусный эфир восстанавливается Н2 до этилгидроксибутирата; присоединяет HCN, NaHSO3 с образованием соответственно циангидрина и гидросульфитного производного.
Слайд 89 Как енол ацетоуксусный эфир
мгновенно обесцвечивает раствор Вг2 (реакция
для количественного определения енола)
Ацетоуксусный эфир
с FeCl3, образует комплекс – интенсивного фиолетового окрашивания.
+
FeCl3
Эта реакция характерна для енольных соединений и совершенно отсутствует у кетонов.
Слайд 90При добавлении избытка FeCl3 появляется фиолетовая окраска (реакция енола).
При приливании
Через некоторое время окраска вновь постепенно появляется в результате превращения новых порций кетонной формы в енольную.
Таутомерия ацетоуксусного эфира
Реакции с бромом в присутствии FeCl3 используются для изучения скорости установления таутомерного равновесия.
Слайд 91Кето-енольная таутомерия
Кнорр, Людвиг (2 декабря 1859 — 4 июня 1921 года) — немецкий
Учился (с 1878 г.) в Мюнхенском, Гейдельбергском, Эрлангенском, Вюрцбургском университетах. Работал в Эрлангенском (1885 г.), затем в Вюрцбургском университетах, с 1889 г. — профессор Йенского университета. Президент Немецкого химического общества (1915—1916 г.).
Основные научные работы Людвига Кнорра посвящены изучению кето-енольной таутомерии и синтезам на основе ацетоуксусного эфира. Выделил (1911) обе формы этого соединения. Незадолго до смерти синтезировал Анальгин (метамизол натрия). Изучал (с 1889) строение алкалоидов — кодеина, морфина, тебаина.
Слайд 92Щавелевоуксусная кислота
Щавелевоуксусная кислота является промежуточным соединением в цикле Кребса и глюконеогенезе.
2- оксобутандиовая
Относится одновременно к α и β- оксокислотам
Слайд 93 Для щавелевоуксусной кислоты характерна кето-енольная таутомерия, причем енольная форма более
Кето – форма 20%
Енольная форма 80%
Устойчивость енольной формы обусловлена более длинной цепью сопряжения.
Щавелевоуксусная кислота, кето-енольная таутомерия
Слайд 94α-оксоглутаровая кислота
2-оксопентандиовая кислота,
α-кетоглутаровая кислота
Ключевой продукт цикла Кребса, образуется в результате декарбоксилирования
Слайд 97ЯМР
Спектроскопия ядерного магнитного резонанса (ЯМР) является наиболее мощным инструментом выяснения структуры
Она основана на магнитных свойствах ядер, имеющих спиновое квантовое число I, отличное от нуля.
Не обладают магнитным моментом ядра с четным числом протонов и нейтронов (12С, 16О, 32 S и др)
Ядра с нечетным числом обладают магнитным моментом (1Н,13С 15N,31P и др.)
Слайд 98В органической химии наибольшее распространение получили:
Спектроскопия протонного магнитного резонанса (ПМР) с
В последнее время используют ядра 13С
Ядро атома водорода состоит из одного протона. Этот протон вращается вокруг своей оси и представляет собой магнит.
Слайд 99 В отсутствие внешнего магнитного поля спины протонов ориентированы беспорядочно.
Но в
Слайд 100При помещении вещества в сильное магнитное поле Н0 ядра ориентируются вдоль
Спиновые состояния, в которых магнитный момент (показан стрелкой) ориентирован по полю, имеют несколько меньшую энергию, чем те, которые – против поля.
Н0
Эта энергетическая разница соответствует энергии фотона радиочастотного излучения
Слайд 101Под действием относительно слабого переменного магнитного поля радиочастотной области (40-500МГц)
Поглощение энергии регистрируется в виде резонансного пика.
Слайд 102Спектроскопия ЯМР
Атомы водорода в молекуле находятся в различном химическом окружении. Одни
Спектр ЯМР возникает как результат поглощения радиочастотного излучения веществом, находящимся в магнитном поле.
Спектроскопия ЯМР позволяет различить атомы водорода в молекуле, находящиеся в различном химическом окружении.
Слайд 103
Зная ,в какой области спектра находятся пики поглощения тех или иных типов атомов водорода, можно сделать определённые выводы о структуре молекулы.
Резонансный сигнал протона каждого типа наблюдается при различных напряженностях магнитного поля.
Разность между резонансными частотами определенного сигнала и сигнала стандартного вещества называется химическим сдвигом.
Слайд 104Стандартным веществом часто служит тетраметилсилан или ТМС.
Положение сигналов протона ТМС принимается
Слайд 105Химический сдвиг в ЯМР
Шкала химических сдвигов называется шкалой δ.
Сдвиг резонансной частоты
δ = 106 Δν / ν0
Обычно все сигналы расположены в области 0 -10 м.д.
Слайд 106Спектры ЯМР
Правая часть спектра называется сильнопольной областью, а левая – слабопольной.В
Слайд 108Спектры ЯМР
Для интерпретации спектра и получения из него структурной информации имеют
1) Положение сигнала в δ шкале ( характеризует тип атома водорода)
2)Площадь сигнала (характеризует число атомов водорода данного типа)
3) Мультиплетность (форма ) сигнала ( характеризует число близко-расположенных атомов водорода других типов)







![Формулы Фишера для оптически активных изомеров винной кислотыD (+) [α]20 = + 12 tпл. =](/img/tmb/4/350624/2fc2646f0031629fe123017ca313c102-800x.jpg)