- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Описание молекул презентация
Содержание
- 1. Описание молекул
- 2. №1 азот-N2 N∈ II периоду →2 ē
- 3. №2 кислород-О2 О∈ II периоду →2 ē
- 4. №3 хлор-Cl2 Cl Cl∈ III периоду →3
- 5. №4 хлороводород-НCl Cl
- 6. №5 аммиак-NH3 Помним, что исходя из формулы
- 7. №6 сероводород-H2S Исходя из того, что валентность
- 8. №7 фторид бериллия ВеF2 Из формулы соединения
- 9. Приняв небольшую дозу энергии (например, при нагревании)
- 10. Ве* F
- 11. №8 метан СН4 Углерод в этой молекуле
- 12. С* Н Н
- 13. №9 оксид серы (IV) SO2 Валентность серы
- 14. S*
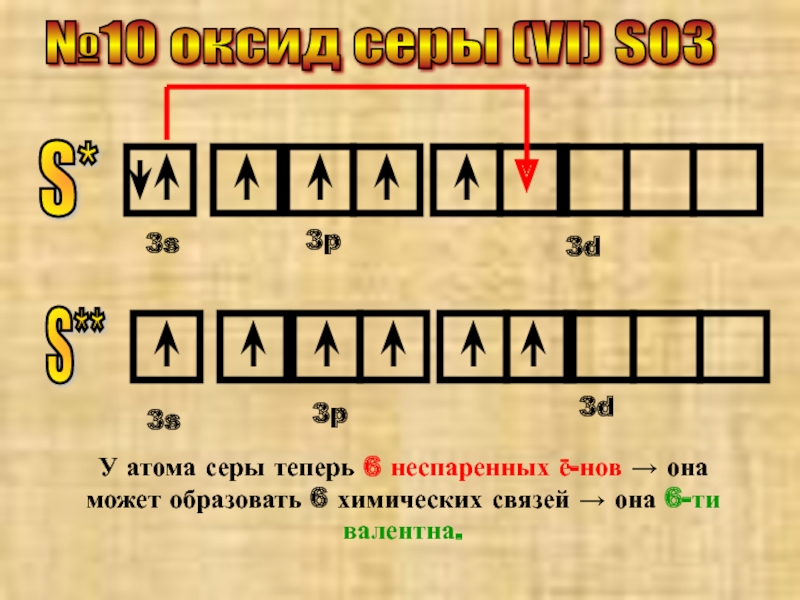
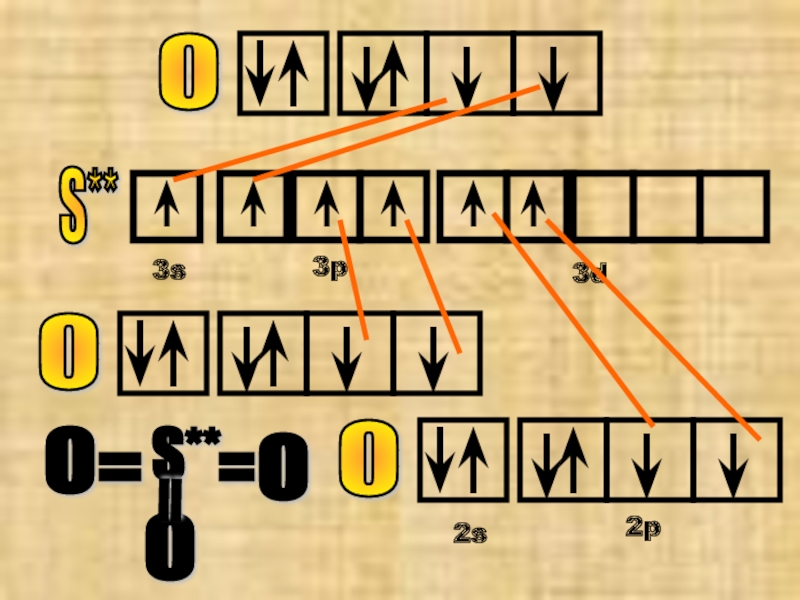
- 15. №10 оксид серы (VI) SO3 S*
- 16. S**
- 17. 11 класс Из этой части презентации узнаем,
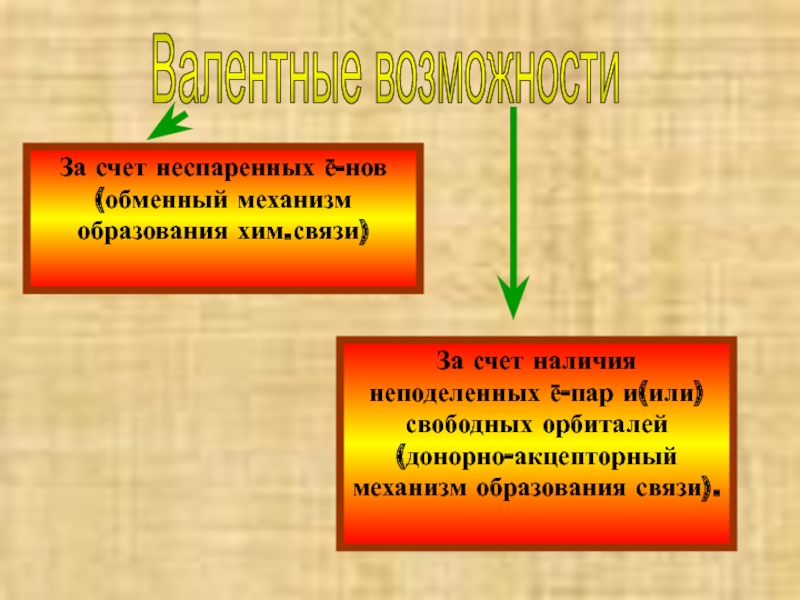
- 18. Валентные возможности За счет неспаренных ē-нов (обменный
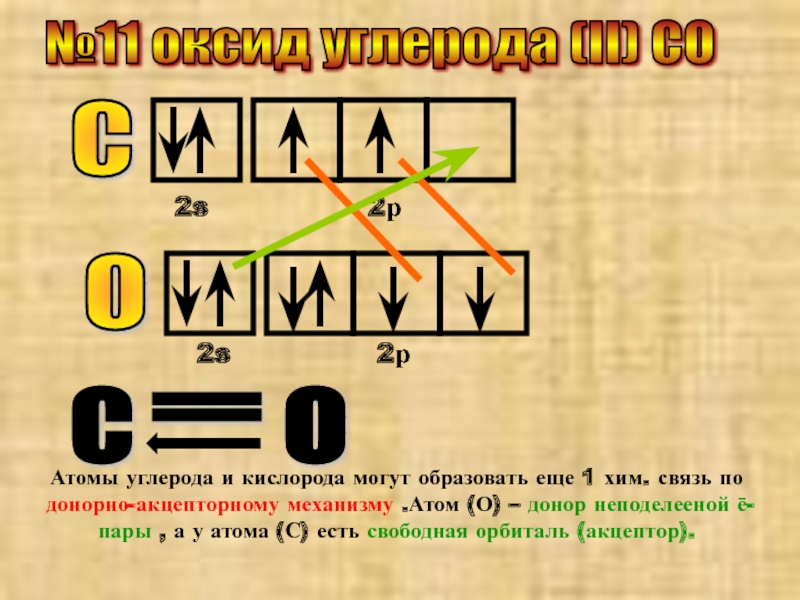
- 19. №11 оксид углерода (II) CO С
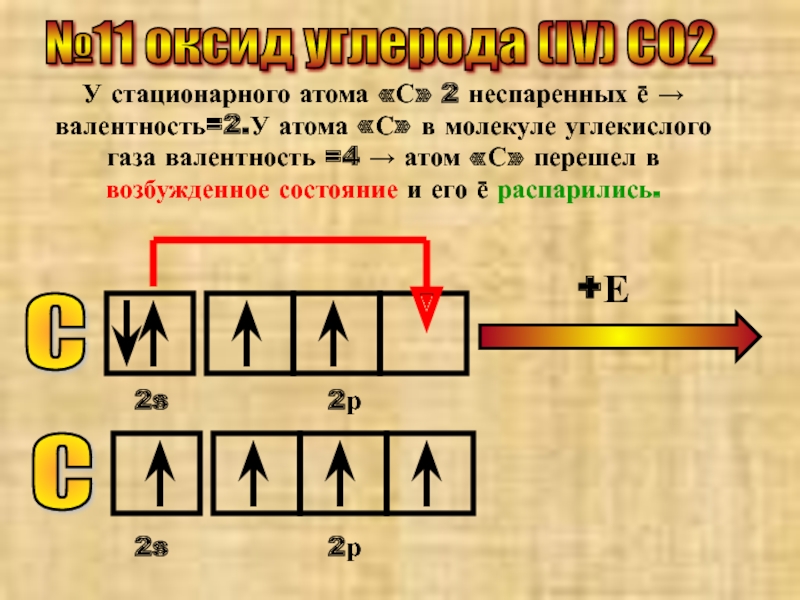
- 20. №11 оксид углерода (IV) CO2 У стационарного
- 21. С 2s 2р
- 22. №12 серная кислота Н2SO4 Построим сначала структурную
- 23. S**
- 24. №13 анион аммония NH4+ В этом сложном
- 25. №14 оксид титана (IV) Здесь надо помнить,
- 26. Ti*
- 27. Особый случай- O* и N* Атомы азота
- 28. N 2s 2р
- 29. О 2s 2р
- 30. №15 озон О3 О
- 31. №16 азотная кислота НNO3 N H О
- 32. N H
- 33. №16 азидоводород HN3 Особенность этой молекулы
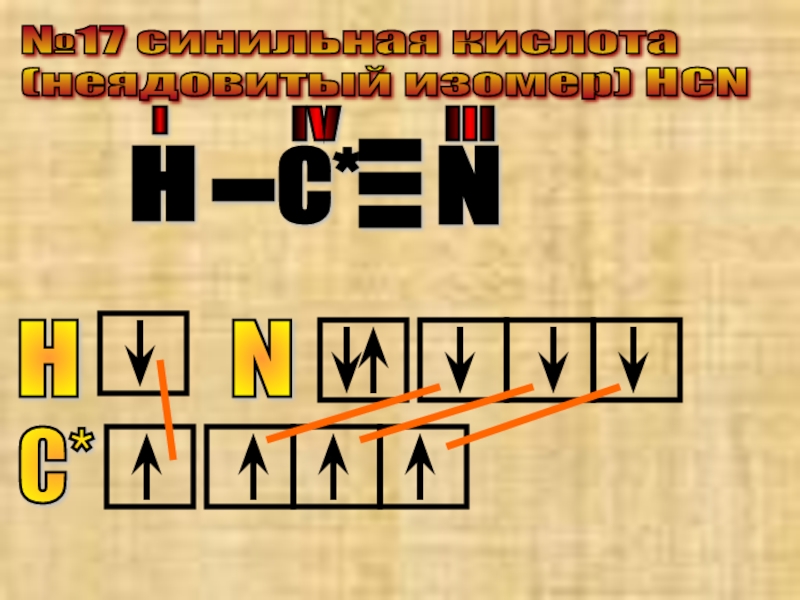
- 34. №17 cинильная кислота (неядовитый изомер)
- 35. №17 cинильная кислота (сильный яд)
- 36. конец
Слайд 1Описание молекул
с помощью квантовых ячеек
Презентация учителя химии 344 лицея
Ипатовой Анастасии Николаевны
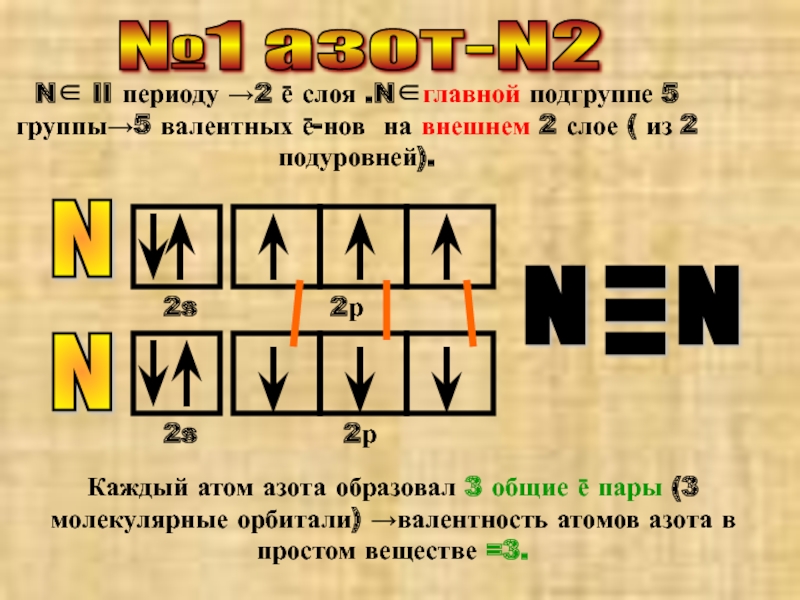
Слайд 2№1 азот-N2
N∈ II периоду →2 ē слоя .N∈главной подгруппе 5 группы→5
N
N
2s
2s
2р
2р
Каждый атом азота образовал 3 общие ē пары (3 молекулярные орбитали) →валентность атомов азота в простом веществе =3.
N
N
-
-
-
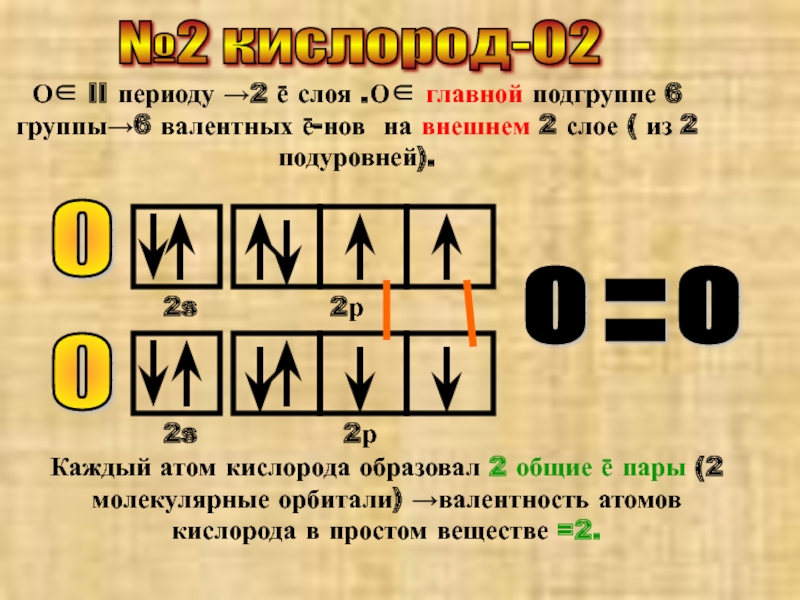
Слайд 3№2 кислород-О2
О∈ II периоду →2 ē слоя .О∈ главной подгруппе 6
О
О
2s
2s
2р
2р
Каждый атом кислорода образовал 2 общие ē пары (2 молекулярные орбитали) →валентность атомов кислорода в простом веществе =2.
О
О
-
-
Слайд 4№3 хлор-Cl2
Cl
Cl∈ III периоду →3 ē слоя .Cl∈ главной подгруппе 7группы→7валентных
Cl
3s
3p
3d
3s
3p
3d
Каждый атом хлора образовал 1 общую ē-пару→1 химическую связь→валентность хлора в простом веществе =1
Cl
Cl
-
Слайд 5№4 хлороводород-НCl
Cl
3s
3p
3d
Н
Атомы водорода и хлора образовали 1 общую ē-пару→ валентность каждого
Н
Cl
-
1s
Слайд 6№5 аммиак-NH3
Помним, что исходя из формулы молекулы, надо рисовать ячейки с
N
Н
Н
Н
Атом азота образовал 3 хим. связи→валентность=3, атомы водорода образовали каждый по 1 хим.связи →валентность=1
N
Н
Н
Н
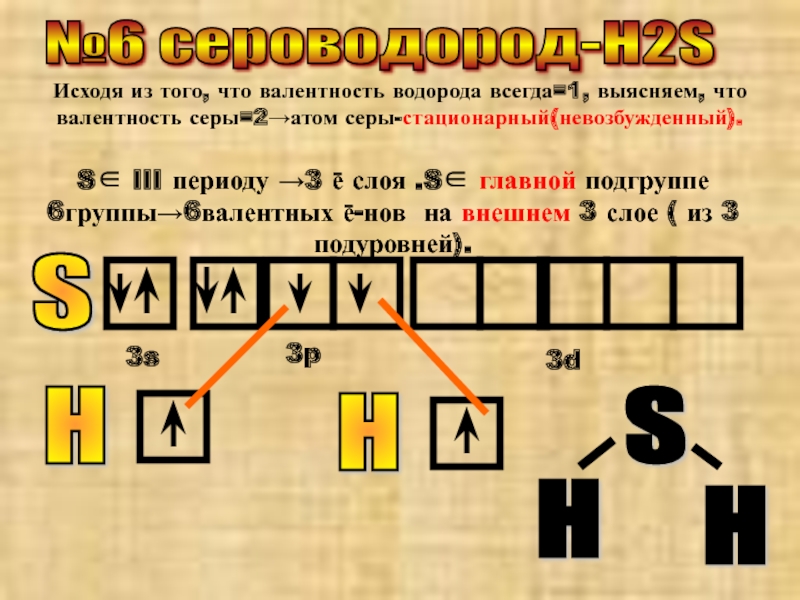
Слайд 7№6 сероводород-H2S
Исходя из того, что валентность водорода всегда=1, выясняем, что валентность
S∈ III периоду →3 ē слоя .S∈ главной подгруппе 6группы→6валентных ē-нов на внешнем 3 слое ( из 3 подуровней).
S
3s
3p
3d
Н
Н
S
Н
Н
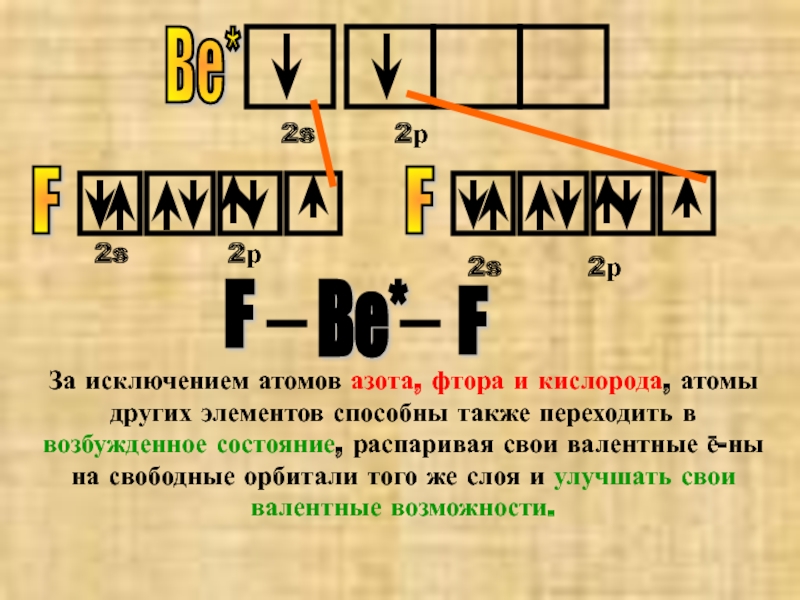
Слайд 8№7 фторид бериллия ВеF2
Из формулы соединения видно, что валентность Ве=2. Также
Ве
2s
2р
Из строения квантовых ячеек видно, что у стационарного (невозбужденного) атома Ве 2 спаренных ē на min по энергии s-подуровне.Как атом Ве приобретает неспаренные ē-ны?
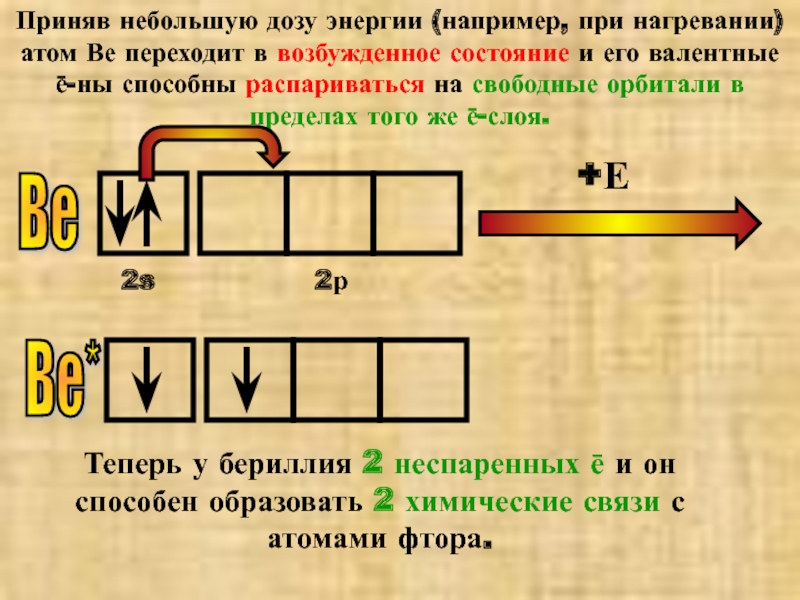
Слайд 9Приняв небольшую дозу энергии (например, при нагревании) атом Ве переходит в
Ве
2s
2р
+Е
Ве*
Теперь у бериллия 2 неспаренных ē и он способен образовать 2 химические связи с атомами фтора.
Слайд 10Ве*
F
F
2s
2s
2s
Ве*
F
F
2р
2р
2р
За исключением атомов азота, фтора и кислорода, атомы других элементов способны
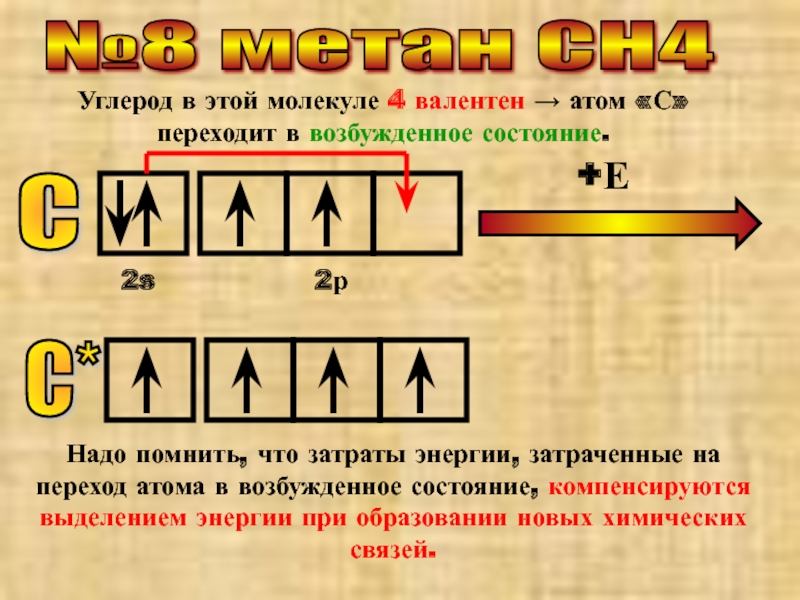
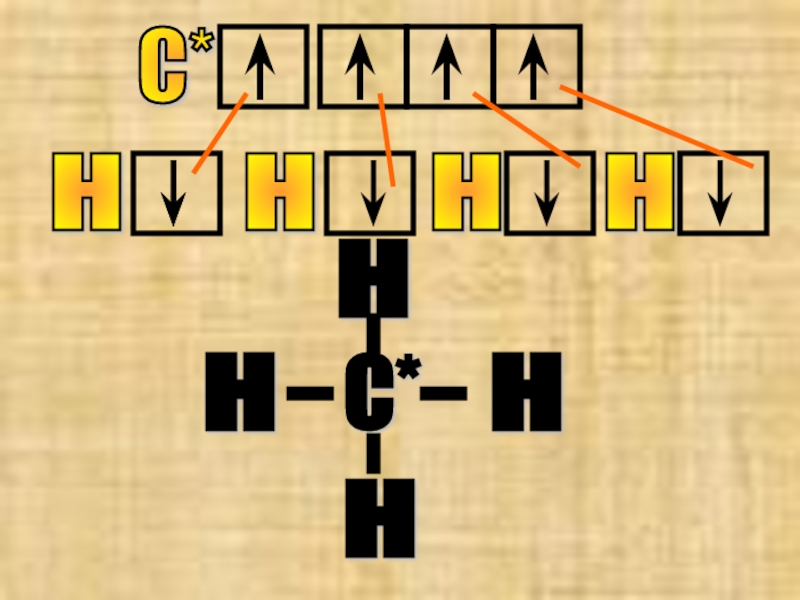
Слайд 11№8 метан СН4
Углерод в этой молекуле 4 валентен → атом «С»
С
2s
2р
+Е
С*
Надо помнить, что затраты энергии, затраченные на переход атома в возбужденное состояние, компенсируются выделением энергии при образовании новых химических связей.
Слайд 13№9 оксид серы (IV) SO2
Валентность серы =4, а у стационарного атома
S
3s
3p
3d
S*
3s
3p
3d
Теперь у атома S* 4 неспаренных ē→она может образовать 4 хим. связи.
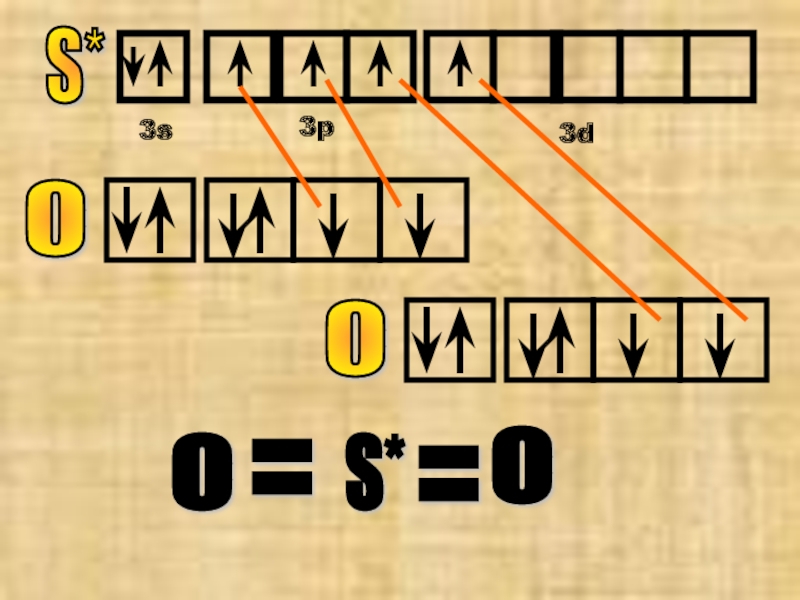
Слайд 15№10 оксид серы (VI) SO3
S*
3s
3p
3d
S**
3s
3p
3d
У атома серы теперь 6 неспаренных ē-нов
Слайд 1711 класс
Из этой части презентации узнаем, как атомы дополнительно улучшают свои
Слайд 18Валентные возможности
За счет неспаренных ē-нов (обменный механизм образования хим.связи)
За счет наличия
Слайд 19№11 оксид углерода (II) CO
С
2s
2р
О
2s
2р
С
О
=
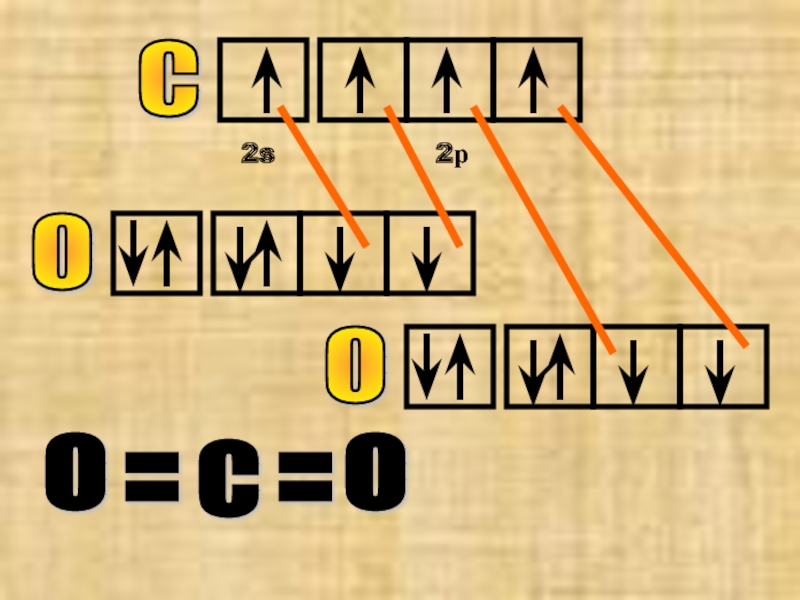
Атомы углерода и кислорода могут образовать еще
Слайд 20№11 оксид углерода (IV) CO2
У стационарного атома «С» 2 неспаренных ē
С
2s
2р
С
2s
2р
+Е
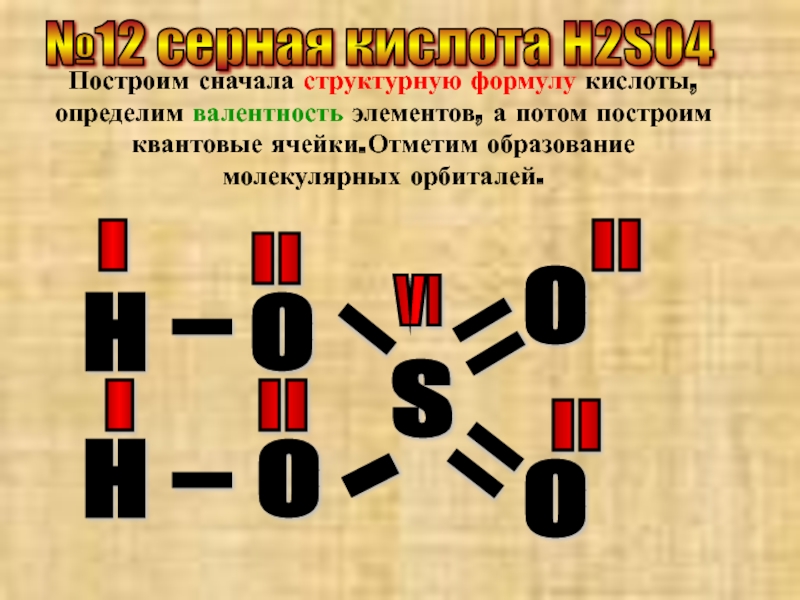
Слайд 22№12 серная кислота Н2SO4
Построим сначала структурную формулу кислоты, определим валентность элементов,
О
О
О
О
Н
S
Н
-
-
-
-
-
-
-
-
VI
I
I
II
II
II
II
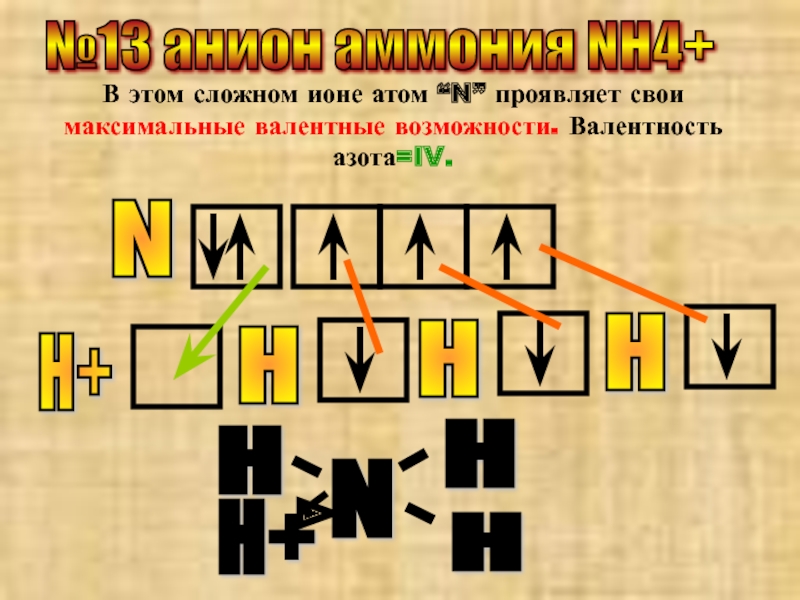
Слайд 24№13 анион аммония NH4+
В этом сложном ионе атом “N” проявляет свои
N
H+
H
H
H
N
H
H
H
H+
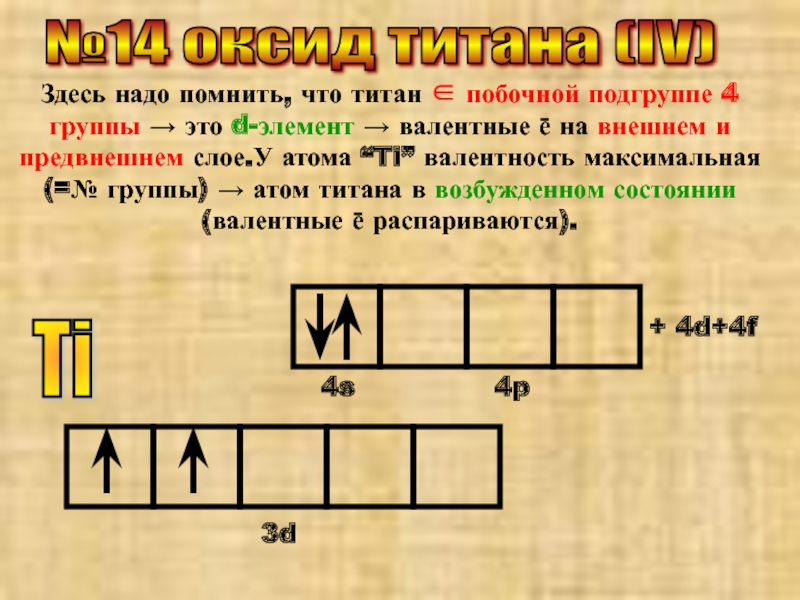
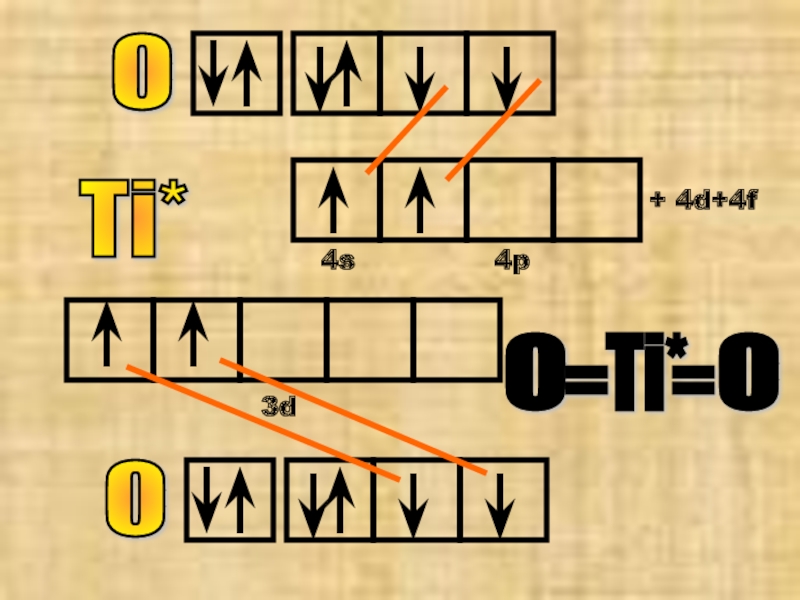
Слайд 25№14 оксид титана (IV)
Здесь надо помнить, что титан ∈ побочной подгруппе
Ti
3d
4s
4p
+ 4d+4f
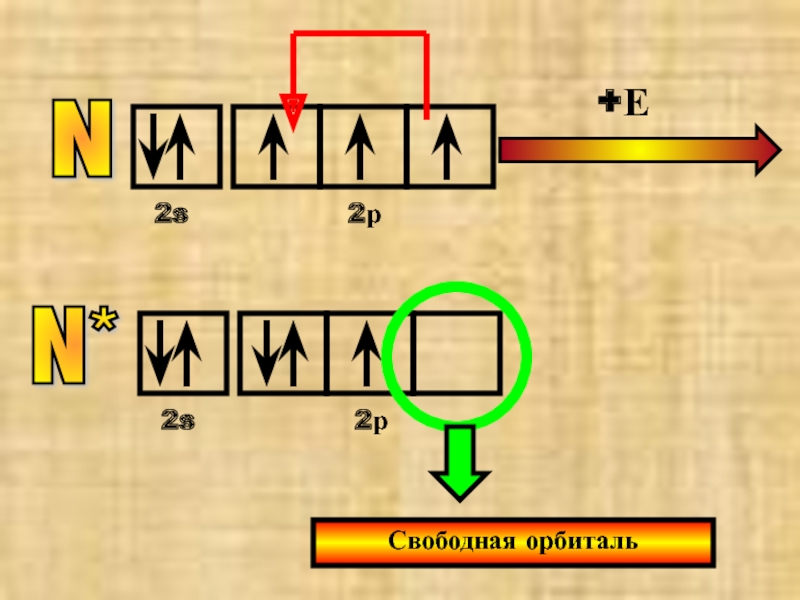
Слайд 27Особый случай- O* и N*
Атомы азота и кислорода не могут распарить
Слайд 31№16 азотная кислота НNO3
N
H
О
О
О*
IV
В этом соединении не надо путать понятия «валентность»,
Слайд 33
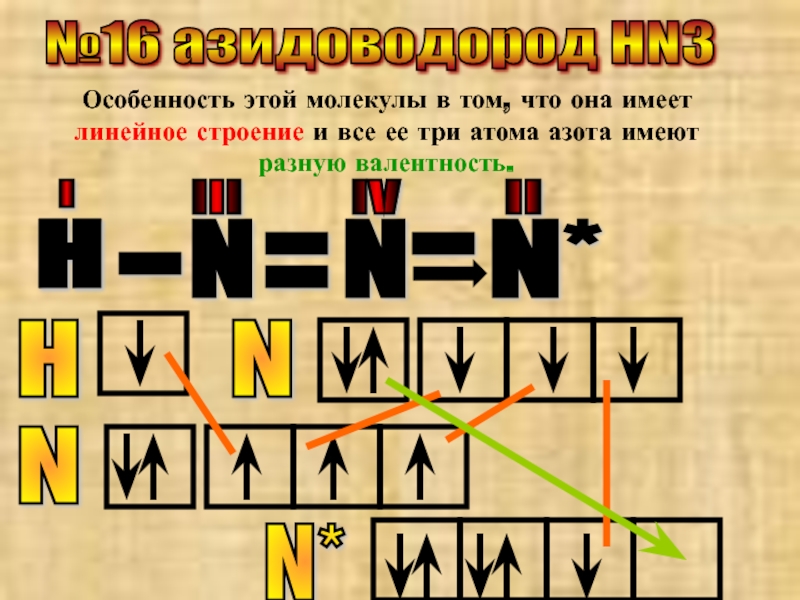
№16 азидоводород HN3
Особенность этой молекулы в том, что она имеет линейное
N
H
N
N*
-
-
-
-
H
IV
III
II
I
N
H
N
N*