- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Оксиды. Определение презентация
Содержание
- 1. Оксиды. Определение
- 2. Определение Оксиды-это сложные вещество состоящий из двух
- 3. Общая формула Общая формула оксидов: ЭхОу Кислород
- 4. Строение оксидов Молекулярное
- 5. Классификация оксидов (с примерами) Кислотные K2O (окись
- 6. Хим. свойства основных оксидов 1. Растворимые в
- 7. Хим.свойства кислотных оксидов 1. Взаимодействуют с
- 8. Хим. свойства амфотерных оксидов 1. Взаимодействуют
- 9. Конец.
Слайд 2Определение
Оксиды-это сложные вещество состоящий из двух элементом один из которых кислород
Слайд 3Общая формула
Общая формула оксидов: ЭхОу
Кислород имеет второе по величине значение электроотрицательности
Слайд 4Строение оксидов
Молекулярное
-Имеют оксиды неметаллических элементов.
-Твердые вещества с высокой температурой плавления и кипения. В большинстве случаев они не растворяются в воде.
-Имеют оксиды металлических элементов.
-Температуры плавления и кипения небольшие. Оксиды неметаллических элементов встречаются в твердом, жидком и газообразном состояниях.
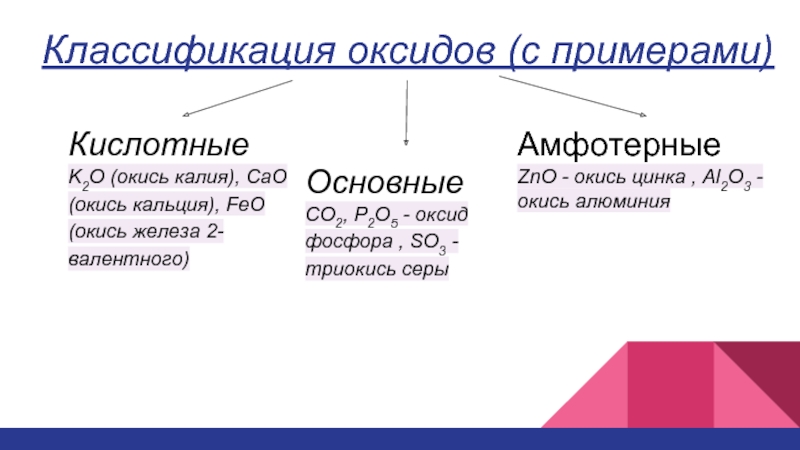
Слайд 5Классификация оксидов (с примерами)
Кислотные
K2O (окись калия), CaO (окись кальция), FeO (окись
Основные
CO2, P2O5 - оксид фосфора , SO3 - триокись серы
Амфотерные
ZnO - окись цинка , Al2O3 - окись алюминия
Слайд 6Хим. свойства основных оксидов
1. Растворимые в воде основные оксиды вступают в
Na2O + H2O → 2NaOH.
2. Взаимодействуют с кислотными оксидами, образуя соответствующие соли Na2O + SO3 → Na2SO4.
3. Реагируют с кислотами, образуя соль и воду:
CuO + H2SO4 → CuSO4 + H2O.
4. Реагируют с амфотерными оксидами:
Li2O + Al2O3 → 2LiAlO2.
Слайд 7Хим.свойства кислотных оксидов
1. Взаимодействуют с водой, образуя кислоту:
SO3 + H2O
Но не все кислотные оксиды непосредственно реагируют с водой (SiO2 и др.).
2. Реагируют с основанными оксидами с образованием соли:
CO2 + CaO → CaCO3
3. Взаимодействуют со щелочами, образуя соль и воду:
CO2 + Ba(OH)2 → BaCO3 + H2O
Слайд 8Хим. свойства амфотерных оксидов
1. Взаимодействуют с кислотами, образуя соль и воду:
ZnO
2. Реагируют с твёрдыми щелочами (при сплавлении), образуя в результате реакции соль – цинкат натрия и воду:
ZnO + 2NaOH → Na2 ZnO2 + H2O.
При взаимодействии оксида цинка с раствором щелочи (того же NaOH) протекает другая реакция:
ZnO + 2NaOH + H2O => Na2[Zn(OH)4]