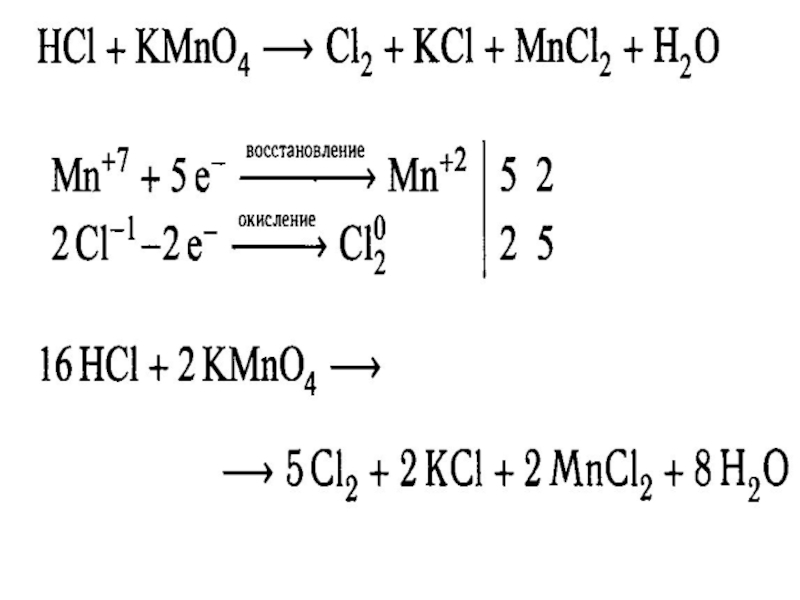- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окислительно-восстановительные реакции. Электролиз презентация
Содержание
- 2. План лекции 1. Основные понятия и определения.
- 3. Чем заняты эти парни? Кто из них натрий, кто хлор?
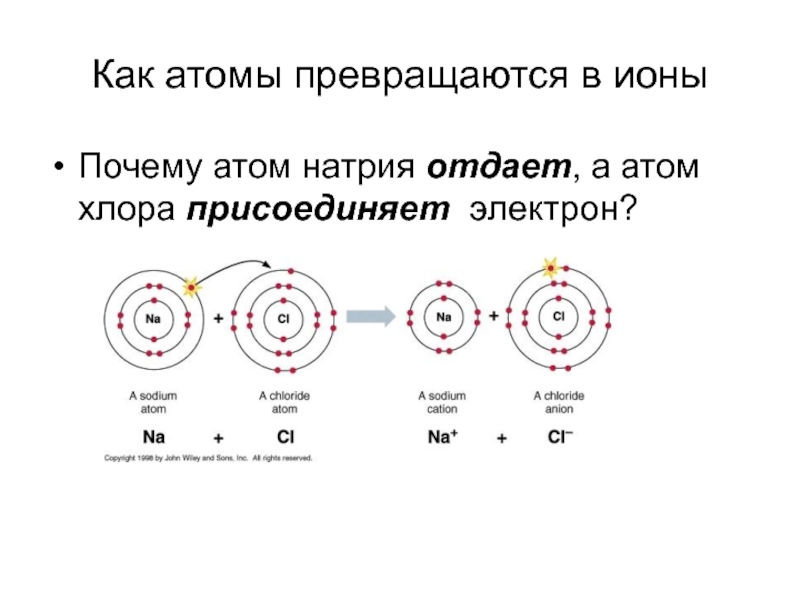
- 4. Как атомы превращаются в ионы Почему атом натрия отдает, а атом хлора присоединяет электрон?
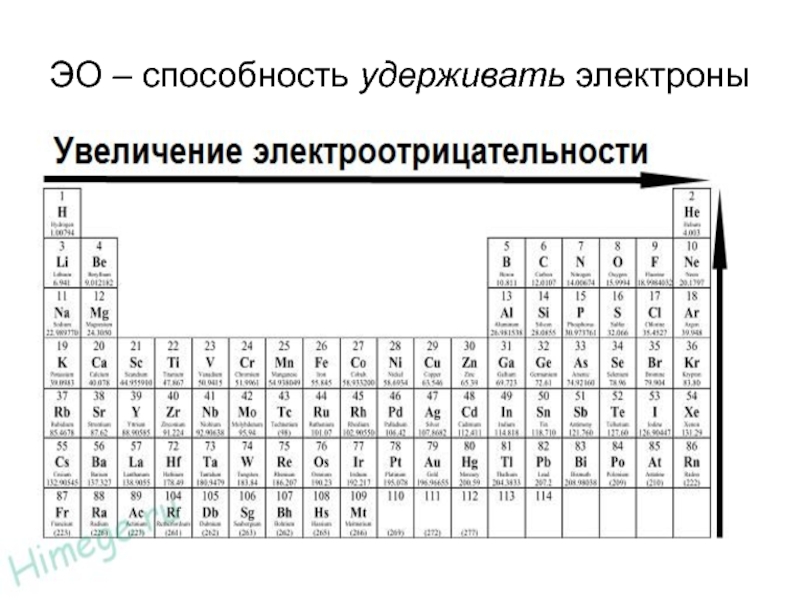
- 5. ЭО – способность удерживать электроны
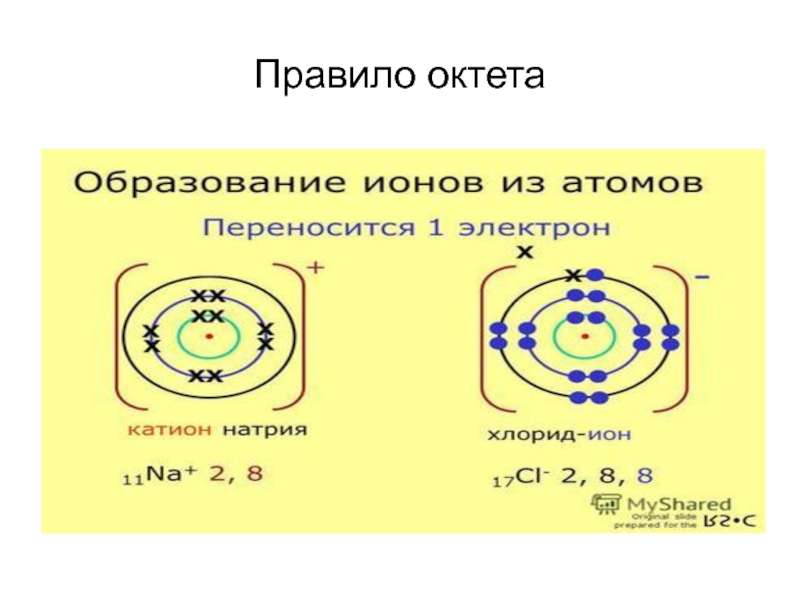
- 6. Правило октета
- 7. Степень окисления (СО) Это условный заряд на
- 8. Важное определение ОВР - это такие химические
- 10. Правила расчета степени окисления (СО) 1.Сумма СО
- 12. Переменные СО серы
- 13. Переменные СО атома азота
- 14. СО железа в его соединениях
- 17. Основные понятия Окислитель (Ox) – частица, которая
- 18. Может ли реакция протекать справа налево?
- 19. Направление ОВР Термодинамические процессы, в том числе
- 21. Стандартный окислительно-восстановительный потенциал (E0) ЭДС = E0
- 22. Направление ОВР E (Zn2+ / Zn) =
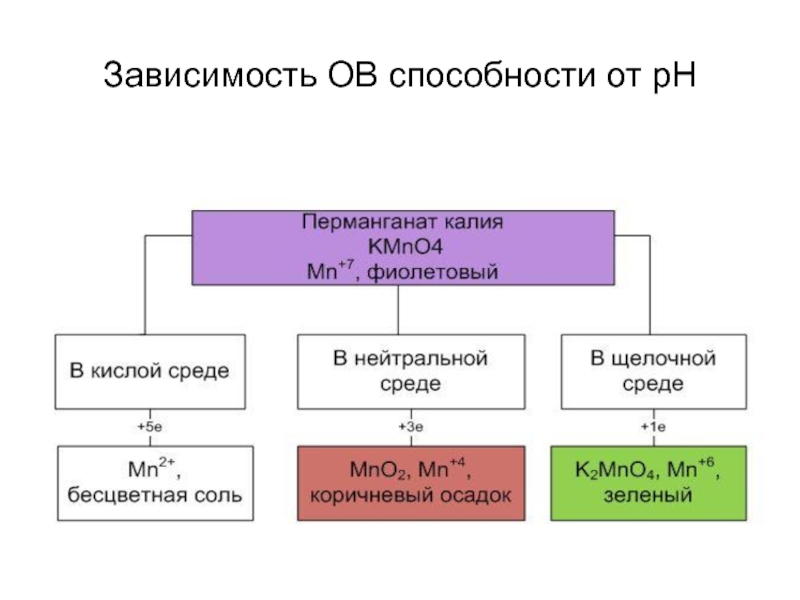
- 24. Зависимость ОВ способности от рН
- 26. Метод электронного баланса
- 27. Метод электронного баланса
- 28. Метод электронного баланса
- 31. Роль ОВР
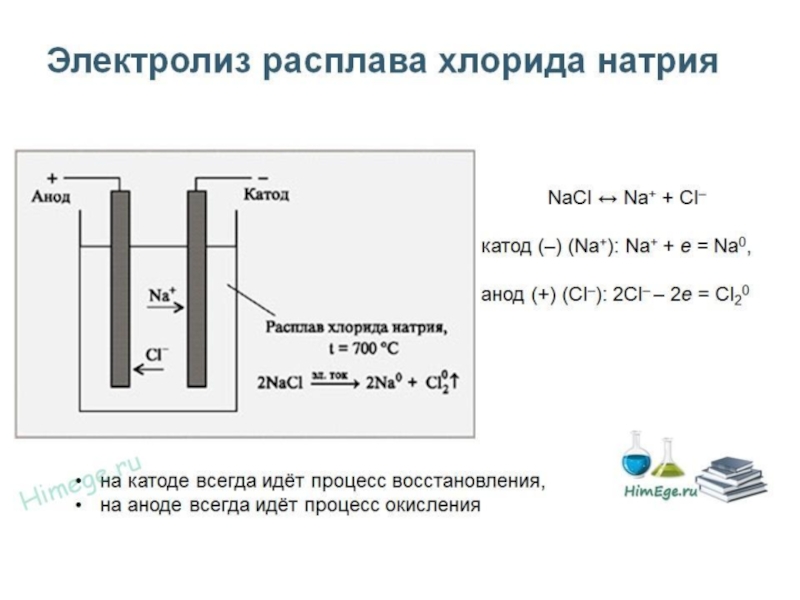
- 32. Электролиз Окислительно-восстановительный процесс разложения электролитов под действием постоянного электрического тока.
- 33. Сущность электролиза! Состоит в том, что электрический
- 35. Электролиз растворов При электролизе растворов наряду с
- 42. Электролиз водного раствора сульфата натрия
- 43. Важный вывод В водном растворе
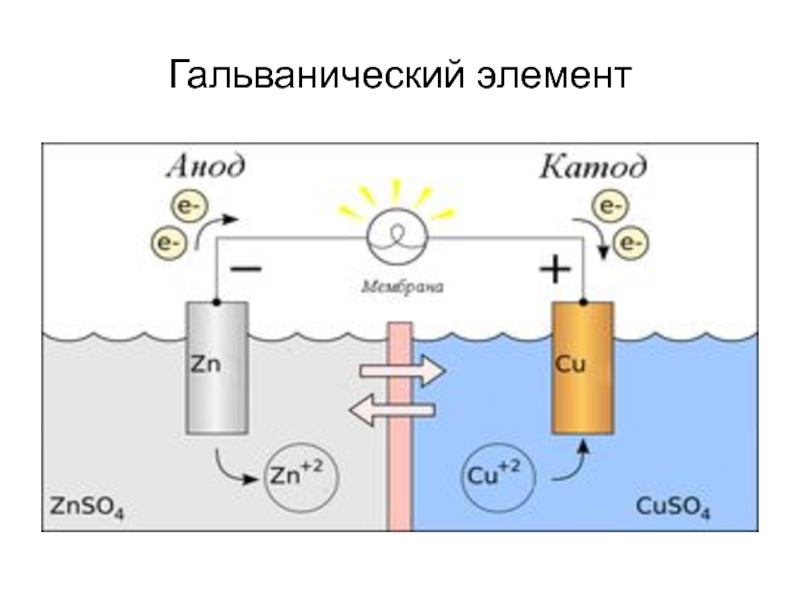
- 48. Гальвани́ческий элеме́нт Это химический источник электрического тока,
- 49. Гальванический элемент
- 50. Основы химической термодинамики
Слайд 2План лекции
1. Основные понятия и определения.
2.Метод электронного баланса.
3. Классификация
ОВР.
4. Значение ОВР.
5. Электролиз как окислительно-восстановительный процесс; практическое использование.
4. Значение ОВР.
5. Электролиз как окислительно-восстановительный процесс; практическое использование.
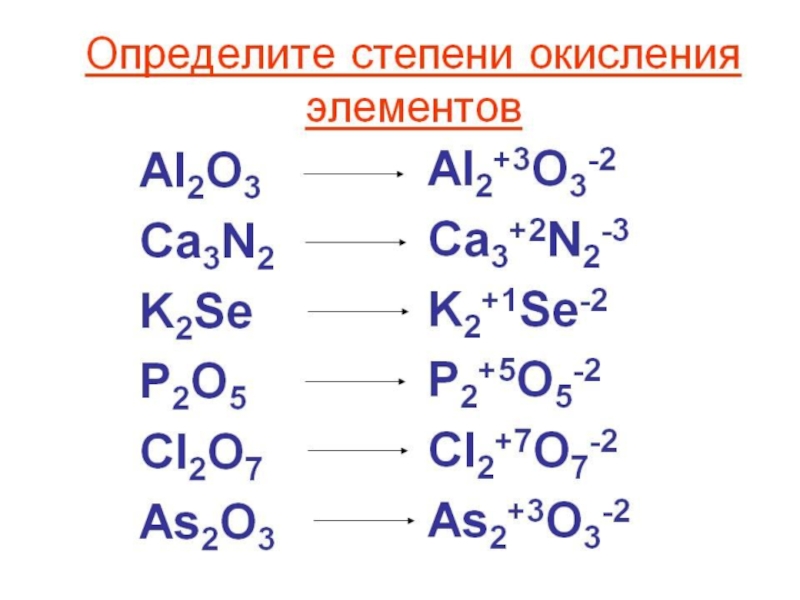
Слайд 7Степень окисления (СО)
Это условный заряд на атоме элемента в соединении, рассчитанный
исходя из предположения, что все общие электронные пары перешли от менее электроотрицательного (ЭО) к более ЭО атому.
Не путать СО с валентностью !!!
Не путать СО с валентностью !!!
Слайд 8Важное определение
ОВР - это такие химические реакции, в которых происходит передача
ЭЛЕКТРОНОВ от одних частиц (атомов, молекул, ионов) к другим, в результате чего изменяется степень окисления атомов, входящих в состав этих частиц.
Слайд 10Правила расчета степени окисления (СО)
1.Сумма СО всех атомов в частице равна
заряду этой частицы.
2. Более электроотрицательным атомам соответствует более низкая СО.
3. Щелочные металлы, фтор, бор, алюминий ИМЕЮТ ПОСТОЯННЫЕ степени окисления
4. Максимальная СО равна номеру группы В пс ( ЕСТЬ исключения).
2. Более электроотрицательным атомам соответствует более низкая СО.
3. Щелочные металлы, фтор, бор, алюминий ИМЕЮТ ПОСТОЯННЫЕ степени окисления
4. Максимальная СО равна номеру группы В пс ( ЕСТЬ исключения).
Слайд 17Основные понятия
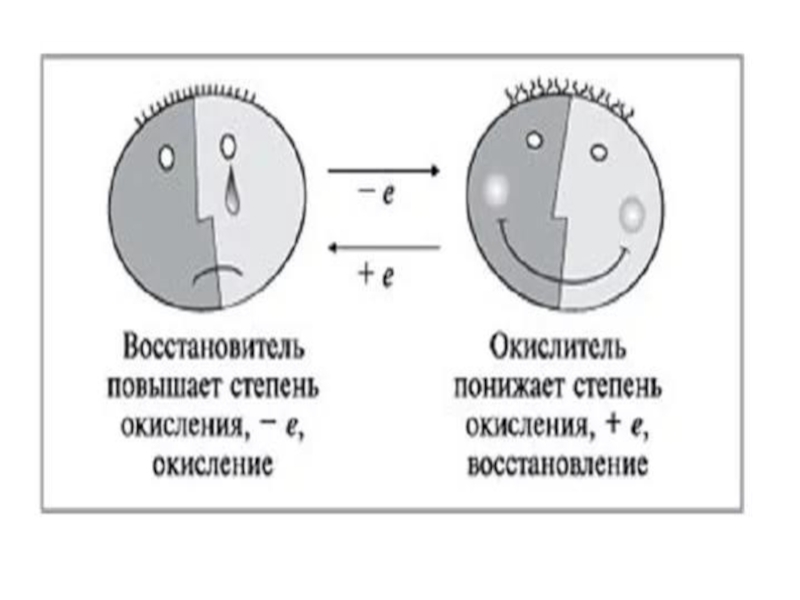
Окислитель (Ox) – частица, которая в ходе ОВР приобретает электроны.
Восстановитель (Red) – частица, которая в ходе ОВР отдает электроны. Восстановление – процесс, в ходе которого окислитель приобретает электроны и переходит в сопряженную восстановленную форму. Окисление – процесс, в ходе которого восстановитель отдает электроны и переходит в сопряженную окисленную форму.
Слайд 19Направление ОВР
Термодинамические процессы, в том числе ОВР, протекают самопроизвольно только в
случае уменьшения свободной энергии Гиббса (G), т е. когда из более сильных окислителя и восстановителя образуются менее сильные окислитель и восстановитель, соответственно.
Слайд 21Стандартный окислительно-восстановительный потенциал (E0)
ЭДС = E0 ок.формы - E0 восст .формы,
КоличественнОЙ характеристикОЙ ОВ СПОСОБНОСТИ веществ и ЯВЛЯЕТСЯ E0 -cтандартный окислительно-восстановительный потенциал. Чем больше положительное значение E0 (В), тем более сильным является окислитель.
Слайд 32Электролиз
Окислительно-восстановительный процесс разложения электролитов под действием постоянного электрического тока.
Слайд 33Сущность электролиза!
Состоит в том, что электрический ток может быть сильным окислителем
и восстановителем. За счет его энергии могут протекать те реакции, которые самопроизвольно протекать не могут, а следовательно, могут быть получены те вещества, которые другими способами получить затруднительно.
Слайд 35Электролиз растворов
При электролизе растворов наряду с процессами восстановления катионов и окисления
анионов вещества на электродах, могут восстанавливаться или окисляться и молекулы воды.
Слайд 43Важный вывод
В водном растворе
на катоде никогда не восстанавливаются катионы
типичных восстановителей, вместо них
восстанавливается вода.
на аноде никогда не окисляются анионы оксокислот, вместо них окисляется вода.
восстанавливается вода.
на аноде никогда не окисляются анионы оксокислот, вместо них окисляется вода.
Слайд 48Гальвани́ческий элеме́нт
Это химический источник электрического тока, основанный на ОВР между двумя
металлами в растворах электролитов. Назван в честь Луиджи Гальвани. в гальванических элементах происходит переход химической энергии в электрическую.