- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окислительно-восстановительные реакции презентация
Содержание
- 1. Окислительно-восстановительные реакции
- 2. Электронная теория ОВР Степень окисления - условный
- 3. Окисление – процесс отдачи электронов атомом, молекулой
- 4. Окислительно-восстановительные реакции меж- молекулярные диспропорционирования
- 5. Влияние среды раствора на протекание ОВР МЭ
- 6. Электродный потенциал. Уравнение Нернста EMe = E0Me
- 7. Электродный потенциал, возникающий на границе фаз называется
- 8. Понятие о гальваническом элементе Гальванический элемент –
- 9. 5KI + KIO3 + 3H2SO4 = 3I2+3K2SO4+3H2O
- 10. Можно ли окислить Br- до элементарного брома,
- 11. Возможность и направление протекания ОВР По величине
- 12. Пример Выбрать галогенид калия в качестве восстановителя
- 13. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ В БИОЛОГИЧЕСКИХ СИСТЕМАХ Окислительно-восстановительные процессы
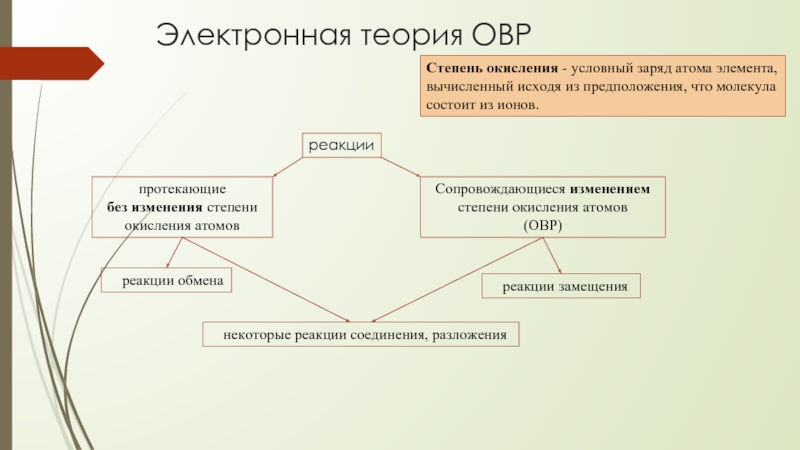
Слайд 2Электронная теория ОВР
Степень окисления - условный заряд атома элемента, вычисленный исходя
реакции
протекающие
без изменения степени окисления атомов
Сопровождающиеся изменением степени окисления атомов
(ОВР)
реакции обмена
некоторые реакции соединения, разложения
реакции замещения
Слайд 3Окисление – процесс отдачи электронов атомом, молекулой или ионом, ст. окисления
Ca – 2e- = Ca+2 H02 – 2e- = 2H+
Восстановление – процесс присоединения электронов атомом, молекулой, ионом. Ст. окисления при этом понижается.
Fe+3 + e- = Fe2+ Cl02 + 2e- = 2Cl-
Окислители
молекулы или ионы, присоединяющие электроны
те простые вещества, элементы которых обладают высокой электроотрицательностью, т.е. неметаллы: F2, O2, Cl2, Br2, S и т.д.
ионы металлов и водорода: Ag +, Au3+, Cu2+, H+, Fe3+, и т.д.
сложные вещества, которые содержат атомы неметаллов, имеющие высокие степени окисления K 2Cr+62O7, KMn+7O4, HN+5O3, H2S+6O4, HCl+7O4, K2Cr+6O4
Восстановители
простые вещества, образованные элементами с низкой электроотрицательностью, т.е. все металлы и некоторые неметаллы (H2, B, C). Наиболее активный восстановитель – франций.
сложные вещества, которые содержат атомы с низкими степенями окисления: Fe+2Cl 2, Cr2+3(SO4)3, KCl-1, H2S-2, N-3H3, H2S+4O3
Вещества, обладающие окислительно-восстановительной двойственностью
содержащие элементы в промежуточных степенях окисления,
могут выполнять как функции окислителей, так и восстановителей,
Например:
N -3H3 - всегда восстановитель
N2-2H4, N-1H2OH, N20, N2+1O, N+2O, N2+3O3, N+4O2 – обладают окислительно – восстановительной двойственностью
N2+5O5 - всегда окислитель
Азот в степени окисления -3 – может быть только восстановителем, т.е. может только повышать степень окисления.
Азот в степени окисления +5 всегда окислитель, повысить степень окисления не может, может только понизить.
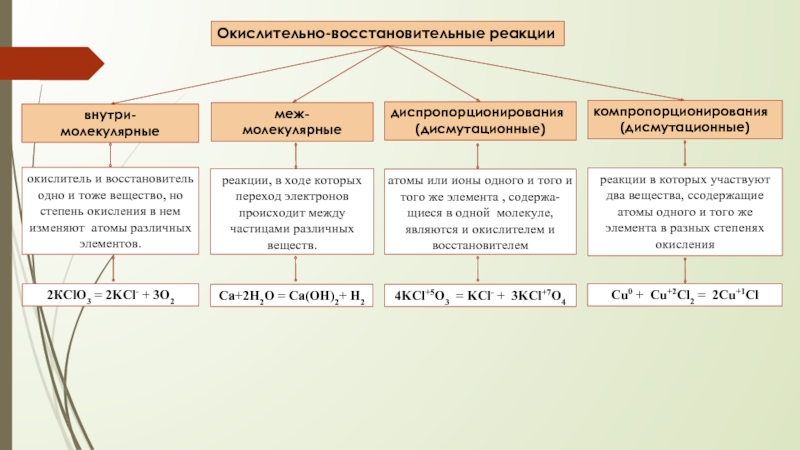
Слайд 4Окислительно-восстановительные реакции
меж- молекулярные
диспропорционирования
(дисмутационные)
внутри- молекулярные
компропорционирования
(дисмутационные)
реакции, в ходе
атомы или ионы одного и того и того же элемента , содержа-щиеся в одной молекуле, являются и окислителем и восстановителем
4KCl+5O3 = KCl- + 3KCl+7O4
окислитель и восстановитель одно и тоже вещество, но степень окисления в нем изменяют атомы различных элементов.
2КClO3 = 2KCl- + 3O2
реакции в которых участвуют два вещества, cсодержащие атомы одного и того же элемента в разных степенях окисления
Cu0 + Cu+2Cl2 = 2Cu+1Cl
Ca+2H2O = Ca(OH)2+ H2
Слайд 5Влияние среды раствора на протекание ОВР
МЭ KMnO4 = М\5 = 158\5
MnO-4 + 8H+ + 5e = Mn+2 + 4H2O
MnO-4+ 1e = MnО42-
MnO-4 + 2H2O + 3e = ↓MnО2 + 4OH-
Эквивалент окислителя и эквивалент восстановителя – это часть моля, которая отвечает соответственно одному присоединенному или отданному каждой молекулой электрону в данной реакции.
МЭ KMnO4 = M\3 = 158\3 = 52,7 г\моль-экв
МЭ KMnO4 = M\1 = 158\1 = 158,0г\моль
Слайд 6Электродный потенциал. Уравнение Нернста
EMe = E0Me + (R ∙T/n ·F) /
а в случае разбавленных растворов полностью диссоциирующих солей данного металла
ЕMe = E0Me + (R∙T/n · F) / ln[Men+],
где E0Me- стандартный электродный потенциал
R- универсальная газовая постоянная R=8,314Дж\моль· К
F- постоянная Фарадея F=96487 Кл
n - заряд иона металла T=298,15 К
аMen+ , [ Men+] – активность или концентрация ионов металла (моль\л)
В.Г. Нернст (1888)
EMe = E0Me + 0,0592/n ·lg [Men+]
Слайд 7Электродный потенциал, возникающий на границе фаз называется стандартным водородным потенциалом Е02Н+/H2,
Потенциалы, измеренные при температуре равной 25 0С, Р=101,325кПа и концентрации ионов 1 моль/л относительно СВЭ называются стандартными электродными потенциалами Е0 или окислительно – восстановительным или редокс – потенциалами
Система с большим электродным потенциалом всегда является окислителем по отношению к системе с меньшим потенциалом
1) чем меньше электродный потенциал металла Е0, тем легче он окисляется и труднее восстанавливается из своих ионов.
2) металлы, имеющие отрицательные значения электродных потенциалов , стоящие левее водорода, способны его вытеснять из разбавленных растворов кислот.
3) каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые имеют более высокий электродный потенциал.
Слайд 8Понятие о гальваническом элементе
Гальванический элемент – это устройство, в котором на
Процесс окисления (отдача электронов) на аноде (отрицательный полюс),
Процесс восстановления (присоединения) электронов – на катоде (положительный полюс)
Причина возникновения электрического тока – разность электродных потенциалов (э.д.с.)
ΔЕ = Ек - Еа > 0
Ек > Еа т.е. катод – электрод с более высоким электродным потенциалом.
медно-цинковый или элемент Даниэля-Якоби.
Zn-2e= Zn+2 (анодный процесс)
Cu2++2е=Cu0 (катодный процесс)
Zn+ Cu2+= Zn+2+ Cu0
Zn+CuSO4 = ZnSO4+Cu
Цинковый электрод – источник электронов –отрицательный,
медный электрод – положительный.
т.к. ЭДС должно быть > 0, поэтому надо из потенциала электрода имеющего большую алгебраическую величину, вычитать электрод- алгебраическая величина которого меньше.
Слайд 95KI + KIO3 + 3H2SO4 = 3I2+3K2SO4+3H2O
восстановительная полупара, включающую ион (атом)
I- - e = I0
2) окислительная полупара, включающая ион (атом) – окислитель,
IO3- + 6H+ + 5e = I0 + 3H2O
Чем выше значение потенциала Е0, тем выше у данной полупары окислительная способность ее окислительной формы.
Окислительная форма полупары, имеющая более высокое значение Е0, может принимать электроны от восстановительной формы с меньшим значением Е0.
Разность между стандартными окислительными потенциалами окислительной и восстановительной полупар называют электродвижущей силой реакции (ЭДС).
ЭДС = Е0Ox – E0Red
если ЭДС > 0 , то такая реакция осуществима;
если ЭДС <0, то возможной будет обратная реакция, для которой ЭДС будет иметь то же самое абсолютное значение, но с обратным знаком.
Слайд 10Можно ли окислить Br- до элементарного брома, используя элементарный хлор, т.е.
Е0 Br2/2Br- = 1,0652В ≈ 1,07 В
Е0 Cl2/2Cl - = 1,3595В ≈ 1,36 В
ЭДС = ∆ Е = Е0окисл. – Е0воост.= 1,3695 – 1,0652 = 0,29В > 0,
Значит, реакция осуществима.
Пример
Слайд 11Возможность и направление протекания ОВР
По величине ЭДС ЭДС > 0
По энергии
Для ОВР при Т = 298 ΔG0= - n ·F · ΔE0
При условиях, отличающихся от стандартных:
Ox + ne ↔ Red
электродный потенциал определяется уравнением Нернста:
Eoх/Red = E00х/Red - (RT/n· F) · ln(CRed/СOx)
Eox/Red и E0ox/Red - электродный и стандартный потенциалы системы.
N - число электронов, участвующих в процессе.
CRed и Cox - молярные концентрации восстановленной и окисленной форм.
Eox/Red = E0ox/Red – (0,059/n) · lg CRed/СOx
или
Слайд 12Пример
Выбрать галогенид калия в качестве восстановителя для FeCl3
2KГ- + 2 Fe
(Г = F-, Cl-, Br-, I- )
По таблице: E0Fe3+/Fe+2 = +0,77 B
E0F2/2F- = + 2,86 B
E0Cl2/2Cl- = + 1,36 B
E0Br2/2Br- = +1,07 B
E0I2/2I- = +0,54 B < 0.77 B
Вычислим э.д.с. с участием гологенидов для KI
ΔЕ0298 = Е0окисл. – Е0восст. = 0,77 – 0,54 = 0,23В > 0. Только иодид калия будет восстанавливать FeCl3, т.к. Δ Е0298 > 0.
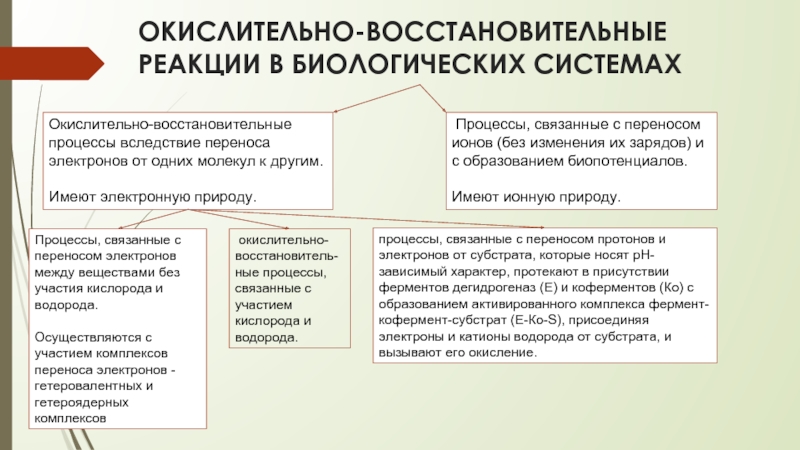
Слайд 13ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ В БИОЛОГИЧЕСКИХ СИСТЕМАХ
Окислительно-восстановительные процессы вследствие переноса электронов от одних
Имеют электронную природу.
Процессы, связанные с переносом ионов (без изменения их зарядов) и с образованием биопотенциалов.
Имеют ионную природу.
Процессы, связанные с переносом электронов между веществами без участия кислорода и водорода.
Осуществляются с участием комплексов переноса электронов - гетеровалентных и гетероядерных комплексов
окислительно-восстановитель-ные процессы, связанные с участием кислорода и водорода.
процессы, связанные с переносом протонов и электронов от субстрата, которые носят pH-зависимый характер, протекают в присутствии ферментов дегидрогеназ (E) и коферментов (Ко) с образованием активированного комплекса фермент-кофермент-субстрат (Е-Ко-S), присоединяя электроны и катионы водорода от субстрата, и вызывают его окисление.