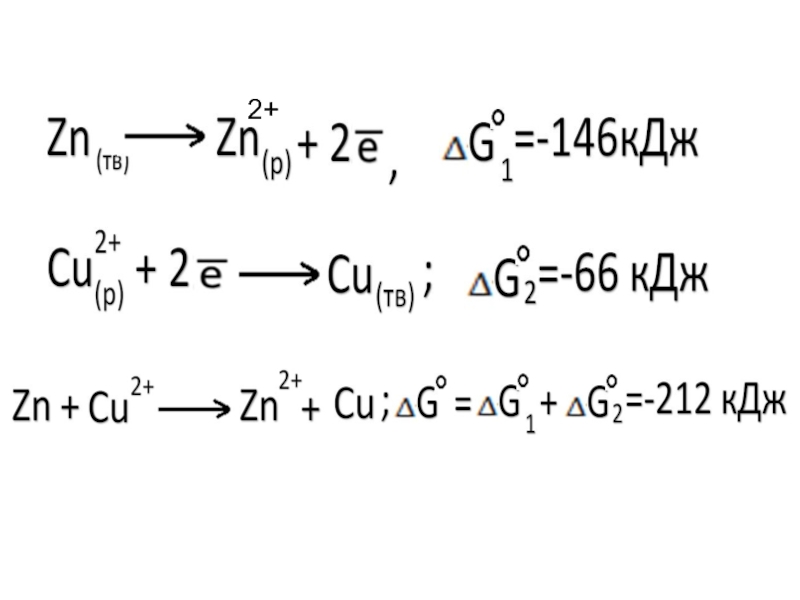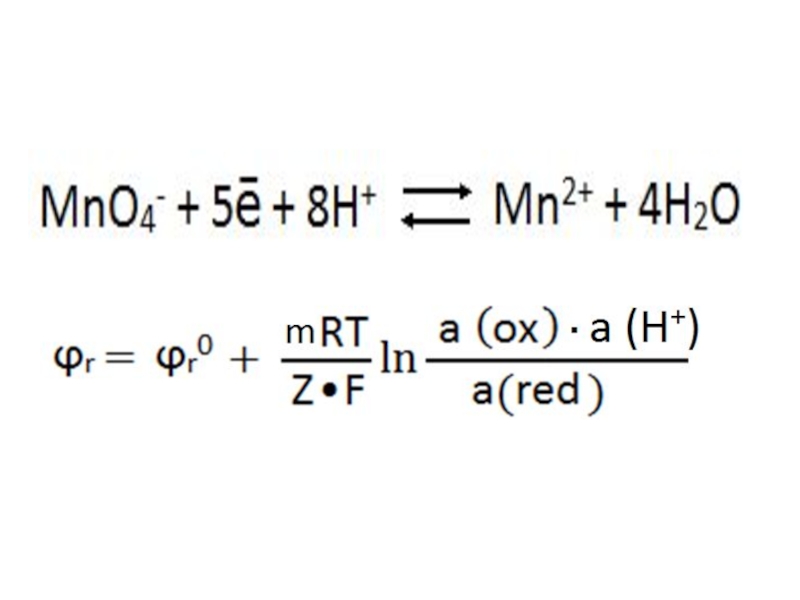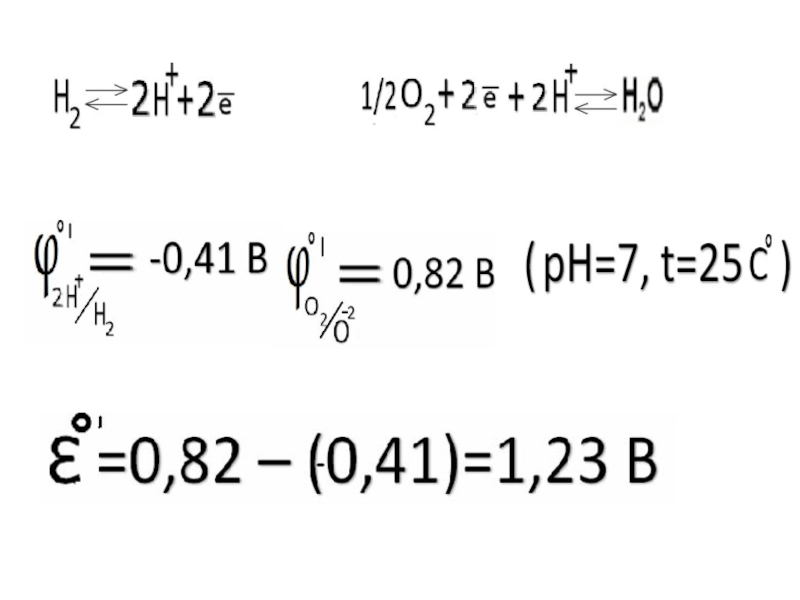- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окислительно-восстановительные равновесия и процессы презентация
Содержание
- 1. Окислительно-восстановительные равновесия и процессы
- 2. Электрохимия - раздел физической химии,
- 3. Учение об электролитах (главным образом о водных
- 4. Глубокая очистка веществ с помощью электролиза Электросинтез
- 5. Превращение химической энергии питательных (органических) веществ в
- 6. Биоэлектрохимия — изучение электрохимических основ работы живых
- 7. Проводники 1 рода — носителями электричества являются
- 8. Величина, характеризующая способность вещества проводить электрический
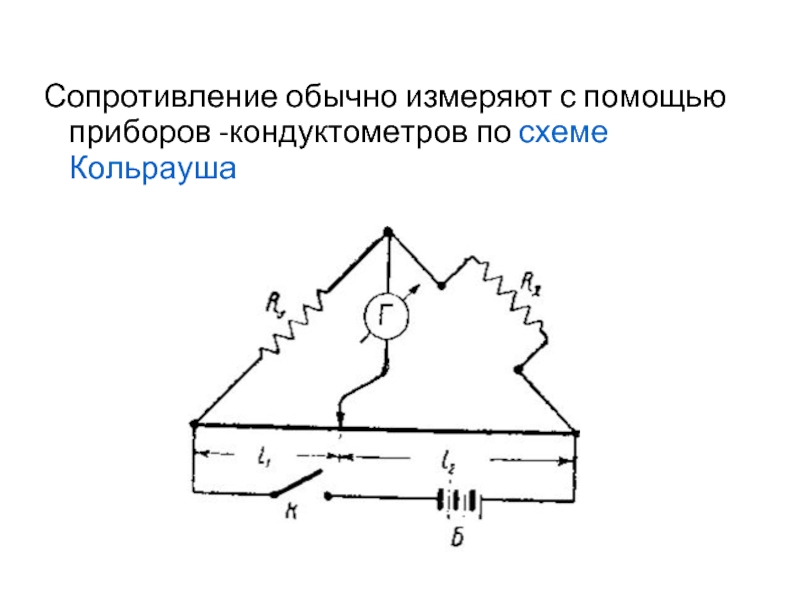
- 9. Сопротивление обычно измеряют с помощью приборов -кондуктометров по схеме Кольрауша
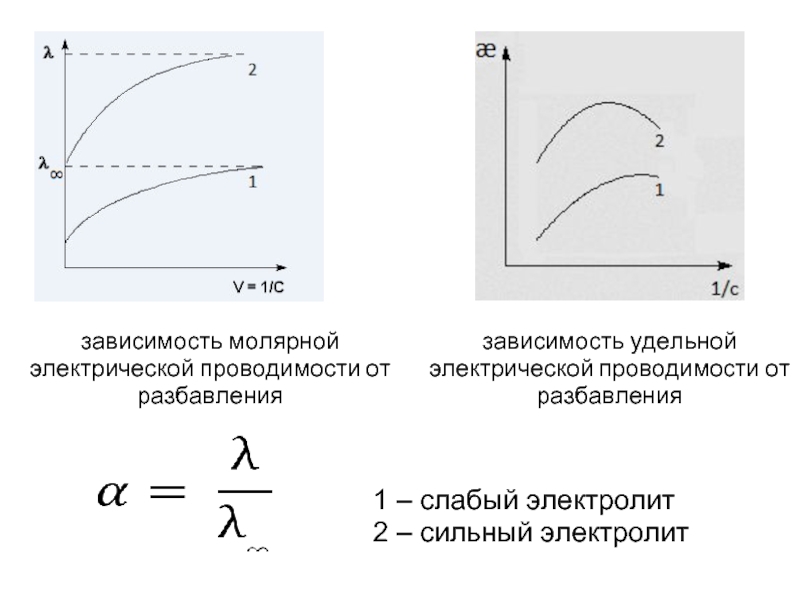
- 10. зависимость удельной электрической проводимости от разбавления зависимость
- 11. Электропроводимость зависит от: Природы электролита Свойств растворителя
- 12. молярная электропроводимость Ом-1 ∙ м2∙ моль-1
- 13. λ уменьшается при увеличении концетрации
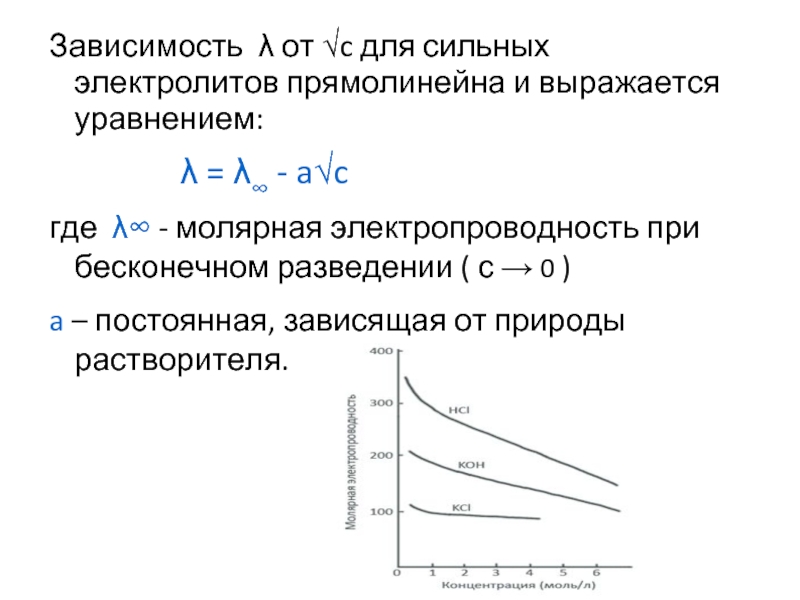
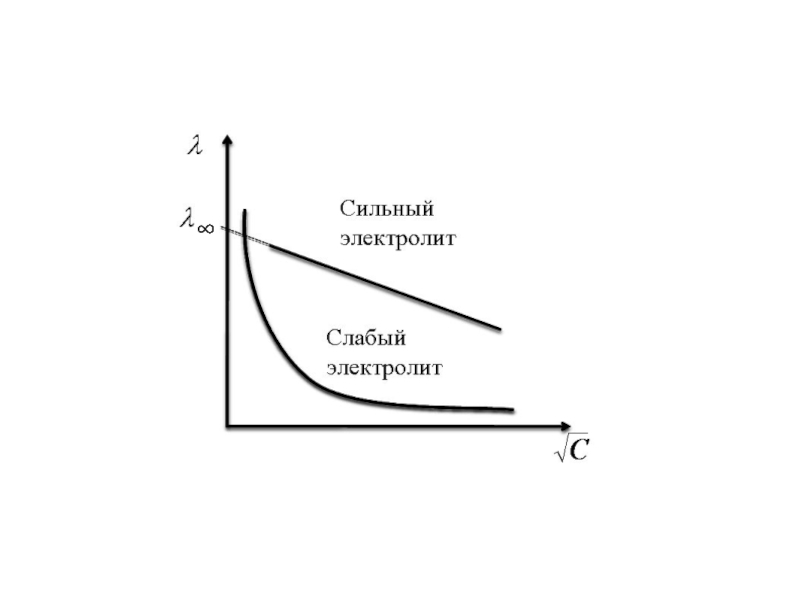
- 14. Зависимость λ от √c для сильных электролитов
- 15. Закон Кольрауша: λ∞ = l∞An + l∞Kt
- 16. ∞
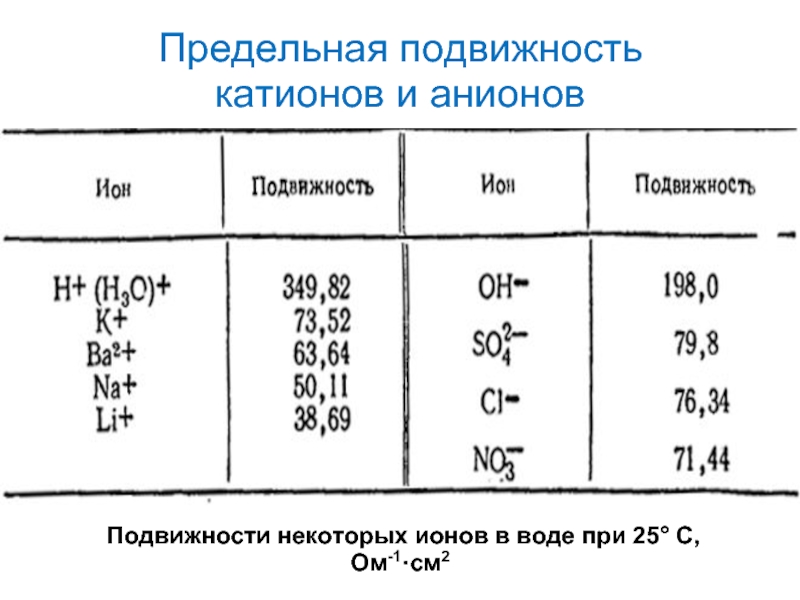
- 17. Предельная подвижность катионов и анионов
- 18. Кондуктометрия – физико-химический метод исследования различных систем,основанный
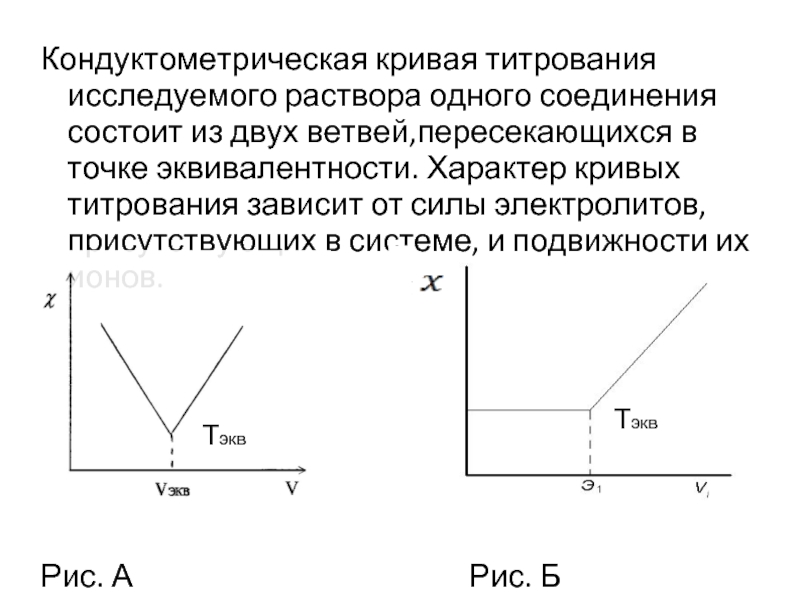
- 19. Кондуктометрическая кривая титрования исследуемого раствора одного соединения
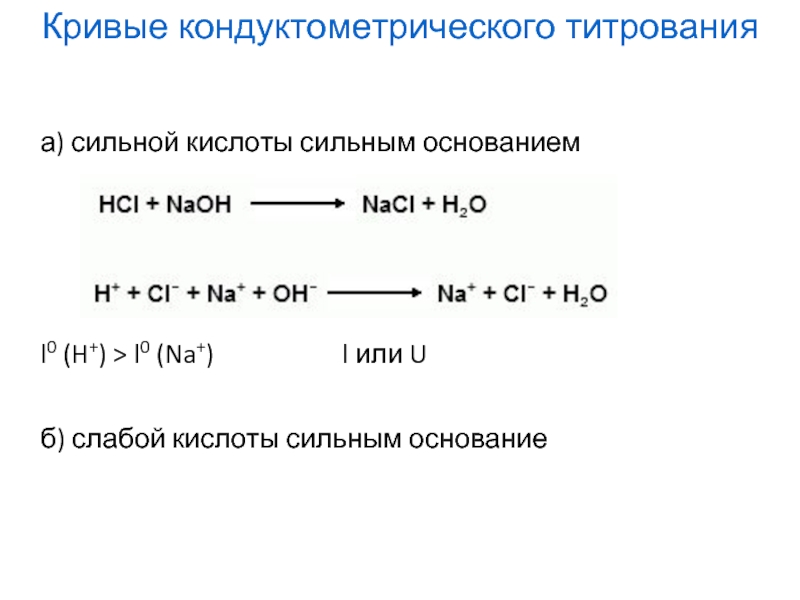
- 20. а) сильной кислоты сильным основанием
- 21. Электродные потенциалы
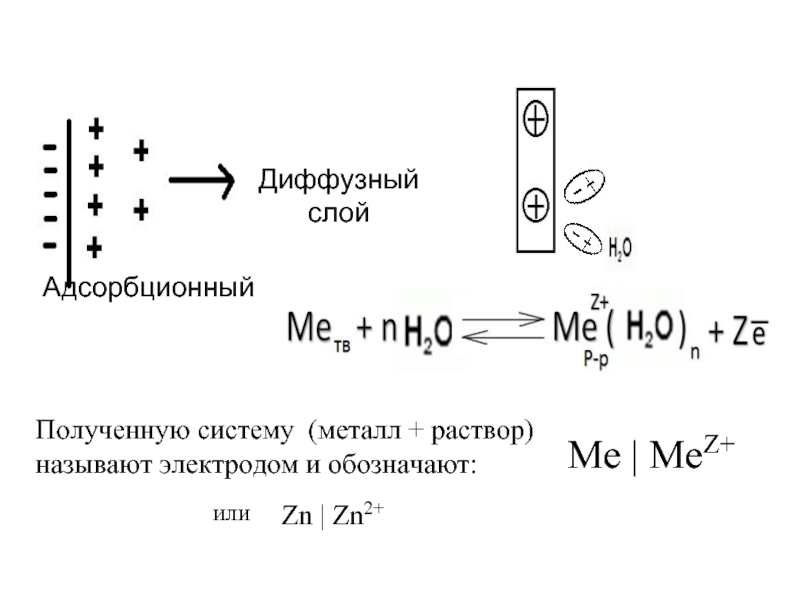
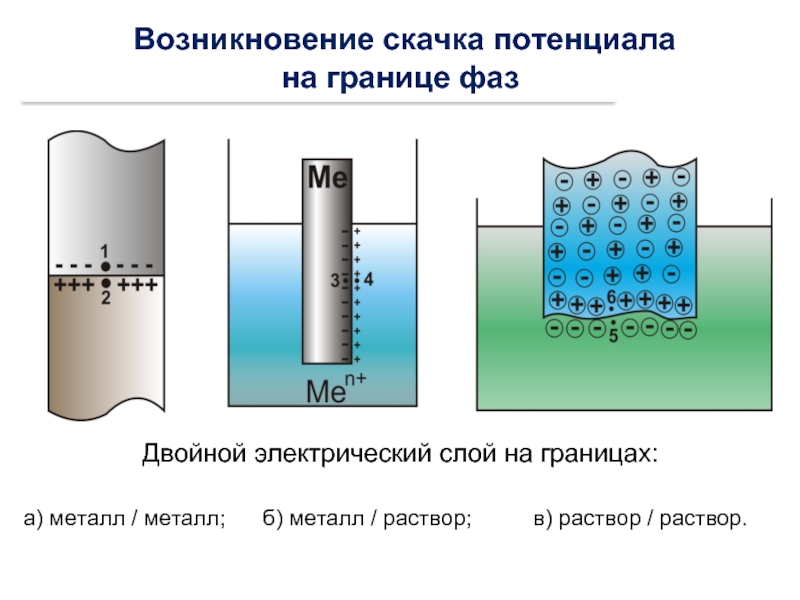
- 22. Диффузный слой Адсорбционный Полученную систему (металл +
- 23. Возникновение скачка потенциала на границе фаз
- 24. 2+
- 25. Схема гальванического элемента Даниэля-Якоби
- 26. 4.1. Электрохимические ГЭ Гальванический элемент Даниэля-Якоби
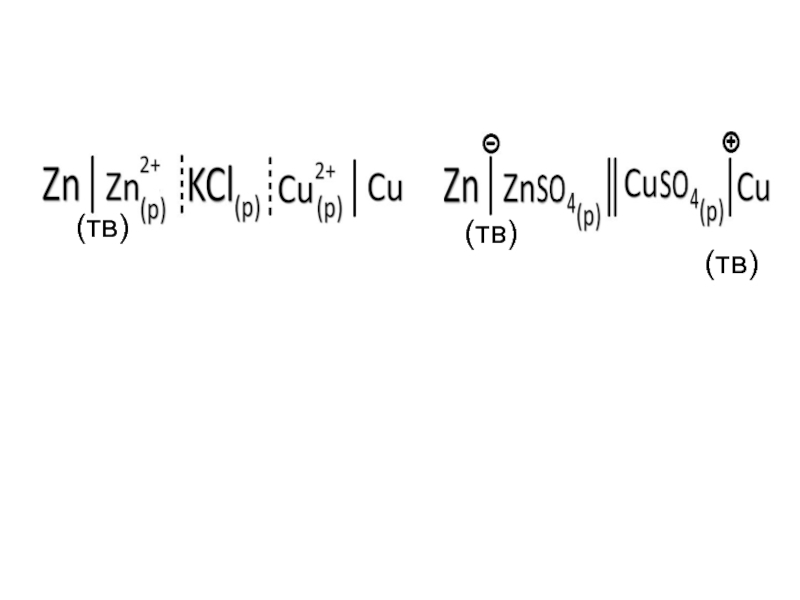
- 27. ПРАВИЛО ЗАПИСИ ГЭ: Слева всегда пишется
- 28. (тв) (тв) (тв)
- 29. (B) Уравнение НЕРНСТА φ (Mez+, Me) –
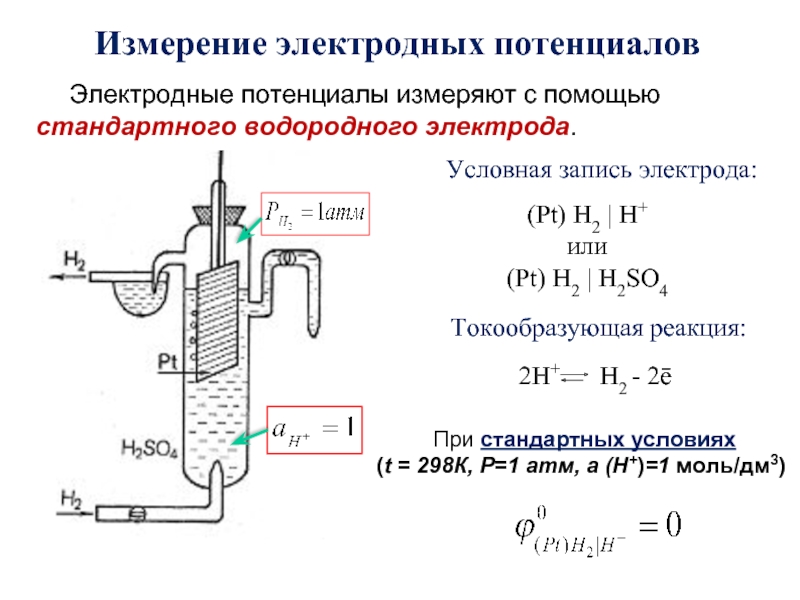
- 30. Измерение электродных потенциалов Электродные потенциалы измеряют с
- 31. Уравнение Нернста для водородного электрода:
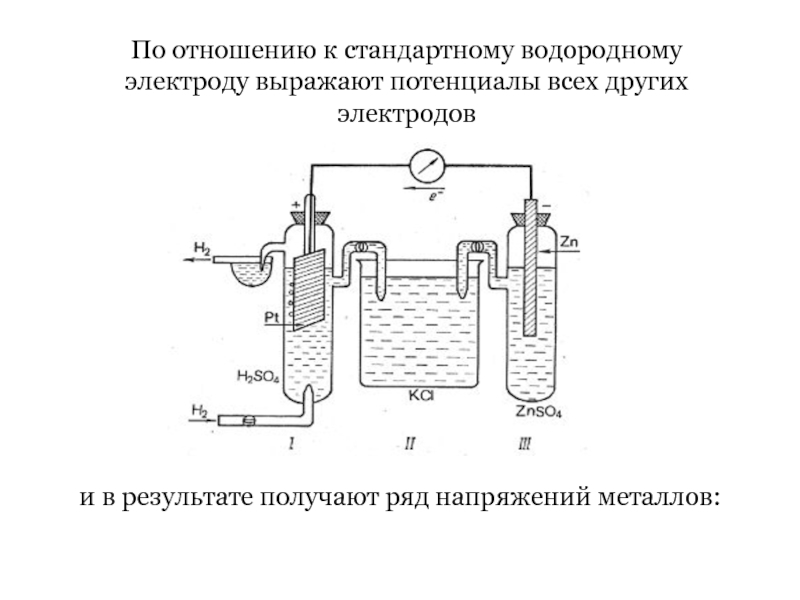
- 32. По отношению к стандартному водородному электроду выражают
- 33. Электрохимический ряд напряжений металлов Увеличение потенциала Усиление
- 34. Окислительно – восстановительные системы
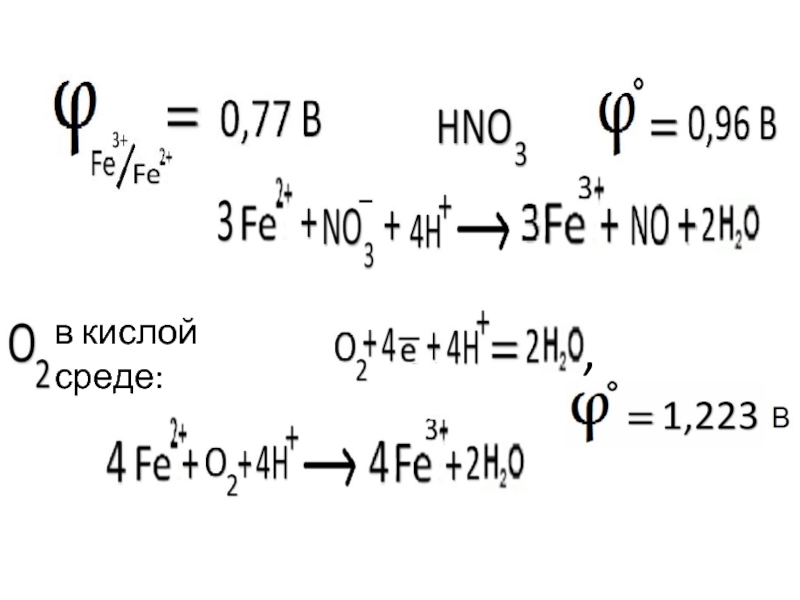
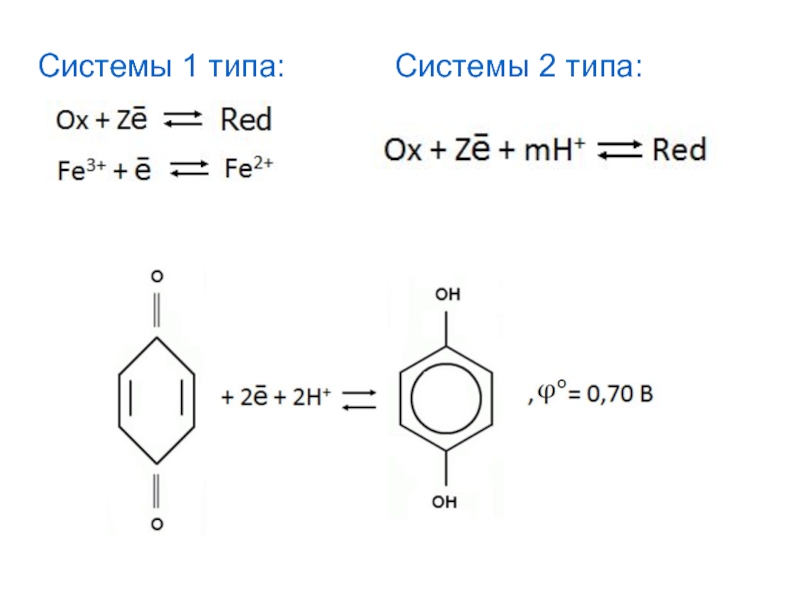
- 35. в кислой среде: ,
- 36. Системы 1 типа: Системы 2 типа:
- 38. система, в которой инертный металл (Pt, Au)
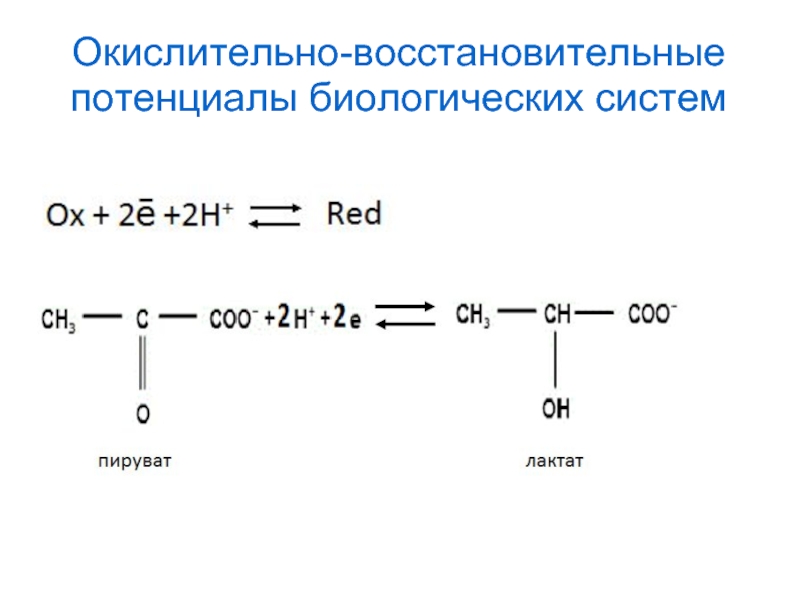
- 39. Окислительно-восстановительные потенциалы биологических систем
- 42. Расчет ЭДС гальванического элемента Электродвижущая сила (ЭДС)
- 43. Направление протекания окислительно-восстановительных реакций Е° = 0
- 44. Электроды: a) I рода Ионно-металлические водородный
- 45. Потенциометрия Потенциометрические методы анализа основаны на измерение
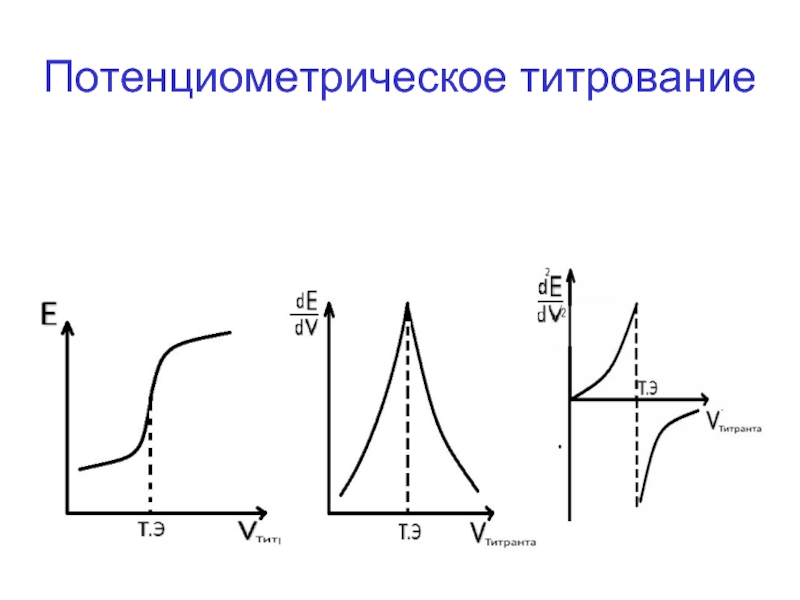
- 46. Потенциометрическое титрование
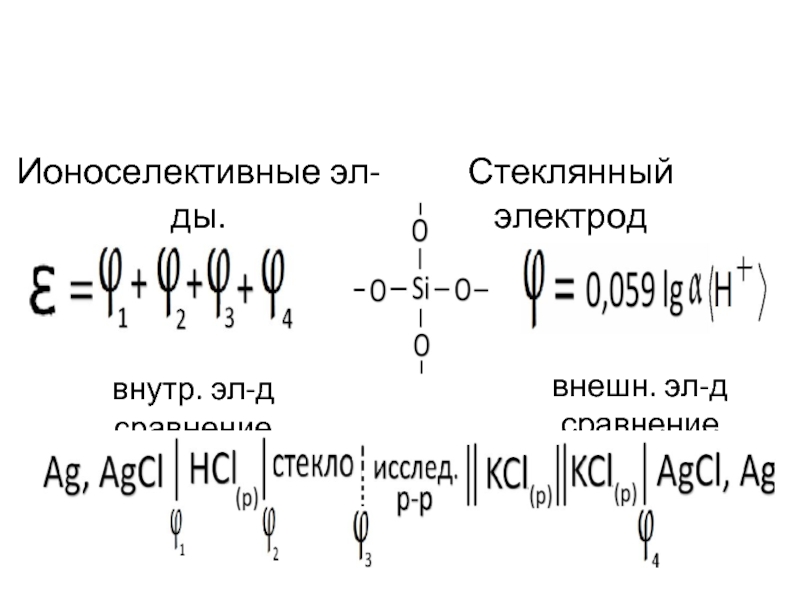
- 48. внешн. эл-д сравнение Ионоселективные эл-ды. Стеклянный электрод внутр. эл-д сравнение
- 49. Хлорсеребряный электрод Для насыщ. KCl:
- 50. Хлорсеребряный электрод - электрод сравнения В насыщенном
- 51. Каломельный электрод Для насыщенного раствора KCl:
Слайд 1Окислительно-восстановительные равновесия и процессы
Электрохимия и электрохимические методы исследования в физиологии и
Слайд 2
Электрохимия - раздел физической химии, изучающий процессы превращения энергии химической реакции
Слайд 3Учение об электролитах (главным образом о водных растворах электролитов)
Термодинамика электродных процессов(учение
Кинетика электродных процессов ( учение о скоростях процессов, проходящих на поверхности раздела фаз)
Основные разделы электрохимии:
Слайд 4Глубокая очистка веществ с помощью электролиза
Электросинтез
Получение тонких пленок, контактов, защитных покрытий
Создание
Развитие и разработка электрохимических методов анализа (полярография, кондуктометрия, потенциометрия и др. - имеют широкое применение в медико-биологических исследованиях)
Практической значение
электрохимии как науки:
Слайд 5Превращение химической энергии питательных (органических) веществ в электрохимическую энергию (зарядка клеточных
Возникновение биопотенциалов и перенос веществ через мембраны
Передача нервных импульсов и т.д.
Электрохимические явления лежат в основе важнейших биохимических процессов:
Слайд 6Биоэлектрохимия — изучение электрохимических основ работы живых систем: биоэлектрохимии мембран, биоэлектрокатализа,
Слайд 7Проводники 1 рода — носителями электричества являются электроны (электронная проводимость). К
Проводники 2 рода — перенос электричества в них осуществляется ионами (ионная проводимость). Это растворы и расплавы электролитов.
Электрохимия изучает проводники 2 рода
Электрическая проводимость растворов электролитов
Слайд 8 Величина, характеризующая способность вещества проводить электрический ток, называется электропроводимостью.
Величина, обратная
Электропроводимость
Сопротивление
ρ
Слайд 10зависимость удельной электрической проводимости от разбавления
зависимость молярной электрической проводимости от разбавления
1
2 – сильный электролит
Слайд 11Электропроводимость зависит от:
Природы электролита
Свойств растворителя
Температуры
Концентрации раствора
Молярная электропроводимость (λ) – электрической проводимость
Слайд 13
λ уменьшается при увеличении концетрации раствора:
для слабых электролитов это связано
для сильных электролитов зависимость определяется силами межионного взаимодействия и диэлектрической проницаемости среды.
Слайд 14Зависимость λ от √c для сильных электролитов прямолинейна и выражается уравнением:
где λ∞ - молярная электропроводность при бесконечном разведении ( с → 0 )
a – постоянная, зависящая от природы растворителя.
Слайд 15Закон Кольрауша:
λ∞ = l∞An + l∞Kt
Предельная молярная электрическая проводимость- (λ∞)
Слайд 17Предельная подвижность
катионов и анионов
Подвижности некоторых ионов в воде при
Слайд 18Кондуктометрия – физико-химический метод исследования различных систем,основанный на измерении их электрической
Прямые и косвенные кондуктометрические измерения
Кондуктометрическое титрование (реакции нейтрализации, замещения и осаждения)
Слайд 19Кондуктометрическая кривая титрования исследуемого раствора одного соединения состоит из двух ветвей,пересекающихся
Рис. А Рис. Б
Тэкв
Тэкв
Слайд 20а) сильной кислоты сильным основанием
l0 (H+) >
б) слабой кислоты сильным основание
Кривые кондуктометрического титрования
Слайд 22Диффузный слой
Адсорбционный
Полученную систему (металл + раствор)
называют электродом и обозначают:
Zn | Zn2+
Ме
или
Слайд 23 Возникновение скачка потенциала
на границе фаз
Двойной электрический слой на границах:
а) металл
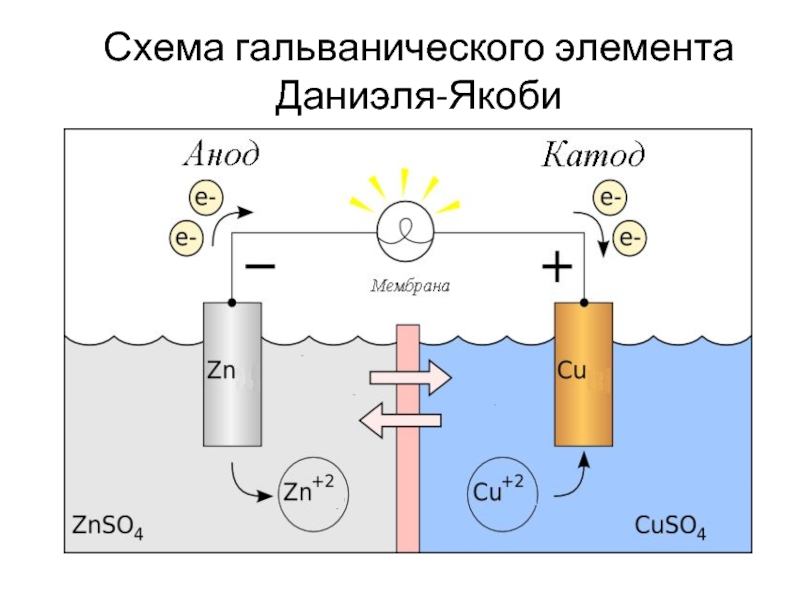
Слайд 26
4.1. Электрохимические ГЭ
Гальванический элемент Даниэля-Якоби
Zn2+
Cu2+
2ē
Zn
Cu
_
+
ZnSO4
CuSO4
KCl
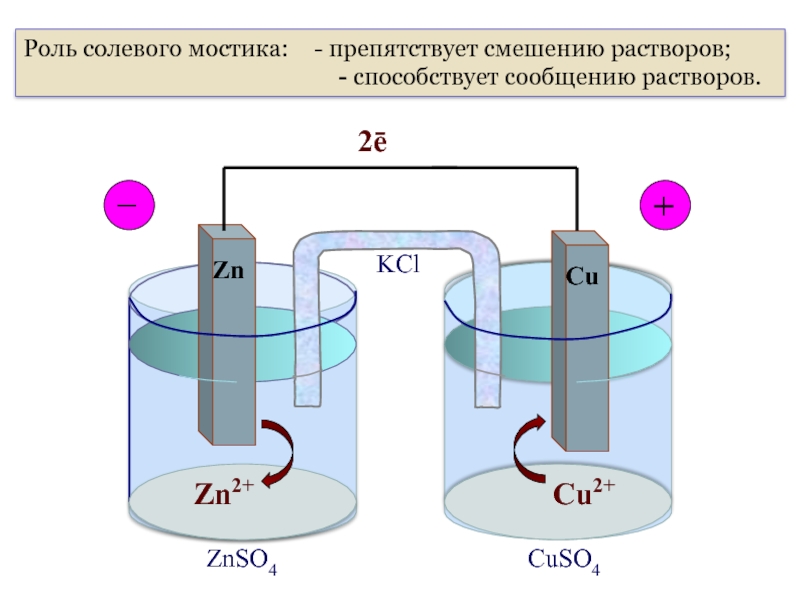
Роль солевого мостика: - препятствует смешению
Слайд 27ПРАВИЛО ЗАПИСИ ГЭ:
Слева всегда пишется электрод с меньшим стандартным потенциалом, этот
Справа пишется электрод с большим стандартным потенциалом, этот электрод называется КАТОДОМ (К) и на нем происходит процесс восстановления (+е).
Например: Привести схему ГЭ, составленного из двух электродов I рода: цинкового и медного.
Zn │ZnSO4; φ0 = -0,76 В
Cu │CuSO4; φ0 = 0,34 В
Слайд 29(B)
Уравнение НЕРНСТА
φ (Mez+, Me) – электродный потенциал металла Me в растворе,
φo (Mez+, Me) – стандартный электродный потенциал, вольт
R – универсальная газовая постоянная, Дж\моль∙К
Т – абсолютная температура, К
n – число электронов, участвующих в электродном процессе,
F – постоянная Фарадея,
a – активность ионов металла в растворе (для разбавленных растворов ее заменяют на концентрацию с), моль/дм3
Слайд 30Измерение электродных потенциалов
Электродные потенциалы измеряют с помощью стандартного водородного электрода.
При
(t = 298К, Р=1 атм, а (Н+)=1 моль/дм3)
Слайд 32По отношению к стандартному водородному электроду выражают потенциалы всех других электродов
и
Слайд 33Электрохимический ряд напряжений металлов
Увеличение потенциала
Усиление окислительных свойств
Уменьшение химической активности металла
Активные
Средней
Благород
ные
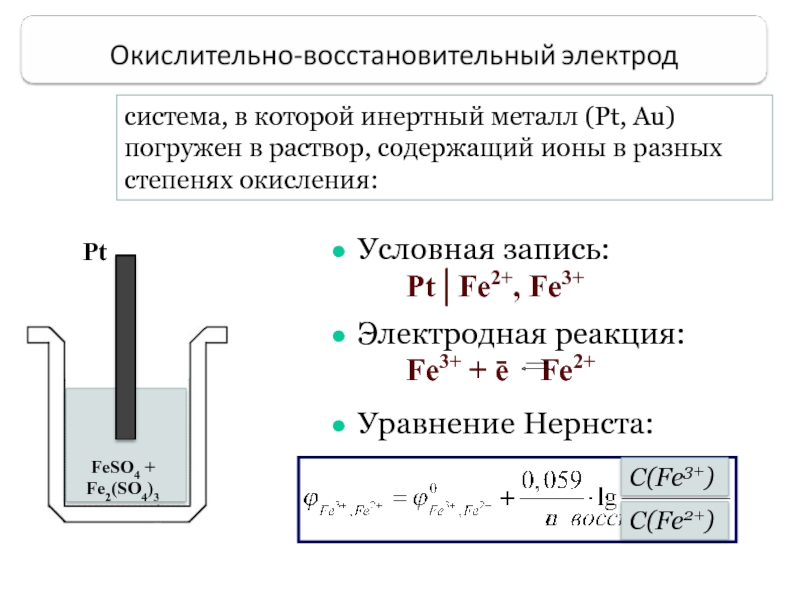
Слайд 38система, в которой инертный металл (Pt, Au) погружен в раствор, содержащий
Pt
FeSO4 + Fe2(SO4)3
Условная запись:
Pt│Fe2+, Fe3+
Электродная реакция:
Fe3+ + ē Fe2+
Уравнение Нернста:
C(Fe3+)
C(Fe2+)
Слайд 42Расчет ЭДС гальванического элемента
Электродвижущая сила (ЭДС) –
это разность электродных потенциалов
ЭДС(Е) Еº=φºок. - φºвосст. Еº>0
Слайд 43Направление протекания окислительно-восстановительных реакций
Е° = 0 – условие возникновения хим. равновесия
Δ G° = -2,3RT Ig Kp
Δ G° = -zFE°
Слайд 44Электроды:
a) I рода
Ионно-металлические
водородный показатель
и
б) II рода
в) Окислительно-восстановительные эл-ды
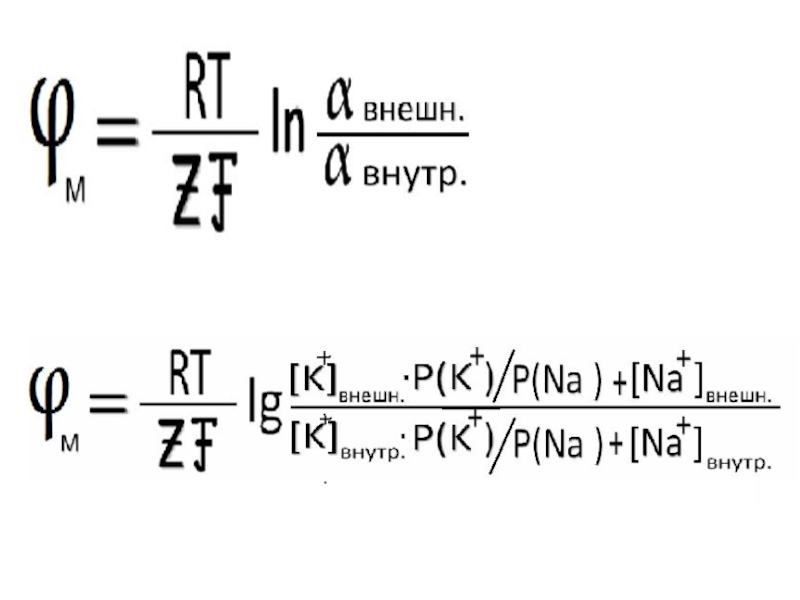
г) мембранные
Слайд 45Потенциометрия
Потенциометрические методы анализа основаны на измерение электрохимических потенциалов,возникающих на погруженных в
Е –ЭДС составленного гальванического элемента
- Потенциал электрода сравнения