- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
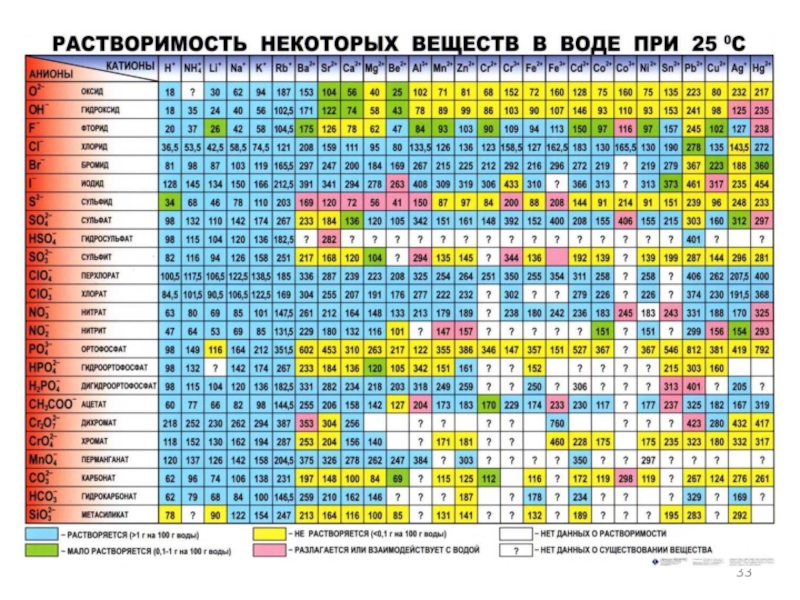
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ презентация
Содержание
- 1. Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
- 2. План лекции: 1. Общие вопросы аналитической химии.
- 3. Рекомендуемая литература
- 4. Новая литература
- 5. Определение предмета «Аналитическая химия»
- 6. Аналитическая химия, или аналитика – это раздел
- 7. Определение VIII Европейской конференции по аналитической химии
- 8. Определение по Г.Кристиану со ссылкой на Чарльза
- 9. Аналитическая служба Административная система, обеспечивающая конкретный анализ
- 10. Основные понятия аналитической химии: принцип, метод и методика анализа
- 11. Принцип анализа Явление, используемое для получения аналитической
- 12. Метод анализа Краткое изложение принципов, лежащих в
- 13. Методика анализа Методика анализа – это подробное
- 14. В зависимости от цели различают качественный, количественный и структурный анализ.
- 15. Качественный анализ Качественный анализ предполагает обнаружение или идентификацию компонентов анализируемого образца.
- 16. Количественный анализ В процессе количественного анализа происходит определение концентраций или масс компонентов.
- 17. Структурный анализ Цель структурного анализа – установление химического и пространственного строения исследуемого соединения.
- 18. Классификация видов анализа в зависимости от определяемого компонента
- 19. Классификация видов анализа в зависимости от массы или объема анализируемой пробы
- 20. Классификация видов анализа в зависимости от процедуры
- 21. Характеристики аналитической реакции Избирательность ( селективность) –
- 22. Избирательность аналитической реакции (в зависимости от
- 23. Методы аналитической химии
- 24. Методы аналитической химии при анализе образцов 1.
- 25. Химические методы обнаружения неорганических веществ.
- 26. Химические методы обнаружения неорганических веществ
- 27. Химические методы обнаружения неорганических веществ основаны на
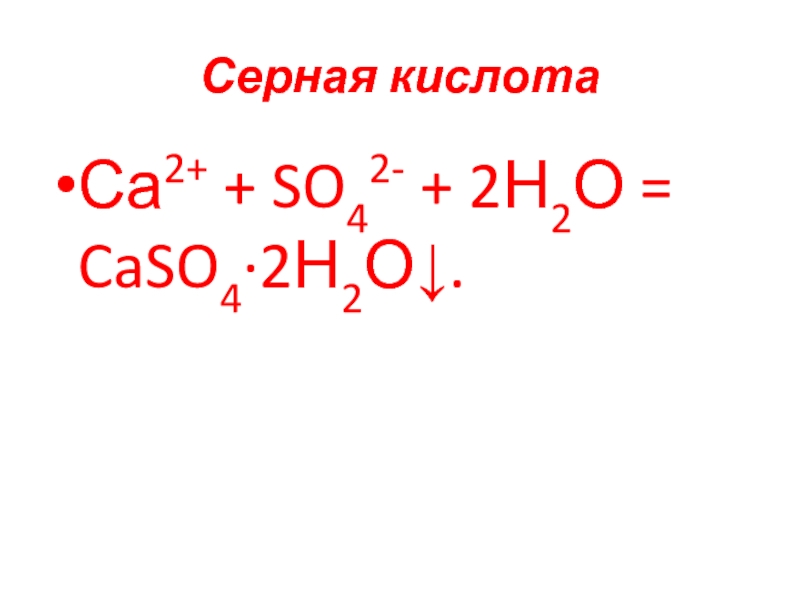
- 28. Эффекты при аналитических реакциях 1. Образование и
- 29. Понятие аналитической группы ионов
- 30. Понятие аналитической группы ионов Аналитическая группа ионов
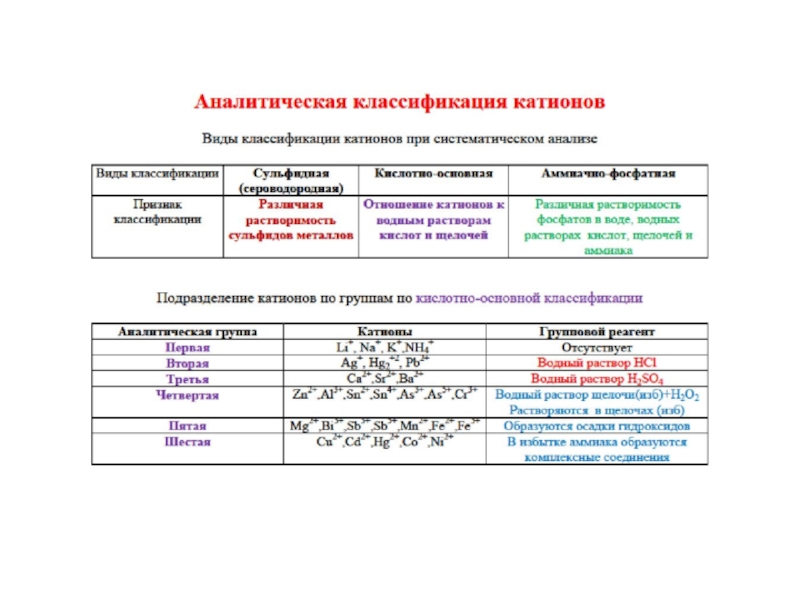
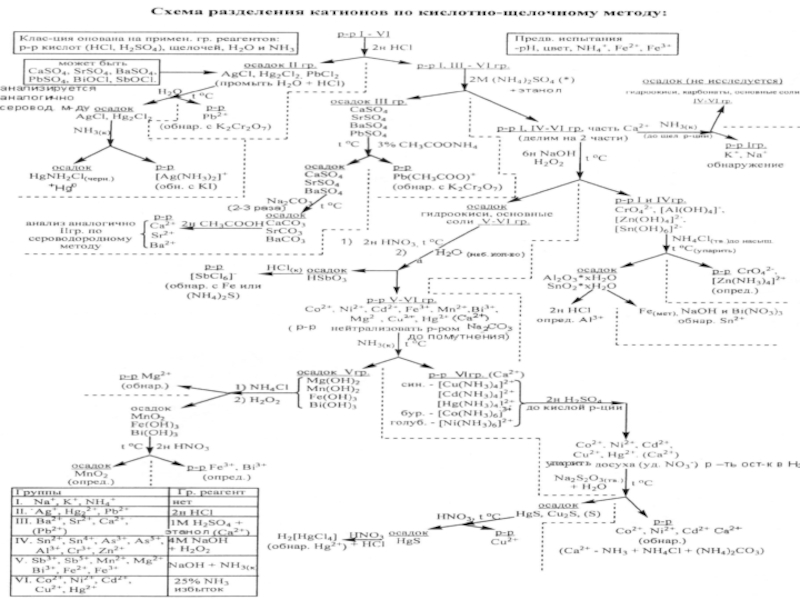
- 31. Аналитическая классификация катионов
- 35. Аналитическая классификация катионов Сульфидная; Кислотно-основная; Аммиачно-фосфатная;
- 36. Сульфидная Аналитическая классификация катионов Групповые реагенты –
- 37. Кислотно-основная аналитическая классификация катионов Все катионы подразделяются
- 38. Аммиачно-фосфатная аналитическая классификация катионов В основу положена
- 39. Кислотно-основная классификация катионов
- 40. Первая аналитическая группа катионов -Li+, Na+, K+, NH4+
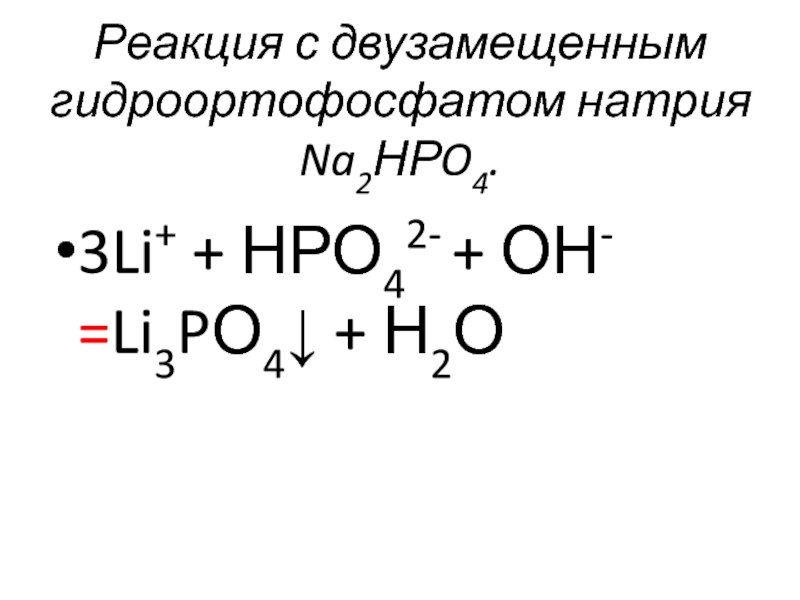
- 41. Реакции ионов Li+
- 42. Реакция с двузамещенным гидроортофосфатом натрия Na2НРO4. 3Li+ + НРО42- + ОН- =Li3PО4↓ + Н2О
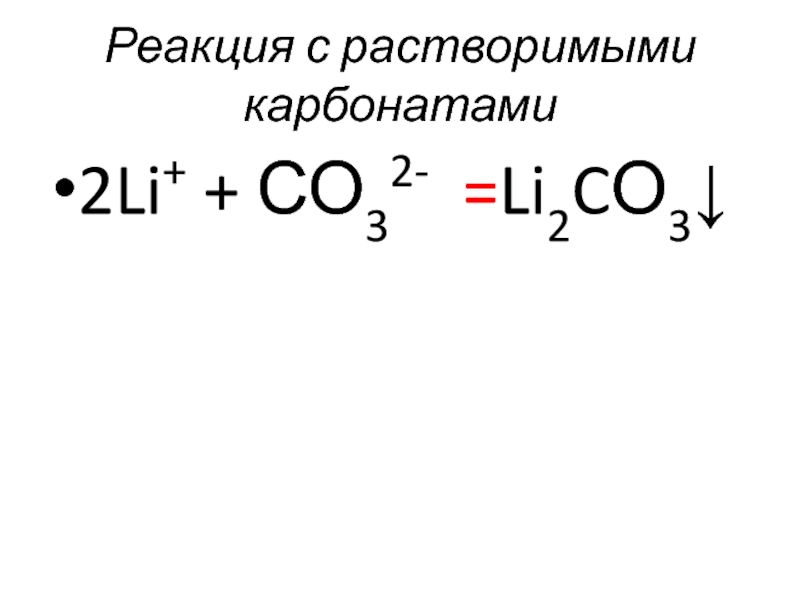
- 43. Реакция с растворимыми карбонатами 2Li+ + СО32- =Li2CО3↓
- 44. Реакция с растворимыми фторидами Li+ + F- = LiF↓
- 45. Реакции ионов Na+
- 46. Микрокристаллоскопическая реакция с цинкуранилацетатом (фармакопейная). Na+ + Zn[(UО2)3(CH3CОО)8] + СН3СОО- + 9Н2О =NaZn(UО2)3(CH3CОО)9∙9Н2О
- 47. .Реакция с гексагидроксостибатом (V) калия Na+ + [Sb(OH)6]- =Na[Sb(OH)6]↓
- 48. Реакции ионов K+
- 49. Реакция с гексанитрокобальтатом (III) натрия (фармакопейная) 2К+ + Na3[Co(NО2)6] = NaK2[Co(NО2)6↓ + 2Na+.
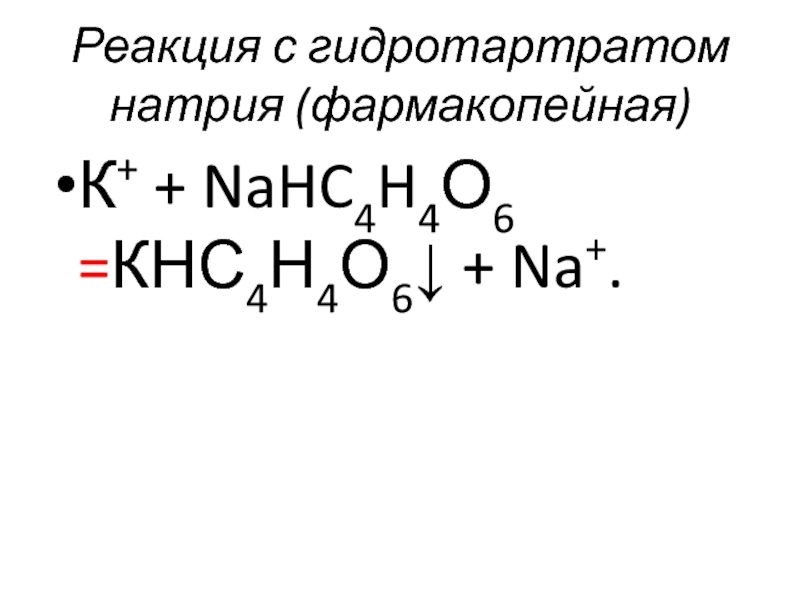
- 50. Реакция с гидротартратом натрия (фармакопейная) К+ + NaHC4H4О6 =КНС4Н4О6↓ + Na+.
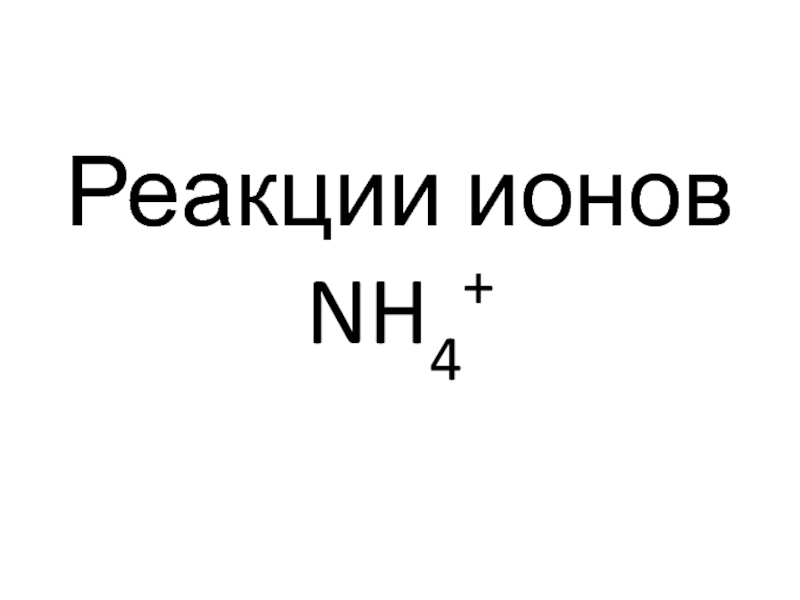
- 51. Реакции ионов NH4+
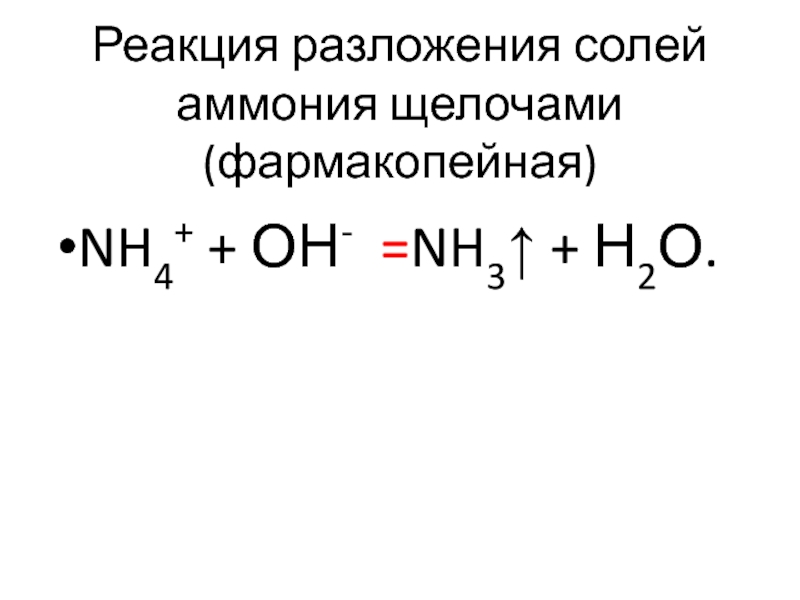
- 52. Реакция разложения солей аммония щелочами (фармакопейная) NH4+ + ОН- =NH3↑ + Н2О.
- 53. Реакция с реактивом Несслера — смесью раствора
- 54. Анализ смеси катионов Li+, Na+,
- 55. Вторая аналитическая группа катионов -Ag+, Pb2+, Hg22+,
- 56. Реакции ионов Ag+
- 57. Реакция со щелочами 2Ag+ + 2ОН-
- 58. Растворимые галогениды Ag+ + Сl- = AgCl↓;
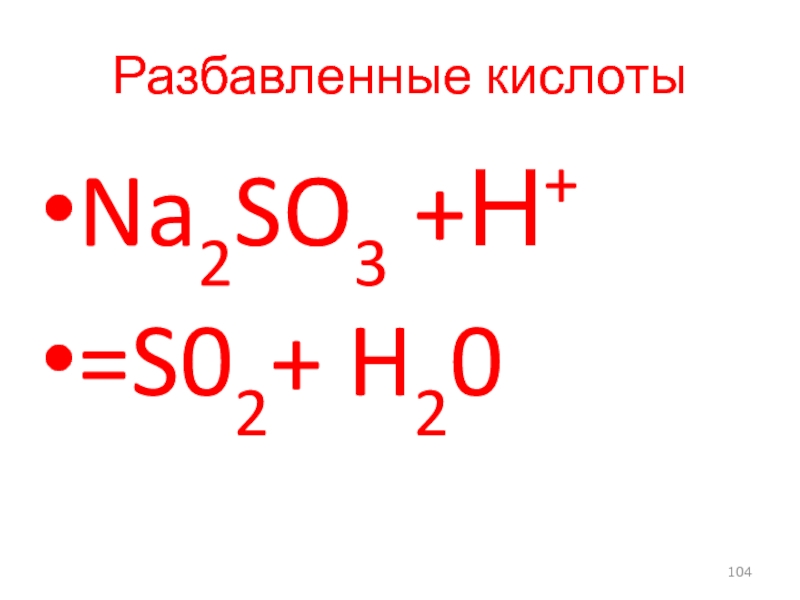
- 59. Различие галогенидов серебра Осадок хлорида серебра растворим
- 60. Хромат калия - осадок кирпично-красного цвета: 2Ag+ + CrО42- = Ag2CrО4↓
- 61. Гидроортофосфат натрия 3Ag+ + 2HPO42- = Ag3PO4↓ + H2PO4-
- 62. Реакция восстановления Ag+ до металлического серебра 4[Ag(NH3)2]OH
- 63. Реакции ионов Pb2+
- 64. Действие щелочей и аммиака Pb2+ + 2OH- = Pb(OH)2 ↓
- 65. Растворимые галогениды Pb2+ +2Cl - = PbCl2
- 66. Осадки галогенидов свинца (II) растворимы в горячей
- 67. Хромат калия образует желтый осадок Pb2+ + CrO42- = PbCrO4 ↓
- 68. Реакция с сульфид-ионами Pb2+ + S2- = PbS ↓
- 69. Реакции ионов Hg22+
- 70. Действие щелочей Hg2+ + 2OH- = Hg2O↓ + H2O
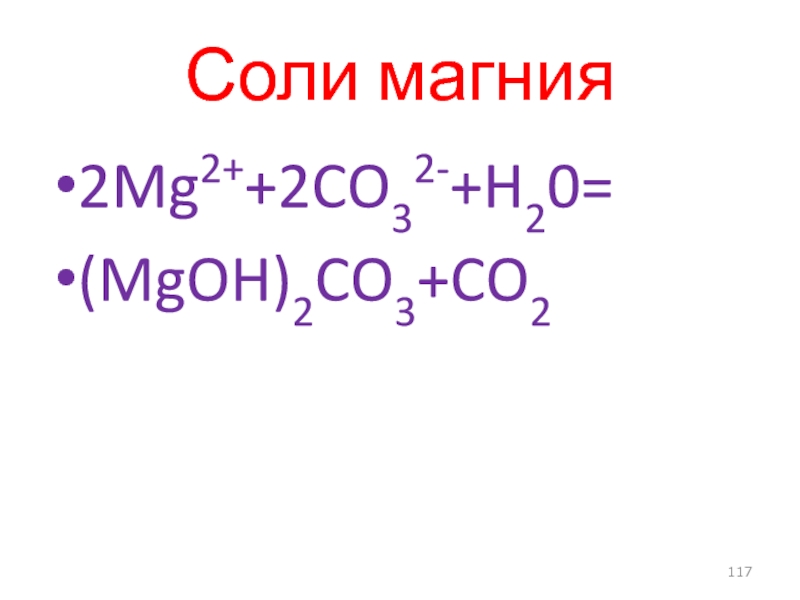
- 71. Водный раствор аммиака 2Hg22+ + 4NH3 + Н2О = [OHg2NH2]+ + 2Hg↓ + 3NH4+.
- 72. Растворимые хлориды Hg22+ + 2Сl- = Hg2Cl2↓.
- 73. Растворимые иодиды Hg22+ + 2I- = Hg2I2↓.
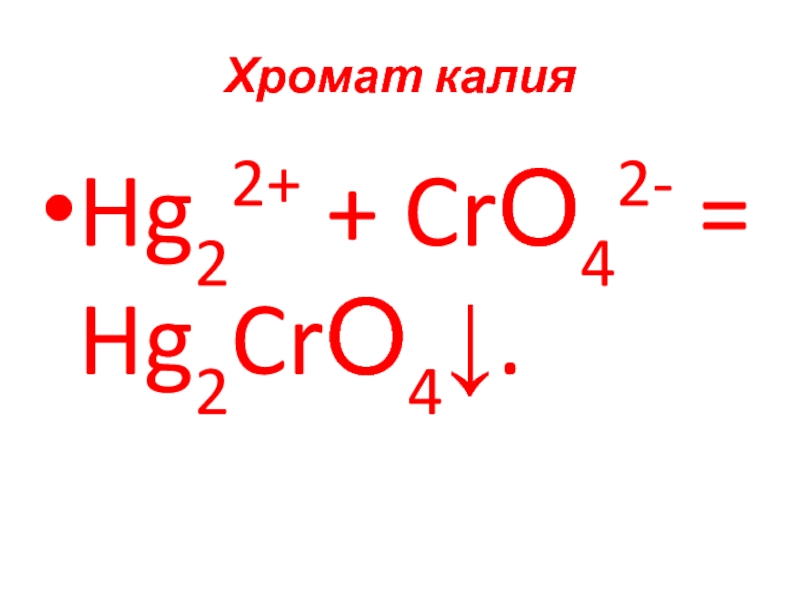
- 74. Хромат калия Hg22+ + CrО42- = Hg2CrО4↓.
- 75. Восстановление ртути (I) до металлической ртути. Hg22+ + Сu = 2Hg↓ + Сu2+.
- 76. Серная кислота Са2+ + SO42- + 2Н2О = CaSO4∙2Н2О↓.
- 77. Третья аналитическая группа катионов -Ca2+ , Sr2+, Ba2+,
- 78. Реакции ионов Ca2+
- 79. Карбонат аммония Са2+ + СO32- = СаСO3↓.
- 80. Оксалат аммония Са2+ + С2O42- = СаС2О4↓
- 81. Гексацианоферрат (II) калия Са2+ + К+ + NH4++ [Fe(CN)6]4- = NH4KCa[Fe(CN)6]↓.
- 82. Реакции ионов Sr2+
- 83. Серная кислота, растворимые сульфаты и гипсовая вода
- 84. Карбонат аммония Sr2+ + СО32- = SrCO3↓.
- 85. Оксалат аммония Sr2+ + С2O42- = SrC2O4↓.
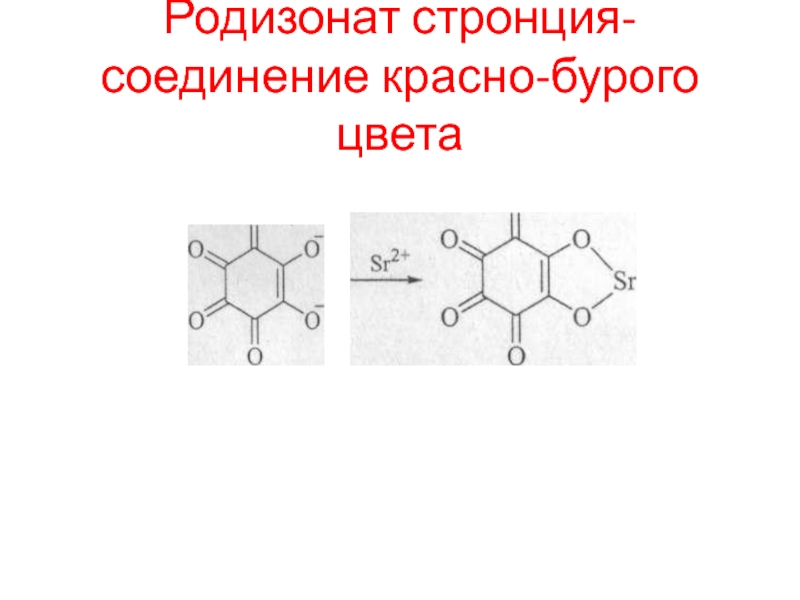
- 86. Родизонат стронция- соединение красно-бурого цвета
- 87. Реакции ионов Ba2+
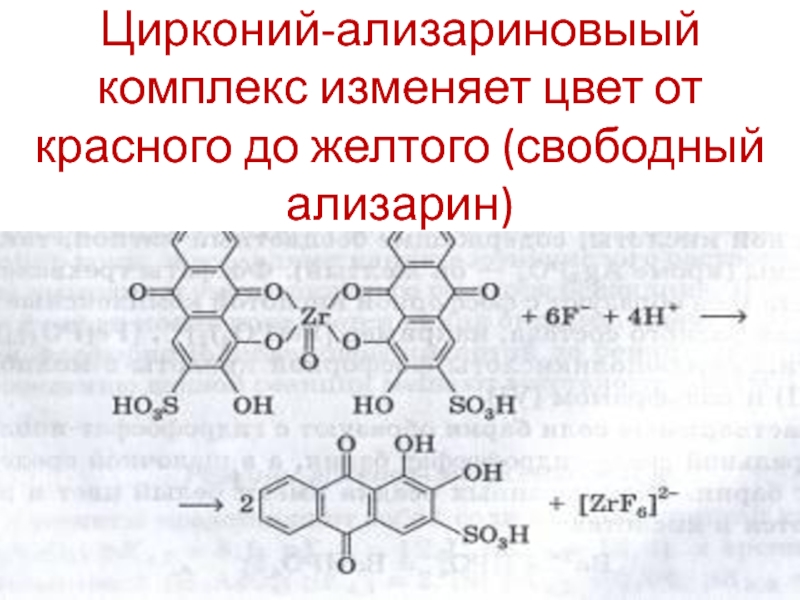
- 88. Серная кислота и растворимые сульфаты Ва2+ + SO42- = BaSO4↓.
- 89. Карбонат аммония Ва2+ + СO32- = BaCO3↓.
- 90. Оксалат аммония Ва2+ + С2O42- = BaC2O4↓.
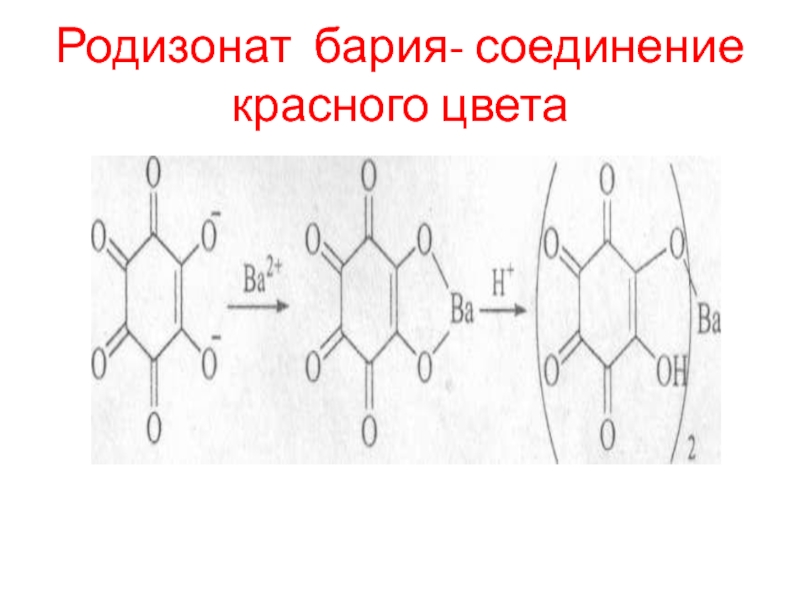
- 91. Родизонат бария- соединение красного цвета
- 92. Хромат или дихромат калия дают осадки ярко-желтого
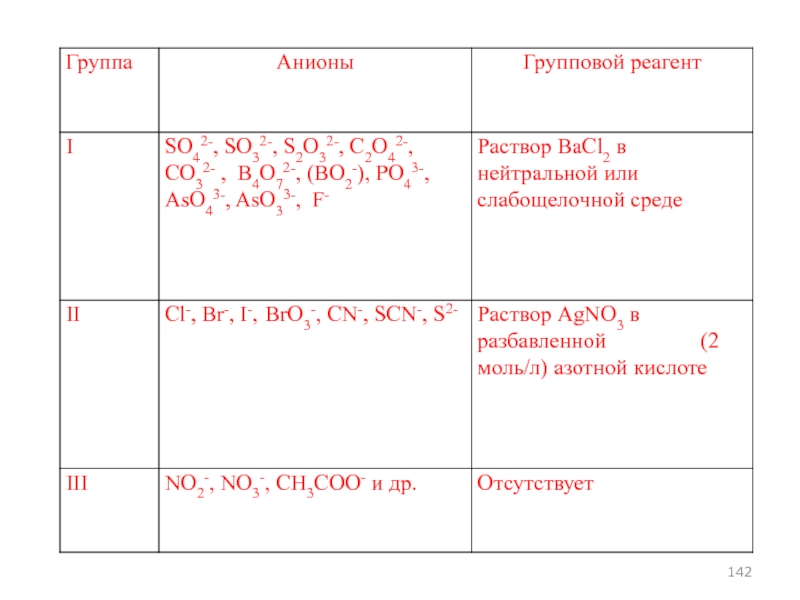
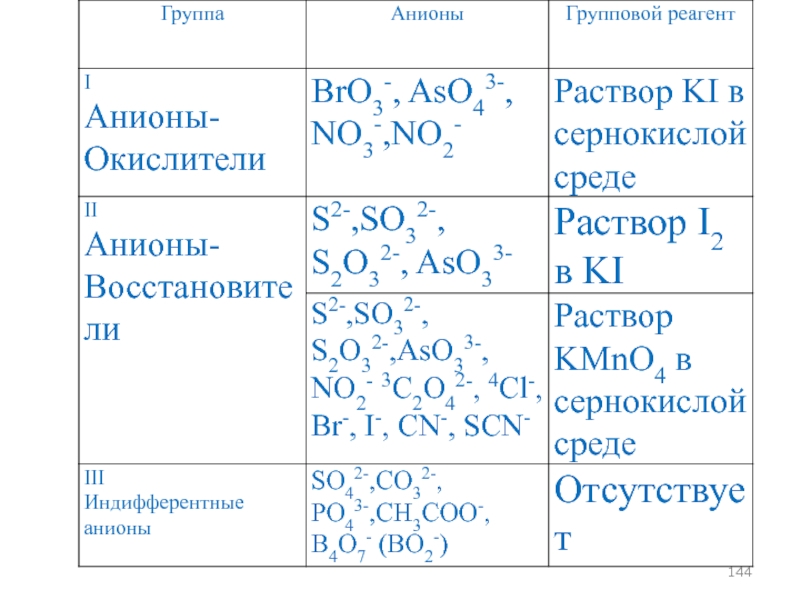
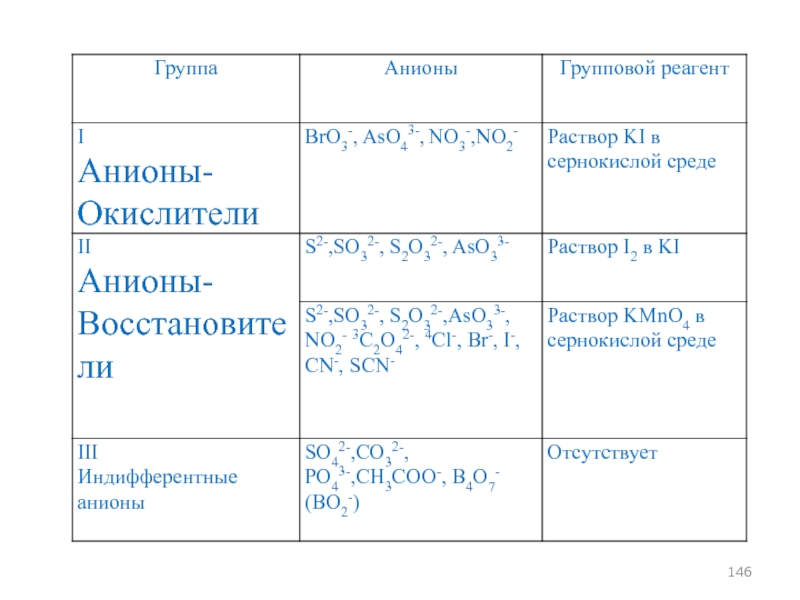
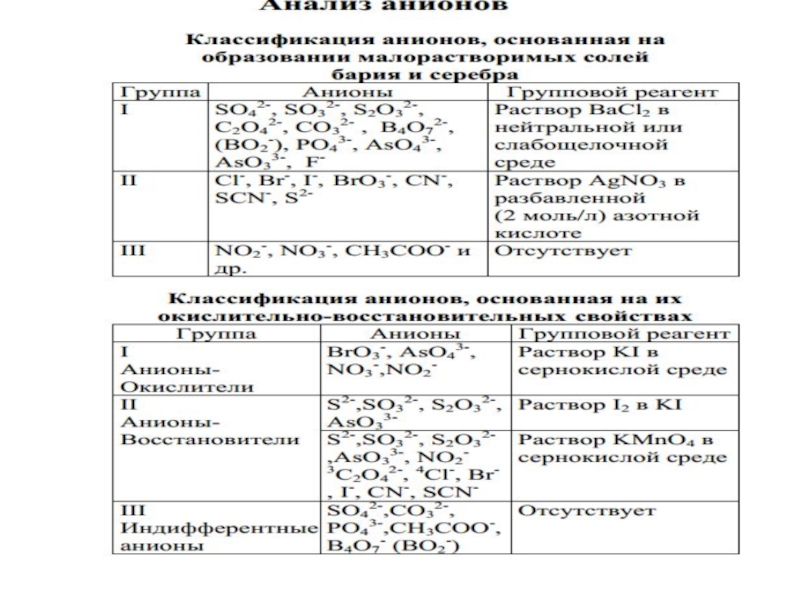
- 93. АНАЛИТИЧЕСКАЯ КЛАССИФИКАЦИЯ АНИОНОВ
- 95. Главная цель групповых реакций Скрининг (отсеивание) анионов, которые не присутствуют в смеси.
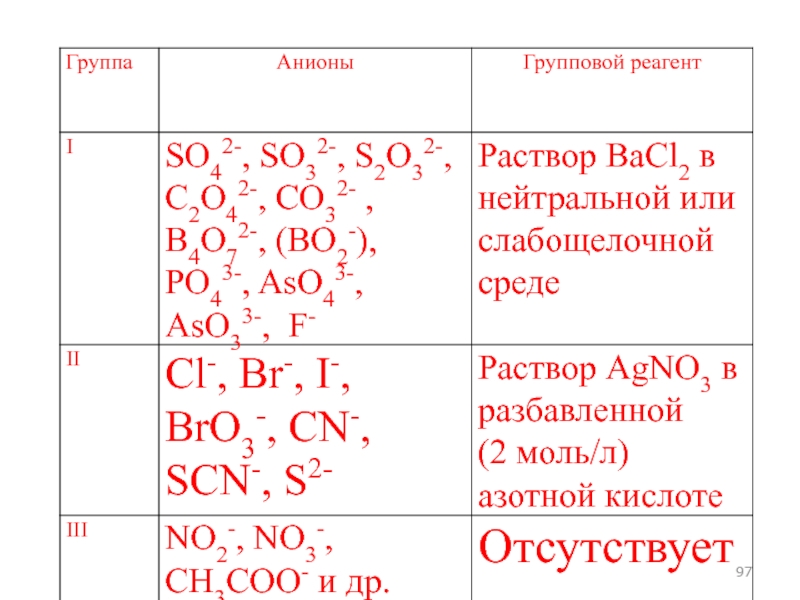
- 96. Классификация анионов, основанная на образовании малорастворимых солей бария и серебра
- 98. Окраска бариевых солей Соли бесцветны, за исключением хроматов
- 99. ОВР - свойства SO32-, S2O32-, C2O42-, AsO33-, - восстановители AsO43-, CrO42- -окислители
- 100. Растворимость в воде и минеральных кислотах BaSO4
- 101. 1. СУЛЬФИТ-ИОНЫ Реакции анионов I аналитической группы
- 102. Реакции Сульфит-ионов Соли бария Соли серебра Разбавленные кислоты Окислители Восстановители Фуксин Нитропруссид натрия
- 103. Реакция с нитратом серебра Ag2SO3(белый осадок)+ Na2SO3 =2Na[Ag(SO3 ) 2]
- 104. Разбавленные кислоты Na2SO3 +Н+ =S02+ H20
- 105. Реакции с окислителями
- 106. Реакции с восстановителями
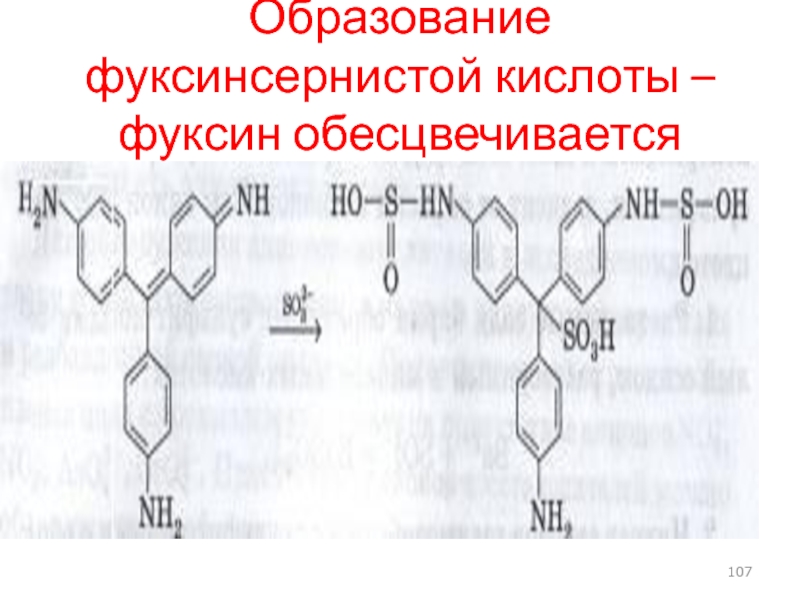
- 107. Образование фуксинсернистой кислоты – фуксин обесцвечивается
- 108. Нитропруссид натрия - Na2[Fe(CN)5NO] – КРАСНОЕ ОКРАШИВАНИЕ, состав продукта неизвестен
- 109. 2.ТИОСУЛЬФАТ-ИОНЫ Реакции анионов I аналитической группы
- 110. Реакции Тиосульфат--ионов Соли бария Соли серебра
- 111. Нитрат серебра Ag2S 2 O3(белый осадок)+ Na2S 2 O3 =2Na 3[Ag(S2O3)2]
- 112. Основная аналитическая реакция в фармхимии 2S2O32-+I2 =S4062-+2I-
- 113. 3.СУЛЬФАТ-ИОНЫ Реакции анионов I аналитической группы
- 114. Реакции сульфат--ионов Соли бария Соли свинца Родизонат бария
- 115. 4. КАРБОНАТ-ИОНЫ Реакции анионов I аналитической группы
- 116. Реакции карбонат--ионов Соли бария Разбавленные кислоты Соли магния
- 117. Соли магния 2Mg2++2CO32-+H20= (MgOH)2CO3+CO2
- 118. 3. ОКСАЛАТ-ИОНЫ Реакции анионов I аналитической группы
- 119. Реакции оксалат--ионов Соли бария Соли кальция Окислители (KMnO4 в кислой среде)
- 120. Окислители (KMnO4 в кислой среде) 2MnO4-+5C2O42-+16H+=2Mn2++ 10CO2+8H2O
- 121. 5. БОРАТ-ИОНЫ Реакции анионов I аналитической группы
- 122. Реакции Борат-ионов С куркумином С хинализарином Этиловый эфир борной кислоты
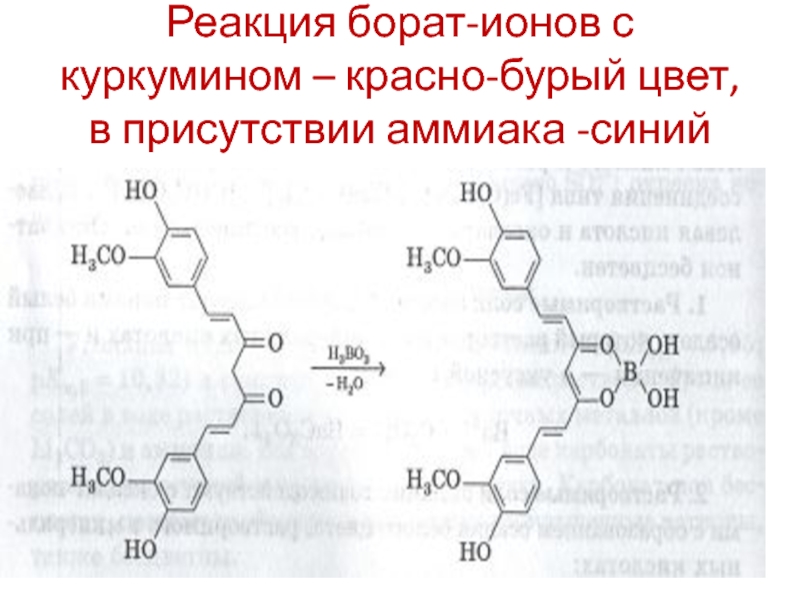
- 123. Реакция борат-ионов с куркумином – красно-бурый цвет, в присутствии аммиака -синий
- 124. Образование и горение этилового эфира борной кислоты
- 125. Реакция борат-инов с хинализарином
- 126. 6. СИЛИКАТ-ИОНЫ Реакции анионов I аналитической группы
- 127. Реакции силикат-ионов Соли бария Нитрат серебра Разбавленные кислоты Образование фторида кремния Молибдат аммония
- 128. Образование желтого силиката серебра 2Ag++SiO32-= =Ag2SiO3
- 129. Образование фторида кремния Na2SiO3+6HF= SiF4+3H2O+2NaF
- 130. 7. ФТОРИД-ИОНЫ Реакции анионов I аналитической группы
- 131. Реакции ФТОРИД-ионов Соли бария Тиоцианат железа Цирконий-ализариновый комплекс Образование фторида кремния (травление стекла)
- 132. Обесцвечивание «кровавой раны» Fe(SCN)3+6F-=[FeF6]3-+3SCN-
- 133. Цирконий-ализариновыый комплекс изменяет цвет от красного до желтого (свободный ализарин)
- 134. 8. ФОСФАТ-ИОНЫ Реакции анионов I аналитической группы
- 135. Реакции фосфат-ионов Соли бария Нитрат серебра Магнезиальная смесь Молибдат аммония Образование молибденовой сини
- 136. Образование гетерополисоединений с молибдатом аммония (NH4)3[PMo12O40]
- 137. ОБРАЗОВАНИЕ МОЛИБДЕНОВОЙ СИНИ Гетерополимолебде-новоая кислота и ее соли восстанавливаются до продукта синего цвета, неизвестного состава
- 138. 9-10. АРСЕНИТ И АРСЕНАТ-ИОНЫ Реакции анионов I аналитической группы
- 139. Образование арсина 4Zn+AsO42-+11H+= AsH3+4Zn2++4H2O
- 140. Реакция Гутцайта
- 141. Реакции Арсенит и арсенат-ионов Соли бария
- 143. Классификация анионов, основанная на их окислительно-восстановительных свойствах
- 145. Классификация анионов, основанная на их окислительно-восстановительных свойствах
- 147. Спасибо за внимание!
Слайд 1Тема лекции
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ.
Слайд 2 План лекции:
1. Общие вопросы аналитической химии. Литература по аналитической химии.
3. Химические
методы обнаружения неорганических веществ.
3. Реакции обнаружения катионов
4. Реакции обнаружения анионов
3. Реакции обнаружения катионов
4. Реакции обнаружения анионов
Слайд 6Аналитическая химия, или аналитика – это раздел химической науки, разрабатывающий на
основе фундаментальных законов химии и физики методы и приемы качественного и количественного анализа атомного, молекулярного и фазового состава вещества.
Слайд 7Определение VIII Европейской конференции по аналитической химии (Эдинбург, 1993)- Аналитическая химия
– это научная дисциплина, которая развивает и применяет методы, средства и общую методологию получения информации о составе и природе вещества
Слайд 8Определение по Г.Кристиану со ссылкой на Чарльза Н.Рейли
Аналитическая химия – это
то, чем занимаются химики- аналитики
Слайд 9Аналитическая служба
Административная система, обеспечивающая конкретный анализ определенных объектов с использованием методов,
рекомендуемых аналитической химией, называется аналитической службой. Аналитическая служба государства представляет собой совокупность аналитических служб отдельных ведомств.
Слайд 11Принцип анализа
Явление, используемое для получения аналитической информации, называется принципом анализа. (Например,
явление - поглощение света веществом, аналитическая информация - природа определяемого вещества и его концентрация)
Слайд 12Метод анализа
Краткое изложение принципов, лежащих в основе анализа вещества (вне зависимости
от определяемого компонента и анализируемого объекта), носит название метода анализа. Например, гравиметрический анализ основан на определении массы веществ, или люминесцентный метод анализа
Слайд 13Методика анализа
Методика анализа – это подробное описание хода выполнения конкретного анализа
данного объекта с использованием выбранного метода, обеспечивающее регламентированные характеристики правильности и воспроизводимости (раздел – методы математической статистики в аналитической химии) анализа.
Слайд 15Качественный анализ
Качественный анализ предполагает обнаружение или идентификацию компонентов анализируемого образца.
Слайд 16Количественный анализ
В процессе количественного анализа происходит определение концентраций или масс компонентов.
Слайд 17Структурный анализ
Цель структурного анализа – установление химического и пространственного строения исследуемого
соединения.
Слайд 20Классификация видов анализа в зависимости от процедуры проведения анализа
Систематический –разделение смеси
ионов на группы или подгруппы.
Дробный – определение определенного элемента, для подтверждения его нахождения в смеси.
Локальный – определение элементов на определенном участке поверхности.
Дробный – определение определенного элемента, для подтверждения его нахождения в смеси.
Локальный – определение элементов на определенном участке поверхности.
Слайд 21Характеристики аналитической реакции
Избирательность ( селективность) – возможность определения в результате аналитической
реакции определенного вещества (одного или нескольких ) в сложной смеси веществ;
Предел обнаружения (определения) – минимальное количество вещества, которое можно определить качественно (количественно);
Предел обнаружения (определения) – минимальное количество вещества, которое можно определить качественно (количественно);
Слайд 22Избирательность аналитической реакции (в зависимости от числа веществ)
Специфические реакции –
позволяют определять только одно вещество;
Избирательные реакции - позволяют определять небольшое число о веществ;
Групповые реакции – используются в систематическом анализе для выделения группы веществ;
Избирательные реакции - позволяют определять небольшое число о веществ;
Групповые реакции – используются в систематическом анализе для выделения группы веществ;
Слайд 24Методы аналитической химии при анализе образцов
1. Метод пробоотбора;
2. Метод разложения проб;
3.
Метод разделения и концентрирования;
4. Метод обнаружения и количественного определения
4. Метод обнаружения и количественного определения
Слайд 27Химические методы обнаружения неорганических веществ основаны на проведении аналитических реакций. Аналитическими
называются химические реакции, результат которых несет определенную аналитическую информацию.
Слайд 28Эффекты при аналитических реакциях
1. Образование и растворение осадков
2. Образование характерных кристаллов
3.
Появление или изменение окраски растворов
4. Выделение газов
4. Выделение газов
Слайд 30Понятие аналитической группы ионов
Аналитическая группа ионов отличается от групп Периодической таблицы
Менделеева Д.И.
Аналитическая группа ионов обладает общностью свойств в реакциях осаждения или выделения, позволяющих отделить их от остальных ионов близкой химической природы
Аналитическая группа ионов обладает общностью свойств в реакциях осаждения или выделения, позволяющих отделить их от остальных ионов близкой химической природы
Слайд 36Сульфидная Аналитическая классификация катионов
Групповые реагенты – сульфид аммония, сероводород и карбонат
аммония.
Все катионы подразделяются на
5 аналитических групп. Различия в растворимости и сульфидов и образования осадков с карбонатом аммония
Все катионы подразделяются на
5 аналитических групп. Различия в растворимости и сульфидов и образования осадков с карбонатом аммония
Слайд 37Кислотно-основная аналитическая классификация катионов
Все катионы подразделяются на 6 аналитических групп. Используется
различие в растворимости соединений по отношения к раствором кислот и
щелочей с учетом комплексообразования в растворах.
щелочей с учетом комплексообразования в растворах.
Слайд 38Аммиачно-фосфатная
аналитическая классификация катионов
В основу положена различная растворимость фосфатов в воде, водных
растворах кислот, щелочей и аммиака. Все катионы делятся на 5 аналитических групп.
Слайд 46Микрокристаллоскопическая реакция с цинкуранилацетатом (фармакопейная).
Na+ + Zn[(UО2)3(CH3CОО)8] + СН3СОО- + 9Н2О
=NaZn(UО2)3(CH3CОО)9∙9Н2О
Слайд 49Реакция с гексанитрокобальтатом (III) натрия (фармакопейная)
2К+ + Na3[Co(NО2)6] = NaK2[Co(NО2)6↓ +
2Na+.
Слайд 53Реакция с реактивом Несслера — смесью раствора тетрайодомеркурama(II) калия K2[HgI4] с
КОН (фармакопейная)
NH4+ + 2[HgI4]2- + 4OH- =[OHg2NH2]I + 7I- + 3H2O
Слайд 54Анализ смеси катионов
Li+, Na+, K+, NH4+
Сразу удаляют аммоний прокаливаем
в щелочной среде, затем Li+– осаждением фторидом аммония или гидроортофосфатом натрия.
Ионы Na+, K+, определяют дробными реакциями
Ионы Na+, K+, определяют дробными реакциями
Слайд 59Различие галогенидов серебра
Осадок хлорида серебра растворим в растворе аммиака. Иодид серебра
не растворяется в растворе аммиака, а бромид серебра растворяется незначительно
Слайд 62Реакция восстановления Ag+ до металлического серебра
4[Ag(NH3)2]OH + CH2O =
4Ag↓ +
(NH4)2CO3 + 6NH3 + 2H2O
Слайд 66Осадки галогенидов свинца (II) растворимы в горячей воде и в присутствии
избытка галогенид-ионов
PbI2↓ + 2I- = [РbI4]2-
PbI2↓ + 2I-
[РbI4]2-.
Слайд 83Серная кислота, растворимые сульфаты и гипсовая вода (насыщенный водный раствор сульфата
кальция)
Sr2++ SO42- = SrSO4↓.
Слайд 92Хромат или дихромат калия дают осадки ярко-желтого цвета
Ва2+ + СгO42-
= ВаСrO4↓;
2Ва2+ + Сг2O72- + Н2O = 2ВаСrO4↓ + 2Н+.
2Ва2+ + Сг2O72- + Н2O = 2ВаСrO4↓ + 2Н+.
Слайд 95Главная цель групповых реакций
Скрининг (отсеивание) анионов, которые не присутствуют в
смеси.
Слайд 100Растворимость в воде и минеральных кислотах
BaSO4 – плохо растворим в воде
и минеральных кислотах,
BaCrO4 BaC2O4 BaSO3 BaF2–хорошо растворимы в минеральных кислотах, плохо в воде и уксусной кислоте
BaCrO4 BaC2O4 BaSO3 BaF2–хорошо растворимы в минеральных кислотах, плохо в воде и уксусной кислоте
Слайд 102Реакции Сульфит-ионов
Соли бария
Соли серебра
Разбавленные кислоты
Окислители
Восстановители
Фуксин
Нитропруссид натрия
Слайд 110Реакции Тиосульфат--ионов
Соли бария
Соли серебра
Разбавленные кислоты
Окислители (KMnO4 в кислой среде)
Восстановители (иод)
Нитропруссид
натрия
Слайд 127Реакции силикат-ионов
Соли бария
Нитрат серебра
Разбавленные кислоты
Образование фторида кремния
Молибдат аммония
Слайд 131Реакции ФТОРИД-ионов
Соли бария
Тиоцианат железа
Цирконий-ализариновый комплекс
Образование фторида кремния (травление стекла)
Слайд 135Реакции фосфат-ионов
Соли бария
Нитрат серебра
Магнезиальная смесь
Молибдат аммония
Образование молибденовой сини
Слайд 137ОБРАЗОВАНИЕ МОЛИБДЕНОВОЙ СИНИ
Гетерополимолебде-новоая кислота и ее соли восстанавливаются до продукта синего
цвета, неизвестного состава






































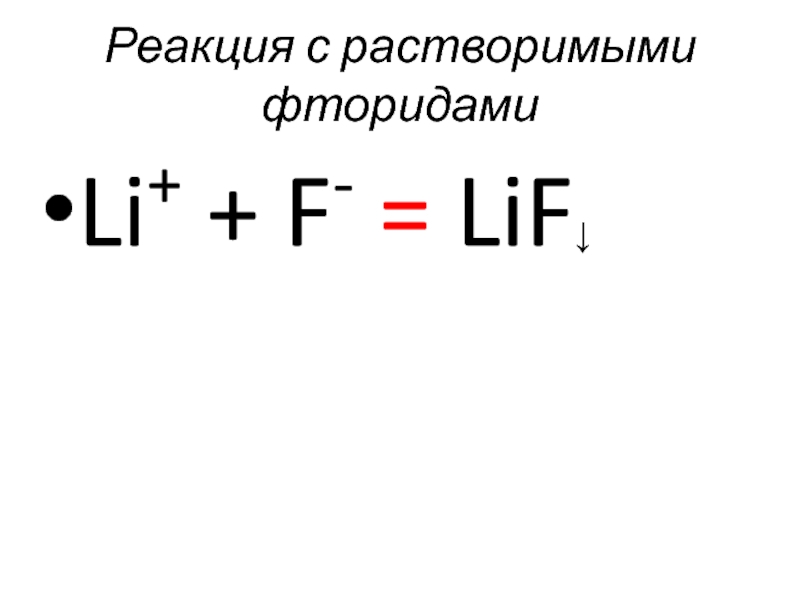
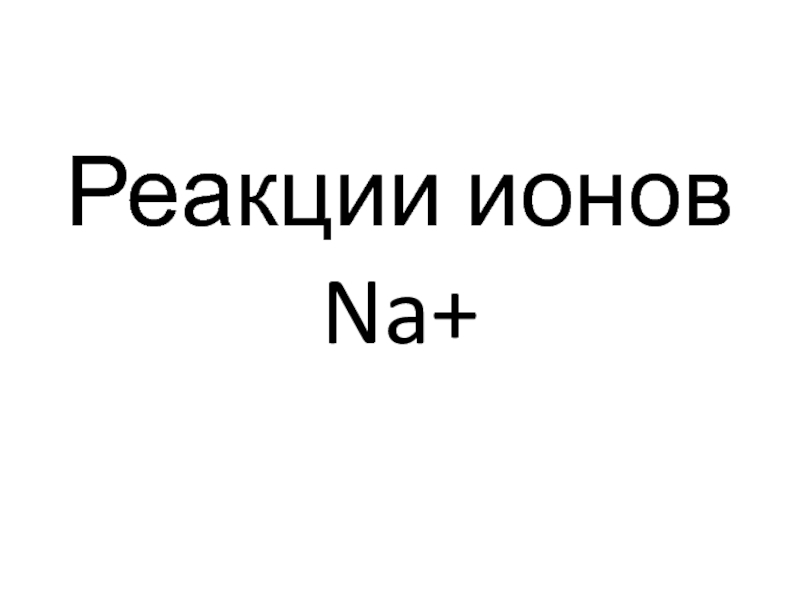
![Микрокристаллоскопическая реакция с цинкуранилацетатом (фармакопейная).Na+ + Zn[(UО2)3(CH3CОО)8] + СН3СОО- + 9Н2О =NaZn(UО2)3(CH3CОО)9∙9Н2О](/img/tmb/5/430258/99355b1c72531d01ab2ef6b416534ee3-800x.jpg)
![.Реакция с гексагидроксостибатом (V) калияNa+ + [Sb(OH)6]- =Na[Sb(OH)6]↓](/img/tmb/5/430258/f2899cdb9907d271deda1610bd527b61-800x.jpg)

![Реакция с гексанитрокобальтатом (III) натрия (фармакопейная)2К+ + Na3[Co(NО2)6] = NaK2[Co(NО2)6↓ + 2Na+.](/img/tmb/5/430258/e0ac14b62d6526ae3057ad2e7766c596-800x.jpg)
![Реакция с реактивом Несслера — смесью раствора тетрайодомеркурama(II) калия K2[HgI4] с КОН (фармакопейная)NH4+ + 2[HgI4]2-](/img/tmb/5/430258/6eae1972707e0bace01340d95461afc2-800x.jpg)



![Реакция со щелочами 2Ag+ + 2ОН- Ag2O↓ + Н2О.Ag2O + 4NH3 + Н2О 2[Ag(NH3)2]+ + 2ОН](/img/tmb/5/430258/826a402bd46f75d794c9e3184cbcd2f1-800x.jpg)




![Реакция восстановления Ag+ до металлического серебра4[Ag(NH3)2]OH + CH2O = 4Ag↓ + (NH4)2CO3 + 6NH3 + 2H2O](/img/tmb/5/430258/d33863ccd9bb1e8a8d197cbfc98700bd-800x.jpg)






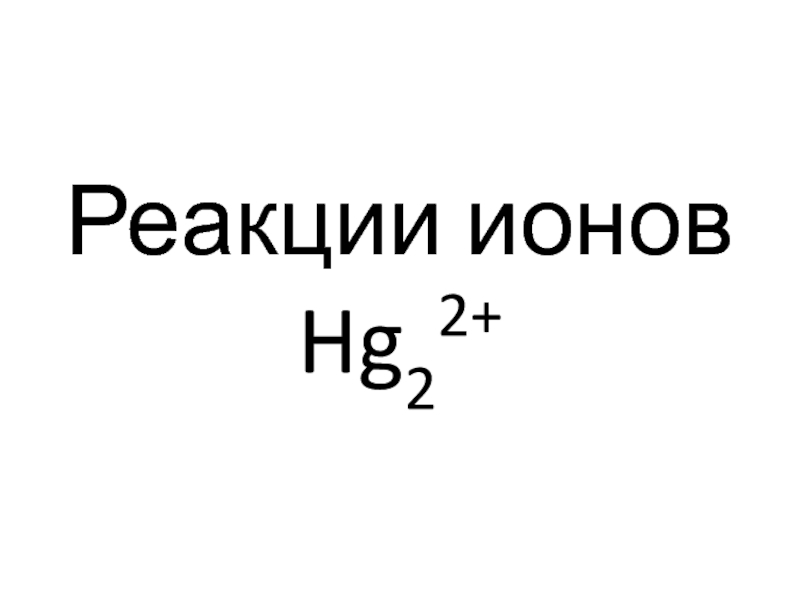

![Водный раствор аммиака2Hg22+ + 4NH3 + Н2О = [OHg2NH2]+ + 2Hg↓ + 3NH4+.](/img/tmb/5/430258/5f44a1340a5a5c2c4951a02b10a22cbf-800x.jpg)

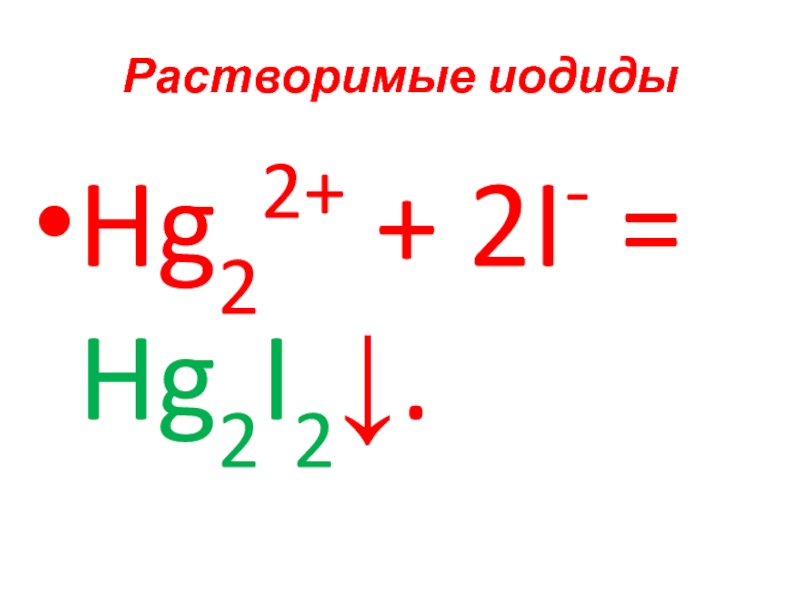




![Гексацианоферрат (II) калияСа2+ + К+ + NH4++ [Fe(CN)6]4- = NH4KCa[Fe(CN)6]↓.](/img/tmb/5/430258/6978356710142e12705abbffc741abfb-800x.jpg)















![Реакция с нитратом серебраAg2SO3(белый осадок)+ Na2SO3=2Na[Ag(SO3 ) 2]](/img/tmb/5/430258/1a316291828bf6ba298a4dbcd6776f0b-800x.jpg)


![Нитропруссид натрия - Na2[Fe(CN)5NO] – КРАСНОЕ ОКРАШИВАНИЕ, состав продукта неизвестен](/img/tmb/5/430258/15cebffcc667c6764c83cce1da152e28-800x.jpg)


![Нитрат серебраAg2S 2 O3(белый осадок)+ Na2S 2 O3=2Na 3[Ag(S2O3)2]](/img/tmb/5/430258/894b291d4b0520eb84d2e16c6b8048af-800x.jpg)


















![Обесцвечивание «кровавой раны»Fe(SCN)3+6F-=[FeF6]3-+3SCN-](/img/tmb/5/430258/f64e1b3f47dca92891cfe1f3a26a91af-800x.jpg)


![Образование гетерополисоединений с молибдатом аммония(NH4)3[PMo12O40]](/img/tmb/5/430258/9b8d40c918fe48cb9c4bd0ae42503448-800x.jpg)