- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общая химическая технология презентация
Содержание
- 1. Общая химическая технология
- 3. Слово «технология» греческого происхождения и имеет дословный
- 4. Основные понятия химической технологии Химико-технологический процесс –
- 5. В общем случае любой Химико-технологический процесс можно
- 6. Сырье – это исходный многокомпонентный материал, поступающий
- 9. В качестве примера: Процесс газофазной каталитической
- 10. Технологический режим - это совокупность технологических параметров,
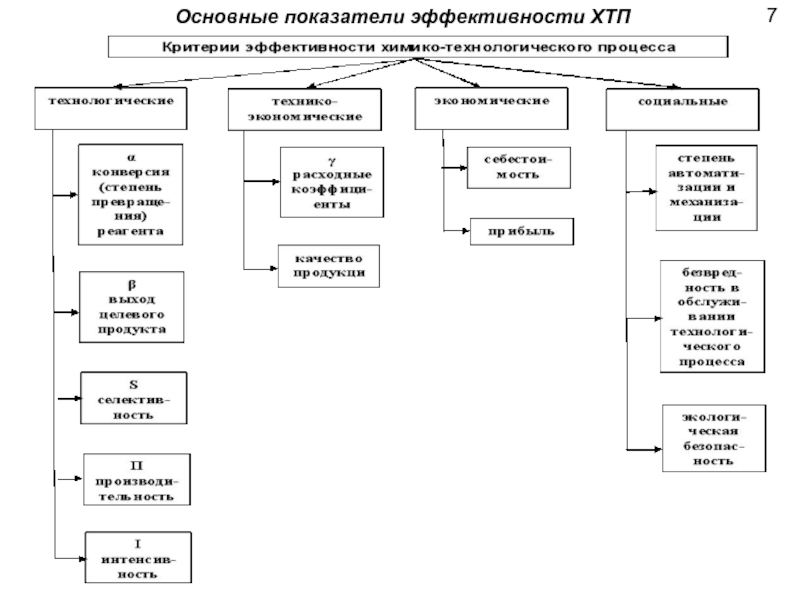
- 11. Основные показатели эффективности ХТП 7
- 12. где: n и m - количество вещества
- 13. При известной концентрации реагента на входе в
- 14. Выберите правильный ответ: Степень превращения (конверсия) реагента
- 15. Выход продукта – отношение реально (фактически) полученного
- 16. Для сложных реакций (параллельных, последовательных, комбинированных), где
- 17. Полная или интегральная селективность – это отношение
- 18. Для параллельных реакций дополнительно используется понятие дифференциальной
- 19. Интенсивность – понятие, которое используют для сравнения
- 20. 15 Расходные коэффициенты по сырью (по реагенту):
- 21. Себестоимость продукции. Разделяется на фабрично-заводскую себестоимость, а
Слайд 1Каралин Эрнест Александрович
Профессор кафедры общей химической технологии КНИТУ
Рабочий телефон:
E-mail: karalin@kstu.ru
Слайд 3Слово «технология» греческого происхождения и имеет дословный перевод «наука о ремесле».
Химическая технология возникла в конце 18 века и на начало 20 века состояла из описания конкретных химических производств, их основного оборудования, материальных и энергетических балансов. По мере развития химической промышленности возникла необходимость выявления общих закономерностей построения химико-технологических процессов, их промышленной реализации и рациональной эксплуатации.
Общая химическая технология – наука, изучающая теоретические основы разработки технологий для различных классов химических реакций.
Задачи ОХТ
1) отыскание общих закономерностей протекания химико-технологических процессов;
2) определение оптимальных условий проведения химико-технологических процессов;
3) изучение химических превращений с учетом массо- и теплообменных процессов;
4) повышение эффективности использования сырья, энергии, снижение количества отходов и выбросов в окружающую среду; повышение качества выпускаемой продукции.
1
Слайд 4Основные понятия химической технологии
Химико-технологический процесс – совокупность взаимосвязанных физических и химических
К физическим процессам относятся –
1. Механические процессы (например, измельчение твердых материалов при подготовке сырья, гранулирование порошков при изготовлении катализаторов неподвижного слоя);
2. Гидродинамические процессы (движение жидкостей и газов, перемешивание, получение и разделение суспензий и эмульсий, фильтрование жидкостей и газов, центрифугирование и т.д.);
3. Тепловые процессы (нагрев и охлаждение без изменения агрегатного состояния, испарение, конденсация, кристаллизация);
4. Массообменные процессы (растворение, адсорбция – концентрирование вещества из газовой или жидкой фазы на поверхности твердого тела, абсорбция – переход вещества из газовой фазы в жидкую, ректификация).
Все физические процессы рассматриваются в курсе «Процессов и аппаратов», в курсе ОХТ изучаются теоретические основы химических процессов, протекающих в аппаратах большого размера (химических реакторах).
5. Химический процесс – как подсистема сложного, многостадийного химико-технологического процесса – это одна или несколько химических реакций, скорость которых определяется законами химической кинетики.
2
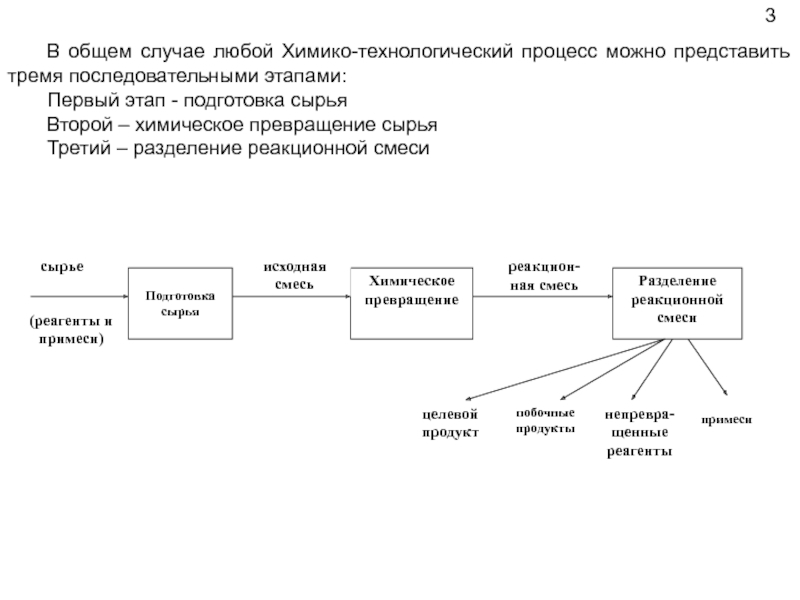
Слайд 5В общем случае любой Химико-технологический процесс можно представить тремя последовательными этапами:
Первый
Второй – химическое превращение сырья
Третий – разделение реакционной смеси
3
Слайд 6Сырье – это исходный многокомпонентный материал, поступающий на массовую переработку (и
В состав сырья входит реагент – индивидуальное химическое соединение, принимающее участие в основной химической реакции химико-технологического процесса и переходящее в результате в целевой продукт.
Остальные компоненты сырья называются примесями. В идеальном случае в химическом превращении должен принимать участие только реагент, на практике встречаются системы, в которых происходит и превращение примесей.
Образующиеся в ходе химических реакций вещества называются продуктами, продукт, ради которого организовано производство называется целевым, все остальные продукты называются побочными.
Реакция, в которой образуется целевой продукт, называется целевой, все другие реакции - побочными реакциями.
Очевидно, что мы должны максимально полно выделить из реакционной смеси все продукты реакции, а также не превращенные реагенты, которые возвращаются на стадию подготовки сырья.
4
Слайд 9В качестве примера:
Процесс газофазной каталитической дегидратации этилового спирта до этилена.
Сырье
В системе протекают две химических реакции:
1. Внутримолекулярная дегидратация: этанол → этилен + вода
2. Межмолекулярная дегидратация: этанол + этанол → диэтиловый эфир + вода
В самом общем виде схема процесса включает три стадии:
Первая стадия - подготовка сырья (испарение воды и этанола, перегрев паров этанола и воды до рабочей температуры), на этой стадии химических превращений не происходит.
Вторая стадия - химическое превращение, образуются новые вещества – продукты реакции (этилен, эфир и вода); так как обычно химическая реакция протекает не до конца,отметим, что часть этанола остается без изменения.
Третья стадия – разделение реакционной смеси (выделение продуктов реакций и не превращенного этанола, который возвращается в начало процесса.
В этом примере:
Сырье – смесь этанол + вода, Реагент – этанол; Целевой продукт - этилен, Целевая реакция - мономолекулярная дегидратация; Побочный продукт – диэтиловый эфир; Побочная реакция - межмолекулярная дегидратация;
Вода одновременно Примесь и Побочный продукт, выделяющийся как в целевой, так и в побочной реакциях
5
Слайд 10Технологический режим - это совокупность технологических параметров, определяющих работу аппарата или
Аппаратом является ректификационная колонна на стадии разделения, теплообменник на стадии подогрева или охлаждения, емкость с мешалкой на стадии смешения и т.д.
В качестве специфического термина, характеризующего аппарат в котором протекает химическая реакция, используется термин Химический реактор, чаще всего без прилагательного «химический».
Совокупность отдельных аппаратов, связанных между собой материальными, тепловыми и энергетическими потоками, называется Технологической схемой процесса.
Технологические параметры – это измеряемые величины, позволяющие по возможности полно охарактеризовать состояние процесса (расход материальных потоков, температура, давление, концентрация компонентов, концентрация катализатора).
6
Слайд 12где: n и m - количество вещества в моль и масса
Степень превращения (конверсия) реагента.
Характеризует все химические превращения данного вещества, протекающие в системе. Рассчитывается как доля вступившего в химические реакции вещества, от его исходного (начального) количества.
Обозначается греческой строчной буквой альфа, в качестве подстрочного индекса может быть указан реагент (брутто формулой, названием).
Например, для системы с двумя химическими реакциями:
aА → bВ (целевой продукт)
a/A → dD (побочный продукт)
αА рассчитывается как разница между количеством реагента (вещества A) на входе в реактор и количеством реагента на выходе из реактора, отнесенная к количеству реагента на входе в реактор.
8
Слайд 13При известной концентрации реагента на входе в аппарат, концентрация на выходе
Степень превращения может выражаться не только в долях 1, но и в процентах (вышеприведенные выражения умноженные на 100%).
9
Если в реакции участвует несколько веществ, степень превращения может быть рассчитана по любому из реагентов.
Для обратимой реакции aА ↔ bВ, предельным состоянием в конкретных условиях проведения является состояние химического равновесия.
Для таких реакций дополнительно используется понятие равновесная степень превращения:
Здесь САравн или СА,е (индекс «е» от английского слова equilibrium) - концентрация реагента к моменту наступления химического равновесия).
Слайд 14Выберите правильный ответ:
Степень превращения (конверсия) реагента при условии, что из 100
1. 0,90 2 . 45 % 3. 10 % 4. 0,45
Слайд 15Выход продукта – отношение реально (фактически) полученного количества продукта к максимально
Для простой необратимой реакции aA → bB
Выход продукта на поданное сырье (на поданный реагент) равен степени превращения:
10
Для обратимой реакции aA ↔ bB
Выход продукта на поданное сырье (на поданный реагент) равен отношению фактической степени превращения к равновесной (максимальной в данных условиях):
Слайд 16Для сложных реакций (параллельных, последовательных, комбинированных), где помимо целевой реакции протекают
В целом для сложных реакций выход по данному продукту рассчитывается как произведение конверсии реагента на селективность по этому продукту.
11
Селективность – доля превращенного реагента, израсходованная на образование данного продукта (не обязательно целевого), при расчете селективности учитываются только химические реакции - основная и побочные.
Слайд 17Полная или интегральная селективность – это отношение количества реагента, израсходованное в
Например, для последовательной реакции
aА (реагент) → bВ (целевой продукт) → cС (побочный продукт)
селективность целевого продукта B по реагенту А:
селективность побочного продукта С по реагенту А
12
Слайд 18Для параллельных реакций дополнительно используется понятие дифференциальной селективности равной отношению скорости
А → В (целевой продукт)
А → С (побочный продукт)
Производительность:
количество продукта произведенного (выработанного) в единицу времени:
где В – количество продукта (кг, тонн), τ - время, для выражения которого может быть использована любая единица – час, сутки, месяц, год)
13
Слайд 19Интенсивность – понятие, которое используют для сравнения эффективности работы аппаратов, используемых
Интенсивность равна производительности, отнесенной например, к единице объема аппарата:
Пример размерности для интенсивности - [кг/(м3⋅ч)].
Для каталитических реакторов производительность аппарата удобно относить к массе (или объему) загруженного катализатора:
14
Слайд 2015
Расходные коэффициенты по сырью (по реагенту):
Теоретический расходный коэффициент рассчитывается по
Например для реакции
aА → bВ (целевой продукт) + cС (побочный продукт)
где Мi – молекулярная масса
Практический или фактический расходный коэффициент – отношение массы реагента, поданного в систему за данный временной интервал, к массе продукта, произведенного в течение этого временного интервала.
Слайд 21Себестоимость продукции.
Разделяется на фабрично-заводскую себестоимость, а именно денежное выражение затрат данного
Фабрично-заводская себестоимость складывается из следующих статей расхода:
1. Сырье, доля затрат на сырье составляет основную долю расходов (60 – 70 и более %);
2. Затраты на топливо и энергию;
3. Амортизационные отчисления, идущие на возмещение износа основного оборудования, коммуникаций, зданий;
4. Зарплата основных рабочих;
5. Цеховые расходы – зарплата вспомогательных рабочих, администрации цеха, вспомогательных служб, текущий ремонт оборудования;
6. Общезаводские расходы – расходы на администрацию завода, охрану, пожарную службу, очистные сооружения).
Если из сырья помимо основного продукта получают побочные продукты, их стоимость вычитается из себестоимости основного продукта.
Прибыль - в бухгалтерском учете - превышение доходов от продажи товаров и услуг над затратами на производство и продажу этих товаров.
16