- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение атома пз и пс Д.И. Менделеева в свете квантовомеханической теории строения атома презентация
Содержание
- 1. Строение атома пз и пс Д.И. Менделеева в свете квантовомеханической теории строения атома
- 2. Ученые древности о строении вещества Древнегреческий ученый
- 4. В 1808 г. английский химик Дальтон сформулировал
- 5. Джозеф Джон Томсон(1856-1940) В конце 19-го века
- 6. Модель атома Томсона Внутри положительно заряженного шара
- 7. Эрнест Резерфорд(1871-1937) В начале 20-го века английский
- 8. Планетарная модель атома Резерфорда в центре
- 9. В 1913 г Нильс Бор (Дания) предположил,
- 11. Изотопы. Так называются атомы, имеющие одинаковый заряд
- 12. Атомы изотопов водорода Ядра изотопов водорода
- 13. В 1924 г французский учёный Луи де
- 14. 1. Электрон в атоме можно рассматривать как
- 15. …электронным облаком. … атомной орбиталью (АО)
- 16. Важным следствием теории квантовой механики является то,
- 17. Главное квантовое число n – определяет номер
- 18. Побочное (орбитальное) квантовое число l – определяет
- 19. Число подуровней, на которые расщепляется энергетический уровень
- 20. Магнитное квантовое число ml – Оно
- 21. Следовательно, можно сказать, что число значений ml
- 23. Состояние электрона в атоме, характеризующееся определенными значениями чисел n, l,ml называется атомной орбиталью.
- 24. Спиновое квантовое число s. характеризует собственный
- 25. Общая характеристика состояния электрона в многоэлектронном атоме
- 26. Электронные конфигурации атомов (порядок заполнения атомных
- 27. Может быть заполнение электронами энергетических уровней и
- 28. Последовательность заполнения электронами уровней и подуровней: 1s22s22p63s23p64s23d104p65s24d105p66s2 4f145d106p67s25f146d107p6…
- 29. При наличии однотипных орбиталей их заполнение происходит
- 30. Атом хлора +17 Cl )2 )8 )7
- 31. «Проскок» электрона Установлено, что у d-орбиталей особо
- 32. Периодический закон Д.И. Менделеева. Открыт в
- 33. Первым вариантом системы элементов, предложенным Д. И.
- 36. Периодом в ПС называется – горизонтальный ряд
- 37. Периодически меняющиеся свойства атомов Атомные и
- 38. Эффективный атомный радиус – радиус сферы действия
- 39. 2. Энергия ионизации (Еион) [кДж/моль] или
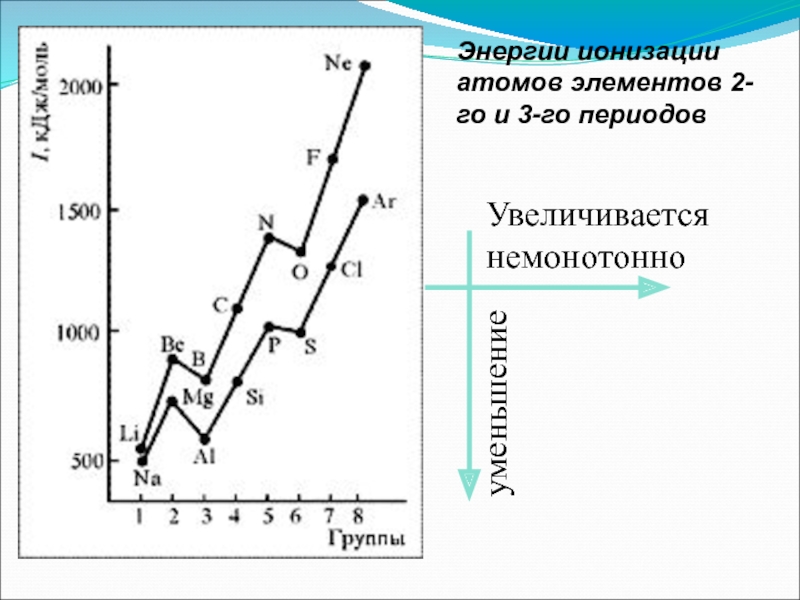
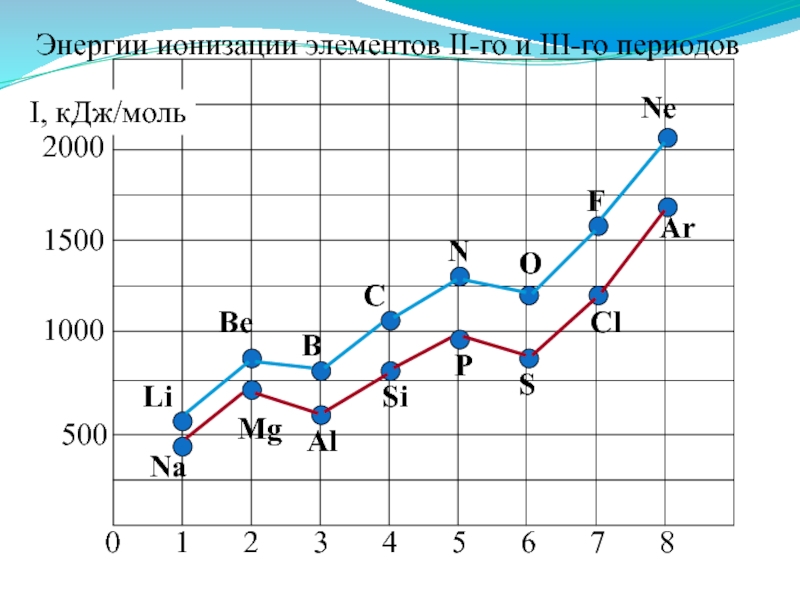
- 40. Энергии ионизации атомов элементов 2-го и 3-го периодов Увеличивается немонотонно уменьшение
- 42. Анализ изменения Еион позволяет сделать некоторые выводы:
- 43. 2. Сродство к электрону (Еср.) [кДж/моль]
- 45. Анализ изменения СЭ позволяет сделать некоторые выводы:
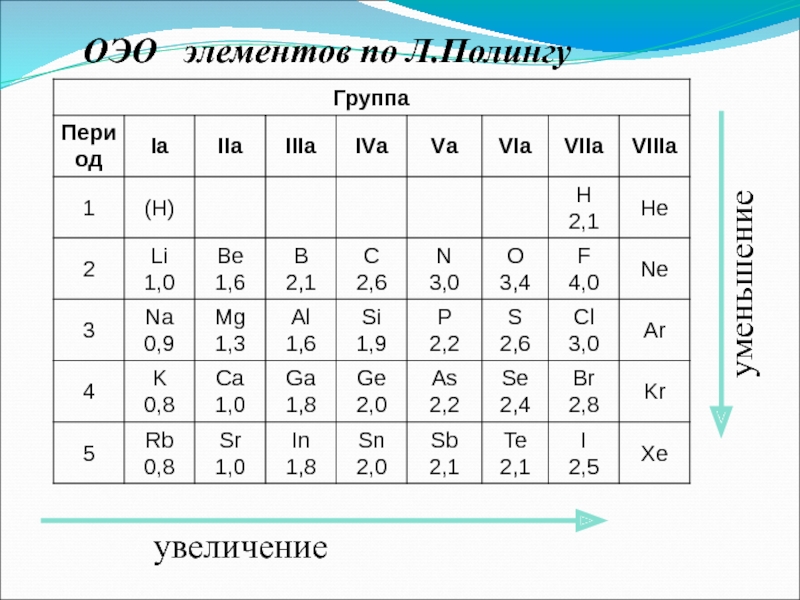
- 46. 3. Электроотрицательность (χ) [кДж/моль] или [эВ/атом]
- 47. увеличение уменьшение ОЭО элементов по Л.Полингу
- 48. СПАСИБО за ВНИМАНИЕ!
Слайд 1СТРОЕНИЕ АТОМА
ПЗ и ПС Д.И. Менделеева в свете квантово-механической теории строения
Слайд 2Ученые древности о строении вещества
Древнегреческий ученый Демокрит 2500 лет назад считал,
Долгое время считалось, что атом является неделимой частицей.
Слайд 3
Атом
Слайд 4В 1808 г. английский химик Дальтон сформулировал атомистическую
«Все вещества состоят из атомов, мельчайших неделимых частиц, которые не могут быть ни созданы, ни уничтожены».
~1900 г
Фотоэффект - испускание электронов металлами и полупроводниками при их освещении. (Столетов А.Г. 1889г.)
Радиоактивность – самопроизвольный распад атомов, сопровождающийся испусканием различных частиц. (А. Беккерель, 1896 г.)
Слайд 5Джозеф Джон Томсон(1856-1940)
В конце 19-го века открыл электрон. Масса электрона оказалась
Слайд 6Модель атома Томсона
Внутри положительно заряженного шара диаметром около 10 м находятся
-10
-
-
-
-
-
-
-
-
-
-
-
Слайд 7Эрнест Резерфорд(1871-1937)
В начале 20-го века английский физик Эрнест Резерфорд открыл атомное
Слайд 8Планетарная модель атома Резерфорда
в центре атома - положительно заряженное ядро :
размер ядра 10-13 см;
масса ядра фактически равна массе атома. электроны движутся вокруг ядра по круговым и эллиптическим орбитам, как планеты вокруг Солнца : электроны удерживаются на орбите кулоновской силой притяжения к ядру, создающей центростремительное ускорение.
число электронов в атоме равно Z ( порядковый номер элемента)
электроны движутся с большой скоростью, образуя электронную оболочку атома.
Слайд 9В 1913 г Нильс Бор (Дания) предположил, что электрон движется не
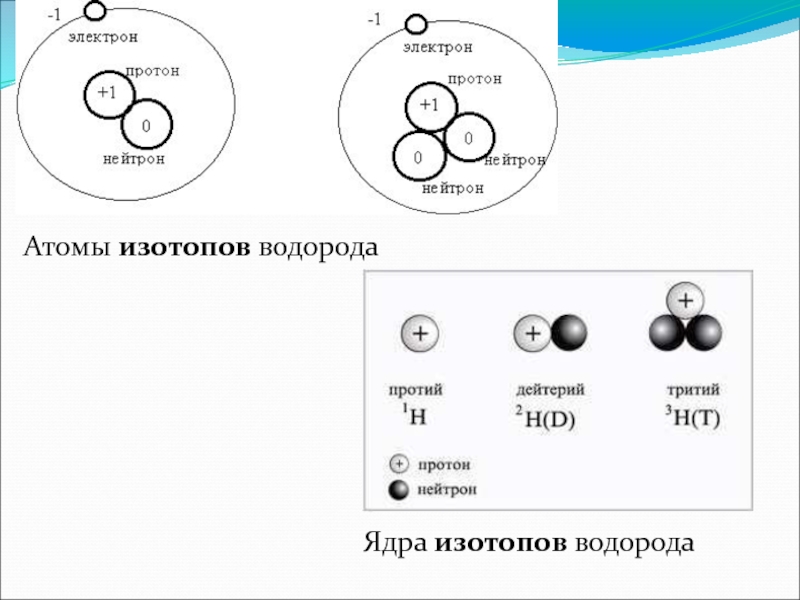
Слайд 11Изотопы.
Так называются атомы, имеющие одинаковый заряд ядра , но различную массу.
Например, 12Н- дейтерий и 13Н- тритий являются изотопами водорода (тритий радиоактивен)
Слайд 13В 1924 г французский учёный Луи де Бройль высказал предположение о
В 1926 г Э. Шредингер
теорию движения микрочастиц –
квантовая (волновую) механику
создание современной квантово-механической модели строения атома.
Эта модель не наглядная !
( очень условное изображение)
λ=10-8 см
Слайд 141. Электрон в атоме можно рассматривать как частицу, которая при движении
2. Электрон в атоме может находиться в любой точке пространства вокруг ядра, однако вероятность его пребывания в разных местах атомного пространства различна.
Слайд 15…электронным облаком.
… атомной орбиталью (АО)
(или электронной плотностью).
Термин "орбита"
«Неужели действительно были такие идиоты, которые думали, что электрон вращается по орбите?»
Н. Бор
Слайд 16Важным следствием теории квантовой механики является то, что вся совокупность сложных
Слайд 17Главное квантовое число n – определяет номер
энергетического уровня
Принимает целочисленные
Чем ↑ n , тем ↑ энергией обладает электрон, и тем слабее он связан с ядром…..
…можно говорить о существовании в атоме энергетических уровней (электронных слоев или оболочек), отвечающих определенным значениям главного квантового числа - n.
Характеризует энергию электронов, занимающих данный энергетический уровень
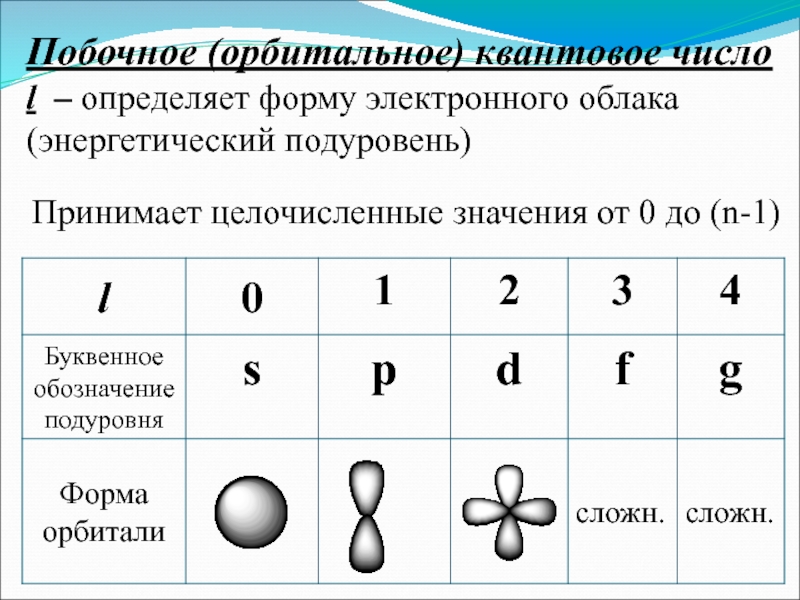
Слайд 18Побочное (орбитальное) квантовое число l – определяет форму электронного облака (энергетический
Принимает целочисленные значения от 0 до (n-1)
Слайд 19Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Например,
Т.о.,
Слайд 20Магнитное квантовое число ml –
Оно принимает все целочисленные значения от
Например, при l =0 ml = 0;
при l =1 ml = -1; 0 ; +1;
при l =2 ml = -2; -1; 0 ; +1; +2;
Любому значению l соответствует (2l+1) возможных расположений электронного облака данного типа в пространстве.
Характеризует ориентацию электронного облака в пространстве
Слайд 21Следовательно, можно сказать, что число значений ml указывает на число орбиталей
s-cостоянию соответствует одна орбиталь,
p-состоянию – три,
d-состоянию – пять,
f-состоянию – семь и т.д.
Число орбиталей на подуровне равно (2l+1),
а общее число орбиталей на энергетическом уровне равно n2.
Все орбитали, принадлежащие одному подуровню данного энергетического уровня, имеют одинаковую энергию в отсутствии магнитного поля (вырожденные).
Слайд 23Состояние электрона в атоме, характеризующееся определенными значениями чисел n, l,ml называется
атомной орбиталью.
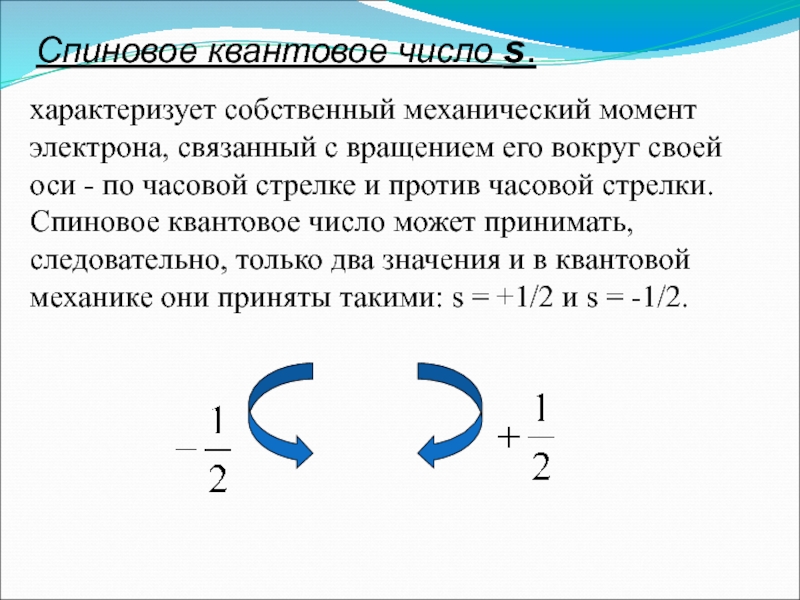
Слайд 24Спиновое квантовое число s.
характеризует собственный механический момент электрона, связанный с
Слайд 25Общая характеристика состояния электрона в многоэлектронном атоме определяется принципом Паули: в
На одной орбитали могут находиться не более двух электронов, отличающихся друг от друга спинами. Максимальная емкость энергетического подуровня – 2(2+l ) электронов, а уровня – 2n2.
Слайд 26Электронные конфигурации атомов
(порядок заполнения атомных орбиталей)
Принцип min энергии –
Этот принцип подтверждается двумя правилами Клечковского:
1. С ростом атомного номера элемента электронов размещаются последовательно на орбиталях, характеризуемых возрастанием суммы главного и орбитального квантовых чисел - (n+l).
2. При одинаковых значениях этой суммы раньше заполняется орбиталь с меньшим значением n
Слайд 27Может быть заполнение электронами энергетических уровней и подуровней идет в следующем
…3s 3p 3d 4s 4p…
(3+0)
(3+1)
(3+2)
(4+0)
(4+1)
3
4
5
4
5
применяем правила Клечковского
…3s 3p 4s 3d 4p…
Увеличение Е
Слайд 28Последовательность заполнения электронами уровней и подуровней:
1s22s22p63s23p64s23d104p65s24d105p66s2
4f145d106p67s25f146d107p6…
Слайд 29При наличии однотипных орбиталей их заполнение происходит в соответствии с правилом
Слайд 30Атом хлора
+17 Cl )2 )8 )7 схема строения атома.
1s2 2s2 2p6
Атом располагается в III периоде, и имеет три энергетических уровня.
Атом располагается в VII группе, главной подгруппе - на внешнем энергетическом уровне 7 электронов.
Слайд 31«Проскок» электрона
Установлено, что у d-орбиталей особо устойчивыми конфигурациями являются d5 и
Сr : ….3d44s2 – неправильно
Сr : ….3d54s1 – правильно
Слайд 32Периодический закон Д.И. Менделеева.
Открыт в 1869 г. великим русским ученым
“Свойства элементов и свойства образуемых ими простых и сложных соединений стоят в периодической зависимости от их атомного веса”.
Это определение немного ошибочно.
Современная формулировка ПЗ гласит:
Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда атомных ядер в результате периодического повторения электронных конфигураций внешнего энергетического уровня.
Слайд 33Первым вариантом системы элементов, предложенным Д. И. Менделеевым 1 марта 1869
Слайд 36Периодом в ПС называется – горизонтальный ряд элементов, в пределах которого
Элементы –аналоги, т.е. расположенные в одной подгруппе ПС, имеют одинаковое строение внешних электронных оболочек атомов при различных значениях n и поэтому проявляют сходные химические свойства.
В вертикальных колонках, называемых группами, объединены элементы, имеющие сходное электронное строение.
Слайд 37Периодически меняющиеся свойства атомов
Атомные и ионные радиусы
2. Энергия ионизации
3. Сродство
4. Электроотрицательность
Слайд 38Эффективный атомный радиус – радиус сферы действия атома или иона
Атомные радиусы
при этом в группах А такое увеличение происходит в большей степени, чем в группах В.
Слайд 392. Энергия ионизации (Еион)
[кДж/моль] или [эВ/атом] (1эВ/атом= 100 кДж/моль. )
Характер изменения в периодах одинаков:
Слайд 42Анализ изменения Еион позволяет сделать некоторые выводы:
1. В периодах Еион ↑,
2. Атомы щелочных Ме (ns1) имеют самые низкие Еион
3. Атомы благородных газов (ns2np6) имеют max Еион
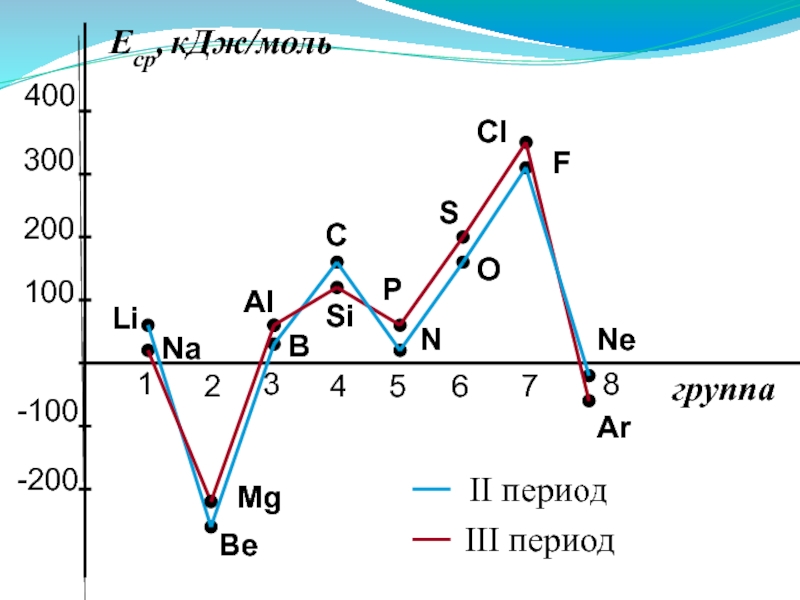
Слайд 432. Сродство к электрону (Еср.)
[кДж/моль] или [эВ/атом] - энергетический
Характер изменения в периодах одинаков:
Слайд 45Анализ изменения СЭ позволяет сделать некоторые выводы:
1. Min (отрицательное) СЭ наблюдается
2. Незначительно СЭ у атомов с конфигурацией np3 (устойчивый наполовину заполненный подуровень)
3. Мах СЭ обладают атомы 7(А) группы – ns2np5
Слайд 463. Электроотрицательность (χ)
[кДж/моль] или [эВ/атом] – характеризует
способность атома в химическом соединении притягивать к себе электроны.


































![2. Энергия ионизации (Еион) [кДж/моль] или [эВ/атом] (1эВ/атом= 100 кДж/моль. ) – минимальная энергия, необходимая](/img/tmb/4/379149/6c45dbc09c882c0f419e99b5353ace5f-800x.jpg)

![2. Сродство к электрону (Еср.) [кДж/моль] или [эВ/атом] - энергетический эффект присоединения электрона к нейтральному](/img/tmb/4/379149/4a99ef97b36fddad7dbeb083f77933d4-800x.jpg)

![3. Электроотрицательность (χ) [кДж/моль] или [эВ/атом] – характеризует способность атома в химическом соединении притягивать](/img/tmb/4/379149/570e25d9ea1f7556727501fdc652bbc8-800x.jpg)