- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общая характеристика металлов IА группы ПСХЭ Д.И. Менделеева презентация
Содержание
- 1. Общая характеристика металлов IА группы ПСХЭ Д.И. Менделеева
- 2. Периодическая система химических элементов Д.И.Менделеева Группы элементов
- 3. Группы элементов I III II VIII IV
- 4. * Fr K Na Li Изменение
- 5. СТРОЕНИЕ АТОМОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ Строение внешнего энергетического уровня ns1 степень окисления +1.
- 6. ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ Литий был открыт шведским
- 7. ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ Натрий и калий были
- 8. * Эти металлы получили название щелочных, потому
- 9. Физические свойства Все металлы этой подгруппы имеют
- 10. Франций радиоактивный щелочной металл В природе
- 11. Физические свойства Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
- 12. Они очень мягкие, их можно резать ножом, скальпелем. Физические свойства
- 13. ХИМИЧЕСКИЕ СВОЙСТВА Из-за высокой химической активности щелочных металлов по
- 14. Нахождение в природе Как очень
- 15. Сподуменн LiAl[Si2O6]
- 16. Галит NaСl
- 17. Природные соединения калия Сильвин КСl
- 18. Лепидолит- один из основных источников редких щелочных металлов, рубидия и цезия
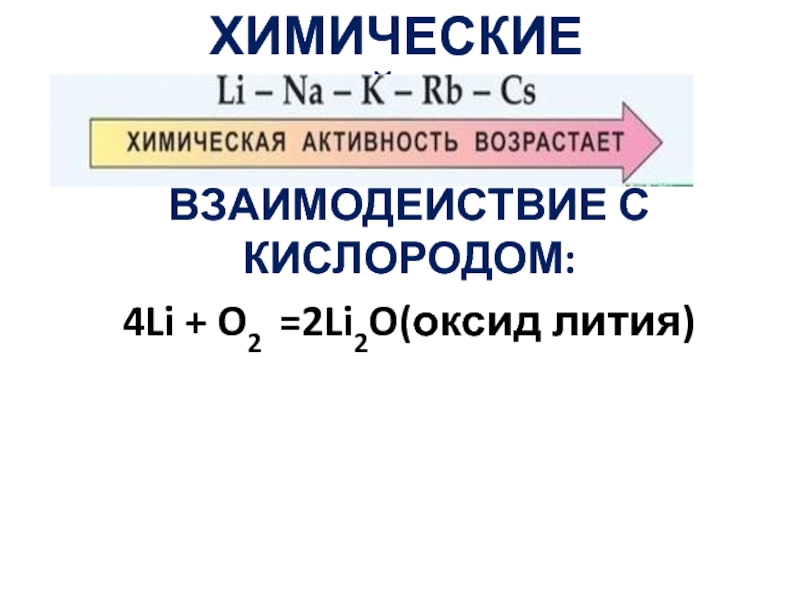
- 19. ХИМИЧЕСКИЕ СВОЙСТВА ВЗАИМОДЕЙСТВИЕ С КИСЛОРОДОМ: 4Li + O2 =2Li2O(оксид лития)
- 20. ВЗАИМОДЕЙСТВИЕ С КИСЛОРОДОМ: Щелочной металл на
- 21. ХИМИЧЕСКИЕ СВОЙСТВА Реакции с неметаллами : 2Li
- 22. Взаимодействие с водой Li - спокойно,
- 23. С кислотами: https://www.youtube.com/watch?v=Td6itaNfJrU&t=3s 2Na+ Н2SО4 = Na2SО4 + Н2 (протекают очень бурно)
- 24. Электролиз расплавов соединений щелочных металлов: 2МеCl =
- 25. * Окраска пламени ионами щелочных металлов Li+
- 26. Оксид натрия Хранить оксид натрия Na2O лучше всего в безводном бензоле.
- 27. Пероксид натрия Na2O2
- 28. ПОЛУЧЕНИЕ ОКСИДОВ Чистый оксид натрия получить непосредственным окислением натрия
- 29. 1) Для получения оксидов натрия и калия
- 30. Общая формула – МеОН Белые кристаллические вещества,
- 31. Едкий натр (гидроксид натрия) NaOH
- 32. Едкое кали (гидроксид калия) КOH
- 33. Схема образования гидроксида натрия: Н ОН Na гидроксид натрия
- 34. Фенолфталеин - малиновый
- 35. Они участвуют во всех реакциях, характерных для оснований — реагируют
- 36. Химические свойства 1.С кислотами Основание + кислота
- 37. 2. С кислотными оксидами
- 38. 3. С амфотерными гидроксидами: 2 NaOH
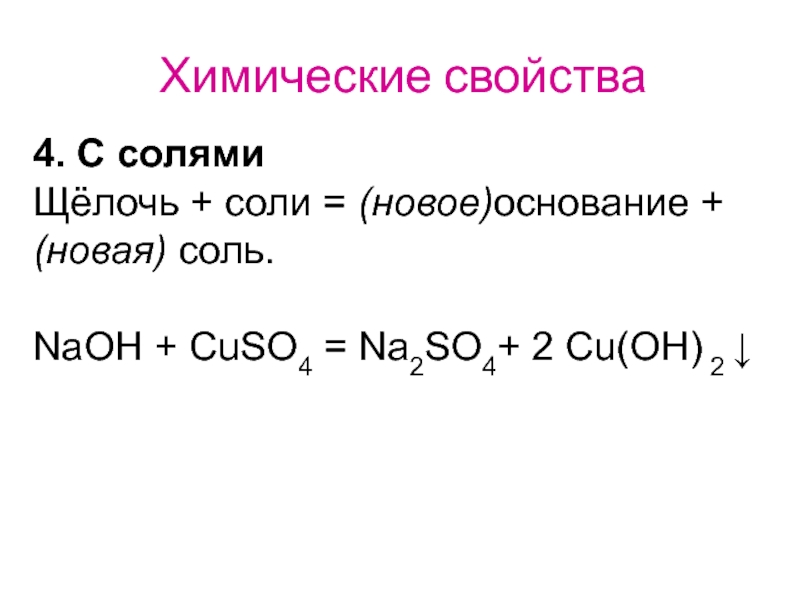
- 39. Химические свойства 4. С солями Щёлочь +
- 40. Соли натрия Na2CO310H2O – кристаллическая сода
- 41. Цезий - самый активный металл на Земле! https://www.youtube.com/watch?v=1gh5JJDvdiQ
- 42. Значение и роль калия в организме Натриий
- 43. источники натрия Натрий содержится в капусте брокколи, цветной капусте, картофеле, фасоли, винограде, арбузе.
- 44. источники калия Калий содержится в продуктах растительного происхождения: фруктах, овощах, картофеле, бобовых и злаковых культурах.
- 45. Мыла – это натриевые или калиевые
- 46. Рубидий Играет немалую роль в организме
- 47. ПОВТОРИМ: Наиболее выраженные металлические свойства проявляет:
- 48. Калий взаимодействует с водой с образованием.... и
- 49. https://www.youtube.com/watch?v=nMptepCx0Jw https://www.youtube.com/watch?v=rccFLDrWMxc&t=4s Окраска пламени ЗАДАНИЕ
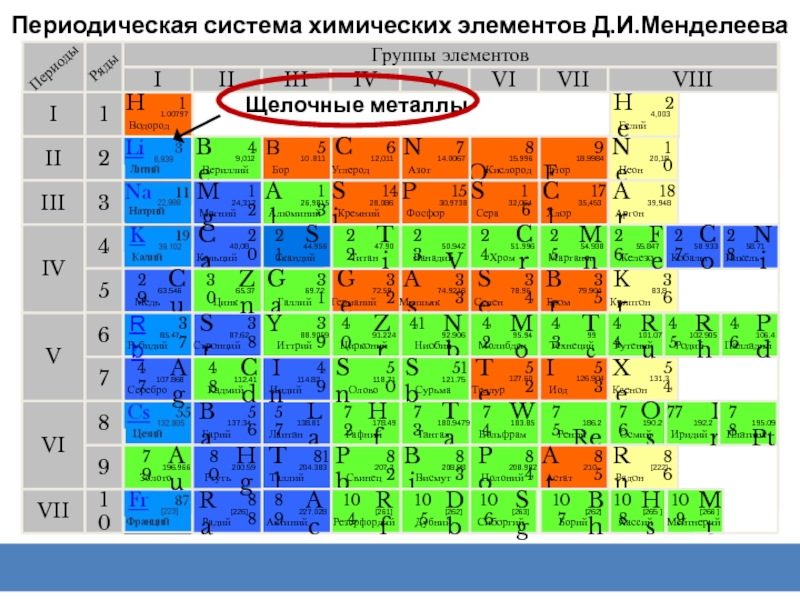
Слайд 2Периодическая система химических элементов Д.И.Менделеева
Группы элементов
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
10
F
фтор
9
18.9984
Br
Бром
35
79.904
I
Иод
53
126.904
Cl
Хлор
17
35,453
At
Астат
85
210
9
8
Щелочные металлы
Слайд 3Группы элементов
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
10
9
8
Щелочные металлы
Периодическая система химических элементов Д.И.Менделеева
В главной подгруппе:
Электроотрицательность уменьшается
Металлические свойства
Радиус атома увеличивается
Слайд 4*
Fr
K
Na
Li
Изменение свойств группе
Увеличиваются восстановительные свойства (способность отдавать электроны)
Уменьшается прочность химической
Уменьшается температура плавления, температура кипения
Слайд 5СТРОЕНИЕ АТОМОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ
Строение внешнего энергетического уровня ns1
степень окисления
Слайд 6ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ
Литий был открыт шведским химиком Й. Арфведсоном в 1817
И назван литием (от греч. литос – камень) поскольку эта щелочь впервые была найдена в "царстве минералов" (камней)
Арфведсон Юхан Август
(12 .01.1792 г. – 28 .10.1841 г.)
Слайд 7ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ
Натрий и калий были впервые получены английским химиком и
Й. Берцелиус предложил назвать один новый элемент натрием (от араб. натрун – сода), а второй элемент калием (от араб. алкали – щелочь)
Гемфри Дэви
(1778 – 1829)
Слайд 8*
Эти металлы получили название щелочных, потому что большинство их соединений растворимы
По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов
Слайд 9Физические свойства
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия).
калий
рубидий
литий
натрий
цезий
Слайд 10Франций
радиоактивный щелочной металл
В природе не существует в таких количествах, которые
Микроскопические количества франция-223 и франция-224 могут быть химически выделены из минералов урана и тория. Другие изотопы франция получают искусственным путём с помощью ядерных реакций.
Fr
Слайд 11Физические свойства
Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Слайд 13ХИМИЧЕСКИЕ СВОЙСТВА
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже
Слайд 14 Нахождение в природе
Как очень активные металлы, они встречаются в
Натрий и калий широко распространены в природе в виде солей.
Соединения других щелочных металлов встречаются редко.
Слайд 20ВЗАИМОДЕЙСТВИЕ С КИСЛОРОДОМ:
Щелочной металл на воздухе легко окисляется до оксида натрия.
2Na +
При горении на воздухе или в кислороде образуются пероксиды:
2Na + O2 = Na2O2(пероксид натрия)
K + O2 = K2O2(пероксид калия)
Слайд 21ХИМИЧЕСКИЕ СВОЙСТВА
Реакции с неметаллами :
2Li + Cl2 = 2LiCl(галогениды)
2Na + S
2Na + H2 = 2NaH(гидриды)
6Li + N2 = 2Li3N(нитриды)
2Li + 2C = 2Li2C2(карбиды)
Слайд 22Взаимодействие с водой
Li - спокойно,
Na - энергично,
остальные
воспламеняется выделяющийся Н2
Rb и Cs реагируют не только
с жидкой Н2О, но и со льдом. .
Все щелочные металлы активно реагируют с водой, образуя щелочи и восстанавливая воду до водорода:
2Ме0 + 2Н2О = 2Ме+1ОН + Н2↑
2Na + 2Н2О = 2NaOH + H2
Скорость взаимодействия щелочного металла с водой увеличивается от лития к цезию:
https://www.youtube.com/watch?v=K-GC_YR3das
Слайд 23С кислотами:
https://www.youtube.com/watch?v=Td6itaNfJrU&t=3s
2Na+ Н2SО4 = Na2SО4 + Н2
(протекают очень бурно)
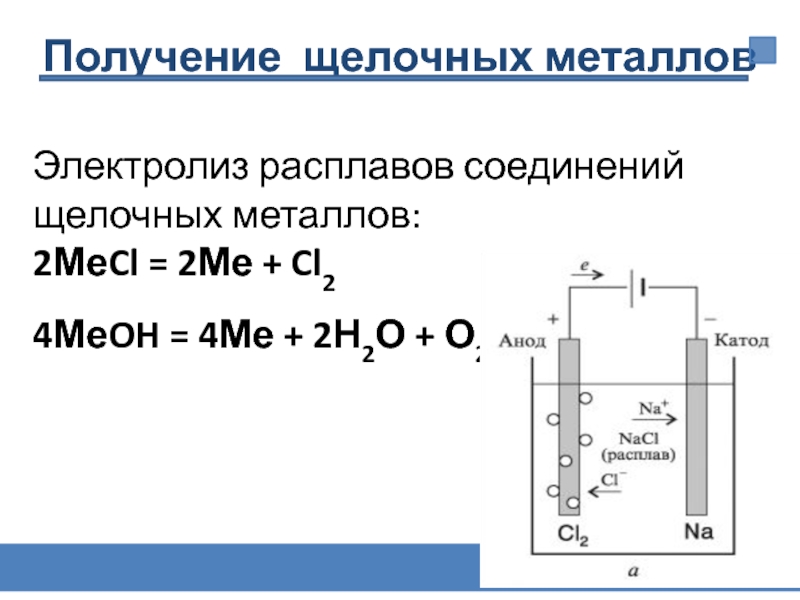
Слайд 24Электролиз расплавов соединений щелочных металлов:
2МеCl = 2Ме + Cl2
4МеOH = 4Ме
Получение щелочных металлов
Слайд 25*
Окраска пламени ионами щелочных металлов
Li+
карминово-
красный
K+
Na+
желтый
Cs+
фиолетовый
Качественная реакция на катионы щелочных металлов -
Слайд 28ПОЛУЧЕНИЕ ОКСИДОВ
Чистый оксид натрия получить непосредственным окислением натрия
нельзя, так как образуется смесь, состоящая
Слайд 291) Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида
Na2O2 + 2Na = 2Na2O
2) Прокаливанием гидрокарбоната натрия:
2NаНСO3 = Na2O + Н2O + 2СO2
ПОЛУЧЕНИЕ ОКСИДОВ
Слайд 30Общая формула – МеОН
Белые кристаллические вещества, гигроскопичны, хорошо растворимы в воде
NaOH – едкий натр
КОН – едкое кали
LiOH - гидроксид лития
Основные свойства усиливаются в ряду:
LiOH → NaOH → KOH → RbOH → CsOH
Щёлочи
Слайд 35Они участвуют во всех реакциях, характерных для оснований — реагируют с
кислотами,
кислотными и амфотерными оксидами,
амфотерными
с солями :
Химические свойства
Слайд 36Химические свойства
1.С кислотами
Основание + кислота = Соль + вода
NaOH + HCl
Реакцию между кислотой и основанием, в результате которой образуется соль и вода, называются реакциями нейтрализации
Слайд 372. С кислотными оксидами
Щёлочь
Ca(OH)2 + CO2 = CaCO3 + H2O
Р2О5 + 6КОН = 2К3РО4 + 3Н2О
Химические свойства
Слайд 39Химические свойства
4. С солями
Щёлочь + соли = (новое)основание + (новая) соль.
NaOH + CuSO4 = Na2SO4+ 2 Cu(OH) 2 ↓
Слайд 40Соли натрия
Na2CO310H2O – кристаллическая сода используется в стекольном производстве, мыловарении, в
NaHCO3 Гидрокарбонат натрия (другие названия: питьевая сода(E-500), пищевая сода, бикарбонат натрия, натрий двууглекислый) — кристаллическая соль.
Слайд 42Значение и роль калия в организме
Натриий и калий отвечают за нормальный
Калий уменьшает отёки и стимулирует выработку необходимых ферментов.
Слайд 43источники натрия
Натрий содержится в капусте брокколи, цветной капусте, картофеле, фасоли, винограде,
Слайд 44 источники калия
Калий содержится в продуктах растительного происхождения: фруктах, овощах, картофеле, бобовых
Слайд 45
Мыла – это натриевые или калиевые соли высших жирных кислот, гидролизующихся
Слайд 46Рубидий
Играет немалую роль в организме и оказывает такое влияние:
оказывает антигистаминное
ослабляет воспалительные процессы в клетках и организме в целом;
оказывает успокаивающее воздействие
Изотопы Rb(87) и Cs(137) - при лечении злокачественных опухолей.
Слайд 47ПОВТОРИМ:
Наиболее выраженные металлические свойства проявляет:
? алюминий
? натрий
? магний
? бериллий
? железо
Активнее других реагирует с кислородом....
? алюминий
? серебро
? цинк
? барий
При комнатной
? медь
? железо
? литий
? цинк
Слайд 48Калий взаимодействует с водой с образованием.... и ....
? соли
?
? щелочи
? оксида калия
В химических реакциях атом алюминия - ...
? окислитель
? восстановитель
? окислитель и восстановитель
? не отдает и не принимает электроны
Слайд 49https://www.youtube.com/watch?v=nMptepCx0Jw
https://www.youtube.com/watch?v=rccFLDrWMxc&t=4s
Окраска пламени
ЗАДАНИЕ
С помощью уравнений реакций осуществите превращения:
1) Na
NaOH → Na2CO3
Li → Li2O → LiOH → LiCl
LiOH













![Сподуменн LiAl[Si2O6]](/img/tmb/5/433863/af9a2b58442b8a856ac991f67bc1a7d6-800x.jpg)




















![3. С амфотерными гидроксидами: 2 NaOH + Zn(ОН)2 → Na2[Zn(OH)4]Тетрагидроксоцинкат натрия](/img/tmb/5/433863/b813f53587656ad82de64f93ae3d0d70-800x.jpg)