- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общая характеристика элементов IIIA-группы. Бор. Алюминий презентация
Содержание
- 1. Общая характеристика элементов IIIA-группы. Бор. Алюминий
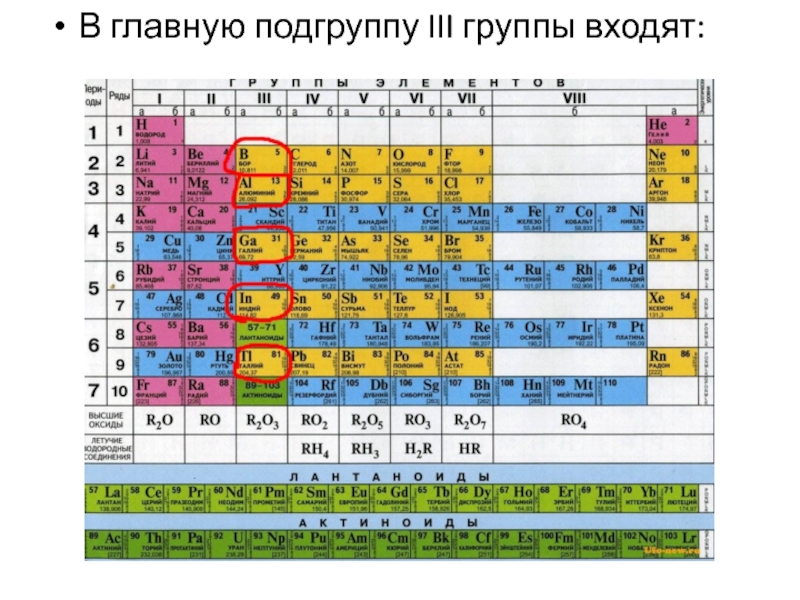
- 2. В главную подгруппу III группы входят:
- 3. III группа Периодической системы К р-элементам
- 4. Элементы IIIА-группы Общая электронная формула: […]
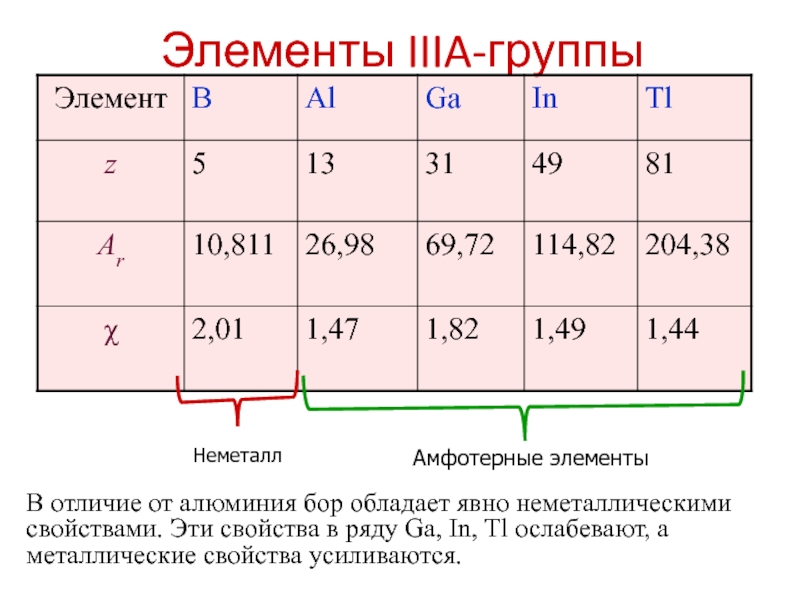
- 5. Элементы IIIA-группы В отличие от алюминия бор
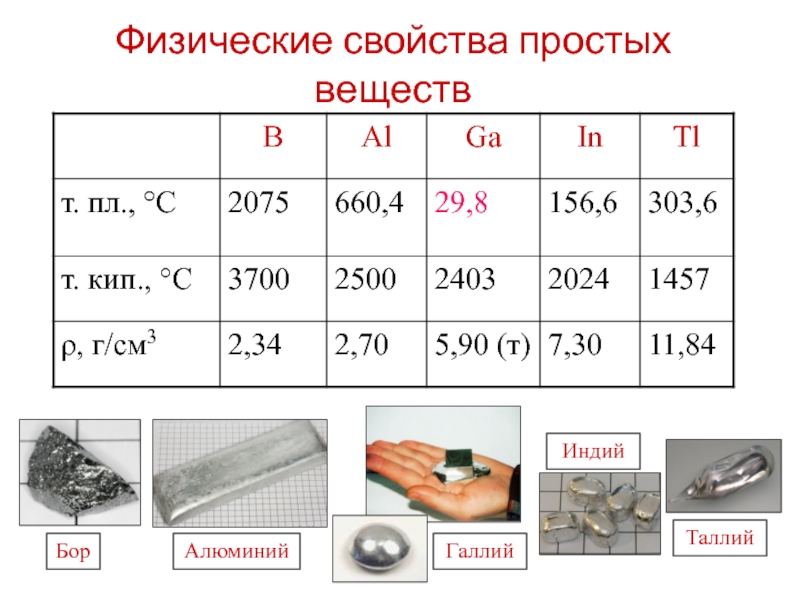
- 6. Физические свойства простых веществ
- 7. Галлий. Га́ллий мягкий пластичный металл серебристо-белого цвета с синеватым оттенком. Лёгкий металл.
- 8. И́ндий ковкий, легкоплавкий, очень мягкий металл серебристо-белого цвета. Индий.
- 9. Таллий. Та́ллий мягкий металл белого цвета с
- 10. Кислородные соединения Оксиды Э2О3 B Al Ga In Tl
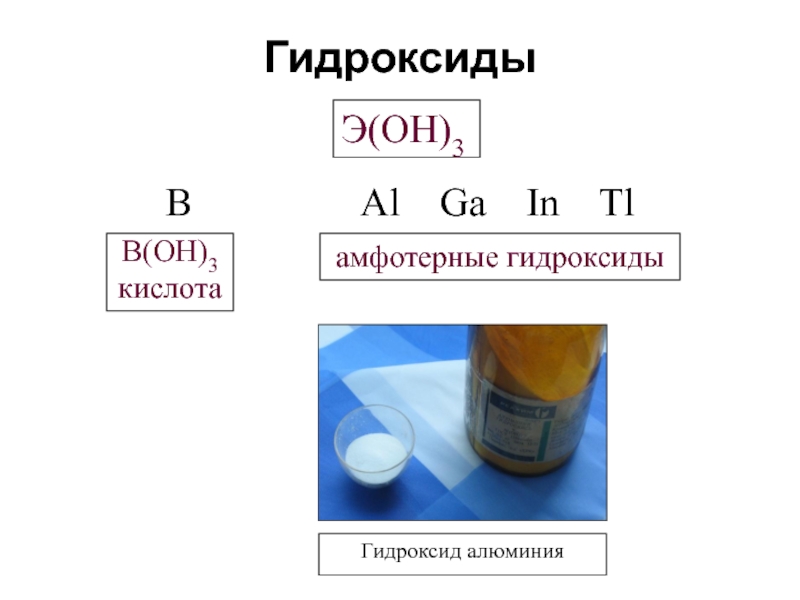
- 11. Гидроксиды Э(OH)3 B
- 12. В 2 3
- 13. Бор Кристаллы бора черного цвета,
- 14. Бор Кристаллический бор построен из двадцатигранника, химически инертен. B12
- 15. Особенности химии бора Получение: B2O3 + 6К
- 16. В обычных условиях кристаллический бор весьма инертен
- 17. Взаимодействие со сложными веществами B + 3HNO3
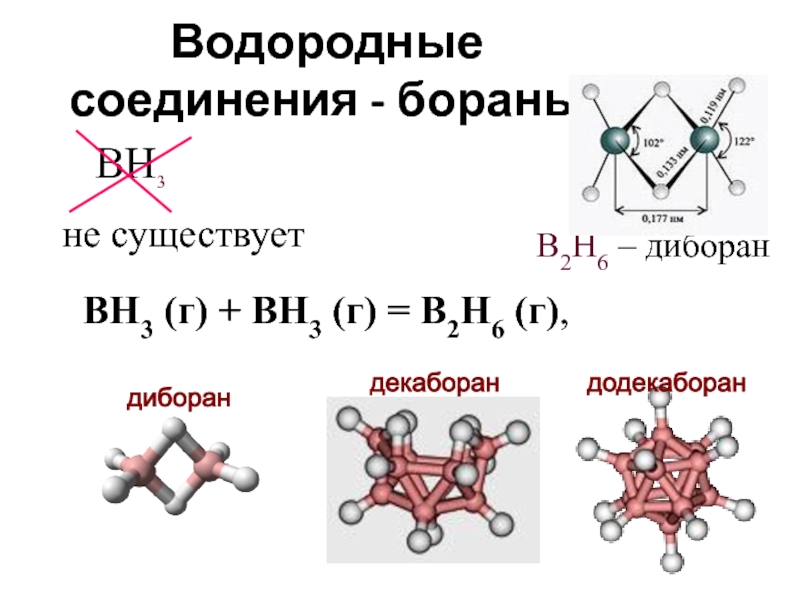
- 18. Водородные соединения - бораны BH3 B2H6
- 19. Бороводороды - химически весьма активны.
- 20. Оксид бора (III) В2O3 Оксид бора (III)
- 22. Ортоборная кислота Ортоборат водорода (в растворе ортоборная
- 23. Строение B(OH)3 и (HBO2)n
- 24. При нейтрализации Н3ВO3 избытком щелочи образуются полибораты,
- 25. Тетраборат натрия Na2B4O7·10H2O (бура) Большинство оксоборатов в
- 26. При прокаливании буры с солями некоторых металлов
- 27. Борная кислота против муравьев эффективна за счет того,
- 28. Ортоборная кислота Н3ВО3 антисептическое средство удобрение
- 29. Алюминий Al 27 +13 0
- 30. Нахождение в природе По распространённости в земной
- 31. AL2O3 Корунд сапфир рубин
- 32. Синий цвет сапфира обусловлен примесями титана и железа в кристаллической решётке Al2O3.
- 33. Физические свойства Мягкий, пластичный (легко вытягивается
- 34. ХИМИЧЕСКИЕ СВОЙСТВА Al – активный
- 36. с
- 37. Взаимодействие со сложными веществами Взаимодействие с водой
- 38. УДАЛЕНИЕ ОКСИДНОЙ ПЛЕНКИ АЛЮМИНИЯ https://www.youtube.com/watch?v=9wnYXTP1OC8
- 39. Алюминий при обычных условиях не взаимодействует с концентрированными H2SO4 и HNO3
- 40. Домашнее задание Подберите коэффициенты методом электронного баланса:
- 41. Гидроксид алюминия Аl(ОН)3 — полимерное соединение. Так,
- 42. При прокаливании гидроксида алюминия А12О3⋅nН2О постепенно теряет
- 43. Современный метод получения алюминия Современный
- 44. ПРИМЕНЕНИЕ АЛЮМИНИЯ В Авиации Военная
- 45. АЛМАГЕЛЬ МААЛОКС Использование соединений алюминия в медицине алюминия гидроксид + магния гидроксид
Слайд 3III группа
Периодической системы
К р-элементам III группы относятся бор, алюминий, галлий,
р- Элементы:
В 1s22s22p1
Al 2s22p63s23p1
Ga 3s23p63d104s24p1
In 4s24p64d105s25p1
Tl 4s24p64d104f145s25p65d106s26p1
Слайд 4Элементы IIIА-группы
Общая электронная формула:
[…] ns 2 (n –1)d 10 np
Степени окисления: 0, +1, +3
Для бора и алюминия характерны соединения только со степенью окисления +3.
(Tl+3 – сильный ок-ль)
Общая характеристика
Слайд 5Элементы IIIA-группы
В отличие от алюминия бор обладает явно неметаллическими свойствами. Эти
Слайд 7Галлий.
Га́ллий мягкий пластичный металл серебристо-белого цвета с синеватым оттенком. Лёгкий металл.
Слайд 9Таллий.
Та́ллий мягкий металл белого цвета с голубоватым оттенком. Относится к группе
Слайд 13Бор
Кристаллы бора черного цвета, тугоплавкие, диамагнитны. В свободном состоянии бор —
Слайд 15Особенности химии бора
Получение:
B2O3 + 6К = 2B(т) + 3К2O
B2H6 = 2B(т)
2BI3 = 2B(т) + 3 I2(г)
https://www.youtube.com/watch?v=tvAWQkdkaFY
Слайд 16В обычных условиях кристаллический бор весьма инертен и непосредственно взаимодействует только
2B + 3F2 = 2BF3
при нагревании (400—700 °С) окисляется кислородом, серой, хлором (и др. галогенами).
4B (т) + 3O2 (г) = 2B2O3 (т),
2B + 3Cl2 = 2BCl3
С водородом бор не взаимодействует.
Слайд 17Взаимодействие со сложными веществами
B + 3HNO3 = B(OH)3 + 3NO2↑
4B +
(сплавление)
Слайд 19Бороводороды
- химически весьма активны.
Так, большинство боранов на воздухе самовоспламеняются
В2Н6 + 3О2 = В2О3 + 3Н2О + Q
Гидриды бора разлагаются водой, спиртами и щелочами с выделением водорода. Наиболее активно гидролизуется диборан:
В2Н6 + 6Н2О = 2Н3ВО3 + 6Н2
Большинство боранов имеет отвратительный запах и очень ядовиты!
Слайд 20Оксид бора (III) В2O3
Оксид бора (III) В2O3 легко переходит в стеклообразное
Как кислотный оксид В2O3 энергично взаимодействует с водой с образованием борной кислоты Н3ВO3.
В2O3 + 3Н2О = 2Н3ВO3
Слайд 22Ортоборная кислота
Ортоборат водорода (в растворе ортоборная кислота).
В твердом состоянии Н3ВО3
Ортоборная кислота — очень слабая, одноосновная. В отличие от обычных кислот ее кислотные свойства обязаны не отщеплению протона, а присоединению ОН--ионов:
B(OH)3 + HOH = [B(OH)4]- + H+
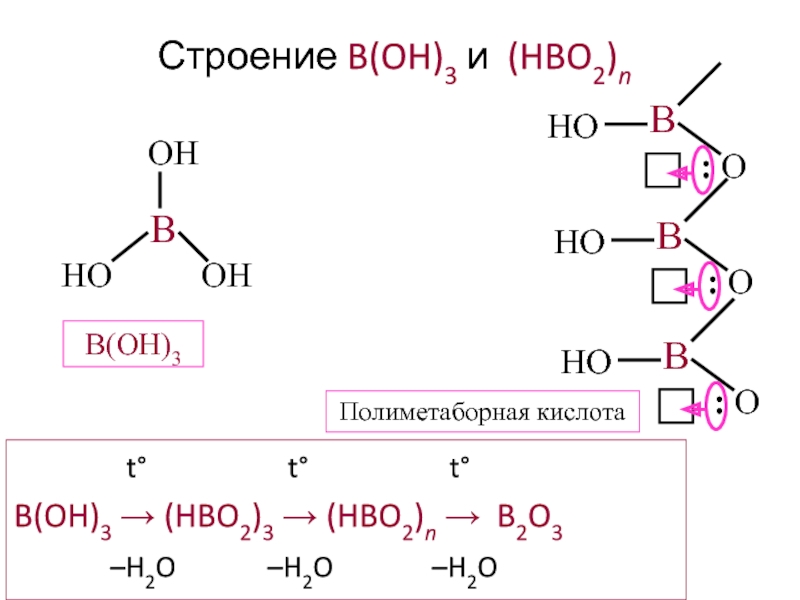
Слайд 23Строение B(OH)3 и (HBO2)n
t°
B(OH)3 → (HBO2)3 → (HBO2)n → B2O3
–H2O –H2O –H2O
B(OH)3
Полиметаборная кислота
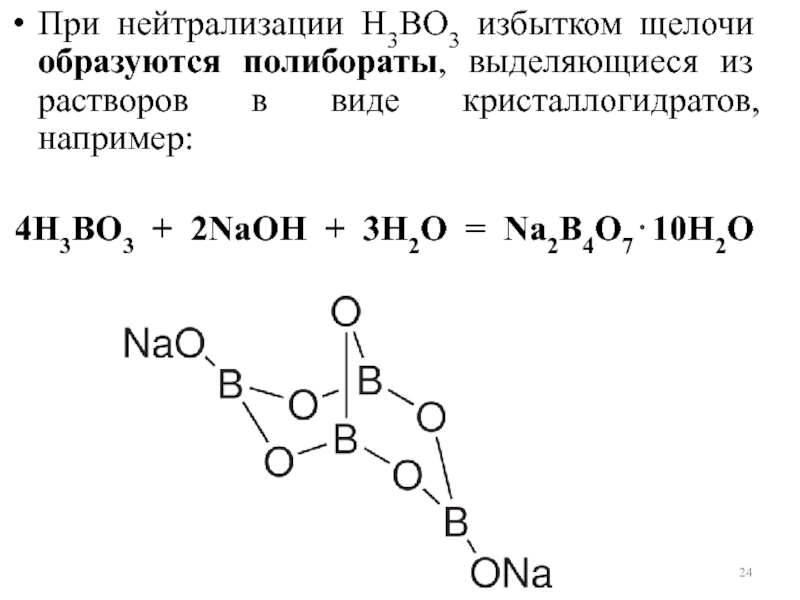
Слайд 24При нейтрализации Н3ВO3 избытком щелочи образуются полибораты, выделяющиеся из растворов в
4Н3ВО3 + 2NаОН + 3Н2O = Nа2В4О7⋅10Н2O
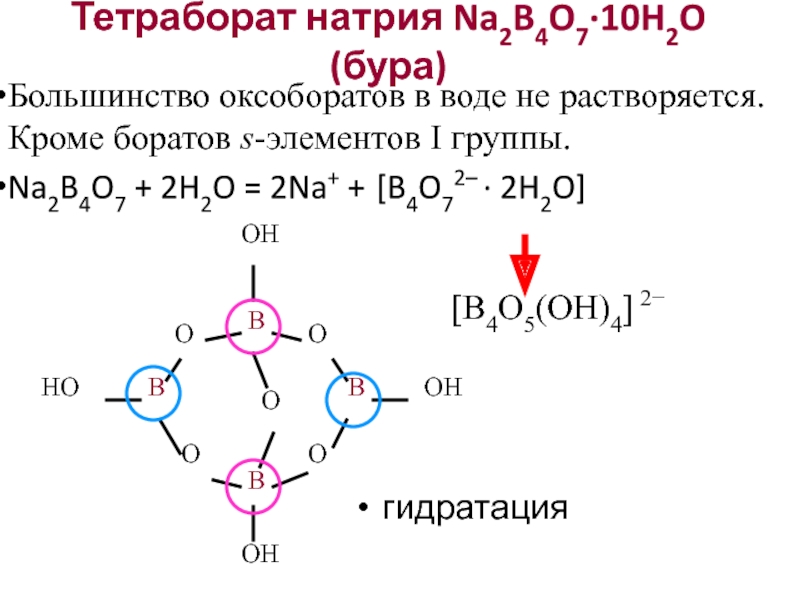
Слайд 25Тетраборат натрия Na2B4O7·10H2O (бура)
Большинство оксоборатов в воде не растворяется. Кроме боратов
Na2B4O7 + 2H2O = 2Na+ + [B4O72– · 2H2O]
гидратация
Слайд 26При прокаливании буры с солями некоторых металлов образуются двойные высокомолекулярные полиметабораты
Тетраборат натрия Na2B4O7·10H2O (бура)
Слайд 27Борная кислота против муравьев
эффективна за счет того, что влияет на работу его
Слайд 30Нахождение в природе
По распространённости в земной коре Земли занимает 1-е место
Боксит - Является основной рудой, из которой извлекают алюминий. Основу камня составляет гидроксид алюминия и глинозем Al2O3(28-80%)
.
Слайд 33Физические свойства
Мягкий, пластичный (легко вытягивается в проволоку и раскатывается в
легкий (с малой плотностью – 2,7 г/см3)
с высокой тепло- и электропроводностью
легкоплавкий (температура плавления 660°C)
серебристо-белый с характерным металлическим блеском
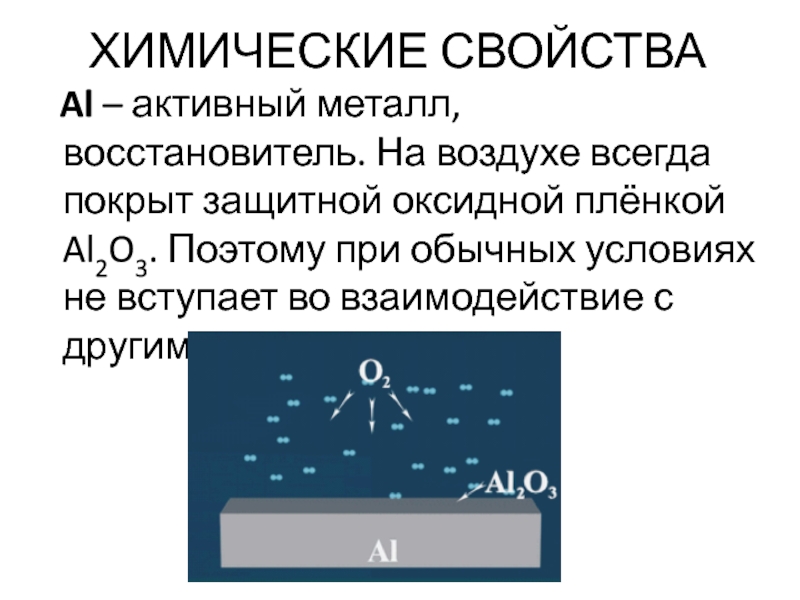
Слайд 34ХИМИЧЕСКИЕ СВОЙСТВА
Al – активный металл, восстановитель. На воздухе всегда
Слайд 36
с серой, образуя сульфид алюминия:
2Al + 3S =
с азотом, образуя нитрид алюминия:
2Al + N2 = 2AlN
с углеродом, образуя карбид алюминия:
4Al + 3С = Al4С3
с хлором, образуя хлорид алюминия:
2Al + 3Cl2 = 2AlCl3
Химические свойства
с кислородом, образуя оксид алюминия:
4Al + 3O2 = 2Al2O3
Взаимодействие с простыми веществами:
Слайд 37Взаимодействие со сложными веществами
Взаимодействие с водой (очищенный от оксидной пленки, например,
2 Al +6H2O=2Al(OH)3 +3H2
Взаимодействует с растворами кислот
2Al +6HCl= 2AlCl3 + 3H2
Взаимодействует с растворами щелочей
2Al+ 2NaOH + 6H2O=2Na[Al(OH)4]+3H2
тетрагидроксоалюминат
натрия
https://www.youtube.com/watch?v=YQF0R6UNE1A
https://www.youtube.com/watch?v=h-1dkeMGiKE
Слайд 40Домашнее задание
Подберите коэффициенты методом электронного баланса:
Al + разб. H2SO4= Al2(SO4)3
Al + разб. HNO3 = Al(NO3)3 + NO2 + H2O
Слайд 41Гидроксид алюминия Аl(ОН)3 — полимерное соединение. Так, природный гидроксид (минерал гидраргиллит)
. Получаемый по обменной реакции гидроксид – студенистый белый осадок.
Аl3+ + 3ОН- = Аl(ОН)3
Состав и структура осадка А12О3⋅nН2О существенно зависят от условий получения и хранения.


![Элементы IIIА-группы Общая электронная формула:[…] ns 2 (n –1)d 10 np 1 Степени окисления: 0,](/img/tmb/5/468855/baf47f9964720d55b8f3304605389e01-800x.jpg)