- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие презентация
Содержание
- 1. Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие
- 2. Обратимые и необратимые химические реакции Химические реакции,
- 3. Химическое равновесие с,
- 5. Принцип Ле-Шателье: «Если
- 6. 1. Концентрация: а)
- 7. В каком направлении сместится химическое равновесие в
Слайд 2Обратимые и необратимые химические реакции
Химические реакции, протекающие в одном направлении, называются
Химические реакции, протекающие при одних и тех же условиях одновременно в двух противоположных направлениях, называются обратимыми.
Слайд 3
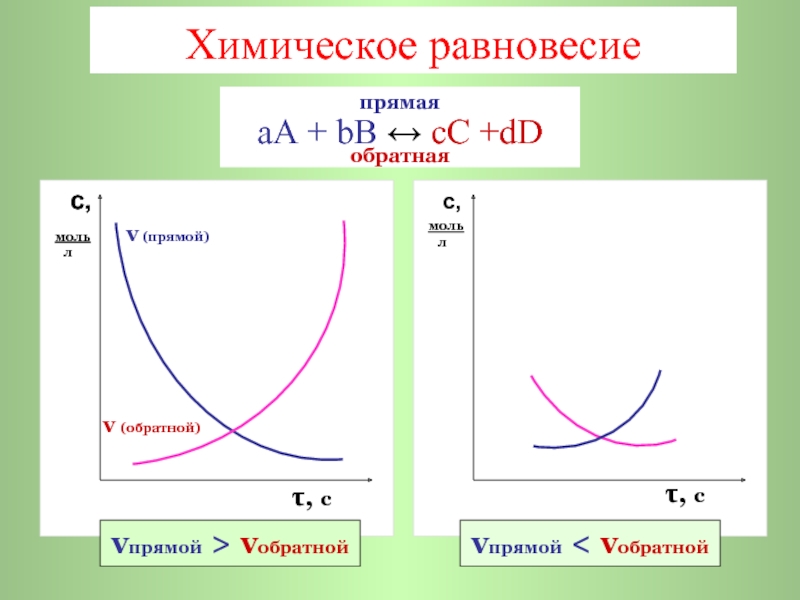
Химическое равновесие
с,
моль v
л
v (обратной)
τ, с
с,
моль
л
τ, с
прямая
аА + bB ↔ cC +dD
обратная
vпрямой > vобратной
vпрямой < vобратной
Слайд 4
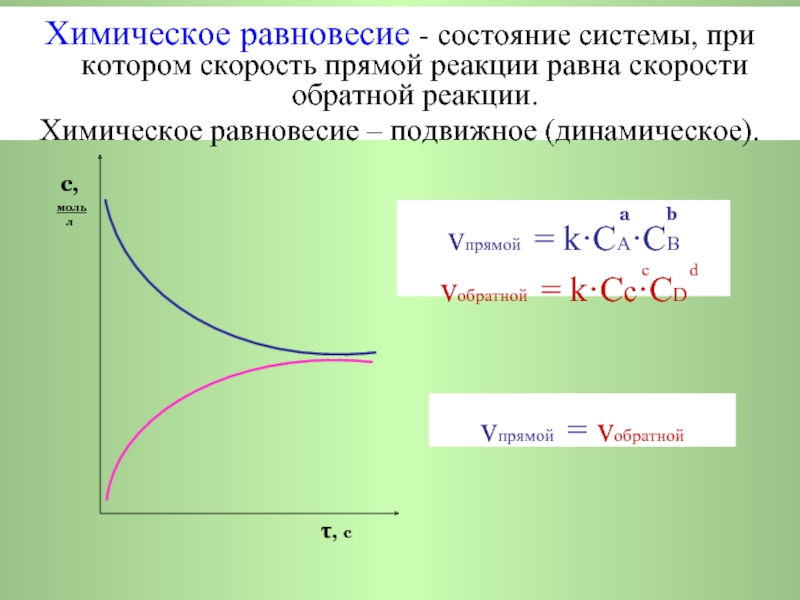
с,
моль
л
τ, с
vпрямой = vобратной
Химическое равновесие - состояние системы, при котором скорость прямой реакции равна скорости обратной реакции.
Химическое равновесие – подвижное (динамическое).
Слайд 5Принцип Ле-Шателье:
«Если на систему, находящуюся в равновесии,
Слайд 6 1. Концентрация:
а) при увеличении концентрации исходных веществ
б) при увеличении концентрации продуктов реакции равновесие смещается в сторону обратной реакции (влево).
2. Температура:
При увеличении температуры равновесие всегда смещается в сторону эндотермической реакции.
3. Давление:
При увеличении давления равновесие смещается в сторону той
реакции, которая приводит к уменьшению объёмов газообразных веществ.
Слайд 7В каком направлении сместится химическое равновесие в системе:
а) SO3(г) ↔ SO2(г)
б) C2H6(г) ↔ C2H4(г) + H2(г) – Q
в) Fe3O4(тв) + CO(г) ↔ Fe(тв) + CO2(г) – Q
г) CH4(г) + S(ж) ↔ CS2(г) + H2S(г) + Q
д) CO2(г) + C(тв) ↔ CO(г) + Q
е) CO(г) + H2O(г) ↔ CO2(г) + H2(г) + Q
ж) С2H4(г) + H2O(ж) ↔ C2H5OH(р-р) + Q
а) при увеличении концентрации реагирующих веществ;
б) при нагревании;
в) при уменьшении давления?