9 класса, МБОУ «Сотниковская СОШ»
Руководитель: Дружинин Виктор Викторович, учитель химии и биологии МБОУ «Сотниковская СОШ»
Место выполнения: Канский район, с. Сотниково, МБОУ «Сотниковская СОШ»
Цель работы- познакомиться с методом решения ОВР с участием органических веществ.
Задачи:
- изучить методы решения ОВР;
- оценить пригодность методов для решения ОВР с участием органических веществ;
- научиться решать ОВР с участием органических веществ.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Методы решения ОВР с участием органических соединений презентация
Содержание
- 1. Методы решения ОВР с участием органических соединений
- 2. Химия- важнейшая наука в жизни человека!
- 3. Химия
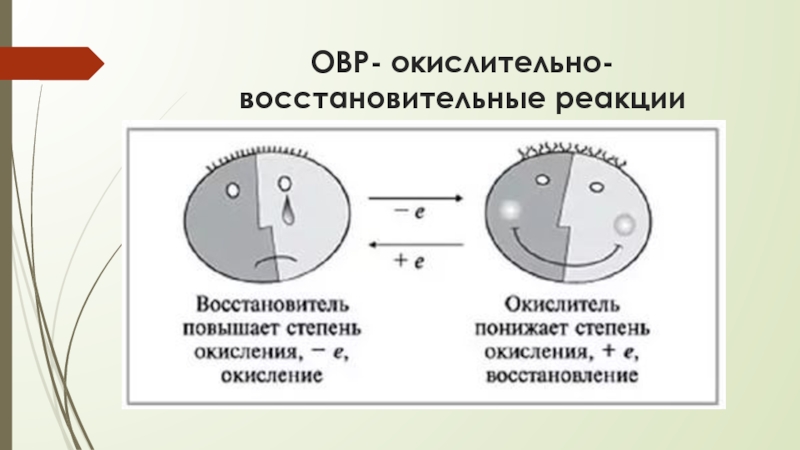
- 4. ОВР- окислительно-восстановительные реакции
- 5. Цель работы- познакомиться с методом решения ОВР
- 6. ОВР
- 7. Способы решения ОВР. Метод ионно-электронного баланcа Метод полуреакций Метод подстановки
- 8. Выводы по работе В ходе работы были
- 9. Пример 1 CH3-CH2-CH=CH2 + KMnO4 + H2O
- 10. Пример 2
- 11. Практическая значимость Эта работа может быть интересна
- 12. Спасибо за внимание!
Слайд 1Методы решения ОВР с участием органических соединений
Выполнил: Морозов Максим Алексеевич, ученик
Слайд 5Цель работы- познакомиться с методом решения ОВР с участием органических веществ.
-
изучить методы решения ОВР;
- оценить пригодность методов для решения ОВР с участием органических веществ;
- научиться решать ОВР с участием органических веществ.
Гипотеза: органические ОВР решаемы на базовом уровне изучения химии.
- оценить пригодность методов для решения ОВР с участием органических веществ;
- научиться решать ОВР с участием органических веществ.
Гипотеза: органические ОВР решаемы на базовом уровне изучения химии.
Слайд 8Выводы по работе
В ходе работы были рассмотрены методы решения ОВР, проанализированы
возможности решения с их помощью реакций с участием органических веществ.
Наиболее подходящим способом оказался метод макроподстановки. Метод этот довольно сложный, но
позволяет решать ОВР с участием органических соединений с использованием базовых знаний химии и математики.
Наиболее подходящим способом оказался метод макроподстановки. Метод этот довольно сложный, но
позволяет решать ОВР с участием органических соединений с использованием базовых знаний химии и математики.
Слайд 9Пример 1
CH3-CH2-CH=CH2 + KMnO4 + H2O = С2Н5-СООК + MnO2 +
KOH+ КНСО3
С -1 – 4е =С+3
С -2 – 6е = С+4 10 3 восстановитель Окисление
Mn+7 + 3е = Mn+4 10 окислитель Восстановление
3CH3-CH2-CH=CH2 + 10KMnO4 + H2O = 3С2Н5-СООК + 10MnO2 + KOH+ 3КНСО3
3CH3-CH2-CH=CH2 + 10KMnO4 + H2O = 3С2Н5-СООК + 10MnO2 + 4KOH+ 3КНСО3
4KOH+ 3КНСО3 = 3К2СО3 + КOH + 3H2O
3СН3-СН2-СН=СН2 + 10KMnO4 + Н2О = 3С2Н5-СООК + 10MnO2 + 4KOH + 3К2СО3
Проверка:
3СН3-СН2-СН=СН2 + 10KMnO4 = 3С2Н5-СООК + 10MnO2 + 4KOH + 3К2СО3 + 4Н2О
С -1 – 4е =С+3
С -2 – 6е = С+4 10 3 восстановитель Окисление
Mn+7 + 3е = Mn+4 10 окислитель Восстановление
3CH3-CH2-CH=CH2 + 10KMnO4 + H2O = 3С2Н5-СООК + 10MnO2 + KOH+ 3КНСО3
3CH3-CH2-CH=CH2 + 10KMnO4 + H2O = 3С2Н5-СООК + 10MnO2 + 4KOH+ 3КНСО3
4KOH+ 3КНСО3 = 3К2СО3 + КOH + 3H2O
3СН3-СН2-СН=СН2 + 10KMnO4 + Н2О = 3С2Н5-СООК + 10MnO2 + 4KOH + 3К2СО3
Проверка:
3СН3-СН2-СН=СН2 + 10KMnO4 = 3С2Н5-СООК + 10MnO2 + 4KOH + 3К2СО3 + 4Н2О
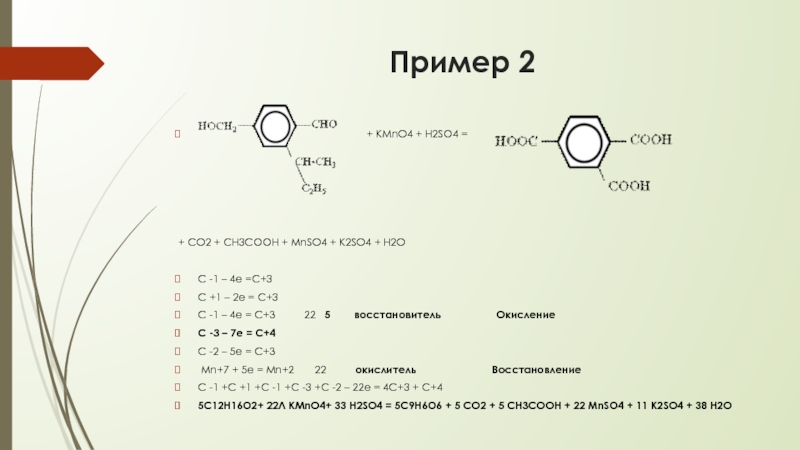
Слайд 10Пример 2
+ KMnO4 + H2SO4 =
+ CO2 + CH3COOH + MnSO4 + K2SO4 + H2O
С -1 – 4е =С+3
С +1 – 2е = С+3
С -1 – 4е = С+3 22 5 восстановитель Окисление
С -3 – 7е = С+4
С -2 – 5е = С+3
Mn+7 + 5е = Mn+2 22 окислитель Восстановление
С -1 +С +1 +С -1 +С -3 +С -2 – 22е = 4С+3 + С+4
5С12Н16О2+ 22Л KMnO4+ 33 H2SO4 = 5С9Н6О6 + 5 CO2 + 5 CH3COOH + 22 MnSO4 + 11 K2SO4 + 38 Н2О
+ CO2 + CH3COOH + MnSO4 + K2SO4 + H2O
С -1 – 4е =С+3
С +1 – 2е = С+3
С -1 – 4е = С+3 22 5 восстановитель Окисление
С -3 – 7е = С+4
С -2 – 5е = С+3
Mn+7 + 5е = Mn+2 22 окислитель Восстановление
С -1 +С +1 +С -1 +С -3 +С -2 – 22е = 4С+3 + С+4
5С12Н16О2+ 22Л KMnO4+ 33 H2SO4 = 5С9Н6О6 + 5 CO2 + 5 CH3COOH + 22 MnSO4 + 11 K2SO4 + 38 Н2О
Слайд 11Практическая значимость
Эта работа может быть интересна ученикам, собирающимся сдавать ЕГЭ по
химии и (или) готовящимся к олимпиадам и конкурсам, а также их преподавателям.