- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Металлы.Положение в ПСХЭ Д.И.Менделеева и строение атома презентация
Содержание
- 1. Металлы.Положение в ПСХЭ Д.И.Менделеева и строение атома
- 2. Происхождение слова «металл» Слово «металл»
- 3. 92 элемента из 114 известных - МЕТАЛЛЫ
- 4. ЭЛЕКТРОННОЕ СТРОЕНИЕ МЕТАЛЛОВ s – элементы :
- 5. ЗАДАНИЕ: Напишите электронные формулы
- 6. ИЗМЕНЕНИЕ СВОЙСТВ В главной подгруппе:
- 7. 1) В ряду химических элементов Li
- 8. 3) Наиболее ярко выражены металлические свойства у
- 9. 5. Наименьший радиус имеет атом элемента кальция
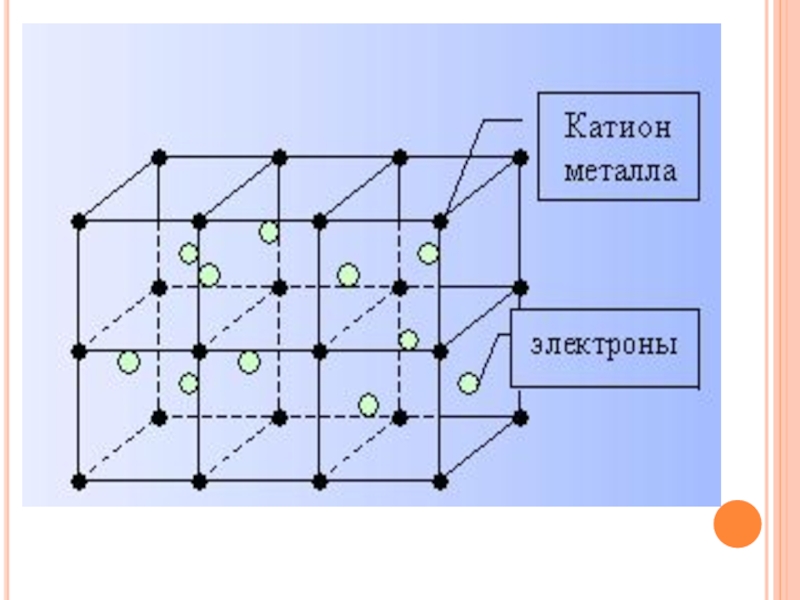
- 10. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ И КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ
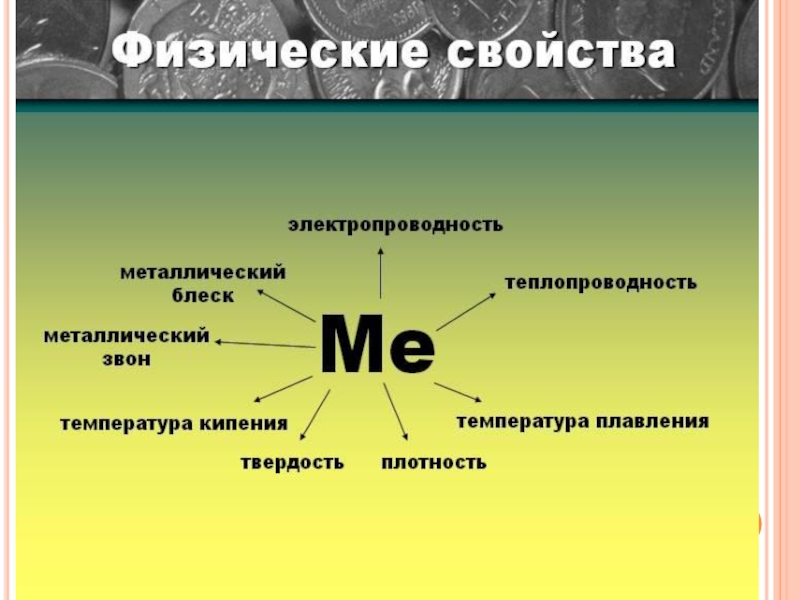
- 12. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
- 13. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ алюминий барий калий 1.Агрегатное
- 14. б) жидкие ртуть
- 15. 2. Тяжелые
- 17. Какие физические свойства зависят от металлической связи
- 18. Электроны перемещаются по всему кристаллу,
- 19. Na, K, Li - 1 валентный электрон
- 20. ЗАГАДКА Название металла? НАТРИЙ БАРИЙ
- 21. ЗАГАДКИ Он в теченье многих лет был
- 22. 1.Какие частицы находятся в узлах кристаллической
- 23. 5. Что обеспечивает металлам высокую
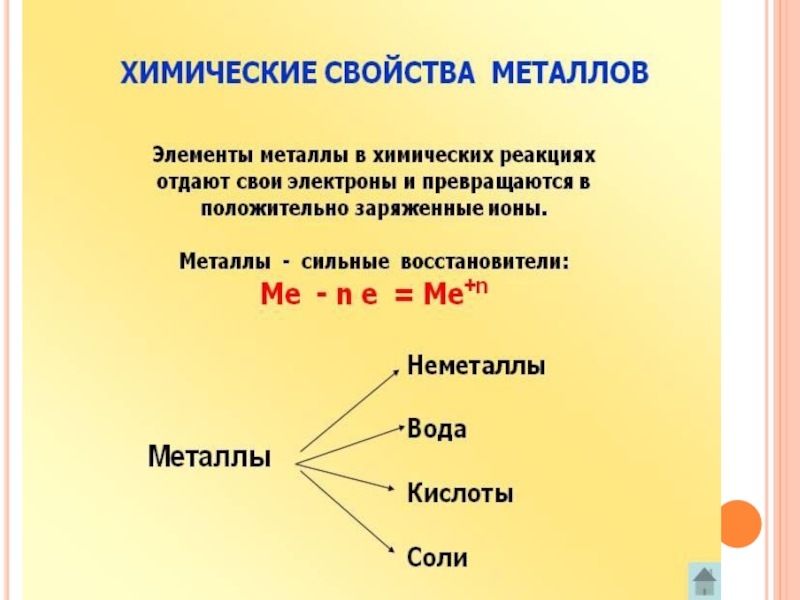
- 24. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
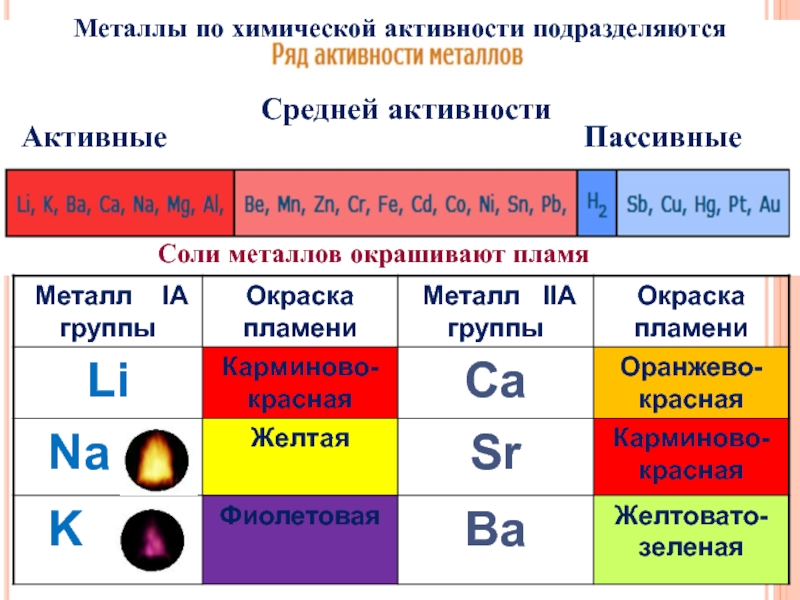
- 26. Активные Средней активности Пассивные Соли металлов окрашивают пламя Металлы по химической активности подразделяются
- 27. Какие металлы более активные? Каждый предыдущий активнее
- 28. С кислотами реагируют только металлы, стоящие
- 29. Металлы взаимодействуют с водой
- 30. Zn + H₂O = ZnO +
- 31. Металлы реагируют с растворами кислот
- 32. Реакции с азотной кислотой: Cu + HNO₃
- 33. Итоги: «свойства металлов» Металлы реагируют
- 34. ТЕСТ 1. Какой металл никогда не вытесняет
- 35. 5. Между какими веществами возможна химическая реакция:
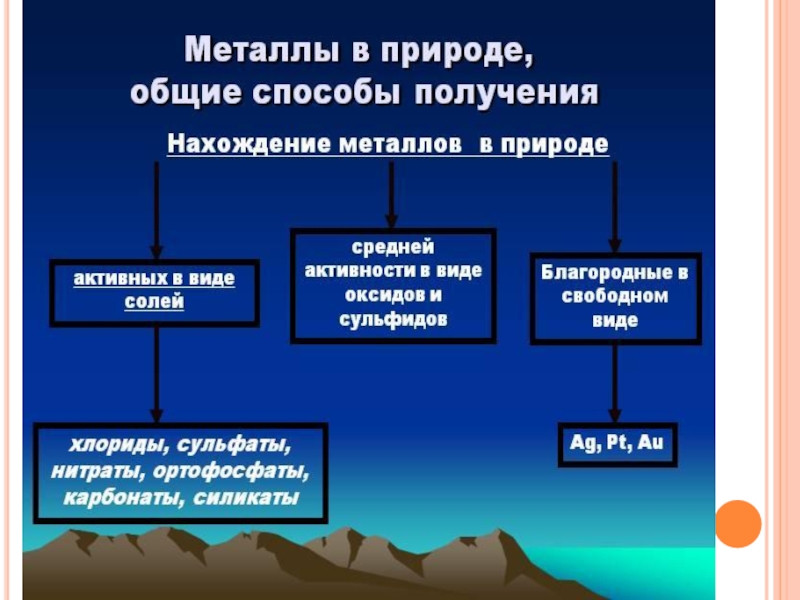
- 36. НАХОЖДЕНИЕ МЕТАЛЛОВ В ПРИРОДЕ И ПОЛУЧЕНИЕ
- 40. МЕТОДЫ ПОЛУЧЕНИЯ МЕТАЛЛОВ Пирометаллургия - восстановление металлов
- 41. 2. Гидрометаллургия – это восстановление металлов
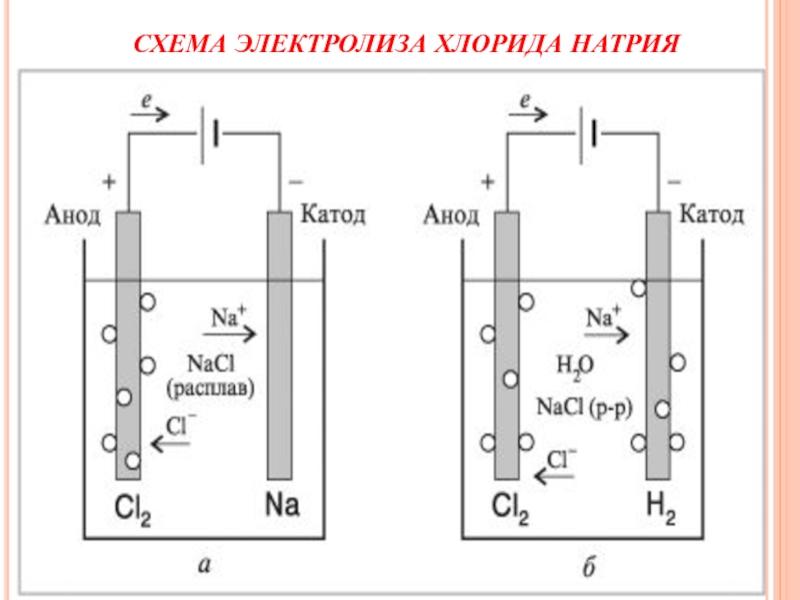
- 42. СХЕМА ЭЛЕКТРОЛИЗА ХЛОРИДА НАТРИЯ
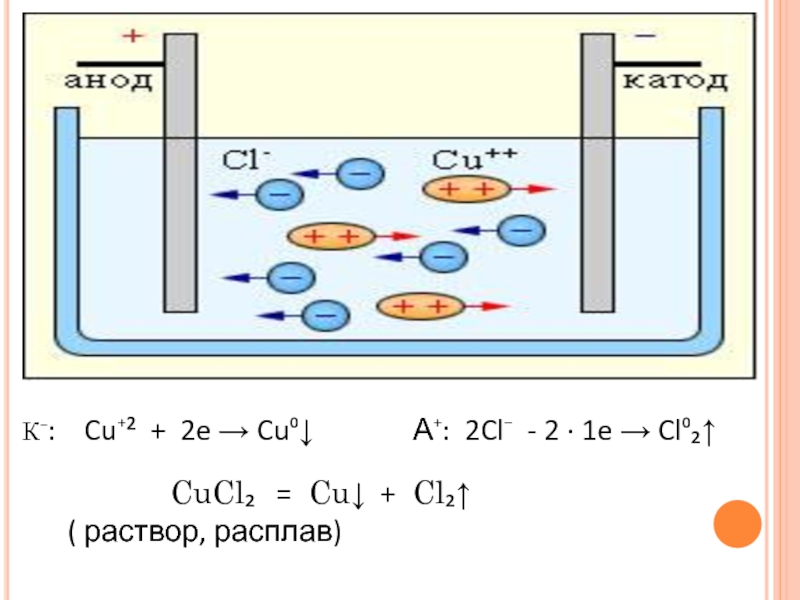
- 44. К⁻: Cu⁺² + 2e →
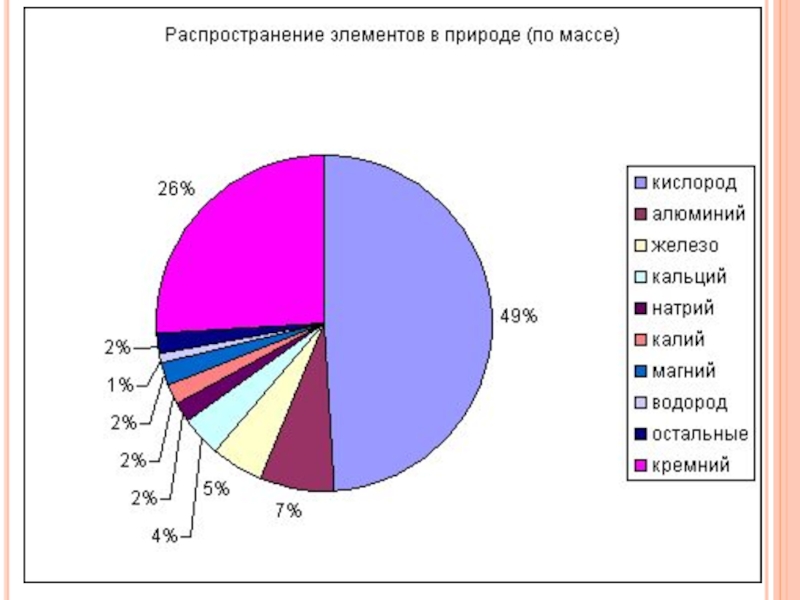
- 45. 1.Какой металл является самым распространенным в
- 46. As, B, ? ,
- 47. натрий магний никель
Слайд 1МЕТАЛЛЫ
Положение в ПСХЭ Д.И.Менделеева и строение атома.
Изменение свойств в
Химическая связь и кристаллическое строение.
Слайд 2Происхождение слова «металл»
Слово «металл» заимствовано из немецкого языка в
М.В. Ломоносова.
Немецкое слово «metall» заимствовано из латинского языка, где «metallum» – «рудник, металл». Латинское в свою очередь заимствовано из греческого языка (μεταλλον – «рудник, копь»)
Слайд 392 элемента из 114 известных - МЕТАЛЛЫ
МЕТАЛЛЫ -
это химические элементы,
отдают электроны внешнего ( предвнешнего)
электронного слоя, превращаясь в положительные
ионы.
Na⁰ - 1e → Na⁺ Mg⁰ - 2e → Mg⁺²
ПРИЧИНА: положение металлов в ПСХЭ
сравнительно большие радиусы атомов
малое число электронов на внешнем слое
Слайд 4ЭЛЕКТРОННОЕ СТРОЕНИЕ МЕТАЛЛОВ
s – элементы : Na 1s²2s²2p⁶3s¹
2. p – элементы: Al 1s²2s²2p⁶3s²3p¹
3. d - элементы: Fe 1s²2s²2p⁶3s²3p⁶4s² 3d⁶
4. f - элементы: La ……. 5d¹6s²
Слайд 5ЗАДАНИЕ:
Напишите электронные формулы
лития
калия
хрома
Li 1s²2s¹
K 1s²2s²2p⁶3s²3p⁶4s¹
Cr
Слайд 6ИЗМЕНЕНИЕ СВОЙСТВ
В главной подгруппе:
число электронов на внешнем - заряды ядер атомов
слое не изменяется увеличиваются
- радиус атома увеличивается - число электронов на
внешнем слое
увеличивается
- ЭО уменьшается - ЭО увеличивается
восстановительные свойства - восстановительные
усиливаются уменьшаются
металлические свойства - металлические
усиливаются ослабевают
( с увеличением порядкового номера элемента)
Слайд 71) В ряду химических элементов Li – Na – K
металлические свойства а) усиливаются б) не изменяются в) ослабевают г) изменяются периодически
2) Усиление металлических свойств элементов в
А-группах периодической системы с увеличением
порядкового номера обусловлено:
а) увеличением атомной массы элементов
б) увеличением общего числа электронов в) увеличением атомного радиуса элемента
г) увеличением номера периода
ОТВЕТ: а
ОТВЕТ: в
Слайд 83) Наиболее ярко выражены металлические свойства у вещества с электронной формулой:
4) Наиболее активный металл:
а) 1s²2s²2p⁶3s¹ б) 1s²2s¹
в) 1s²2s²2p⁶3s²3p¹ г) 1s²2s²2p⁶3s²3p⁶4s¹
ОТВЕТ: в
ОТВЕТ: г
Слайд 95. Наименьший радиус имеет атом элемента
кальция
3) бария 4) радия
6. Символ и формула высшего оксида элемента, электронная формула внешнего и пред внешнего энергетических уровней атома которого …..3s23p63d54s1:
1) Cr и CrO3 2) K и K2O
3) Mn и Mn2O7 4) Se и SeO3
7. Металл М образует высший оксид состава М2О3. Электронная формула валентного энергетического уровня атома М
ns2np1 2) ns2np2
3) ns2np3 4) ns2np5
ОТВЕТ: 5 - 1 6 - 2 7 - 1
Слайд 152. Тяжелые и
( 5 г/см³)
Os : 22,5 г/ см³ Li : 0,53 г/см³
Легкоплавкие и тугоплавкие
( 1000⁰С)
Ga: 30⁰С, Cs: 28,6⁰С W : 3410⁰С
Мягкие и твердые
Na, K, Pb Cr, Ti, Mo
Слайд 17Какие физические свойства зависят от металлической
связи и типа кристаллической решетки?
металлический
пластичность
электропроводность
теплопроводность
плотность
температура плавления
твердость
ВОПРОСЫ:
почему металлы пластичны?
почему металлы имеют блеск?
почему высока электро- и теплопроводность?
почему механическая прочность, плотность и
температура плавления сильно отличаются?
Слайд 18Электроны перемещаются по всему кристаллу,
поэтому разрыв связей
происходит.
2. Электроны отражают световые лучи.
3. Под воздействием приложенного электрического
напряжения хаотически движущиеся электроны
приобретают направленное движение ( эл.ток).
Подвижные свободные электроны, сталкиваясь с
колеблющимися атом-ионами, обмениваются с ними
энергией.
С увеличением числа электронов, связывающих атом-ионы и уменьшением межатомного расстояния в кристаллах показатели механической прочности, плотности, температуры плавления возрастают.
Слайд 19Na, K, Li - 1 валентный электрон - мягкие, легкие,
W - 5 валентных электронов - твердый, тугоплавкий,
тяжелый.
Слайд 21ЗАГАДКИ
Он в теченье многих лет был причиной многих бед
Был металл серебристо-белым,
мелом.
Красит пламя в желтый цвет, в воду кинь – его уж
нет.
К восьмой группе отнесен, в честь России назван он.
«Камнем» назван он людьми, но попробуй-ка
возьми.
Из него солдатик твой, не болеет он « чумой».
(Золото)
(Кальций)
(Натрий)
(Рутений)
. (Литий)
(Олово)
Слайд 221.Какие частицы находятся в узлах кристаллической
решетки металлов?
в) катионы и нейтральные атомы г) анионы и катионы
2.Какой металл наименее электропроводен?
а) W б)Zn в)Сг
3. У какого металла наибольшая плотность? а)платина б)вольфрам в)железо г)свинец
4.Какой металл самый легкий?
а)калий б)олово в)алюминий г)медь
ОТВЕТ: 1 - В 2 - В 3 - Г 4 - А
Слайд 235. Что обеспечивает металлам высокую электропроводность?
а) атомы металлов б) катионы металлов в) свободные электроны
г) катионы металлов и свободные электроны
6. Чем обусловлена ковкость металлов?
а) мягкостью металлов б) наличием электронного газа
в) несвязанностью ионов между собой
г) наличием в кристаллической решетке катионов металлов
7. Какой из металлов наиболее твердый?
а) титан в) никель
б) цинк г) хром
ОТВЕТ: 5 - В 6 - Б 7 - Г
Слайд 26Активные
Средней активности
Пассивные
Соли металлов окрашивают пламя
Металлы по химической активности подразделяются
Слайд 27Какие металлы более активные?
Каждый предыдущий активнее последующего в ряду активности металлов
Каждый
Вытесняются активными металлами
Слайд 28 С кислотами реагируют только металлы, стоящие в ряду активности металлов
Все ли металлы реагируют с кислотами?
реагируют
не реагируют
Все ли металлы реагируют с водой?
Без нагревания с образованием щелочей и вытеснением водорода
При нагревании с образованием оксидов и вытеснением водорода
не реагируют
Слайд 29 Металлы взаимодействуют с водой
Металлы реагируют с неметаллами
2Mg +
Оксид магния основный
Реакция окисления, соединения, ОВР
Mg – восстановитель, кислород-окислитель
3Br2+ 2Al→2AlBr3
бромид алюминия - соль
Реакция соединения, ОВР
Al – восстановитель, бром-окислитель
2Na + 2H2O→2NaOH+ H2↑
гидроксид натрия
Реакция замещения, ОВР
Na – восстановитель, катион водород-окислитель
Металлы реагируют с кислородом
Слайд 30Zn + H₂O = ZnO + H₂
Реакция ОВР, атомы цинка - восстановители, ионы водорода - окислители
Реакция замещения.
МЕТАЛЛЫ РЕАГИРУЮТ С СОЛЯМИ
Fe + CuSO₄ = FeSO₄ + Cu
Реакция ОВР, атомы железа - восстановители, ионы меди - окислители
Слайд 31Металлы реагируют с растворами кислот
Mg + 2
ОВР, атомы магния - восстановители; ионы водорода
- окислители
Cu + HCl ≠
Концентрированная серная кислота:
Zn + H₂SO₄ = ZnSO₄ + H₂O + S↓
составьте электронный баланс, какой
коэффициент у окислителя?
Сu + 2H₂SO₄ = CuSO₄ + 2H₂O + SO₂↑
Слайд 32Реакции с азотной кислотой:
Cu + HNO₃ → Cu(NO₃)₂ + H₂O +
какой коэффициент у восстановителя?
Слайд 33Итоги: «свойства металлов»
Металлы реагируют с
1. С неметаллами с образованием
2. С водой (металлы стоящие до водорода)
3. С кислотами (металлы стоящие до водорода)
5. С солями менее активных металлов
6. С кислородом с образованием основных оксидов
Слайд 34ТЕСТ
1. Какой металл никогда не вытесняет водород из воды?
а) алюминий
2. С какими растворами солей будут взаимодействовать металлы?
а) Al+ Hg(NO3 )2 б) Zn+Na2SO4
в) Mg+KNO3 г) Сu+ FeCl3
3. Какой металл не вытесняет водород из кислот?
а) железо б) платина в) свинец г) цинк
4. Между раствором какой соли и металлом произойдет
химическая реакция?
а) алюминий + нитрат калия б) железо + хлорид меди(II)
в) золото + нитрат серебра г) цинк + нитрат натрия
ОТВЕТ: 1 - Г 2 - А 3 - Б 4 - Б
Слайд 355. Между какими веществами возможна химическая реакция:
а) медью и водой
в) золотом и водородом г) железом и хлоридом натрия
6. Установите соответствие:
ОТВЕТ: 5 - б ; 6: А – 3, Б - 1, В - 2, Г - 4
Слайд 40МЕТОДЫ ПОЛУЧЕНИЯ МЕТАЛЛОВ
Пирометаллургия - восстановление металлов из
с помощью C, CO, H₂, Al, Mg
SnO₂ + 2C = Sn + 2CO↑ } из ОКСИДОВ
Cu₂O + C = 2Cu + CO↑
CuO + H₂↑ = Cu + H₂O
a) 2ZnS + 3O₂ = 2ZnO + 2SO₂↑ } из
б) ZnO + C = Zn + CO↑ СУЛЬФИДОВ
Металлотермия: TiO₂ + 2Mg = Ti + 2MgO
3MnO₂ + 4Al = 3Mn + 2Al₂O₃
Слайд 412. Гидрометаллургия – это восстановление металлов
а) получение раствора соли
б) используют более активный металл или электролиз
а) CuO + H₂SO₄ = CuSO₄ + H₂O
б) CuSO₄ + Fe = Cu + FeSO₄
или электролизом
Так получают Zn, Ag, Mo, Au, U
3.Электрометаллургия - восстановление металлов
в процессе электролиза растворов
или расплавов их соединений
Слайд 451.Какой металл является самым распространенным в
земной коре?
а) медь
2.Какие металлы встречаются в природе только в виде
соединений?
а) серебро, магний б) натрий, калий в) ртуть, медь
3. Укажите промышленный способ получения натрия:
а) восстановление металла из оксида
б) электролиз расплава оксида
в) электролиз раствора хлорида натрия
г) электролиз расплава хлорида натрия
ОТВЕТ: 1 - б 2 - б 3 - г