- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Материаловедение. Основы металловедения презентация
Содержание
- 1. Материаловедение. Основы металловедения
- 2. Основы металловедения Свойства металлов Основы кристаллизации металлов
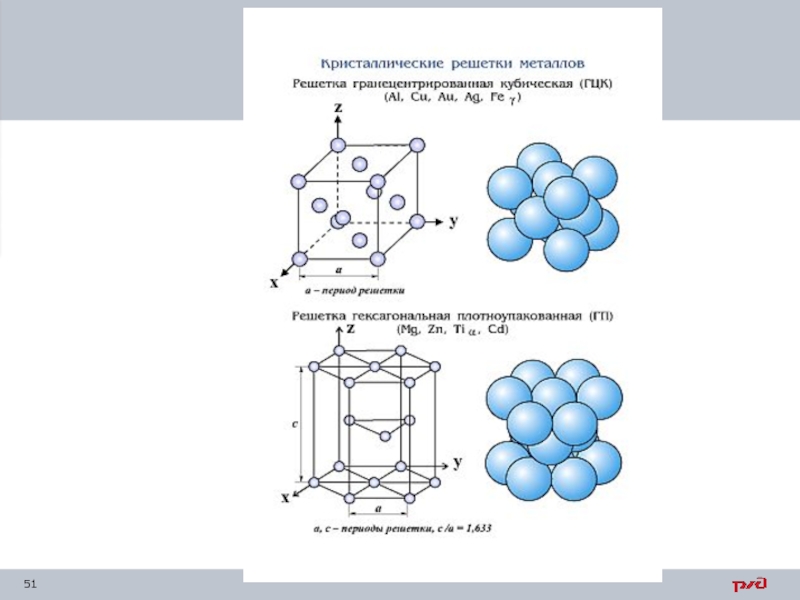
- 3. Основы металловедения
- 4. Материаловедение – это наука, изучающая связь между
- 5. Материаловедением называют прикладную науку о связи состава,
- 7. Положение металлов в Периодической системе химических элементов
- 8. Положение металлов в П.С. Если в
- 9. Металлы в природе Самым распространенным металлом
- 10. Металлы в природе Самородок платины Самородок серебра Самородок золота нефелин
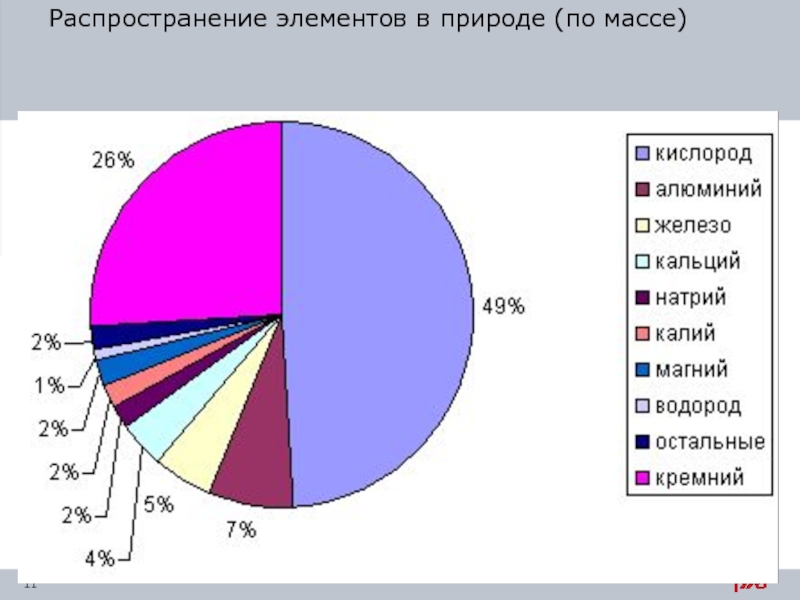
- 11. Распространение элементов в природе (по массе)
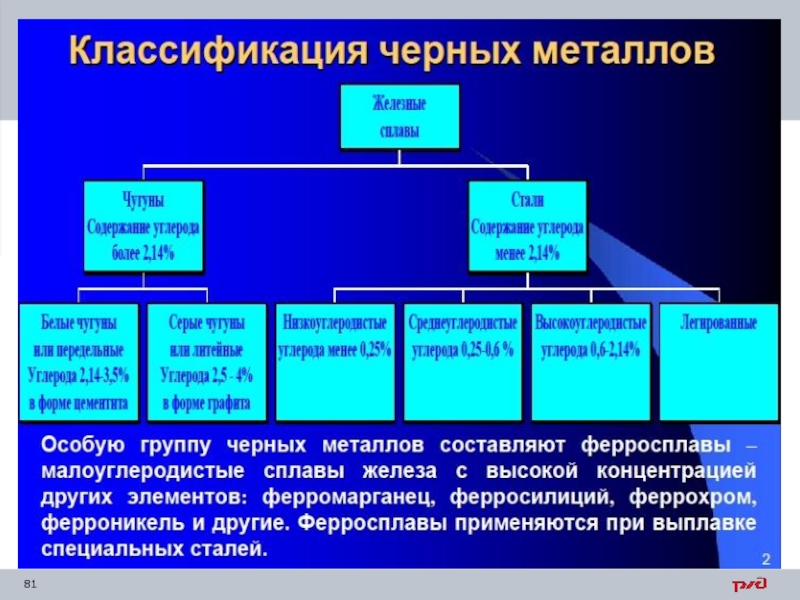
- 12. Классификация металлов В технике кроме чистых металлов,
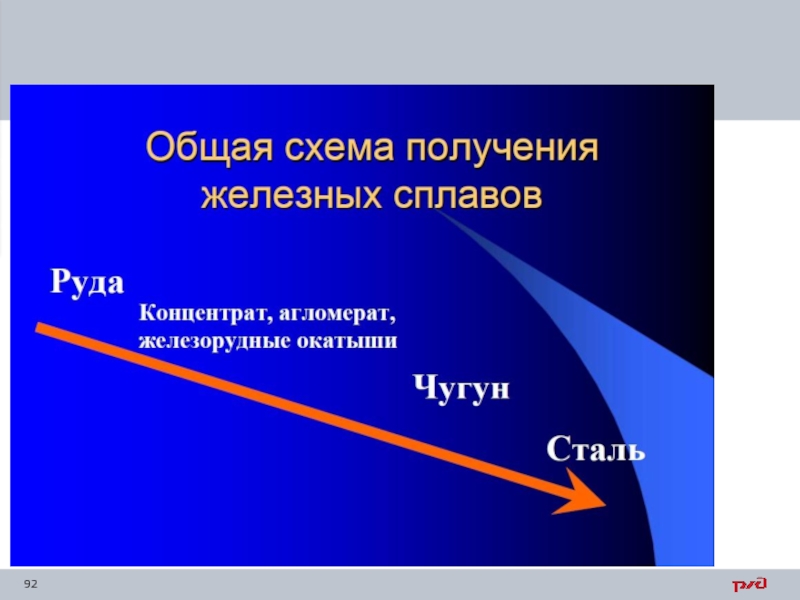
- 13. Черные сплавы Чугун Сталь
- 14. Цветные сплавы Бронза Латунь Мельхиор Дюралюминий
- 15. Все металлы условно поделены на черные и
- 16. Признаки металлов Пластичность Электропроводность Теплопроводность Металлический блеск
- 17. Электронное строение металлов Общность свойств металлов определяется
- 18. Электронное строение металлов Свободные электроны являются переносчиками
- 19. Свойства металлов
- 20. Свойства металлов Физические
- 21. Физические свойства – материал проявляет под действием
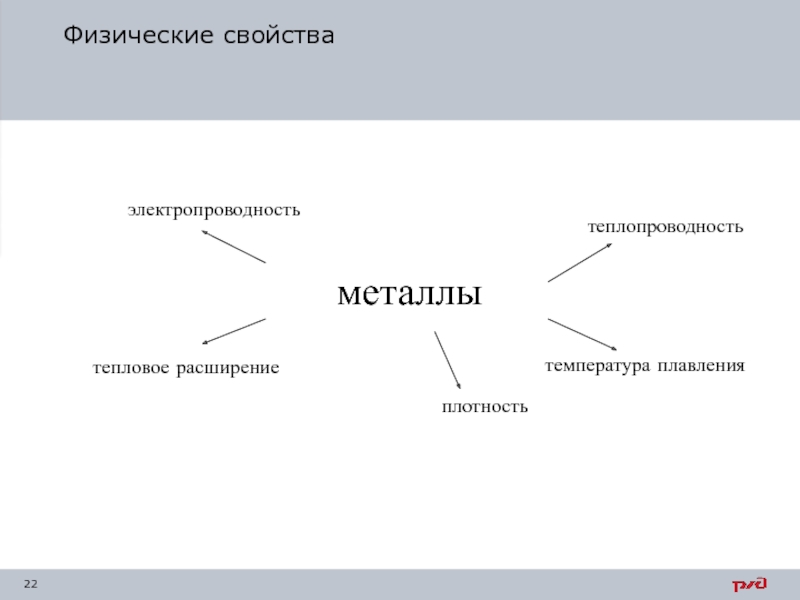
- 22. Физические свойства
- 23. Основные физические свойства Плотность – это масса
- 24. Основные физические свойства Температура плавления является
- 25. Основные физические свойства Температура плавления Плотность металлов
- 26. Основные физические свойства Теплопроводность обусловлена
- 27. Основные физические свойства Электропроводность связана с направленным
- 28. Основные физические свойства Тепловое расширение – свойство
- 29. Химические свойства
- 30. Виды коррозии По характеру изменения поверхности металла
- 31. Химические свойства Химический состав. Он определяет фазовый
- 33. Электрохимическая коррозия развивается в жидких электролитах –
- 34. Методы борьбы с коррозией
- 35. Защита металлов от коррозии Меры борьбы с
- 36. Механические свойства Механические свойства металлов определяют
- 37. Механические свойства Для определения механических свойств
- 38. Твердость по Бринеллю (ГОСТ 9012–59) Сущность
- 40. Твердость по Роквеллу (ГОСТ 9013–59) Твердость
- 42. Испытание на усталость. Рессоры, шейки осей
- 43. Технологические свойства Технологические свойства –обрабатываемость резанием,
- 44. Структура металлов Простейшим способом выявления структуры
- 45. Исследование излома металлов
- 46. Технологические пробы. Для определения способности металла принимать
- 47. Основы кристаллизации металлов
- 48. Различают аморфное и кристаллическое
- 49. Элементарная кристаллическая решетка Наименьший объем кристалла,
- 52. Кристаллизация Любое вещество может находиться в трех
- 53. Первичная кристаллизация Первичная кристаллизация – это переход
- 54. Процесс кристаллизации чистого металла: До точки 1
- 55. Центры кристаллизации образуются независимо друг от друга
- 56. Если металл охлаждать медленно, кристаллизация наступает вовремя,
- 57. Условия получения мелкозернистой структуры Стремятся к
- 58. Первичная кристаллизация Первичная кристаллизация.
- 59. Чем больше степень переохлаждения (ΔТ), тем больше
- 60. Строение металлического слитка.
- 61. Строение металлического слитка Результаты кристаллизации - на
- 62. Структура металлического слитка Результаты кристаллизации - на
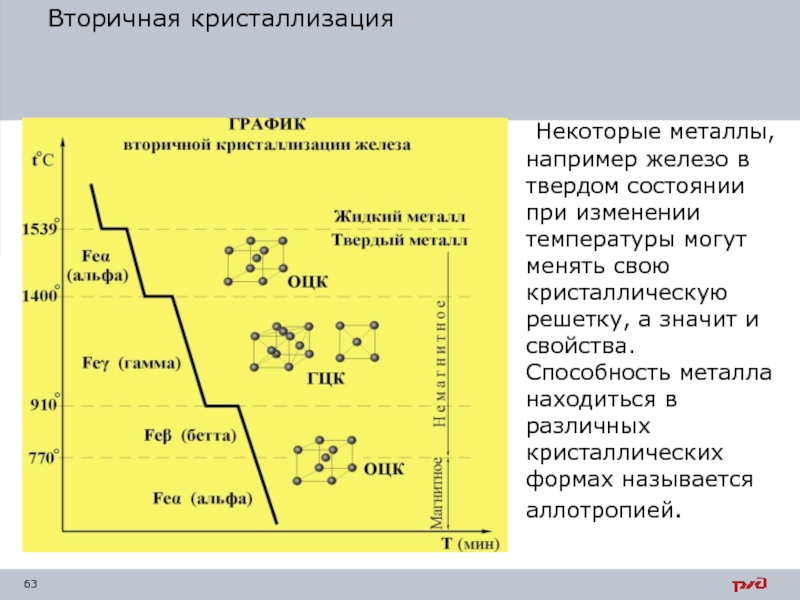
- 63. Вторичная кристаллизация Некоторые металлы, например железо в
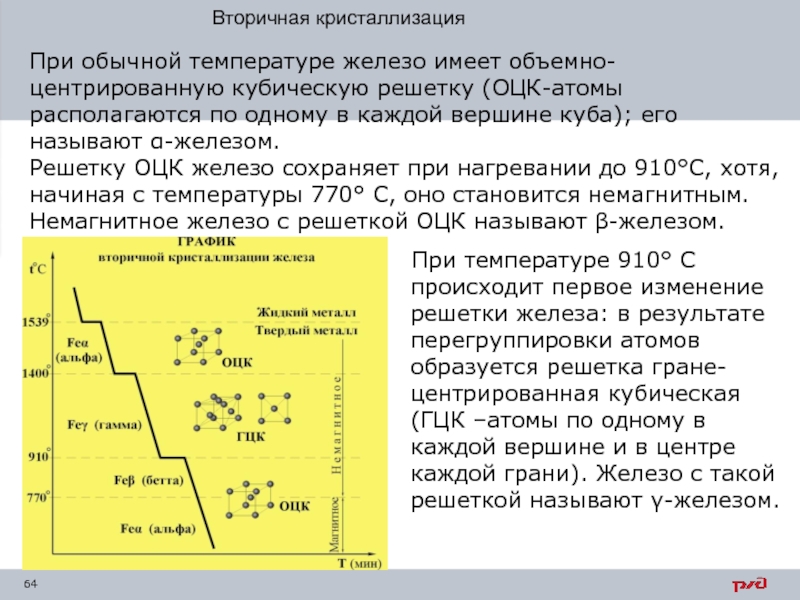
- 64. При обычной температуре железо имеет объемно-центрированную кубическую
- 65. Второе аллотропическое превращение происходит при температуре 1400°
- 66. Основы теории сплавов
- 67. Сплавы Сплавы обладают такими свойствами, которые
- 68. Строение сплавов Металлическими сплавами называют вещества,
- 69. Получение сплавов: Сплавлением, т.е. соединением компонентов сплавов
- 70. СПЕКАНИЕ, в технике
- 71. Основы теории сплавов Однородная часть
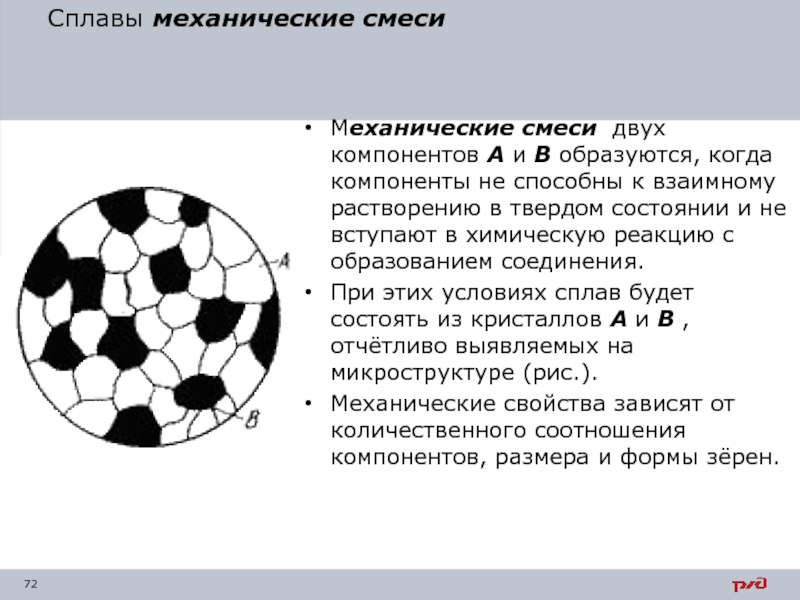
- 72. Сплавы механические смеси Механические смеси двух компонентов
- 73. Сплавы химические соединения Сплавы химические соединения
- 74. Сплавы твёрдые растворы В жидком состоянии большинство
- 75. Замещение Внедрение Вычитание Типы твердых
- 76. Твердые растворы замещения В растворах замещения
- 77. Твердые растворы внедрения Твердые растворы
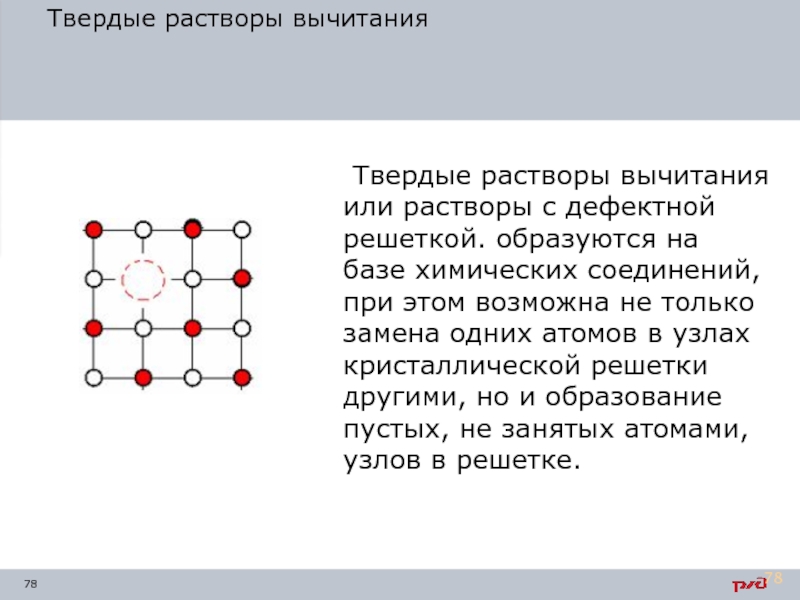
- 78. Твердые растворы вычитания Твердые растворы вычитания
- 79. Основные типы твердых растворов 1
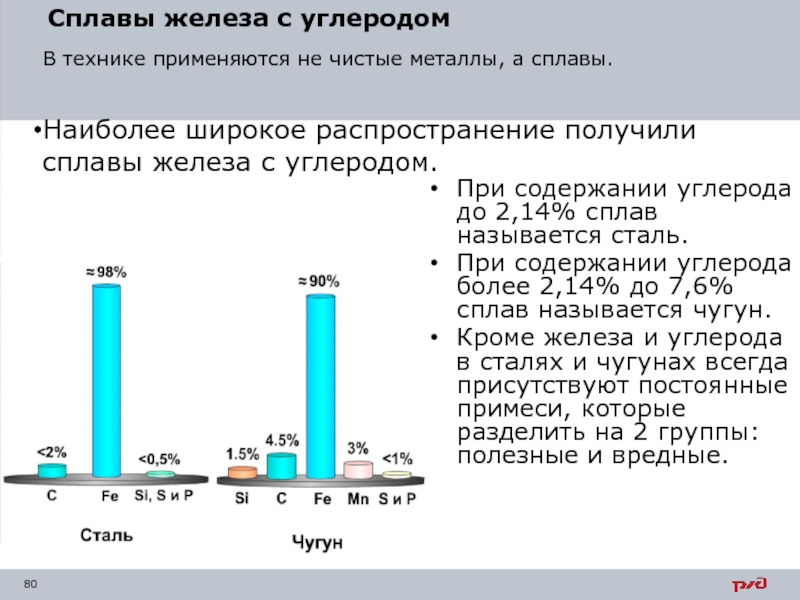
- 80. Сплавы железа с углеродом При содержании углерода
- 82. Влияние содержания углерода на свойства стали
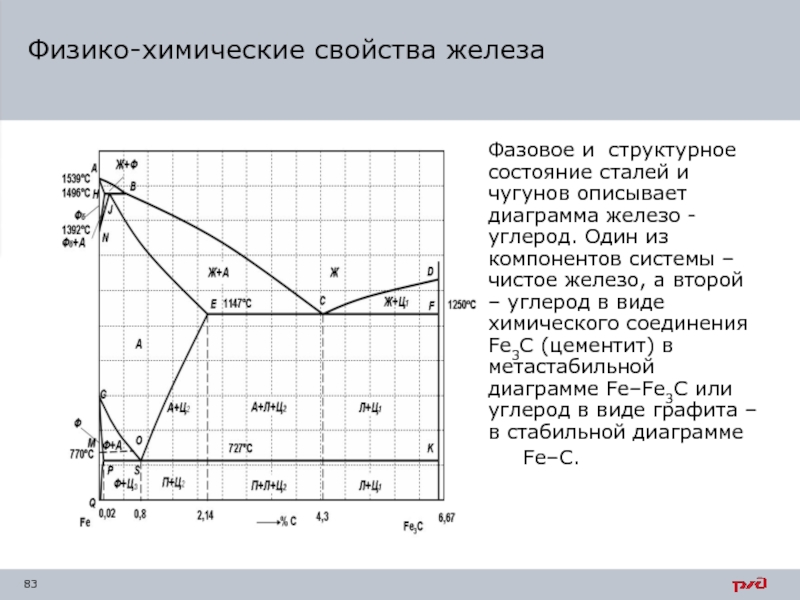
- 83. Физико-химические свойства железа Фазовое и
- 84. В зависимости от содержания углерода железоуглеродистые сплавы
- 85. Чугун Чугу́н — сплавсплав железасплав железа с углеродом (и другими элементами). Содержание углерода в
- 86. Полезные примеси Кремний (Si) – является раскислителем
- 87. Вредные примеси Сера (S) – вызывает красноломкость
- 88. Сера является вредной примесью в стали, делая
- 89. Вредные примеси Кислород (O2) – делает структуру
- 90. Фосфор, присутствуя в твердом растворе в феррите,
- 91. Производство стали и чугуна
- 93. Железнодорожный транспорт и транспортное машиностроение в значительных
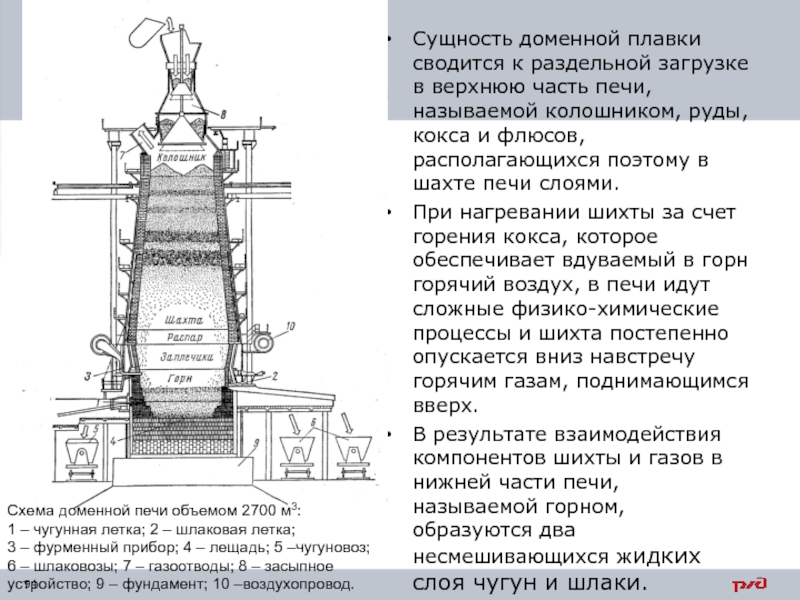
- 94. Сущность доменной плавки сводится к раздельной загрузке
- 95. Железные руды Железные руды
- 96. Топливо Топливо, применяемое для выплавки чугуна, должно
- 98. Флюсы Флюсы способствуют расплавлению и отделению пустой
- 99. Плавка чугуна Плавку чугуна производят в доменных
- 100. Чугуны Белый чугун – название
- 101. Серые чугуны Излом такого чугуна имеет серый
- 102. Серые чугуны В высокопрочном сером чугуне
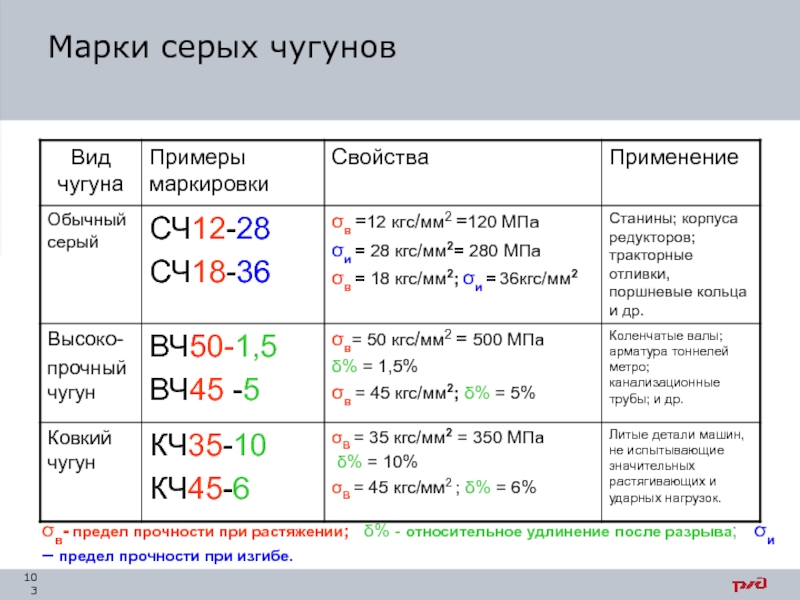
- 103. Марки серых чугунов σв- предел
- 104. Способы производства стали Основной способ
- 105. Устройство конвертера Устройство конвертера Бессемеровский и
- 106. Конвертор представляет собой сосуд грушевидной формы. Верхнюю
- 107. Бессемеровский процесс
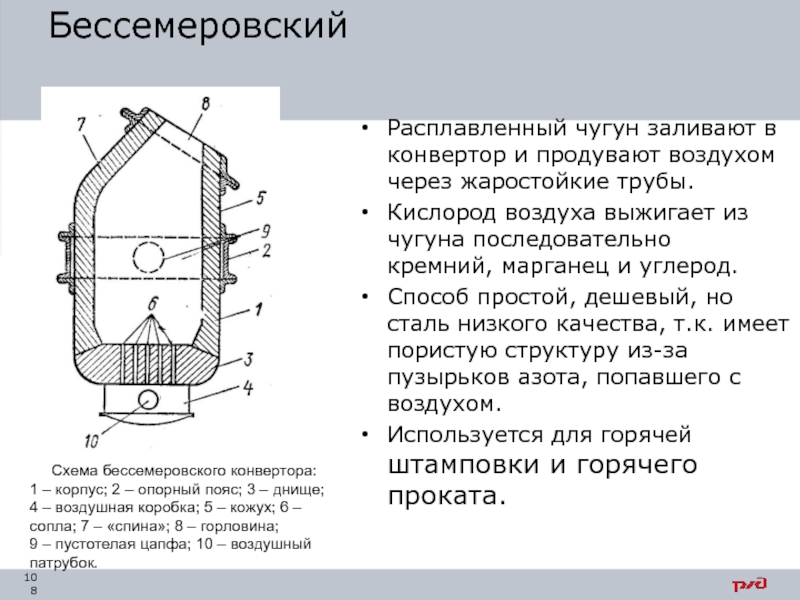
- 108. Бессемеровский Расплавленный чугун заливают в конвертор и
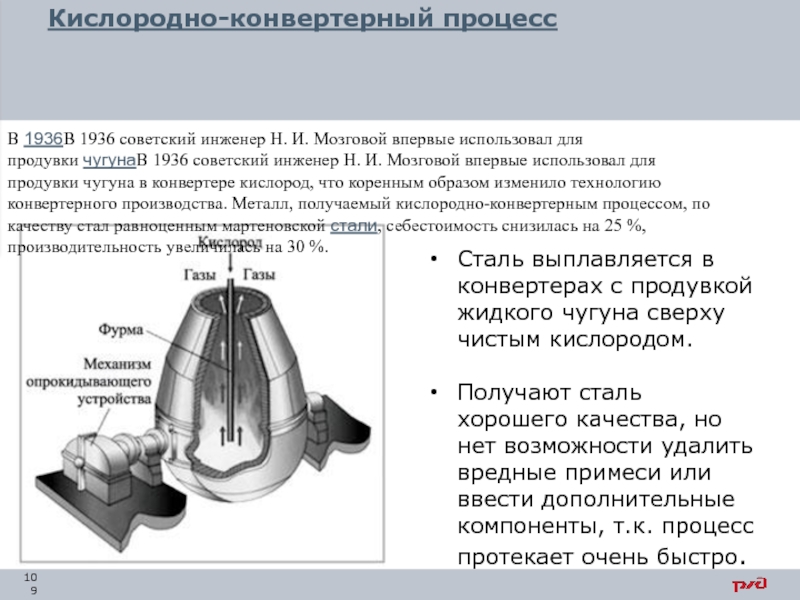
- 109. Кислородно-конвертерный процесс Сталь выплавляется в конвертерах с
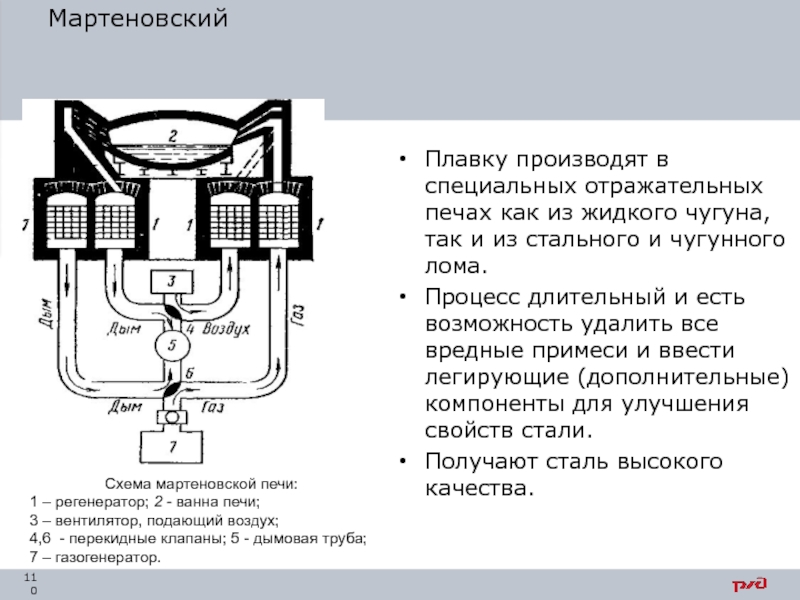
- 110. Мартеновский Плавку производят в специальных отражательных печах
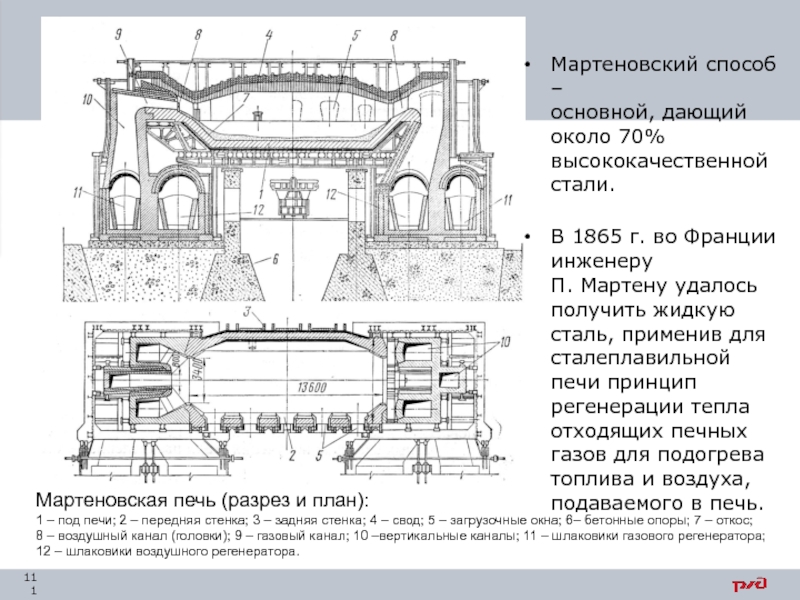
- 111. Мартеновская печь (разрез и план): 1 – под печи;
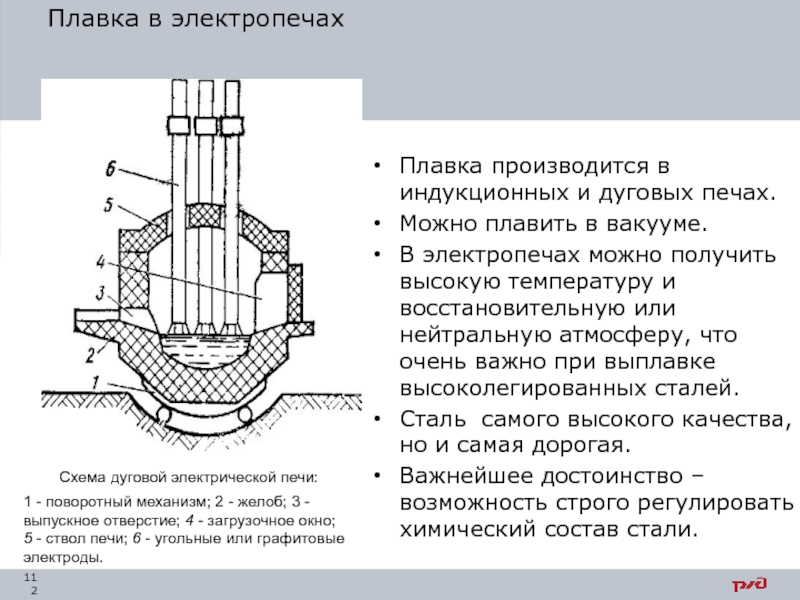
- 112. Плавка в электропечах Схема дуговой электрической печи:
Слайд 2Основы металловедения
Свойства металлов
Основы кристаллизации металлов
Основы теории сплавов
Производство стали и чугуна
Содержание презентации
Слайд 4 Материаловедение – это наука, изучающая связь между химическим составом, структурой и
Материаловедение
Слайд 5Материаловедением называют прикладную науку о связи состава, строения и свойств материалов.
Решение важнейших технических проблем, связанных с экономией материалов, уменьшением массы машин и приборов, повышением точности, надежности и работоспособности механизмов и приборов во многом зависит от развития материаловедения.
Теоретической основой материаловедения являются разделы физики и химии, однако наука о материалах в основном развивается экспериментальным путем.
Изучение физических (плотность, теплопроводность, магнитная проницаемость), механических (твердость, прочность, модуль упругости), технологических (жидкотекучесть, ковкость, обрабатываемость резанием) и эксплуатационных свойств (сопротивление коррозии, изнашиванию, хладостойкость, жаропрочность) позволяет определить области рационального использования различных материалов с учетом экономических требований.
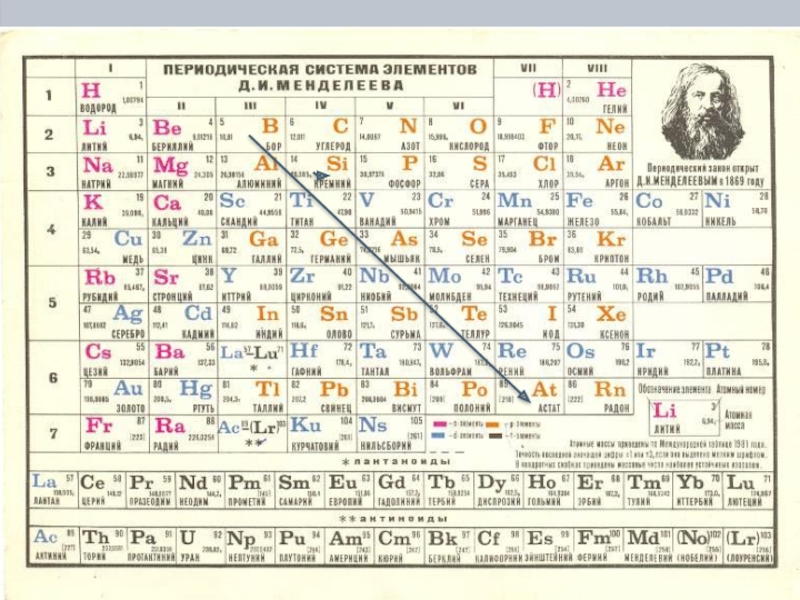
Слайд 7Положение металлов в Периодической системе химических элементов
Условная граница между
B(бор) – Si(кремний) – As(мышьяк) –Te(теллур) – At (астат)
Слайд 8 Положение металлов в П.С.
Если в П. С. элементов Д. И.
Слайд 9 Металлы в природе
Самым распространенным металлом в земной коре является алюминий.
боксит
гематит
магнетит
Пудожгорский
Костомукша
Север Карелии
Слайд 12Классификация металлов
В технике кроме чистых металлов, чаще применяют металлические сплавы, которые
Металлы разделяют на черные и цветные. К черным относятся железо и сплавы на его основе - стали и чугуны;
остальные металлы являются цветными.
Основную часть вырабатываемых в мире металлов составляет сталь как сплав железа с углеродом. В строительстве в основном применяют черные металлы - чугуны и стали для каркасов зданий, мостов, труб, кровли, арматуры в железобетоне.
Слайд 15Все металлы условно поделены на черные и цветные. Черные металл обычно
Цветные металлы имеют красную, желтую, белую окраску. Они обладаю большой пластичностью, малой твердостью, низкой температурой плавления. Известно, что олово имеет полиморфизм. Типичный представитель – медь.
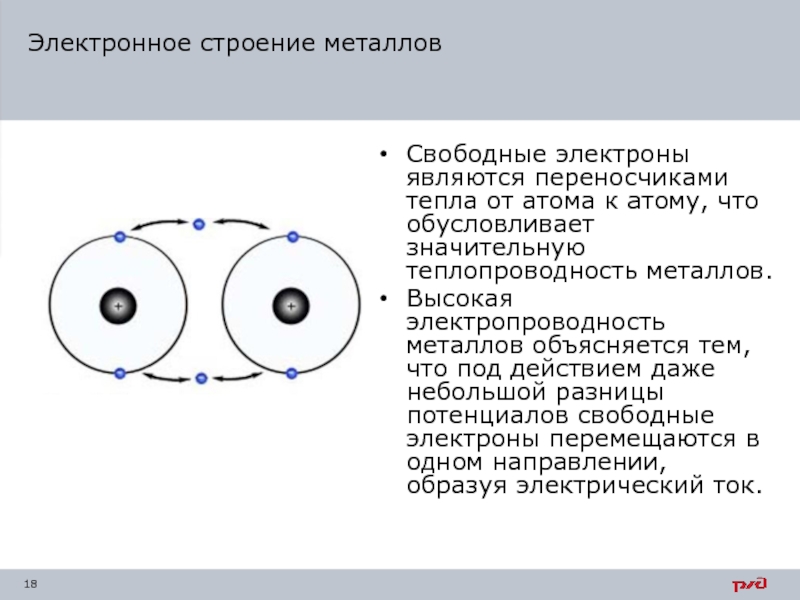
Слайд 17Электронное строение металлов
Общность свойств металлов определяется подобием электронного строения их атомных
У металлов внешние свободные электроны слабо связаны с ядром, поэтому они легко перескакивают с орбиты одного атома на орбиты других атомов, образуя подобие электронного газа. Атомы при этом ионизируются.
Слайд 18Электронное строение металлов
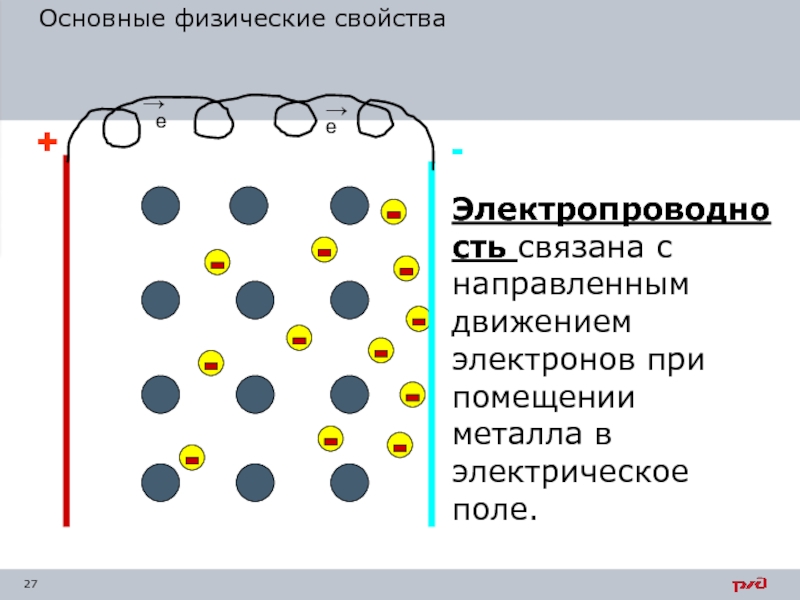
Свободные электроны являются переносчиками тепла от атома к атому,
Высокая электропроводность металлов объясняется тем, что под действием даже небольшой разницы потенциалов свободные электроны перемещаются в одном направлении, образуя электрический ток.
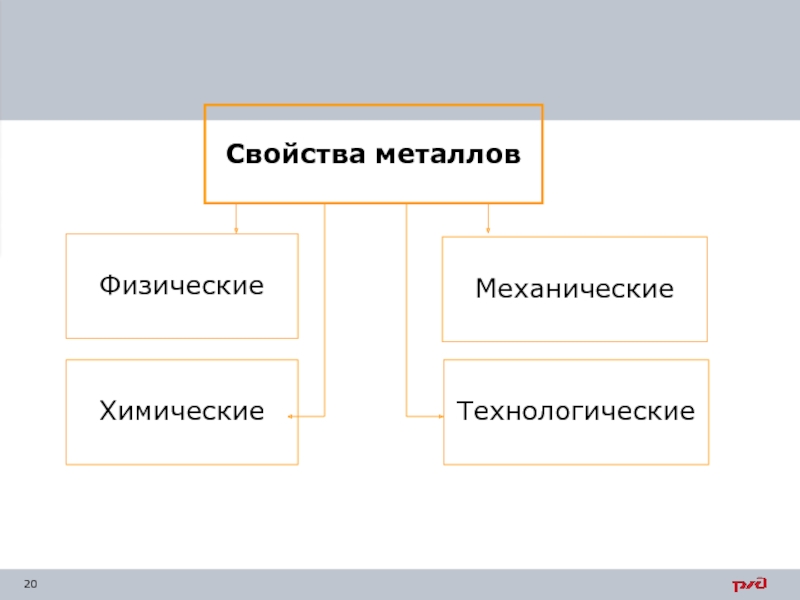
Слайд 21Физические свойства – материал проявляет под действием физических полей или сред.
Механические свойства оценивают способность материала сопротивляться внешним механическим нагрузкам (прочность, пластичность, вязкость, твердость и другие).
Технологические свойства характеризуют возможность применения материалов для технологических операций изготовления из них заготовок или деталей (литейные свойства, свариваемость, обрабатываемость резаньем, закаливаемость).
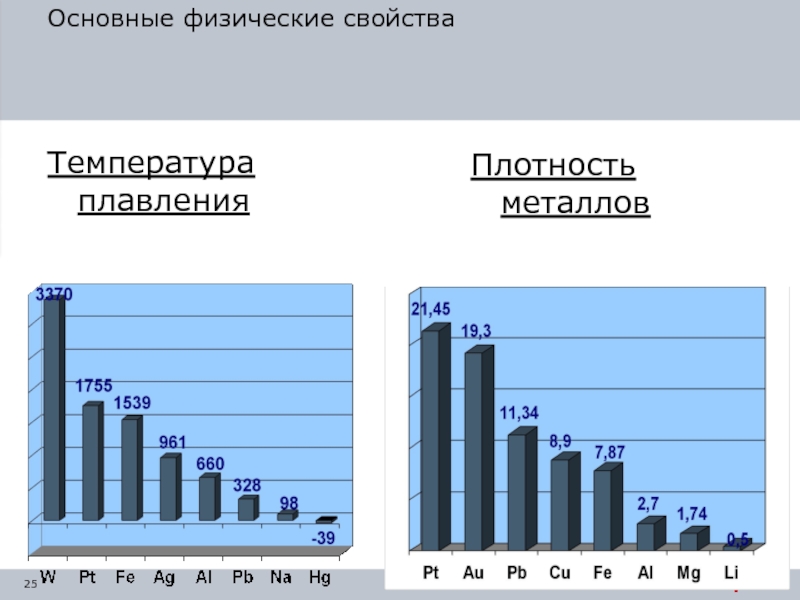
Слайд 23Основные физические свойства
Плотность – это масса единицы объема.
[Г/СМ3]
Легкие металлы (плотность меньше
Самый легкий металл – литий.
Тяжелые металлы (плотность больше 5 г/см3).
Самый тяжелый металл – осмий.
Например, плотность алюминия составляет 2,7 г/см3, а меди 8,9 г/см3.
Слайд 24Основные физические свойства
Температура плавления является той температурой, при которой металл переходит
Металлы, имеющие температуру плавления выше, чем у железа (1539º) называются тугоплавкими, а ниже 500º - легкоплавкими.
Для сравнения: температура плавления вольфрама - 3416º, меди - 1083º, алюминия 660º.
Слайд 26Основные физические свойства
Теплопроводность
обусловлена большой подвижностью электронов, которые сталкиваясь с
Происходит выравнивание температуры по всему куску металла.
Слайд 27Основные физические свойства
Электропроводность связана с направленным движением электронов при помещении металла
Слайд 28Основные физические свойства
Тепловое расширение – свойство металла увеличивать свои размеры при
Свойство характеризуется коэффициентом линейного расширения, показывающим, на какую долю первоначальной длины расширился материал при повышении температуры на 1°C.
Это свойство необходимо обязательно учитывать при конструировании машин и приборов, при застывании литых деталей и охлаждении свариваемых конструкций.
Например, в механизме газораспределения двигателя специально устанавливается тепловой зазор для компенсации расширения деталей при нагревании.
В тоже время эту способность металлов используют при прессовой посадке нагорячую.
Слайд 30Виды коррозии
По характеру изменения поверхности металла различают:
- местную,
- избирательную коррозию.
2. Коррозия под напряжением, или коррозионное растрескивание, возникает в конструкциях при воздействии рабочих напряжений.
3. Химическая коррозия − процесс разрушения материалов под воздействием жидкостей-неэлектролитов и газовой высокотемпературной среды.
4. Электрохимическая коррозия возникает при контакте металлов с электролитами, чаще всего во влажной среде через электродные реакции.
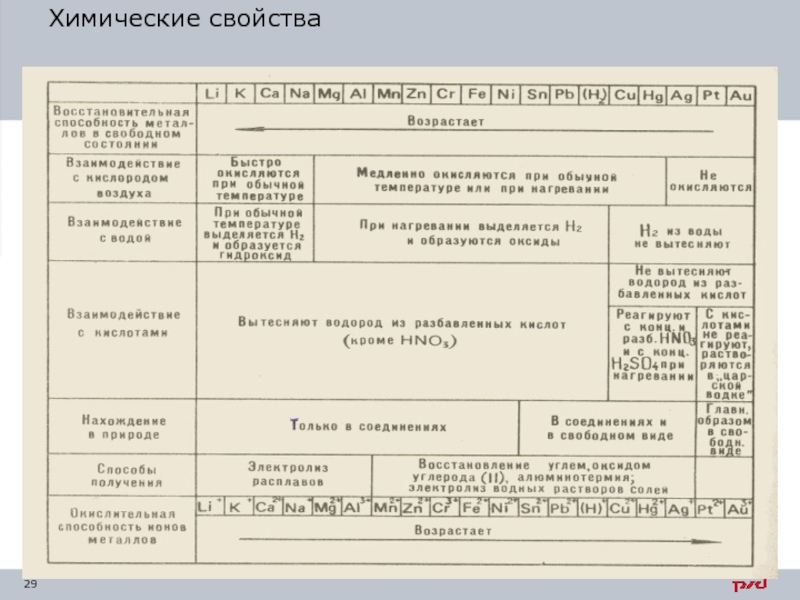
Слайд 31Химические свойства
Химический состав. Он определяет фазовый состав, структуру и свойства материалов.
Коррозионная стойкость - устойчивость материала к воздействию внешней агрессивной среды: атмосферного воздуха, влаги, морской воды и др.
Жаростойкость (окалиностойкость) - способность сопротивляться химическому разрушению (окислению) в газовых средах при температуре выше 5500 С. Для повышения окалиностойкости стали легируют элементами, которые изменяют состав и строение окалины, образуя тонкие защитные пленки.
Слайд 32
Химические
Химические свойства определяют работоспособность деталей под воздействием окружающей среды.
Если нагревать металл, то на поверхности образуется оксидный слой (окалина) – результат химической коррозии в атмосфере сухих газов. Скорость роста толщины оксидной плёнки (мкм/ч) или изменение массы металла (г/(м2·ч)) при повышенной температуре являются показателями жаростойкости. На основании экспериментов устанавливают допустимую рабочую температуру, при которой скорость окисления не превышает заданного значения.
Коррозионная стойкость определяется скоростью изменения массы металла или линейных размеров детали. При этом учитывается степень изменения механических свойств из-за разрушения поверхностных слоёв.
Химическая коррозия в сухих газах (воздух, углекислый газ, кислород, серосодержащие газы, сухой водяной пар) создаёт при нормальной температуре тонкую оксидную плёнку, обладающую защитными свойствами. Исключение – редкоземельные металлы. Увеличение толщины плёнки (>10нм) снижает плотность; рыхлость облегчает доступ кислорода; разница в удельном объёме плёнки и металла создаёт напряжение, плёнка растрескивается, коррозионное разрушение усиливается.
Слайд 33Электрохимическая коррозия развивается в жидких электролитах – водных растворах щелочей, солей,
В зависимости от условий электрохимическая коррозия может быть атмосферной, морской, почвенной, кислотной, щелочной, а также контактной, межкристаллитной, точечной и сплошной. Коррозионное разрушение в вершине трещины приводит под нагрузкой к резкому снижению предела выносливости, растрескиванию.
Коррозия блуждающими токами опасна для труб в почве, оболочек подземных кабелей, рельсов и других деталей пути, железнодорожных опор контактной сети, устройств автоматики, связи и др.
Наибольшую коррозию вызывает постоянный ток, переменный ток менее опасен. Защитные покрытия не обеспечивают защиту; радиус действия блуждающих токов доходит до десятков километров от токонесущих рельсовых путей на электрифицированных железных дорогах.
Химические свойства
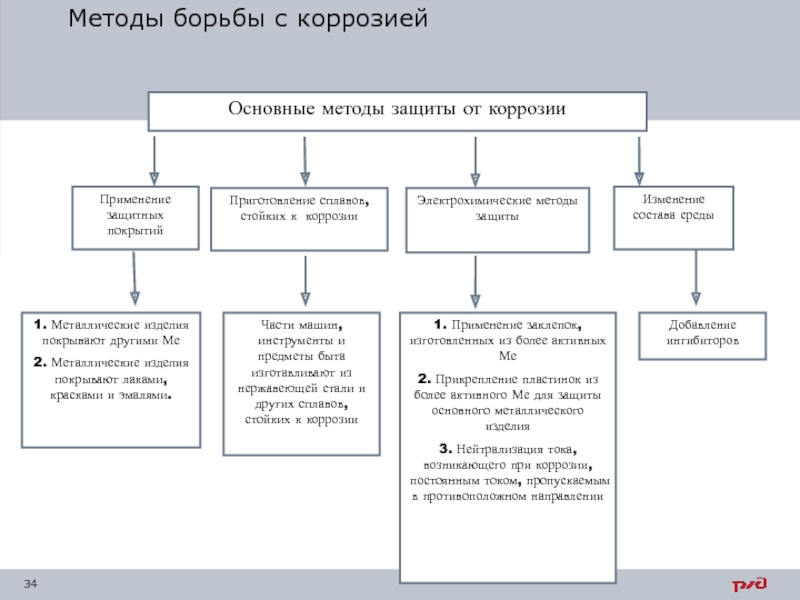
Слайд 35Защита металлов от коррозии
Меры борьбы с коррозией:
1. Снижение содержания примесей в
2. Легирование сплавов элементами, которые связывают металл в фазы.
3. Нанесение защитных покрытий.
Защитные покрытия – это пленки. Они могут быть металлическими, оксидными, полимерными, битумными, лакокрасочными, бетонными.
Металлические пленки – это механическая (катодное покрытие) или электрохимическая (анодное покрытие) защита.
Металлизация – покрытие поверхности детали слоем металла (сплава) для придания ей особых физических, химических и механических свойств для защиты от коррозии, износа, эрозии или декоративных целей.
Лакокрасочные покрытия служат для механической защиты металла пленкой из лаков и красок.
Битумные покрытия – применяют для труб диаметром до 800 мм и при температуре транспортируемых материалов до 40 °С.
Полимерные покрытия получают наклеиванием полимерной пленки, напылением порошкообразного полимера на поверхность металлопластов. Такие покрытия представляют собой липкие изоляционные полиэтиленовые (полихлорвиниловые) ленты, которые наматывают на трубопроводы.
Слайд 36Механические свойства
Механические свойства металлов определяют их способность сопротивляться действию внешних
прочность — способность металла оказывать сопротивление действию внешних сил, не разрушаясь;
упругость — свойство металла восстанавливать свою форму после прекращения действия внешних сил, вызвавших изменение формы (деформацию);
пластичность — свойство металла деформироваться без разрушения под действием внешних сил и сохранять измененную форму после прекращения действия сил. Пластичность — свойство, обратное упругости;
твердость — способность металла оказывать сопротивление проникновению в него более твердого тела;
вязкость — способность металла оказывать сопротивление ударным нагрузкам. Вязкость — свойство, противоположное хрупкости;
износостойкость — сопротивление металла изнашиванию вследствие процессов трения. Износ определяется по изменению размеров или массы деталей.
Слайд 37Механические свойства
Для определения механических свойств металлов проводят статические испытания на
Наиболее распространенными методами определения механических свойств металлов являются испытания на твердость (вдавливанием индентора в образец и измерением отпечатка) на специальных приборах, называемых твердомерами. Существуют также способы царапания, упругого отскока, ультразвуковых колебаний.
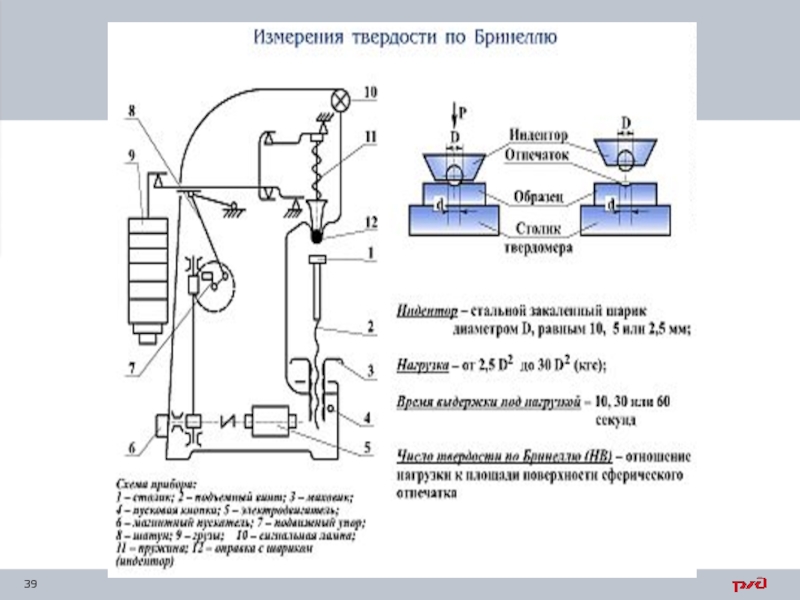
Слайд 38 Твердость по Бринеллю (ГОСТ 9012–59)
Сущность метода: в образец вдавливают стальной
Диаметр шарика может быть:
1; 2; 2,5; 5; 10 мм.
Твердость по Бринеллю обозначается НВ. Например, 185 НВ, Н/мм2 (кгс/мм2).
Этот метод применяют для стали с твердостью менее 450 НВ, а для цветных сплавов – более 200 НВ.
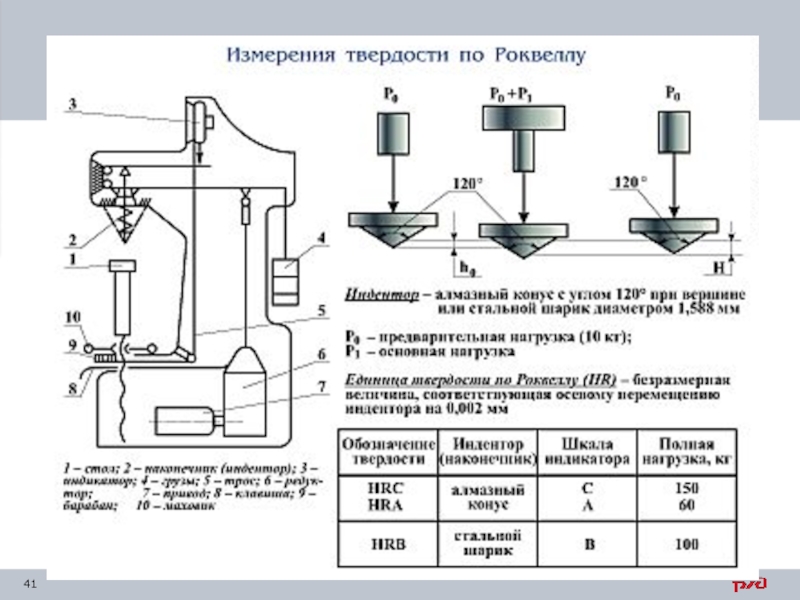
Слайд 40 Твердость по Роквеллу (ГОСТ 9013–59)
Твердость обозначают символом HR с указанием
Твердость по Роквеллу – безразмерная величина.
По шкале С замеряют твердость высокую (более 450 НВ); шкала А используется для определения твердости тонких (0,5–1,0 мм.) поверхностных слоев и очень твердых материалов; шкала В – для мягких материалов (менее 400 НВ).
Сущность метода состоит во вдавливании наконечника с алмазным конусом с углом у вершины 1200 (шкалы А и С) или со стальным шариком диаметром 1,5875 мм
(шкала В). Образец последовательно приложенных предварительной Р0
и основной Р1 нагрузок.
После снятия основной нагрузки Р1 прибор на шкале показывает число твердости по Роквеллу HR.
Слайд 42
Испытание на усталость. Рессоры, шейки осей локомотивов и вагонов, пальцы кривошипов,
вагонных колёс осей подвижного состава
Слайд 43Технологические свойства
Технологические свойства –обрабатываемость резанием, ковкость, свариваемость, штамповка, прокаливаемость и
В то же время часто требуется комплекс разных свойств для обеспечения работоспособности в условиях эксплуатации.
Так, для материала камеры сгорания двигателя тепловоза необходимы жаропрочность и жаростойкость, теплопроводность и коррозионная стойкость.
Результаты испытания в лабораторных условиях и в эксплуатации – на подвижном составе, в пути и т.д. позволяют правильно выбирать материал и его обработку для повышения надёжности и долговечности детали.
Слайд 44Структура металлов
Простейшим способом выявления структуры материала является исследование излома:
хрупкий –
вязкий (пластичный) – структура волокнистая, чем длиннее волокно, тем мягче материал (рис.3);
усталостный – там где зародилась микротрещина, кромки детали, соприкасаясь зашлифовывают друг друга, образуется светлое пятно . В зоне окончательного разрушения структура зернистая или волокнистая (рис.4).
Слайд 46Технологические пробы. Для определения способности металла принимать в холодном состоянии заданную
Способность листового металла к штамповке определяется пробой на выдавливание (ГОСТ 10510—74), а к образованию загиба — пробой на двойной кровельный замок (ГОСТ 13814—68).
Проволока проверяется на скручивание и навивание, трубы — на изгиб, сплющивание, бортование и т. д.
Абразивная износостойкость определяется (ГОСТ 17367—71) сравнением размеров или веса испытуемого и эталонного образцов при их трении о поверхность с закрепленными абразивными частицами.
Слайд 48
Различают аморфное и кристаллическое строение тел. В аморфных телах атомы расположены
Металлы — тела кристаллические. Кристаллическое строение металлов можно представить себе в виде пространственной решетки , в узлах которой расположены атомы (точнее, ионы, так как свободные электроны металлов, перемещаясь от одного атома к другому, образуют как бы «электронный газ»).
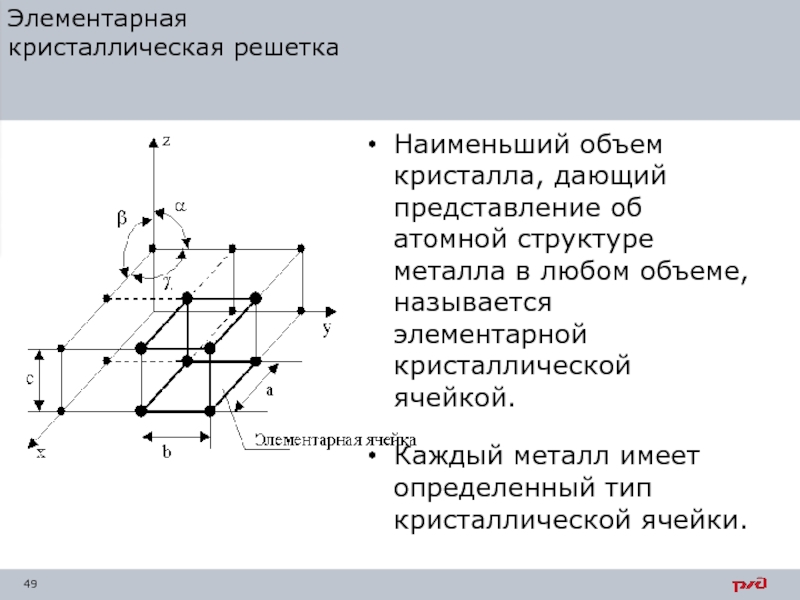
Слайд 49Элементарная
кристаллическая решетка
Наименьший объем кристалла, дающий представление об атомной структуре металла
Каждый металл имеет определенный тип кристаллической ячейки.
Слайд 52Кристаллизация
Любое вещество может находиться в трех агрегатных состояниях:
твердом,
жидком,
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров.
Кристаллизация металлов состоит из 2-х этапов: первичной и вторичной.
Слайд 53Первичная кристаллизация
Первичная кристаллизация – это переход металла из жидкого в твердое
Этим процессом можно управлять, чтобы получить материал с нужными свойствами. Кривая охлаждения чистого металла
Ттеор – теоретическая температура кристаллизации;
Ткр – фактическая температура кристаллизации;
ΔТ – степень переохлаждения.
Слайд 54Процесс кристаллизации чистого металла:
До точки 1 охлаждается металл в жидком состоянии,
На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации.
Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной.
После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии.
Слайд 55Центры кристаллизации образуются независимо друг от друга в случайных местах. Сначала
Процесс кристаллизации состоит из 2-х стадий:
зарождения центров,
роста кристаллов вокруг этих центров.
Процесс кристаллизации
Слайд 56Если металл охлаждать медленно, кристаллизация наступает вовремя, центров образуется мало, зерна
При быстром охлаждении процесс кристаллизации запаздывает и протекает очень быстро, центров образуется много, зерно получается мелким, а материал прочным.
Чем больше степень переохлаждения (ΔТ), тем больше центров и тем мельче зёрна, что имеет практическое значение.
Можно искусственно измельчить зерно при медленным охлаждении путем введения в основной металл более тугоплавкого металла, который начнет кристаллизоваться раньше и служить искусственными центрами.
Слайд 57Условия получения
мелкозернистой структуры
Стремятся к получению мелкозернистой структуры. Оптимальными условиями для
Размер зерен при кристаллизации зависит и от числа частичек нерастворимых примесей, которые играют роль готовых центров кристаллизации – оксиды, нитриды, сульфиды.
Чем больше частичек, тем мельче зерна закристаллизовавшегося металла.
Стенки изложниц имеют неровности, шероховатости, которые увеличивают скорость кристаллизации.
Мелкозернистую структуру можно получить в результате модифицирования, когда в жидкие металлы добавляются посторонние вещества – модификаторы.
По механизму воздействия различают:
Вещества не растворяющиеся в жидком металле – выступают в качестве дополнительных центров кристаллизации.
Поверхностно - активные вещества, которые растворяются в металле, и, осаждаясь на поверхности растущих кристаллов, препятствуют их росту.
Слайд 58Первичная кристаллизация
Первичная кристаллизация. Охлаждаясь, жидкий металл переходит в твердое состояние. Такой
Зернистая структура кристаллов образуется при весьма медленном охлаждении преимущественно чистых металлов. В производственных условиях в процессе кристаллизации сплавов обычно образуются древовидные кристаллы-дендриты («дендрон» по-гречески дерево). Первоначально образуются длинные ветви — оси первого порядка, затем одновременное удлинением этих осей перпендикулярно к ним растут оси второго порядка; на осях второго порядка зарождаются оси третьего порядка и т. д. В последнюю очередь затвердевает металл в междендритном пространстве.
Слайд 59Чем больше степень переохлаждения (ΔТ), тем больше центров и тем мельче
Рост зерен идет неравномерно.
Первоначально образуются длинные ветви первого порядка, одновременно с удлинением этих осей перпендикулярно растут оси второго порядка и т.д., пока не заполнится пространство между ветвями.
Кристалл древовидной формы – дендрит – образуется при большой степени переохлаждения.
Слайд 60
Строение металлического слитка. Выплавленный жидкий металл, затвердевая в специальной форме (изложнице),
При переходе из жидкого состояния в твердое происходит сокращение объема металла, называемое усадкой. В результате усадки в слитке образуется воронкообразная пустота — усадочная раковина, под которой находится зона усадочной рыхлости, т. е. место концентрации мелких усадочных раковин. Верхнюю часть слитка, в которой расположены усадочная раковина, зоны концентрированной рыхлости, как дефектную отделяют от качественной части слитка. Дефектная часть составляет 15—25% массы слитка.
Строение металлического слитка.
Слайд 61Строение металлического слитка
Результаты кристаллизации - на примере получения стального слитка. Стальной
1 - зоны мелких зерен в большом количестве, образовавшихся у поверхности слитка в результате очень быстрого охлаждения;
2 - зоны крупных древовидных кристаллов (дендритов) , вытянутых в направлении отвода тепла, т. е. перпендикулярно к стенке изложницы;
3 –зоны различно ориентированных крупных дендритов.
Слайд 62Структура металлического слитка
Результаты кристаллизации - на примере получения стального слитка.
Зоны:
1 - мелкие зерна в большом количестве, образовавшиеся у поверхности слитка в результате очень быстрого охлаждения;
2 - крупные древовидные кристаллы (дендриты) , вытянутые в направлении отвода тепла;
3 – различно ориентированные крупные зерна;
4 – усадочная раковина;
5 – зона усадочной рыхлости.
Слайд 63Вторичная кристаллизация
Некоторые металлы, например железо в твердом состоянии при изменении температуры
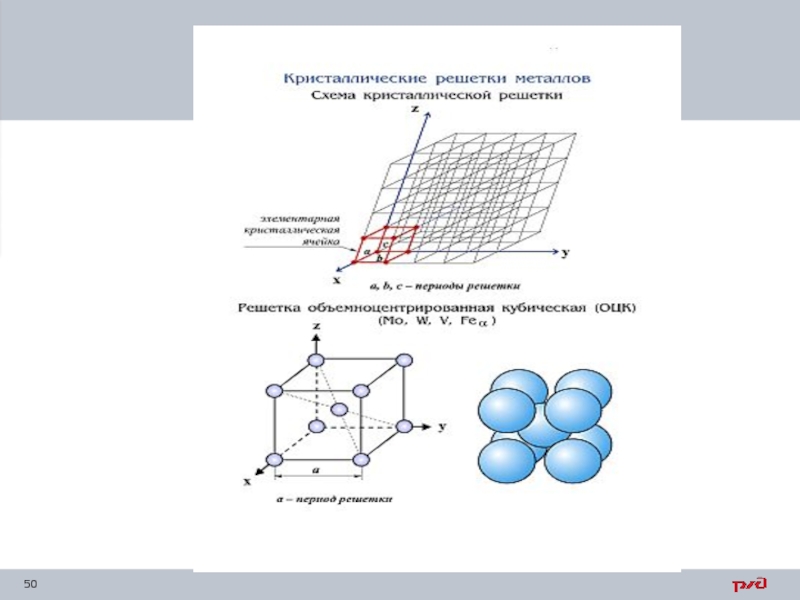
Слайд 64При обычной температуре железо имеет объемно-центрированную кубическую решетку (ОЦК-атомы располагаются по
При температуре 910° С происходит первое изменение решетки железа: в результате перегруппировки атомов образуется решетка гране-
центрированная кубическая
(ГЦК –атомы по одному в каждой вершине и в центре каждой грани). Железо с такой решеткой называют γ-железом.
Вторичная кристаллизация
Слайд 65Второе аллотропическое превращение происходит при температуре 1400° С — железо приобретает
Основными модификациями железа являются α и γ. На αγ и γα превращениях основаны процессы термической обработки стали. Модификации железа α и γ обладают различной способностью растворять углерод; γ - железо способно растворить почти в 100 раз больше углерода, чем
α - железо.
Вторичная кристаллизация
Слайд 67 Сплавы
Сплавы обладают такими свойствами, которые не имеют образующие их металлы.
Сплавы – это материалы с характерными свойствами, состоящие из двух или более компонентов, из которых по крайней мере один – металл.
Сплавы
однородные
неоднородные
при сплавлении образуется раствор одного Ме в другом.
Припой: одна часть свинца и две части олова
при сплавлении образуется механическая смесь Ме
Дюралюмин: 95% алюминия, 4% меди, 0,5% марганца и 0,5% магния
Слайд 68Строение сплавов
Металлическими сплавами называют вещества, образованные:
1. двумя или несколькими металлами,
2.
3. металлами и химическими соединениями, обладающими металлическими свойствами.
Слайд 69Получение сплавов:
Сплавлением, т.е. соединением компонентов сплавов в жидком состоянии;
Спеканием, например, чтобы
Электролизом, т.е. под действием электрического тока;
Диффузией.
Слайд 70
СПЕКАНИЕ, в технике - соединение мелкозернистых и порошкообразных материалов в куски
Диффузия – перенос вещества, обусловленный беспорядочным тепловым движением диффундирующих частиц. Основными типами движения при диффузии в твёрдых телах являются случайные периодические скачки атомов из узла кристаллической решётки в соседний узел или вакансию.
Слайд 71Основы теории сплавов
Однородная часть сплава с границами, обладающая специфическими составом, строением
Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевании возможно различное взаимодействие компонентов.
В зависимости от характера взаимодействия компонентов различают сплавы:
механические смеси;
химические соединения;
твердые растворы.
Слайд 72Сплавы механические смеси
Механические смеси двух компонентов А и В образуются, когда
При этих условиях сплав будет состоять из кристаллов А и В , отчётливо выявляемых на микроструктуре (рис.).
Механические свойства зависят от количественного соотношения компонентов, размера и формы зёрен.
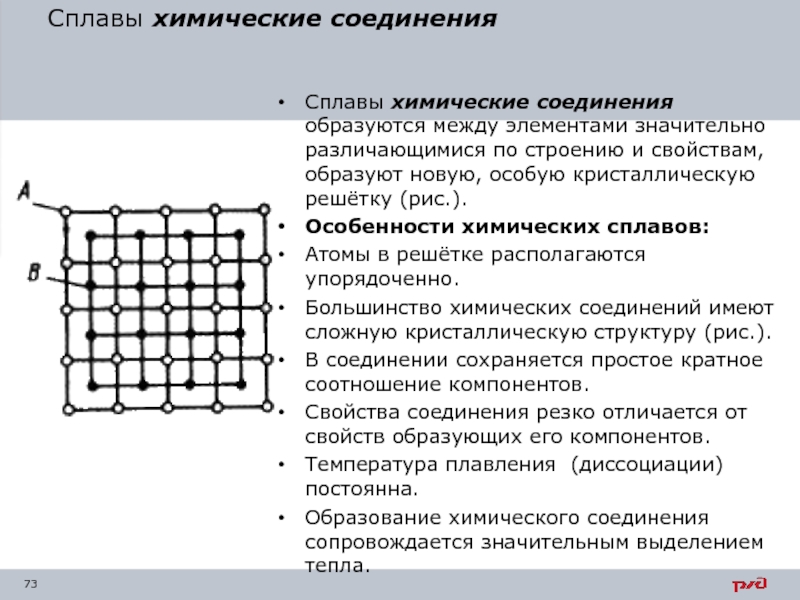
Слайд 73Сплавы химические соединения
Сплавы химические соединения образуются между элементами значительно различающимися
Особенности химических сплавов:
Атомы в решётке располагаются упорядоченно.
Большинство химических соединений имеют сложную кристаллическую структуру (рис.).
В соединении сохраняется простое кратное соотношение компонентов.
Свойства соединения резко отличается от свойств образующих его компонентов.
Температура плавления (диссоциации) постоянна.
Образование химического соединения сопровождается значительным выделением тепла.
Слайд 74Сплавы твёрдые растворы
В жидком состоянии большинство металлических сплавов представляют собой однородные
Для получения сплава твердого раствора необходимо выполнение главного условия: одно вещество (Растворитель) должно сохранить свою кристаллическую решётку, а второе – Растворимое – должно отдать свои атомы в решетку растворителя.
Слайд 75
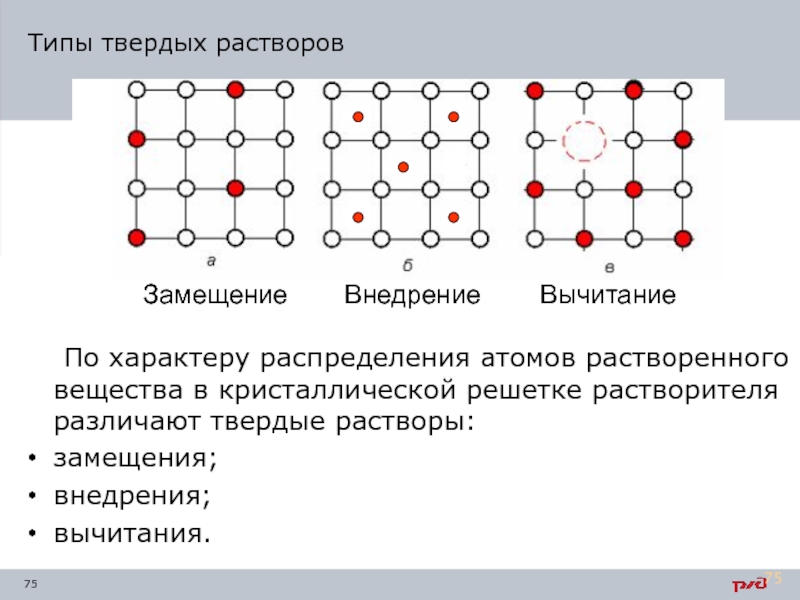
Замещение
Внедрение
Вычитание
Типы твердых растворов
По характеру распределения атомов растворенного вещества в кристаллической решетке
замещения;
внедрения;
вычитания.
Слайд 76
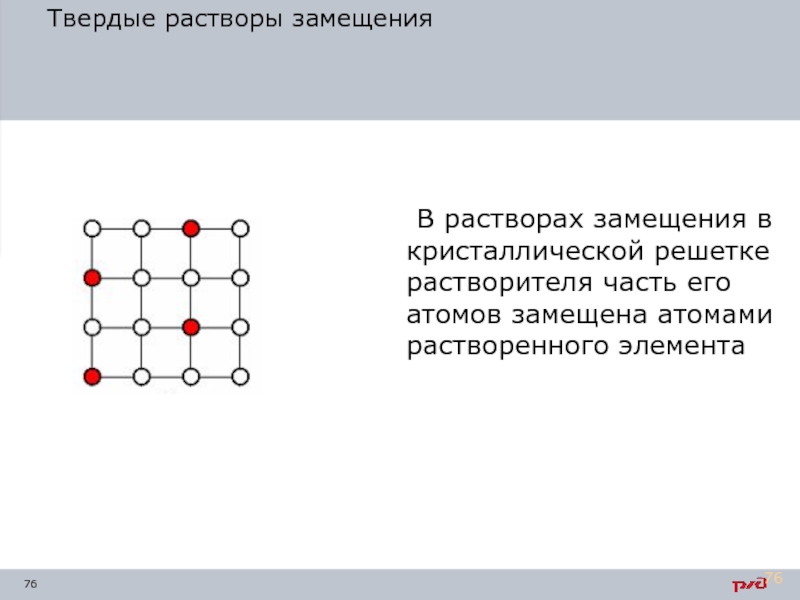
Твердые растворы замещения
В растворах замещения в кристаллической решетке растворителя часть его
Слайд 77
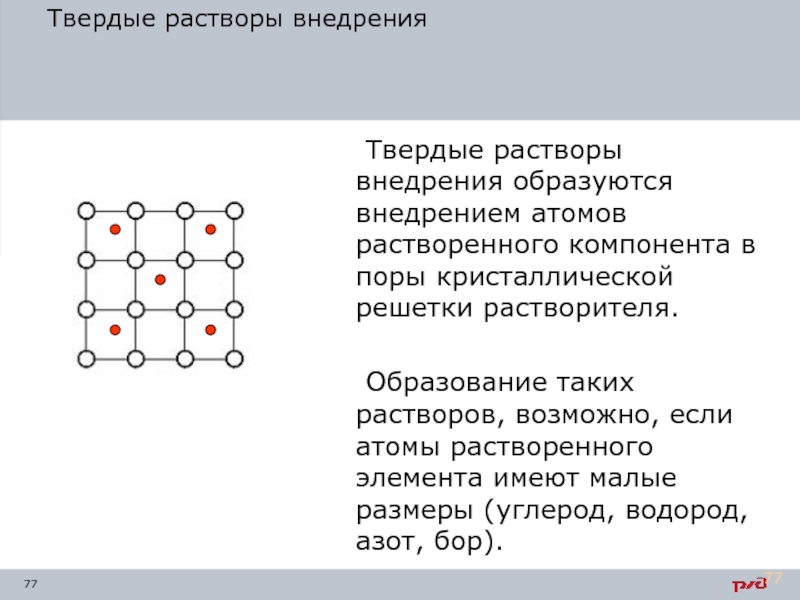
Твердые растворы внедрения
Твердые растворы внедрения образуются внедрением атомов растворенного компонента в
Образование таких растворов, возможно, если атомы растворенного элемента имеют малые размеры (углерод, водород, азот, бор).
Слайд 78
Твердые растворы вычитания
Твердые растворы вычитания или растворы с дефектной решеткой. образуются
Слайд 80Сплавы железа с углеродом
При содержании углерода до 2,14% сплав называется сталь.
При
Кроме железа и углерода в сталях и чугунах всегда присутствуют постоянные примеси, которые разделить на 2 группы: полезные и вредные.
В технике применяются не чистые металлы, а сплавы.
Наиболее широкое распространение получили сплавы железа с углеродом.
Слайд 82Влияние содержания углерода на свойства стали
Углерод - элемент, определяющий структуру и
Углерод относится к неметаллам.
В сплавах железа с углеродом углерод находится в состоянии твердого раствора с железом и в виде химического соединения – цементита (Fe3C), а также в свободном состоянии в виде графита (в серых чугунах).
С ростом содержания углерода в структуре стали увеличивается количество цементита, при одновременном снижении доли феррита. Изменение соотношения между составляющими приводит к уменьшению пластичности, а также к повышению прочности и твердости. Прочность повышается до содержания углерода около 1%, а затем она уменьшается, так как образуется грубая сетка цементита вторичного.
Углерод влияет на вязкие свойства. Увеличение содержания углерода повышает порог хладоломкости и снижает ударную вязкость.
Повышаются электросопротивление.
Углерод оказывает влияние и на технологические свойства. Повышение содержания углерода ухудшает литейные свойства стали (используются стали с содержанием углерода до 0,4 %), обрабатываемость давлением и резанием, свариваемость. Следует учитывать, что стали с низким содержанием углерода также плохо обрабатываются резанием.
Слайд 83
Физико-химические свойства железа
Фазовое и структурное состояние сталей и чугунов описывает
Fe–C.
Слайд 84В зависимости от содержания углерода железоуглеродистые сплавы делят на две группы:
Стали:
б) эвтектоидные (С ≈ 0,8 %);
в) заэвтектоидные ( 2,14 % > С > 0,8 %);
2. Чугуны: а) доэвтектические
(4,3 % > С > 2,14 %);
б) эвтектические (С ≈ 2,14 %);
в) заэвтектические (6,67 % > С > 4,3 %).
Железоуглеродистые сплавы
Слайд 85Чугун
Чугу́н — сплавсплав железасплав железа с углеродом (и другими элементами). Содержание углерода в чугуне не менее 2,14% (и другими
Слайд 86Полезные примеси
Кремний (Si) – является раскислителем стали, а также улучшает ее
Марганец (Mn) – является раскислителем и нейтрализует вредное влияние серы.
Слайд 87Вредные примеси
Сера (S) – вызывает красноломкость стали, т.е. разрушение при высокой
При наличии в стали серы образуются сульфиды железа, которые располагаются в виде нитей по границам зерен, резко снижая прочность. Кроме того, при 9850 они плавятся.
При введении марганца в сталь, он забирает серу у железа, образуя сульфиды марганца, которые располагаются отдельными вкраплениями, не влияющими на прочность, их температура плавления 18000.
Слайд 88Сера является вредной примесью в стали, делая ее красноломкой, что препятствует
Слайд 89Вредные примеси
Кислород (O2) – делает структуру стали пористой. Раскисление производится кремнием,
Фосфор (P) сообщает стали хладноломкость, т. е. разрушение при низких температурах. Фосфор способствует росту зерна, что и делает сталь хрупкой. Удаляется флюсами при плавке.
Центробежное электрошлаковое литьё. Залив расплава металла во вращающуюся форму.
Слайд 90Фосфор, присутствуя в твердом растворе в феррите, делает последний хрупким (хладноломким),
Слайд 93Железнодорожный транспорт и транспортное машиностроение в значительных количествах применяют чугун в
Однако главное назначение чугуна — получение из него стали.
Исходными материалами для получения чугуна являются :
Железная руда
Топливо
Флюсы
Выплавляются чугуны в доменных печах.
Слайд 94Сущность доменной плавки сводится к раздельной загрузке в верхнюю часть печи,
При нагревании шихты за счет горения кокса, которое обеспечивает вдуваемый в горн горячий воздух, в печи идут сложные физико-химические процессы и шихта постепенно опускается вниз навстречу горячим газам, поднимающимся вверх.
В результате взаимодействия компонентов шихты и газов в нижней части печи, называемой горном, образуются два несмешивающихся жидких слоя чугун и шлаки.
Схема доменной печи объемом 2700 м3:
1 – чугунная летка; 2 – шлаковая летка; 3 – фурменный прибор; 4 – лещадь; 5 –чугуновоз; 6 – шлаковозы; 7 – газоотводы; 8 – засыпное устройство; 9 – фундамент; 10 –воздухопровод.
Слайд 95Железные руды
Железные руды состоят из окислов железа и пустой породы.
В зависимости от природы окислов железа различают следующие железные руды:
магнитный железняк содержит железа до 72%;
красный железняк - до 65% железа;
бурый железняк - содержание железа от 30 до 50%.
Перед плавкой руду обогащают, т.е. отделяют от пустой породы. Наиболее распространенный способ – магнитный.
Слайд 96Топливо
Топливо, применяемое для выплавки чугуна, должно обладать высокой теплотой сгорания, малой
Слайд 98Флюсы
Флюсы способствуют расплавлению и отделению пустой породы и золы.
Обычно в
Слайд 99Плавка чугуна
Плавку чугуна производят в доменных печах, при этом получают чугуны
Серый (литейный) чугун – применяется для изготовления деталей машин (отливок) - содержание углерода от 2,2% до 3.7%.
Белый (передельный) чугун – используется для производства стали.
Слайд 100Чугуны
Белый чугун – название получил по матово-белому цвету излома;
структура
свойства: высокая твердость и износостойкость, хрупкость, практически не поддается обработке режущим инструментом;
марки: ИЧХ3, ИЧХ5, ИЧХ15… (износостойкий хромистый чугун с содержанием хрома 3%, 5%, 15% соответственно…);
применение: детали, работающие в условиях интенсивного износа без ударных нагрузок(например, линейки направляющих, детали шаровых мельниц).
Слайд 101Серые чугуны
Излом такого чугуна имеет серый цвет. Обладает хорошими литейными свойствами.
Слайд 102Серые чугуны
В высокопрочном сером чугуне графит находится в форме шаровидного
Слайд 103Марки серых чугунов
σв- предел прочности при растяжении; δ% - относительное
Слайд 104Способы производства стали
Основной способ производства стали – это получение ее
Это можно сделать несколькими методами:
I. Конвертерный
Бессемеровский
Кислородно-конвертерный
II. Мартеновский
III. Плавка в электропечах
Слайд 105Устройство конвертера
Устройство конвертера
Бессемеровский и томасовский конвертеры представляют собой сосуд грушевидной формы,
Слайд 106Конвертор представляет собой сосуд грушевидной формы. Верхнюю часть называют козырьком или
Емкость современных конвекторов равна 60 – 100 т. и более, а давление воздушного дутья 0,3-1,35 Мн/м. Количество воздуха необходимого для переработки 1 т чугуна, составляет 350 кубометров.
Перед заливкой чугуна конвектор поворачивают до горизонтального положения, при котором отверстия фурм оказываются выше уровня залитого чугуна. Затем его медленно возвращают в вертикальное положение и одновременно подают дутье, не позволяющее металлу проникать через отверстия фурм в воздушную коробку. В процессе продувки воздухом жидкого чугуна выгорают кремний, марганец, углерод и частично железо.
При достижении необходимой концентрации углерода конвектор возвращают в горизонтальное положение и прекращают подачу воздуха. Готовый металл раскисляют и выливают в ковш.
Слайд 107
Бессемеровский процесс
Первый массовый способ получения жидкой сталиПервый массовый способ получения жидкой стали открыл английский
Томасовский процесс
Англичанин Сидни Джилкрист ТомасАнгличанин Сидни Джилкрист Томас в 1878Англичанин Сидни Джилкрист Томас в 1878 вместо кислой динасовой футеровки бессемеровского конвертера применил основную футеровку, а для связывания фосфораАнгличанин Сидни Джилкрист Томас в 1878 вместо кислой динасовой футеровки бессемеровского конвертера применил основную футеровку, а для связывания фосфора предложил использовать известь. Томасовский процесс позволил перерабатывать высокофосфористые чугуныАнгличанин Сидни Джилкрист Томас в 1878 вместо кислой динасовой футеровки бессемеровского конвертера применил основную футеровку, а для связывания фосфора предложил использовать известь. Томасовский процесс позволил перерабатывать высокофосфористые чугуны и получил распространение в странах, где железные руды большинства месторождений содержат много фосфораАнгличанин Сидни Джилкрист Томас в 1878 вместо кислой динасовой футеровки бессемеровского конвертера применил основную футеровку, а для связывания фосфора предложил использовать известь. Томасовский процесс позволил перерабатывать высокофосфористые чугуны и получил распространение в странах, где железные руды большинства месторождений содержат много фосфора (БельгияАнгличанин Сидни Джилкрист Томас в 1878 вместо кислой динасовой футеровки бессемеровского конвертера применил основную футеровку, а для связывания фосфора предложил использовать известь. Томасовский процесс позволил перерабатывать высокофосфористые чугуны и получил распространение в странах, где железные руды большинства месторождений содержат много фосфора (Бельгия, ЛюксембургАнгличанин Сидни Джилкрист Томас в 1878 вместо кислой динасовой футеровки бессемеровского конвертера применил основную футеровку, а для связывания фосфора предложил использовать известь. Томасовский процесс позволил перерабатывать высокофосфористые чугуны и получил распространение в странах, где железные руды большинства месторождений содержат много фосфора (Бельгия, Люксембург, др.). Однако и томасовская сталь была низкого качества.
В 1864 французский металлург П. Мартен разработал процесс получения стали в мартеновской печи. В отличие от конвертерных способов получения стали, мартеновский процесс отличался малой требовательностью к химическому составу исходного материала, позволял переплавлять большое количество стального лома; качество мартеновской стали было выше конвертерной. Однако следует заметить, что время плавки в мартеновской печи гораздо больше, чем в конвертере. Вследствие этого мартеновский способ вытесняется окончательно конвертерным. Единственным достоинством стали выплавленной в мартеновской печи, по сравнению с конвертерной, остается её большой ассортимент, в то время как для повышения количества марок стали конвертерной используют установку доводки стали. К середине XX века мартеновским способом изготовлялось около 80 % всей стали, производимой в мире.
Слайд 108Бессемеровский
Расплавленный чугун заливают в конвертор и продувают воздухом через жаростойкие трубы.
Кислород
Способ простой, дешевый, но сталь низкого качества, т.к. имеет пористую структуру из-за пузырьков азота, попавшего с воздухом.
Используется для горячей штамповки и горячего проката.
Рисунок 2 – Схема устройства бессемеровского конвертора:
1 – корпус; 2 – опорный пояс; 3 – днище; 4 – воздушная коробка; 5 – кожух; 6 –сопла; 7 – «спина»; 8 – горловина; 9 – пустотелая цапфа; 10 – воздушный патрубок.
Схема бессемеровского конвертора:
1 – корпус; 2 – опорный пояс; 3 – днище; 4 – воздушная коробка; 5 – кожух; 6 –сопла; 7 – «спина»; 8 – горловина; 9 – пустотелая цапфа; 10 – воздушный патрубок.
Слайд 109Кислородно-конвертерный процесс
Сталь выплавляется в конвертерах с продувкой жидкого чугуна сверху чистым
Получают сталь хорошего качества, но нет возможности удалить вредные примеси или ввести дополнительные компоненты, т.к. процесс протекает очень быстро.
В 1936В 1936 советский инженер Н. И. Мозговой впервые использовал для продувки чугунаВ 1936 советский инженер Н. И. Мозговой впервые использовал для продувки чугуна в конвертере кислород, что коренным образом изменило технологию конвертерного производства. Металл, получаемый кислородно-конвертерным процессом, по качеству стал равноценным мартеновской стали, себестоимость снизилась на 25 %, производительность увеличилась на 30 %.
Слайд 110Мартеновский
Плавку производят в специальных отражательных печах как из жидкого чугуна, так
Процесс длительный и есть возможность удалить все вредные примеси и ввести легирующие (дополнительные) компоненты для улучшения свойств стали.
Получают сталь высокого качества.
Схема мартеновской печи:
1 – регенератор; 2 - ванна печи;
3 – вентилятор, подающий воздух;
4,6 - перекидные клапаны; 5 - дымовая труба; 7 – газогенератор.
Слайд 111Мартеновская печь (разрез и план):
1 – под печи; 2 – передняя стенка; 3 – задняя стенка; 4 – свод;
Мартеновский способ –
основной, дающий около 70% высококачественной стали.
В 1865 г. во Франции инженеру
П. Мартену удалось получить жидкую сталь, применив для сталеплавильной печи принцип регенерации тепла отходящих печных газов для подогрева топлива и воздуха, подаваемого в печь.
Слайд 112Плавка в электропечах
Схема дуговой электрической печи:
1 - поворотный механизм; 2 -
Плавка производится в индукционных и дуговых печах.
Можно плавить в вакууме.
В электропечах можно получить высокую температуру и восстановительную или нейтральную атмосферу, что очень важно при выплавке высоколегированных сталей.
Сталь самого высокого качества, но и самая дорогая.
Важнейшее достоинство – возможность строго регулировать химический состав стали.

















![Основные физические свойстваПлотность – это масса единицы объема. [Г/СМ3] Легкие металлы (плотность меньше 5 г/см3).](/img/tmb/4/340952/05f0cc3d49ef5714bbafa7b82a2d3fde-800x.jpg)