вони утворюють.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лужноземельні елементи. Фізичні та хімічні властивості простих речовин та сполук, що вони утворюють презентация
Содержание
- 1. Лужноземельні елементи. Фізичні та хімічні властивості простих речовин та сполук, що вони утворюють
- 2. До елементів ІІ групи головної підгрупи належать:
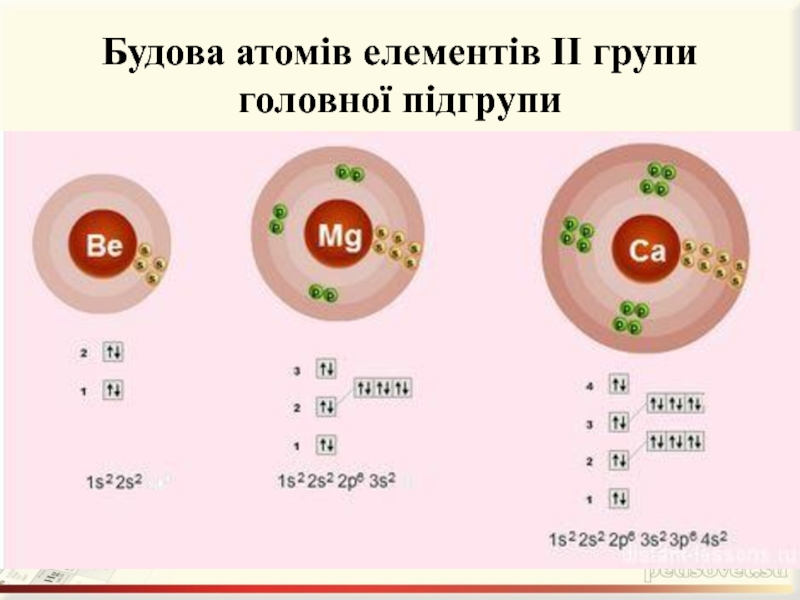
- 3. Будова атомів елементів ІІ групи головної підгрупи
- 4. Поширеність у природі Be
- 5. Прості речовини - лужноземельні метали Be
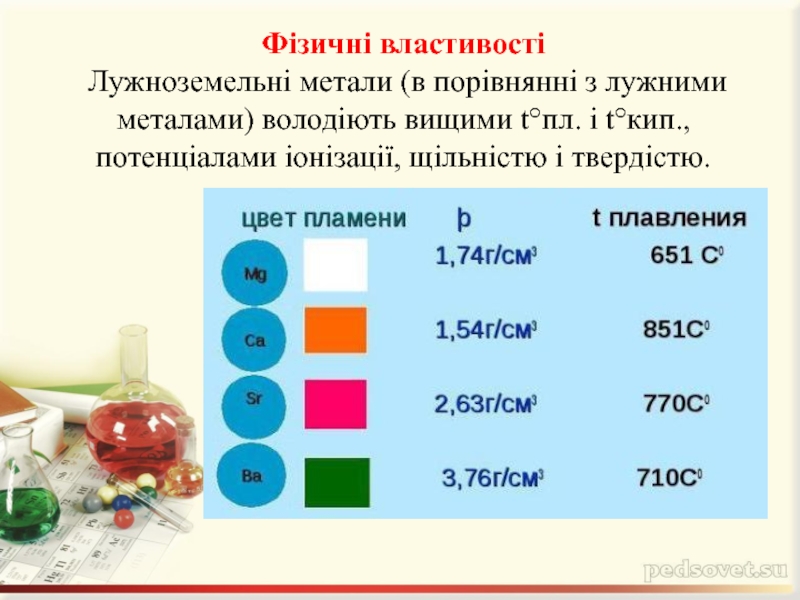
- 6. Фізичні властивості Лужноземельні метали (в порівнянні з
- 7. Хімічні властивості лужноземельних металів (загальні схеми рівнянь
- 8. Хімічні властивості Метали головної підгрупи II
- 9. 4. Всі метали розчиняються в кислотах:
- 10. Оксиди лужноземельних металів Отримання 1) Окислення металів
- 11. Гідроксиди лужноземельних металів R(OH)2
- 12. Завдання додому Прочитати параграф 21 Виконати завдання
Слайд 4Поширеність у природі
Be 3BeO • Al2O3 • 6SiO2
– берил
Mg MgCO3 – магнезит
CaCO3 • MgCO3 – доломіт
KCl • MgCl2 • 6H2O – карналіт
Ca CaCO3 – кальцит (вапняк, мармур і ін.)
Ca3(PO4)2 – апатит
CaSO4 • 2H2O – гіпс
Ca5(PO4)3F– фтороапатит
CaF2 – плавиковий шпат (флюорит)
Sr SrSO4 – целестин
SrCO3 – стронціаніт
Ba BaSO4 – барит
BaCO3 – вітерит
Mg MgCO3 – магнезит
CaCO3 • MgCO3 – доломіт
KCl • MgCl2 • 6H2O – карналіт
Ca CaCO3 – кальцит (вапняк, мармур і ін.)
Ca3(PO4)2 – апатит
CaSO4 • 2H2O – гіпс
Ca5(PO4)3F– фтороапатит
CaF2 – плавиковий шпат (флюорит)
Sr SrSO4 – целестин
SrCO3 – стронціаніт
Ba BaSO4 – барит
BaCO3 – вітерит
Слайд 6Фізичні властивості Лужноземельні метали (в порівнянні з лужними металами) володіють вищими t°пл.
і t°кип., потенціалами іонізації, щільністю і твердістю.
Слайд 7Хімічні властивості лужноземельних металів
(загальні схеми рівнянь реакцій)
2Me +O2 → 2MeO
Me
+H2 → MeH2
Me +Cl2 → MeCl2
Me +S → MeS
Me +2HCl → MeCl2 + H2
Me +2HOH → Me(OH)2 +Н2
Me +Cl2 → MeCl2
Me +S → MeS
Me +2HCl → MeCl2 + H2
Me +2HOH → Me(OH)2 +Н2
Слайд 8
Хімічні властивості
Метали головної підгрупи II групи - сильні відновники; у сполуках
проявляють тільки ступінь окислення +2. Активність металів і їх відновна здатність збільшується в ряду: –Be–Mg–Ca–Sr–Ba→
1. Реакція з водою.
Mg + 2H2O (t°)→ Mg(OH)2 + H2
Ca + 2H2O → Ca(OH)2 + H2
2. Реакція з киснем. Всі метали утворюють оксиди RO, барій-пероксид – BaO2: 2Mg + O2 → 2MgO
Ba + O2 → BaO2
3. З іншими неметалами утворюються бінарні сполуки:
Be + Cl2 → BeCl2 (галогеніди)
Ba + S → BаS (сульфіди)
3Mg + N2 → Mg3N2 (нітриди)
Ca + H2 → CaH2 (гідриди)
Ca + 2C → CaC2 (карбіди)
3Ba + 2P → Ba3P2 (фосфіди)
Берилій і магній порівняно поволі реагують з неметалами.
1. Реакція з водою.
Mg + 2H2O (t°)→ Mg(OH)2 + H2
Ca + 2H2O → Ca(OH)2 + H2
2. Реакція з киснем. Всі метали утворюють оксиди RO, барій-пероксид – BaO2: 2Mg + O2 → 2MgO
Ba + O2 → BaO2
3. З іншими неметалами утворюються бінарні сполуки:
Be + Cl2 → BeCl2 (галогеніди)
Ba + S → BаS (сульфіди)
3Mg + N2 → Mg3N2 (нітриди)
Ca + H2 → CaH2 (гідриди)
Ca + 2C → CaC2 (карбіди)
3Ba + 2P → Ba3P2 (фосфіди)
Берилій і магній порівняно поволі реагують з неметалами.
Слайд 94. Всі метали розчиняються в кислотах:
Ca + 2HCl → CaCl2 + H2
Mg + H2SO4(розв.)→ MgSO4 + H2
Берилій також розчиняється у водних розчинах лугів:
Be + 2NaOH + 2H2O → Na2[Be(OH)4]+ H2
5. Якісна реакція на катіони лужноземельних металів – забарвлення полум'я в наступні кольори:
Ca2+ - темно-оранжевий
Sr2+ - темно-червоний
Ba2+ - ясно-зелений
Катіон Ba2+ зазвичай відкривають обмінною реакцією з сульфатною кислотою або її солями: Ba2+ + SO42- = BaSO4↓(білий осад)
Сульфат барію – білий осад, нерозчинний в мінеральних кислотах.
Mg + H2SO4(розв.)→ MgSO4 + H2
Берилій також розчиняється у водних розчинах лугів:
Be + 2NaOH + 2H2O → Na2[Be(OH)4]+ H2
5. Якісна реакція на катіони лужноземельних металів – забарвлення полум'я в наступні кольори:
Ca2+ - темно-оранжевий
Sr2+ - темно-червоний
Ba2+ - ясно-зелений
Катіон Ba2+ зазвичай відкривають обмінною реакцією з сульфатною кислотою або її солями: Ba2+ + SO42- = BaSO4↓(білий осад)
Сульфат барію – білий осад, нерозчинний в мінеральних кислотах.
Ca2+
Ba2+
Sr2+
Слайд 10Оксиди лужноземельних металів
Отримання
1) Окислення металів (окрім Ba, який утворює пероксид)
2) Термічне
розкладання нітратів або карбонатів
CaCO3 (t°)→ CаO + CO2
2Mg(NO3)2 (t°)→ 2MgO + 4NO2 + O2
Хімічні властивості
Типові основні оксиди. Реагують з водою (окрім BеO), кислотними оксидами і кислотами
MgO + H2O → Mg(OH)2
3CaO + P2O5 → Ca3(PO4)2
CaO + 2HNO3 → Ca (NO3)2 + H2O
CaCO3 (t°)→ CаO + CO2
2Mg(NO3)2 (t°)→ 2MgO + 4NO2 + O2
Хімічні властивості
Типові основні оксиди. Реагують з водою (окрім BеO), кислотними оксидами і кислотами
MgO + H2O → Mg(OH)2
3CaO + P2O5 → Ca3(PO4)2
CaO + 2HNO3 → Ca (NO3)2 + H2O
Слайд 11Гідроксиди лужноземельних металів R(OH)2
Отримання
Реакції лужноземельних металів або їх оксидів з водою:
Ba + 2H2O → Ba(OH)2 + H2
CаO(негашене вапно)+ H2O → Ca(OH)2(гашене вапно)
Хімічні властивості
Гідроксиди R(OH)2 - білі кристалічні речовини, у воді розчинні гірше, ніж гідроксиди лужних металів (розчинність гідроксидів зменшується із зменшенням порядкового номера)
Be(OH)2 – амфотерний гідроксид,
Mg(OH)2 – слабка основа,
решта гідроксидів - сильні основи (луги).
1) Реакції з кислотними оксидами: Ca(OH)2 + SO2 → CaSO3↓ + H2O
Ba(OH)2 + CO2 → BaCO3 ↓ + H2O
2) Реакції з кислотами:
Mg(OH)2 + 2CH3COOH → (CH3COO)2Mg + 2H2O
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
3) Реакції обміну з солями: Ba(OH)2 + K2SO4 → BaSO4↓ + 2KOH
CаO(негашене вапно)+ H2O → Ca(OH)2(гашене вапно)
Хімічні властивості
Гідроксиди R(OH)2 - білі кристалічні речовини, у воді розчинні гірше, ніж гідроксиди лужних металів (розчинність гідроксидів зменшується із зменшенням порядкового номера)
Be(OH)2 – амфотерний гідроксид,
Mg(OH)2 – слабка основа,
решта гідроксидів - сильні основи (луги).
1) Реакції з кислотними оксидами: Ca(OH)2 + SO2 → CaSO3↓ + H2O
Ba(OH)2 + CO2 → BaCO3 ↓ + H2O
2) Реакції з кислотами:
Mg(OH)2 + 2CH3COOH → (CH3COO)2Mg + 2H2O
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
3) Реакції обміну з солями: Ba(OH)2 + K2SO4 → BaSO4↓ + 2KOH
Слайд 12Завдання додому
Прочитати параграф 21
Виконати завдання 201, 208 на с.151-152
Підготувати презентацію з
теми: “Твердість води. Способи її усунення”