- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лигандообменные равновесия и процессы. Строение комплексных соединений презентация
Содержание
- 1. Лигандообменные равновесия и процессы. Строение комплексных соединений
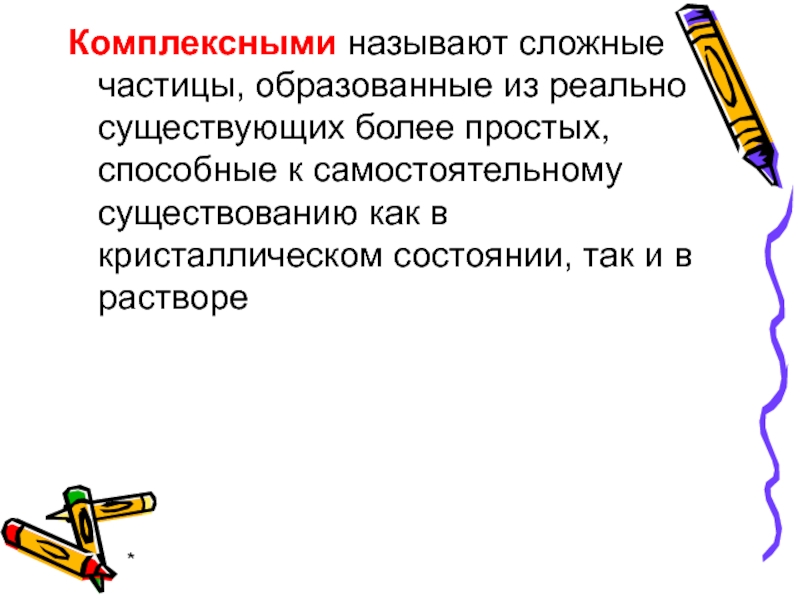
- 2. * Комплексными называют сложные частицы, образованные из
- 3. * Fe(CN)3 + 3KCN → K3[Fe(CN)6]
- 4. * Комплексными (координационными) соединениями называют
- 5. * 1. М + L = внутренняя
- 6. * [Ni(NH3)6]Cl2
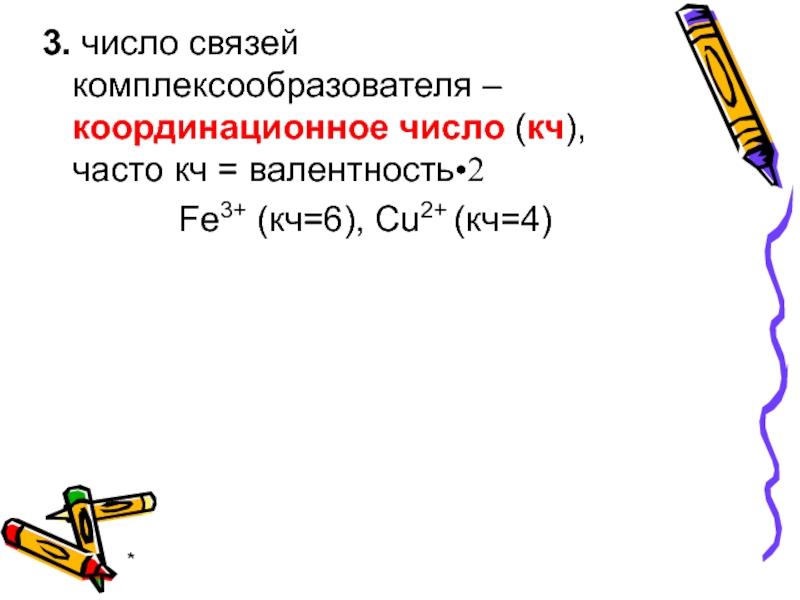
- 7. * 3. число связей комплексообразователя – координационное
- 8. * 4. число связей лиганда – дентантность
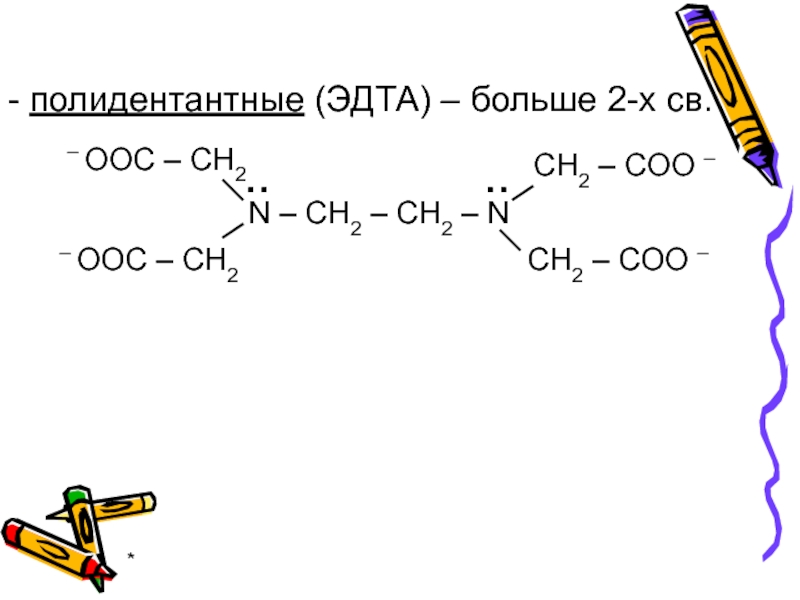
- 9. * - полидентантные (ЭДТА) – больше 2-х св.
- 10. * [Al(OH)4]- Механизм образования донорно-акцепторных связей: Al 3+ sp3 гибридизация
- 11. * как правило, лиганды – доноры
- 12. * (OH)- 4 [Zn+x Na+ (+1) +
- 13. * На способность к комплексообразованию влияют: 1.
- 14. * 2. Природа лиганда (чем больше поляризуемость
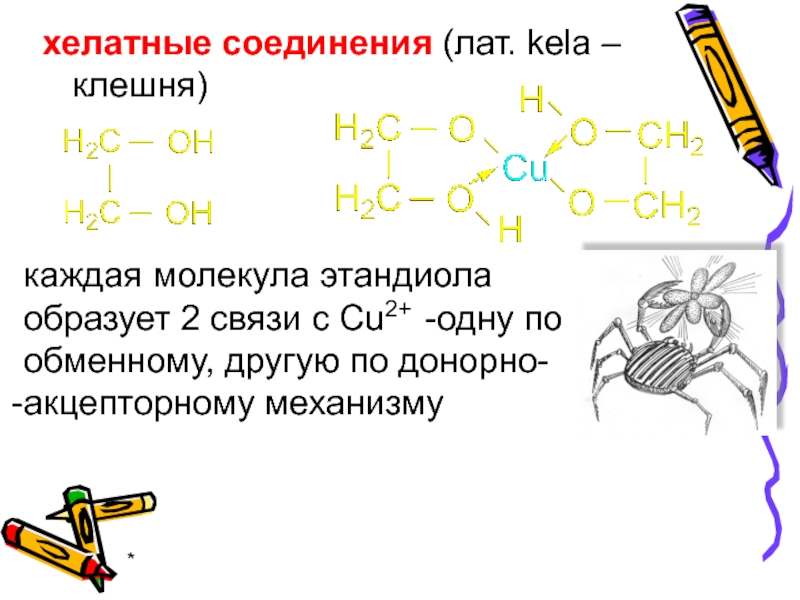
- 15. * хелатные соединения (лат. kela – клешня)
- 16. * НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2- 4- 3- 5- 6- ди- три- тетра- пента- гекса- ЧИСЛИТЕЛЬНЫЕ:
- 17. * НАЗВАНИЯ ЛИГАНДОВ: H2O – аква- NH3
- 18. * Названия комплексообразователя: - в составе катиона
- 19. * В названии комплекса: сначала название
- 20. * после названия коплексообразователя указывается его валентность;
- 21. * тетра гидроксо цинкат (II) Na+2 4]
- 22. * гекса циано феррат (III) K+3 6]
- 23. * гекса циано феррат (II) K+4 6]
- 24. * Классификация комплексных соединений 1. по природе
- 25. * 2. по знаку заряда комплекса катионные
- 26. * 4. По составу и хим. свойствам
- 27. * Изомерия комплексных соединений геометрическая (цис-транс-изомерия) [Pt(NH3)2Cl2]
- 28. * 2. ионизационная [Co(NH3)5Br]SO4 сульфат бромопентаамминкобальта (III) (красно-фиолетовый) [Co(NH3)5SO4]Br бромид сульфатопентаамминкобальта (III) (красный)
- 29. * 3. гидратная [Cr(H2O)6]Cl3 хлорид гексааквахрома
- 30. * 4. координационная [Co(NH3)6][Cr(CN)6] гексацианохромат (III)
- 31. * Диссоциация комплексных соединений Первичная (на ионы
- 32. * Вторичная (обратимая, ступенчатая): [Ag(NH3)2]+↔ [Ag(NH3)]+ +
- 33. * [Ag(NH3)2]+↔ Ag+ + 2NH3
- 34. * Чем больше КУ (чем меньше КН), тем устойчивее комплекс
- 35. * Многие вещества в организме (АК, белки,
- 36. * Некоторые природные
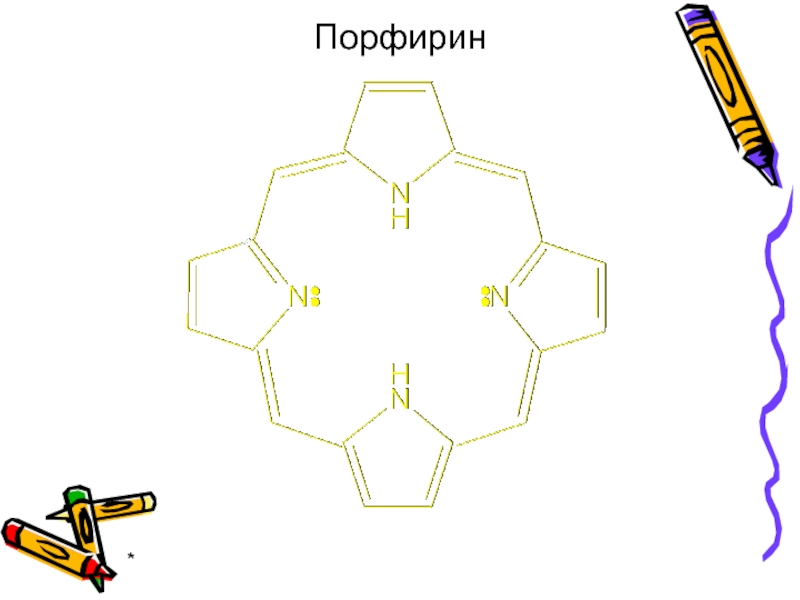
- 37. * Порфирин
- 38. * В результате комплексообразования образуются комплексные соединения
- 39. * В организмах встречаются комплексы,
- 40. * В составе гемоглобина, миоглобина, цитохромов,
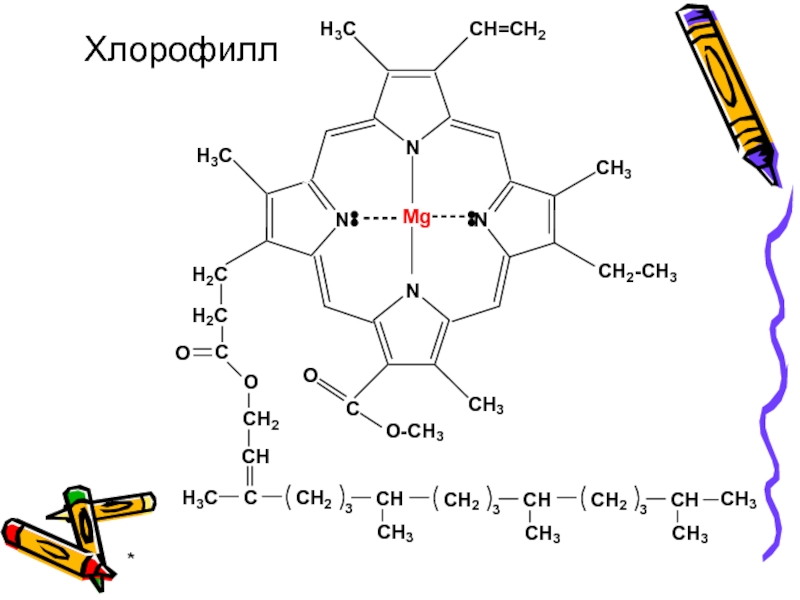
- 41. * Хлорофилл
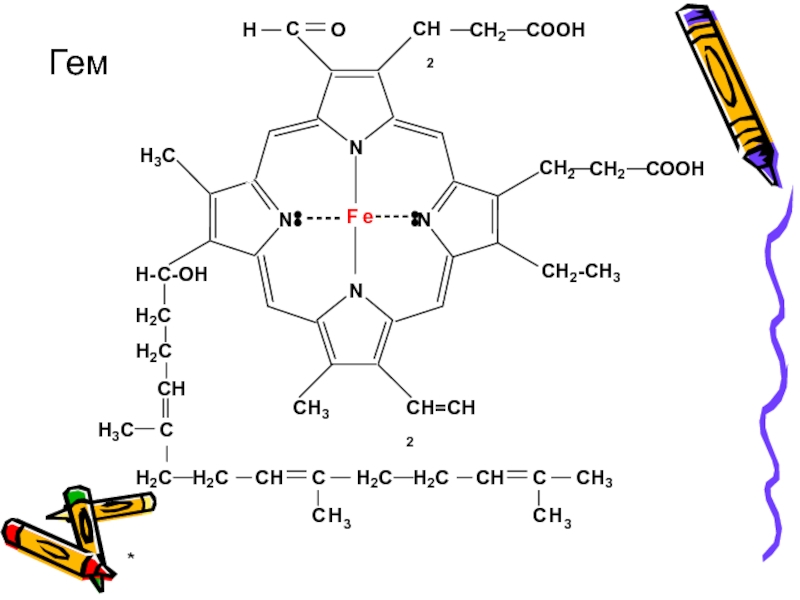
- 42. * Гем
- 43. * В гемоглобине и миоглобине комплексообразователь Fe2+
- 44. * Оксимиоглобин поддерживает необходимое парциальное давление в
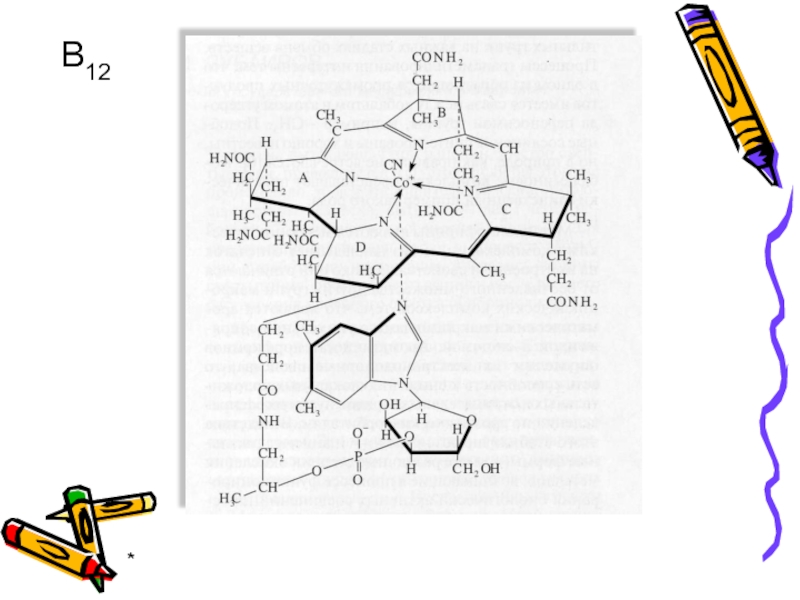
- 45. * В12
- 46. * Витамин В12
- 47. * Причины нарушения металлолигандного равновесия в организме:
Слайд 2*
Комплексными называют сложные частицы, образованные из реально существующих более простых, способные
Слайд 4*
Комплексными (координационными) соединениями называют вещества,
молекулы которых
центрального атома (или иона) М, непосредственно связанного с определенным числом n других молекул (или ионов) L, называемых лигандами
(определение основано на теории Вернера)
Положения теории Вернера:
Слайд 5*
1. М + L = внутренняя сфера
2. ионы за пределами [ ] – внешняя сфера (противоионы)
При этом в растворе ионы составляющие внутреннюю сферу не обнаруживаются:
Fe3+ + 3SCN– = Fe(SCN)3 (кроваво-красный)
K3[Fe(CN)6] + 3KSCN → нет реакции
Слайд 7*
3. число связей комплексообразователя – координационное число (кч),
Fe3+ (кч=6), Cu2+ (кч=4)
Слайд 8*
4. число связей лиганда – дентантность
- монодентантные (H2O:, CN–, :NH3,
- бидентантные (CO32–, SO32–, SO42–, :NH2CH2COO–) – две связи
Слайд 11*
как правило, лиганды – доноры электронов,
комплексообразователь – акцептор,
но
ион Hg2+ - донор электронов (… 5d10 6s2 )
I– - акцептор (…5s2 4d10 5p6 5d0 5f0 )
Слайд 12*
(OH)-
4
[Zn+x
Na+
(+1)
+ x
+ (-1)
]
2
·2
·4 = 0
x = 0-2+4
x = +2
Na+[Zn+2(OH)-4]
Расчет заряда комплексообразователя
исходя из электронейтральности:
2
Слайд 13*
На способность к комплексообразованию влияют:
1. Природа комплексообразователя (чем больше радиус М
s << p < d < f
Способность к комплексообразованию растёт
Слайд 14*
2. Природа лиганда (чем больше поляризуемость лиганда, т. е. способность трансформировать
ОН– < Н2О < Cl– < RSH < СN–
Способность к комплексообразованию растёт
Би- и полидентантные лиганды образуют
более прочные связи с М (хелатный эффект)
Слайд 15*
хелатные соединения (лат. kela – клешня)
каждая молекула этандиола
образует 2 связи
акцепторному механизму
Слайд 17*
НАЗВАНИЯ ЛИГАНДОВ:
H2O – аква-
NH3 – аммин-
СO – карбонил-
OН– - гидроксо-
(СN)– -
F–, Cl– , Br – , I – - фторо-,
хлоро-, бромо-, йодо-
(NO3)– - нитро-
O2– - оксо-
SO32– - сульфито-
SO42– - сульфато-
С2O42– - оксалато-
en – этилендиаммин-
(NH2CH2CH2NH2)
H+ - гидро-
S2– - тио-
Слайд 18*
Названия комплексообразователя:
- в составе катиона – русское (железо, серебро, никель, медь
- в составе аниона – латинское название + ат
Fe - феррат
Cu - купрат
Ag - аргентат
Au - аурат
Hg - меркурат
Zn - цинкат
Al - алюминат
Слайд 19*
В названии комплекса:
сначала название аниона (одним словом), потом название катиона
в названии комплексного иона:
число лигандов
название лигандов
название комплексообразователя;
Слайд 20*
после названия коплексообразователя указывается его валентность;
если разные лиганды, сначала отрицательные, потом
потом положительно заряженные
Слайд 21*
тетра
гидроксо
цинкат (II)
Na+2
4]
(OH)-
[Zn+2
натрия
[Cu+2
(en)0
3]
Cl-2
хлорид
этилендиаммин
три
меди (II)
Слайд 24*
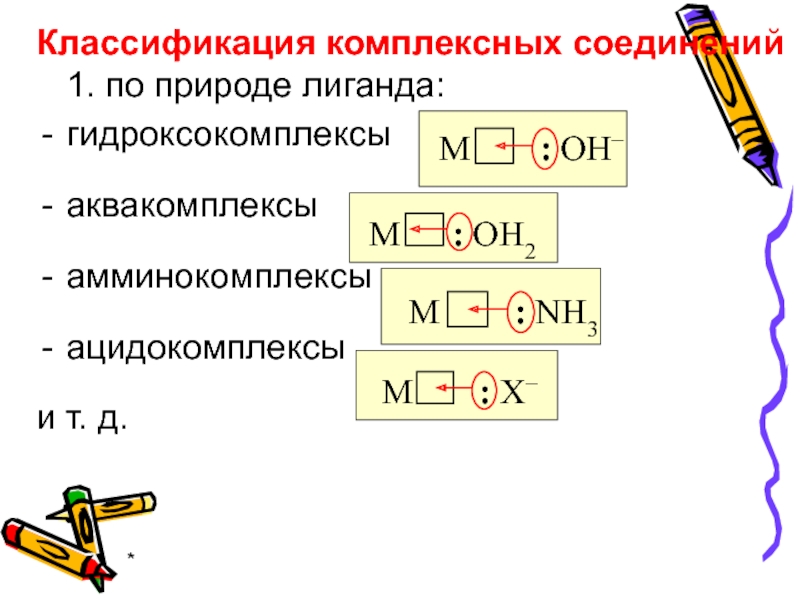
Классификация комплексных соединений 1. по природе лиганда:
гидроксокомплексы
аквакомплексы
амминокомплексы
ацидокомплексы
и т. д.
Слайд 25*
2. по знаку заряда комплекса
катионные [Ag(NH3)2]Cl
анионные K3[Fe(CN)6]
нейтральные
3. По наличию или отсутствию циклов
простые K3[Fe(CN)6]
циклические (хелаты и внутрикомплексные соединения)
Слайд 26*
4. По составу и хим. свойствам
- кислоты H[AuCl4]
- основания [Ag(NH3)2]OH
- соли
Слайд 27*
Изомерия комплексных соединений
геометрическая (цис-транс-изомерия)
[Pt(NH3)2Cl2]
цис-изомер
- противоопухолевая
активность
трас-изомер
- не активен
Слайд 28*
2. ионизационная
[Co(NH3)5Br]SO4
сульфат бромопентаамминкобальта (III)
(красно-фиолетовый)
[Co(NH3)5SO4]Br
бромид сульфатопентаамминкобальта (III)
(красный)
Слайд 29*
3. гидратная
[Cr(H2O)6]Cl3 хлорид гексааквахрома (III)
(серо-фиолетового цвета)
[Cr(H2O)5Сl ]Cl2·H2O
гидрат хлорида хлоропентааквахрома (III)
(зелёно-фиолетового цвета)
[Cr(H2O)4Сl2 ]Cl·2H2O
дигидрат хлорида дихлоротетрааквахрома (III)
(тёмно-зелёного цвета)
Слайд 30*
4. координационная
[Co(NH3)6][Cr(CN)6]
гексацианохромат (III) гексаамминкобальта (III)
[Cr(NH3)6][Co(CN)6]
гексацианокобальтат (III) гексаамминхрома (III)
Слайд 31*
Диссоциация комплексных соединений
Первичная (на ионы внешней и внутренней сферы):
[Ag(NH3)2]Cl =
Сильный электролит - распадается полностью
Слайд 35*
Многие вещества в организме (АК, белки, НК, витамины, гормоны, порфирины) являются
Слайд 36*
Некоторые природные прочные комплексные соединения содержат в
Важнейшим свойством порфиринов является наличие в молекуле координационной полости, ограниченной 4 атомами азота и способной координировать ионы металлов различной степени окисления.
Слайд 38*
В результате комплексообразования образуются комплексные соединения порфиринов (металлопорфирины) обладающие многообразными структурными
Слайд 39*
В организмах встречаются комплексы, в которых
Слайд 40*
В составе гемоглобина, миоглобина, цитохромов, каталазы и пероксидазы порфирины выступают
Слайд 43*
В гемоглобине и миоглобине комплексообразователь Fe2+ образует 4 связи с
Слайд 44*
Оксимиоглобин поддерживает необходимое парциальное давление в тканях.
Оксигемоглобин переносит О2 в
Слайд 46*
Витамин В12 необходим для нормального кроветворения и
Накапливается витамин В12 в печени. Его недостаток в организме вызывает злокачественную анемию.
Слайд 47*
Причины нарушения металлолигандного равновесия в организме:
Долговременное непоступление в организм катионов биометаллов
Поступление катионов биометаллов в значительно больших количествах;
Поступление катионов токсичных металлов.

![*Fe(CN)3 + 3KCN → K3[Fe(CN)6]CuSO4+5H2O→ [Cu(H2O)4]SO4·H2O NiCl2+6H2O→[Ni(H2O)6]Cl2](/img/tmb/5/485355/d4f3a6cf123e370c70e7f34c979c631d-800x.jpg)


![* [Ni(NH3)6]Cl2 K4[Fe(CN)6][Cr(CO)6]Внеш.сферы нет](/img/tmb/5/485355/1214c2952107574592d6967f96b50194-800x.jpg)

![*[Al(OH)4]-Механизм образования донорно-акцепторных связей:Al3+sp3 гибридизация](/img/tmb/5/485355/37c7feaf8aca4cccd9393d2ee9e1c4df-800x.jpg)
![* как правило, лиганды – доноры электронов, комплексообразователь – акцептор, но есть исключение [HgI4]2- :ион](/img/tmb/5/485355/1f413ceebe1d73a95a5e2ef6fc2abb09-800x.jpg)
![*(OH)-4[Zn+xNa+(+1)+ x+ (-1)]2·2·4 = 0x = 0-2+4x = +2Na+[Zn+2(OH)-4]Расчет заряда комплексообразователя исходя из электронейтральности: 2](/img/tmb/5/485355/80b5cebd4ebadeb72d951ba7b7f5b852-800x.jpg)







-[Zn+2натрия[Cu+2(en)03]Cl-2хлоридэтилендиамминтримеди (II)](/img/tmb/5/485355/cda717a29d117c6477d079314c12f477-800x.jpg)
-[Fe3+калия[Ag+(NH3)02]Cl-хлоридамминдисеребра (I)](/img/tmb/5/485355/3ff16fba75aaa6a7c0871a349d0bd11f-800x.jpg)
-[Fe2+калия[Co+3Сl3 (NH3)3]триамминтрихлорокобальт (III)](/img/tmb/5/485355/a8b1408ca4366e25b2fc5ee2d108534c-800x.jpg)
![*2. по знаку заряда комплексакатионные [Ag(NH3)2]Clанионные K3[Fe(CN)6]нейтральные [Pt(NH3)2Cl2]3. По наличию или отсутствию цикловпростые](/img/tmb/5/485355/62a5650824ba238c0f81ee38944d3277-800x.jpg)
![*4. По составу и хим. свойствам- кислоты H[AuCl4]- основания [Ag(NH3)2]OH- соли [Co(NH3)6]Cl2](/img/tmb/5/485355/fa71865ad438b040b2259c083d09e8ae-800x.jpg)
![*Изомерия комплексных соединенийгеометрическая (цис-транс-изомерия)[Pt(NH3)2Cl2]цис-изомер- противоопухолеваяактивность трас-изомер- не активен](/img/tmb/5/485355/17f17f979641fdb9aa84d4bd4991c80d-800x.jpg)
![*2. ионизационная[Co(NH3)5Br]SO4 сульфат бромопентаамминкобальта (III)(красно-фиолетовый)[Co(NH3)5SO4]Br бромид сульфатопентаамминкобальта (III)(красный)](/img/tmb/5/485355/359750f793388638d2d242ef8434ea90-800x.jpg)
![*3. гидратная[Cr(H2O)6]Cl3 хлорид гексааквахрома (III)](/img/tmb/5/485355/2b45c474d4b0d2ffb6902c752005e25f-800x.jpg)
![*4. координационная [Co(NH3)6][Cr(CN)6]гексацианохромат (III) гексаамминкобальта (III)[Cr(NH3)6][Co(CN)6]гексацианокобальтат (III) гексаамминхрома (III)](/img/tmb/5/485355/79ce37582fe06ae35ef5d850d88164a8-800x.jpg)
![*Диссоциация комплексных соединенийПервичная (на ионы внешней и внутренней сферы): [Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl– Сильный](/img/tmb/5/485355/f8c6982d4c8eb6880d04023fbcd7d989-800x.jpg)
![*Вторичная (обратимая, ступенчатая):[Ag(NH3)2]+↔ [Ag(NH3)]+ + NH3 [Ag(NH3)]+↔ Ag+ + NH3](/img/tmb/5/485355/db3b8a7b702469ffbf021e967752cefa-800x.jpg)
![*[Ag(NH3)2]+↔ Ag+ + 2NH3](/img/tmb/5/485355/15833602d0bbf947d074f5eafd086950-800x.jpg)