- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лигандообменные равновесия и процессы презентация
Содержание
- 1. Лигандообменные равновесия и процессы
- 2. Координационная теория, предложенная в 1893 году А.
- 3. Комплексные соединения – устойчивые хим. соединения
- 4. [Ag(NH3)2] внутренняя сфера внешняя
- 5. по составу: Основания [Ag(NH3)2]OH Кислоты Н[AuCl4] Соли Na2[Zn(OH)4] КЛАССИФИКАЦИЯ Неэлектролиты [Pt(NH3)2Cl2]
- 6. по виду лигандов: Амино- [Cu(NH3)4](OH)2 Аква- [Cr(H2O)6]Cl3 Гидроксо- Na2[Zn(OH)4]
- 7. по заряду внутренней сферы: Катионные [Ag(NH3)2]+OH
- 8. Диссоциация комплексных соединений Первичная диссоциация –
- 9. Вторичная диссоциация – распад внутренней сферы на
- 10. Устойчивость комплексных соединений Для качественной
- 11. Константа устойчивости (Kуст) - величина,
- 12. Константы нестойкости некоторых комплексных ионов
- 13. Комплексообразователь (центральный атом (М)) – атом или
- 16. Лиганды (L) – молекулы или ионы, которые
- 17. Если в состав лиганда входит атом имеющий
- 18. Би- и полидентатные лиганды часто образуют хелаты
- 19. Эффективность донорно-акцепторного взаимодействия L и M (прочность
- 21. Наиболее прочная связь возникает между «мягкими» L
- 22. Биокомплексы: ферменты, витамины, гармоны.
- 23. Очень «мягкие»: Cd2+, Pb2+, Hg2+, сильно токсичны,
- 24. Детоксикацию организма от металлов токсикантов проводят при
- 25. унитиол
- 26. тетацин (кальцийдинатриевая соль ЭДТА) -OOCH2C
Слайд 2Координационная теория, предложенная в 1893 году А. Вернером и дополненная Л.А.Чугаевым.
Лев Александрович
Чугаев
(1873-1922)
Альфред
Вернер
(1866-1919)
Слайд 3
Комплексные соединения – устойчивые хим. соединения сложного состава, в которых хотя
Образование комплексной соли
3KCN + Fe(CN)3 = K3[Fe(CN)6]
Слайд 4[Ag(NH3)2]
внутренняя сфера
внешняя сфера
комплексообразователь
лиганды
Cl
координационное число
[Fe(CN)6]
K3
комплексный катион
комплексный анион
Слайд 5по составу:
Основания
[Ag(NH3)2]OH
Кислоты
Н[AuCl4]
Соли
Na2[Zn(OH)4]
КЛАССИФИКАЦИЯ
Неэлектролиты
[Pt(NH3)2Cl2]
Слайд 7по заряду внутренней сферы:
Катионные
[Ag(NH3)2]+OH
Нейтральные
[Pt(NH3)2Cl2]0
Анионные
Na2[Zn(OH)4] -
Слайд 8Диссоциация комплексных соединений
Первичная диссоциация –
распад КС в растворе на ионы
[Zn(NH3)4]Cl2 → [Zn(NH3)4]2+ + 2Cl-
Слайд 9Вторичная диссоциация – распад внутренней сферы на составляющие ее компоненты. Процесс
[Zn(NH3)4]2+ ↔ Zn2+ + 4NH30
Слайд 10Устойчивость комплексных соединений
Для качественной характеристики устойчивости КС используют:
комплекса (Кнест)
.
Чем меньше значение Кнест, тем более устойчиво КС.
Слайд 11 Константа устойчивости (Kуст) - величина, обратная Кнест
.
Чем больше значение Куст, тем более устойчиво КС
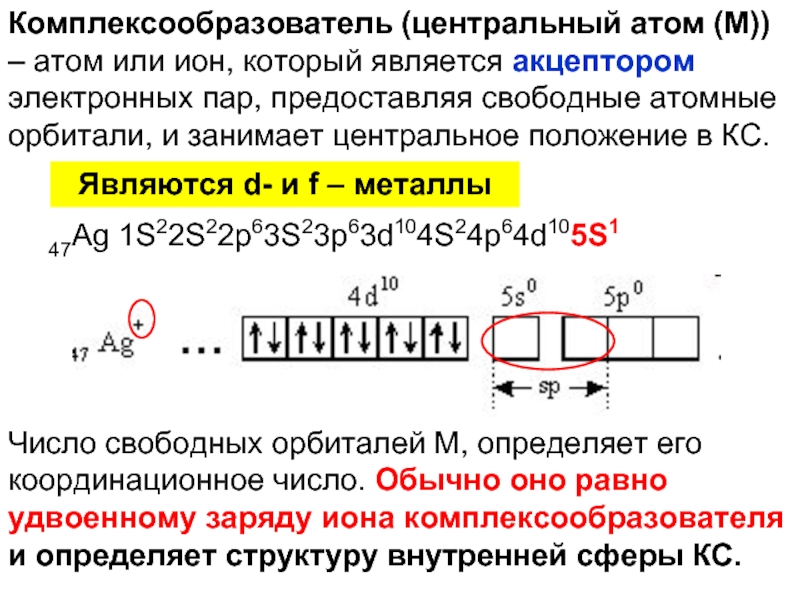
Слайд 13Комплексообразователь (центральный атом (М)) – атом или ион, который является акцептором
47Ag 1S22S22p63S23p63d104S24p64d105S1
Являются d- и f – металлы
Число свободных орбиталей М, определяет его координационное число. Обычно оно равно удвоенному заряду иона комплексообразователя и определяет структуру внутренней сферы КС.
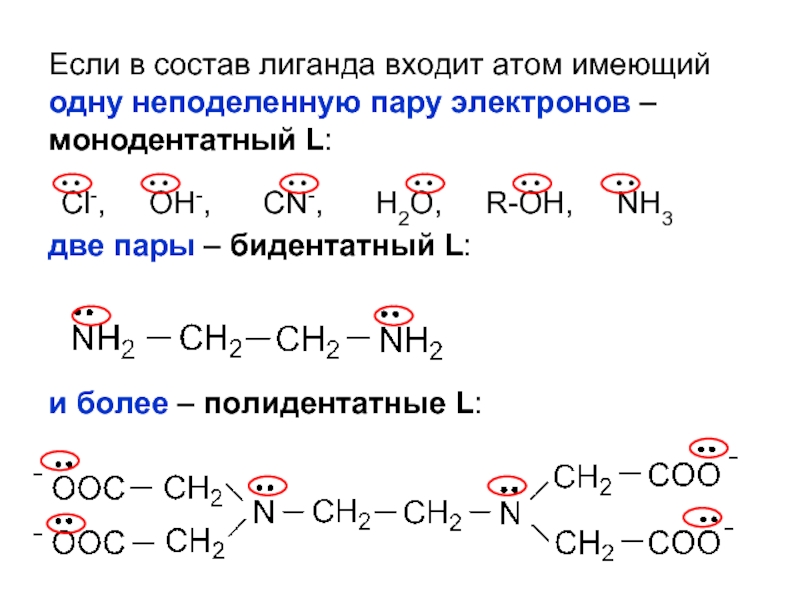
Слайд 16Лиганды (L) – молекулы или ионы, которые являются донорами электронных пар
По числу связей, образуемых лигандом с комплексообразователем, лиганды делятся на моно-, би- и полидентатные.
Слайд 17Если в состав лиганда входит атом имеющий одну неподеленную пару электронов
две пары – бидентатный L:
и более – полидентатные L:
Cl-, OH-, CN-, H2O, R-OH, NH3
• •
• •
• •
• •
• •
• •
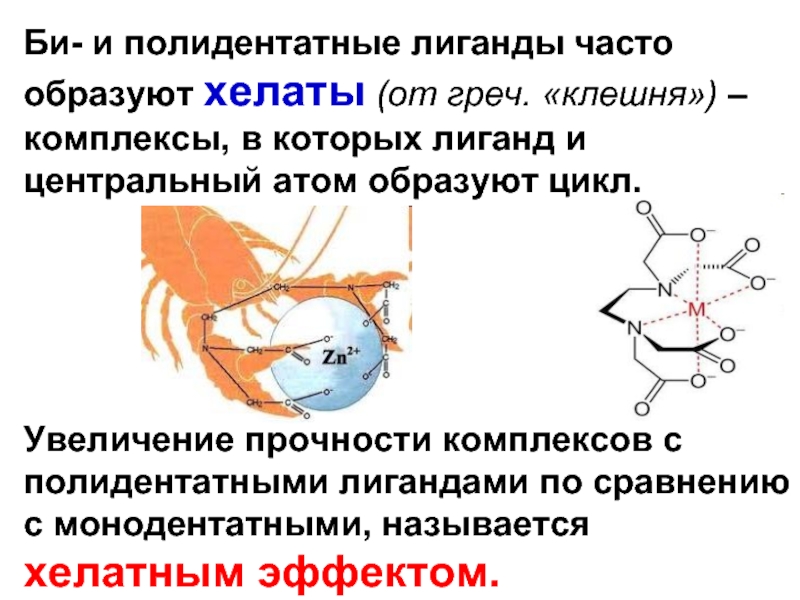
Слайд 18Би- и полидентатные лиганды часто образуют хелаты (от греч. «клешня») –
Увеличение прочности комплексов с полидентатными лигандами по сравнению с монодентатными, называется хелатным эффектом.
Слайд 19Эффективность донорно-акцепторного взаимодействия L и M (прочность связи) определяется их поляризуемостью.
Чем
Слайд 21Наиболее прочная связь возникает между «мягкими» L и M.
Белки содержат «мягкие»
Слайд 23Очень «мягкие»: Cd2+, Pb2+, Hg2+, сильно токсичны, т.к. образуют прочные комплексы
Тиоловые яды
Слайд 24Детоксикацию организма от металлов токсикантов проводят при помощи лиганд-препаратов на основе
Эффективными препаратами для хелатотерапии являются:
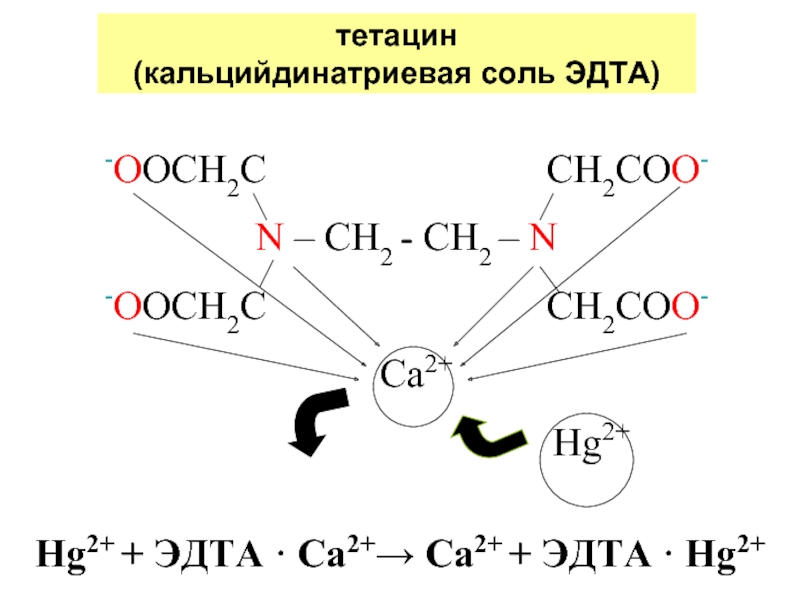
Слайд 26тетацин
(кальцийдинатриевая соль ЭДТА)
-OOCH2C
N – CH2 - CH2 – N
-OOCH2C CH2COO-
Сa2+
Hg2+
Hg2+ + ЭДТА · Ca2+→ Ca2+ + ЭДТА · Hg2+



![[Ag(NH3)2]внутренняя сферавнешняя сферакомплексообразовательлиганды Clкоординационное число[Fe(CN)6]K3комплексный катионкомплексный анион](/img/tmb/1/11458/dd44b6a39ed17a38d6f03e41528545af-800x.jpg)
![по составу:Основания[Ag(NH3)2]OHКислотыН[AuCl4]СолиNa2[Zn(OH)4]КЛАССИФИКАЦИЯНеэлектролиты[Pt(NH3)2Cl2]](/img/tmb/1/11458/89bb8948bdbce27fb8a190a4b1282c71-800x.jpg)
2Аква-[Cr(H2O)6]Cl3Гидроксо-Na2[Zn(OH)4]](/img/tmb/1/11458/c1dc48af525d5c798c18644ac2291053-800x.jpg)
![по заряду внутренней сферы:Катионные[Ag(NH3)2]+OHНейтральные[Pt(NH3)2Cl2]0АнионныеNa2[Zn(OH)4] -](/img/tmb/1/11458/f046235fd5c4e2c9b0a2a74ea3970b85-800x.jpg)