- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 6. Химическая кинетика презентация
Содержание
- 1. Лекция 6. Химическая кинетика
- 2. Химическая кинетика - то раздел химии, изучающий скорость и механизм химических реакций.
- 3. 6.1 Понятие о скорости и механизме химических
- 4. Большинство биохимических реакций являются гомогенными (протекающими в
- 5. Средняя скорость гомогенной реакции (υ) равна изменению
- 6. [A]0_ и [A] – исходная и
- 7. Средняя скорость гетерогенной реакции, протекающей на границе
- 8. где ν0 и ν – количество вещества
- 9. Чтобы произошла химическая реакция, необходимо взаимодействие между
- 11. Во всем многообразии столкновений выделяют элементарные стадии
- 12. Характеристикой элементарной стадии является ее молекулярность, т.е.
- 13. Механизм химической реакции – это число и последовательность элементарных стадий процесса.
- 14. Химические реакции простые по механизму представляет собой
- 15. 6.2 Уравнения, описывающие влияние концентрации реагирующих веществ на скорость химических реакций, называются кинетическими уравнениями.
- 16. Кинетические уравнения составляют на основе закона действующих
- 17. Математическое выражение ЗДМ для реакции: аА +
- 18. k зависит от температуры и природы веществ
- 19. Порядок реакции определяется только экспериментально. Он является
- 20. Только для простых реакций порядок и молекулярность
- 21. Кинетическое описание простых реакций. Реакции нулевого порядка
- 22. Условное уравнение: Константа скорости
- 23. [A] Кинетическая кривая реакций нулевого порядка υ
- 24. Время полуреакции (τ ½) –это время, необходимое
- 25. Реакции первого порядка (n=1) Примеры: каталитические и
- 26. Условное уравнение: Константа скорости
- 27. Кинетическая кривая реакции первого порядка [A] υ
- 28. Время полуреакции: τ ½ = ℓn 2 k
- 29. Кинетика сложных реакций 1) обратимые реакции
- 30. A B C k1 k2 KClO3
- 31. Скорость реакции равна скорости ее лимитирующей
- 32. υ T 6.3 Влияние температуры
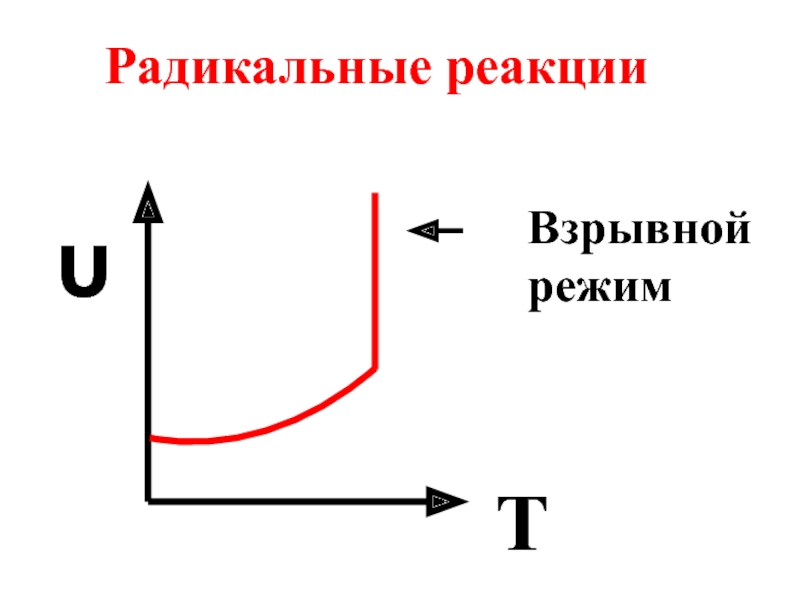
- 33. υ T Взрывной режим Радикальные реакции
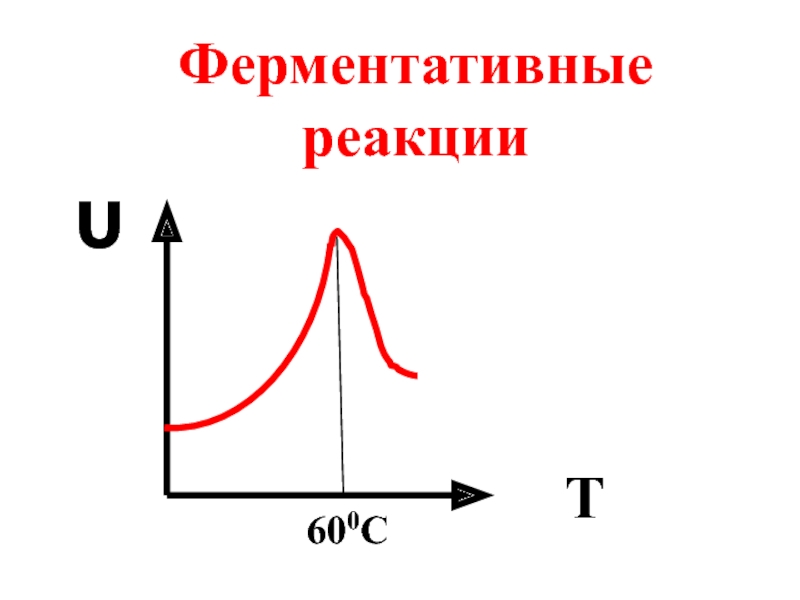
- 34. Ферментативные реакции υ T 600C
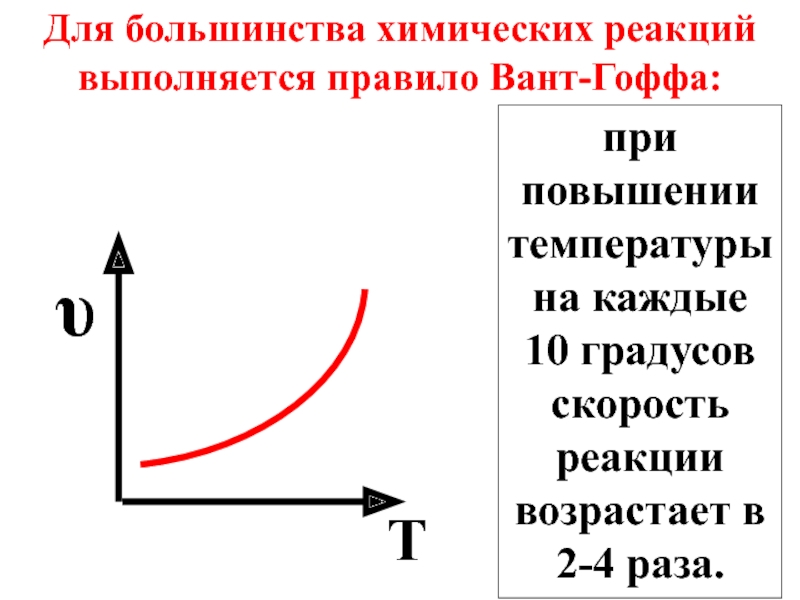
- 35. Для большинства химических реакций выполняется правило Вант-Гоффа:
- 36. υT 2 = υT 1 γ
- 37. Значительно точнее зависимость скорости и температуры описывается
- 38. где υ0 и k0 - коэффициенты пропорциональности,
- 39. С точки зрения теории активного комплекса, энергия
- 40. Активный комплекс - промежуточная частица, в которой
- 41. Схема химической реакции : А + В
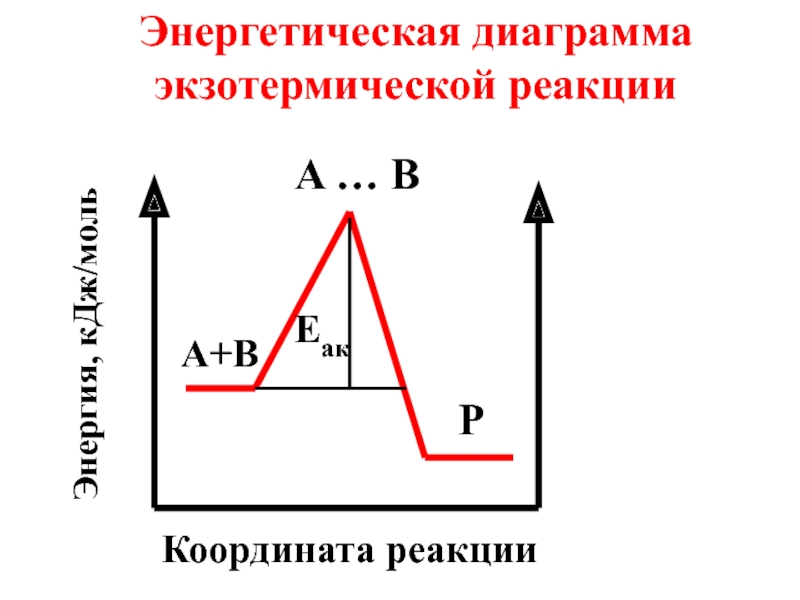
- 43. Энергетическая диаграмма экзотермической реакции A … B P A+B Eaк Координата реакции Энергия, кДж/моль
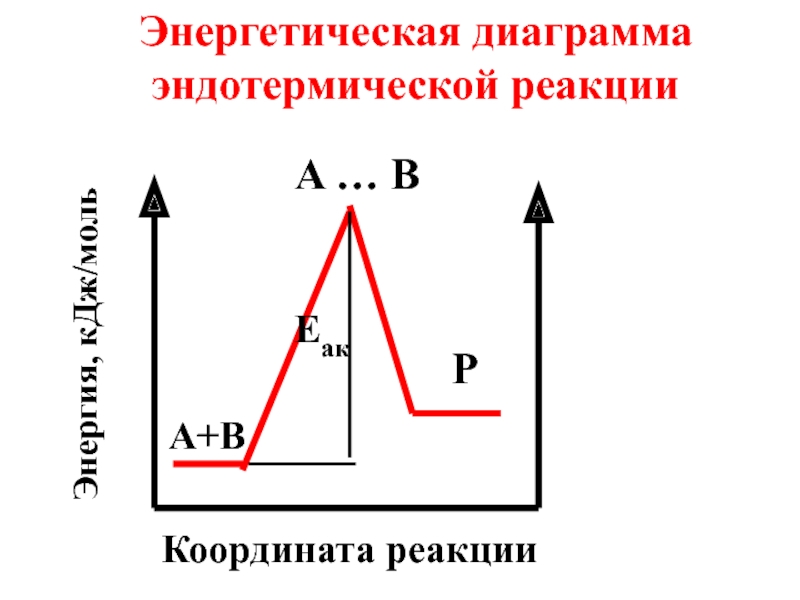
- 44. Энергетическая диаграмма эндотермической реакции A … B P A+B Eaк Координата реакции Энергия, кДж/моль
- 45. Энергия активации (Еак) зависит от природы реагирующих веществ и не зависит от температуры.
- 46. С повышением температуры в реакционной смеси возрастает
- 47. 6.4 Катализаторы – это вещества, изменяющие скорость
- 48. С точки зрения теории активного комплекса механизм
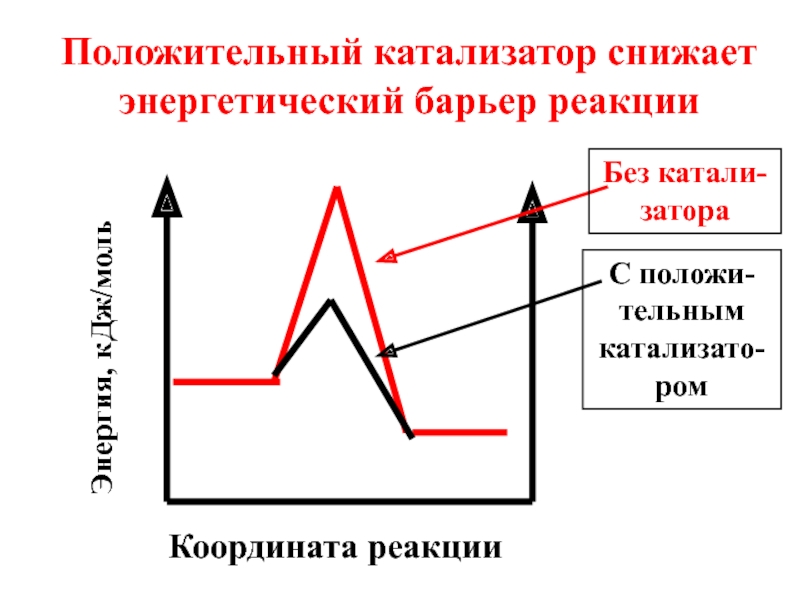
- 49. Координата реакции Положительный катализатор снижает энергетический барьер реакции Энергия, кДж/моль Без катали-затора С положи-тельным катализато-ром
- 50. Под воздействием положи-тельного катализатора в реакционной смеси
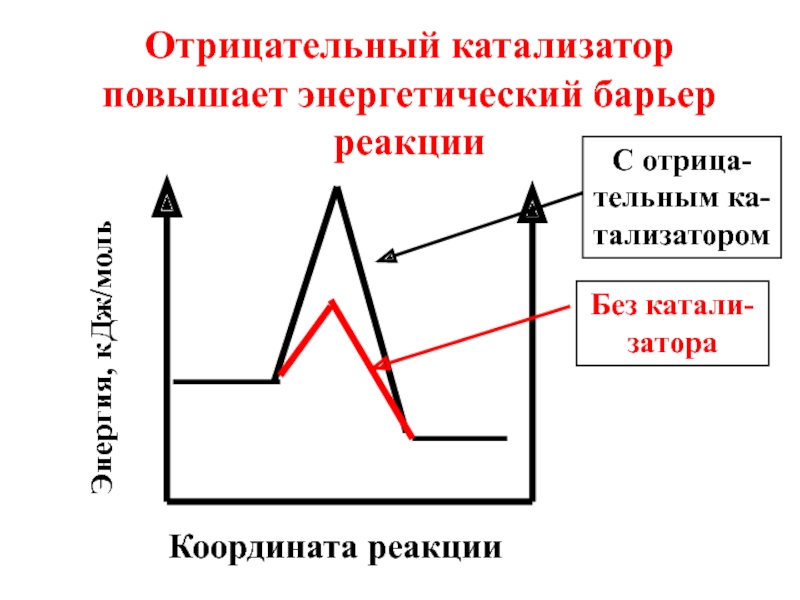
- 51. Координата реакции Отрицательный катализатор повышает энергетический барьер реакции Энергия, кДж/моль Без катали-затора С отрица-тельным ка-тализатором
- 52. Под воздействием отрицательного катализатора в реакционной смеси
- 53. Практически все биохимические реакции являются ферментативными. Фермен-ты
- 54. Ферменты отличаются от обычных катализаторов: а) более
- 55. Механизм односубстратной ферментативной реакции можно представить схемой:
- 56. Е –
- 57. Характеристикой первой стадии ферментативной реакции является КМ
- 58. KM KM = 10‾5–10‾3 моль/л Чем меньше КМ, тем устойчивее комплекс .
- 59. Кинетическое уравнение ферментативной реакции: υ = k2
- 60. k2 равна числу молекул субстрата, превращающихся в
- 61. Из-за невозможности экспериментального определения [ES], уравнение (1)
- 62. υ = [E]общ [S] KM +
- 63. Произведение k2×[E]общ является величиной постоянной, которую обозначают
- 64. При низкой концентрации субстрата
- 65. 2) При высокой концентрации субстрата Км
- 66. Кинетическая кривая ферментативной реакции [S] υ Реакция нулевого порядка Реакция первого порядка
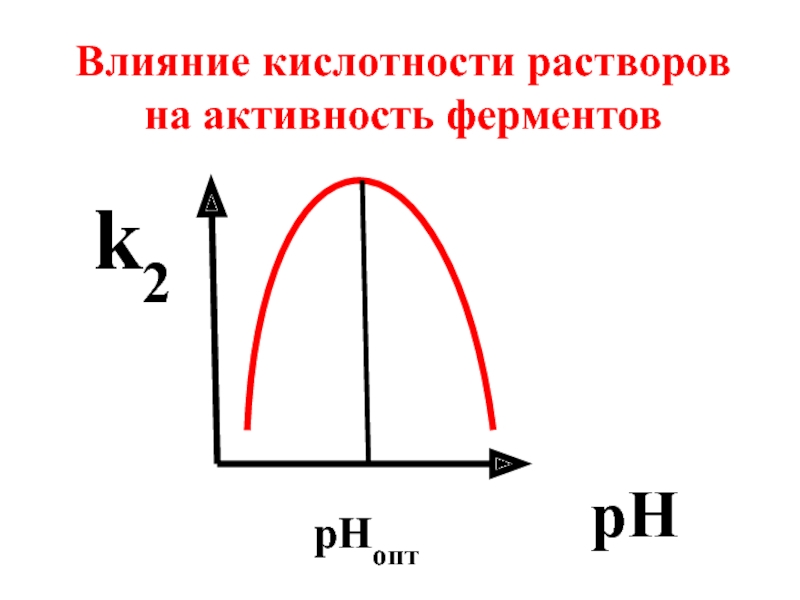
- 67. На активность ферментов оказывают влияние: а) температура, б) кислотность среды, в) наличие ингибиторов
- 68. pH рНопт Влияние кислотности растворов на активность ферментов k2
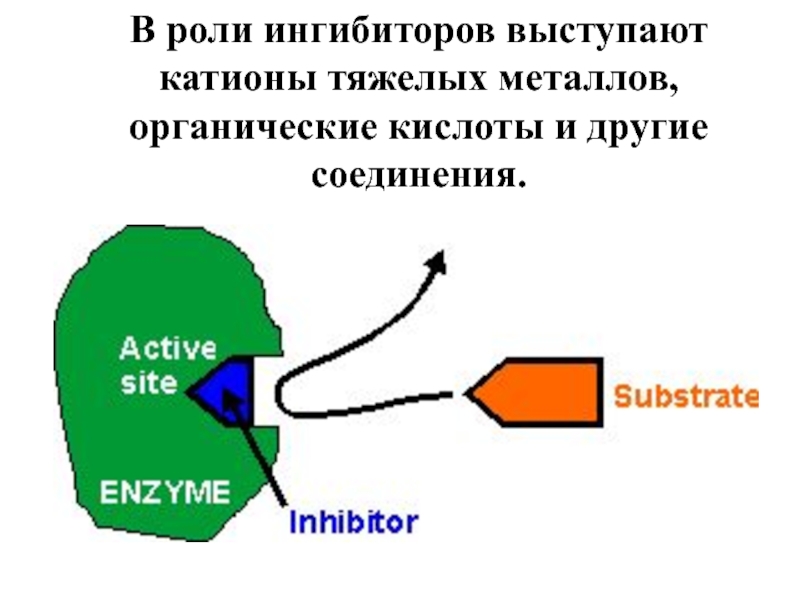
- 69. Ингибиторы ферментов – это вещества, занимающие часть
- 70. В роли ингибиторов выступают катионы тяжелых металлов, органические кислоты и другие соединения.
- 71. Благодарим за внимание !!!
Слайд 36.1 Понятие о скорости и механизме химических реакций.
6.2 Влияние концентрации реагирующих
6.3 Влияние температуры на скорость химических реакций.
6.4 Ферментативный катализ
План
Слайд 4Большинство биохимических реакций являются гомогенными (протекающими в одной фазе). Они могут
Слайд 5Средняя скорость гомогенной реакции (υ) равна изменению концентрации вещества в единицу
υ =
[A] - [A]0
τ
Слайд 6 [A]0_ и [A] – исходная и конечная концентрация вещества, моль/л
τ
(+) – вещество образуется,
(–) – вещество расходуется.
Слайд 7Средняя скорость гетерогенной реакции, протекающей на границе раздела фаз, равна изменению
υ =
ν - ν0 S ×τ
Полное обновление костной ткани составляет от 4 до 7 лет.
Слайд 8где ν0 и ν – количество вещества в начальный и конечный
S – площадь поверхности раздела фаз, м2
Слайд 9Чтобы произошла химическая реакция, необходимо взаимодействие между молекулами реагирующих веществ.
Слайд 11Во всем многообразии столкновений выделяют элементарные стадии процесса. Элементарная стадия –
Слайд 12Характеристикой элементарной стадии является ее молекулярность, т.е. число участвующих в ней
мономолекулярными I2 → 2I
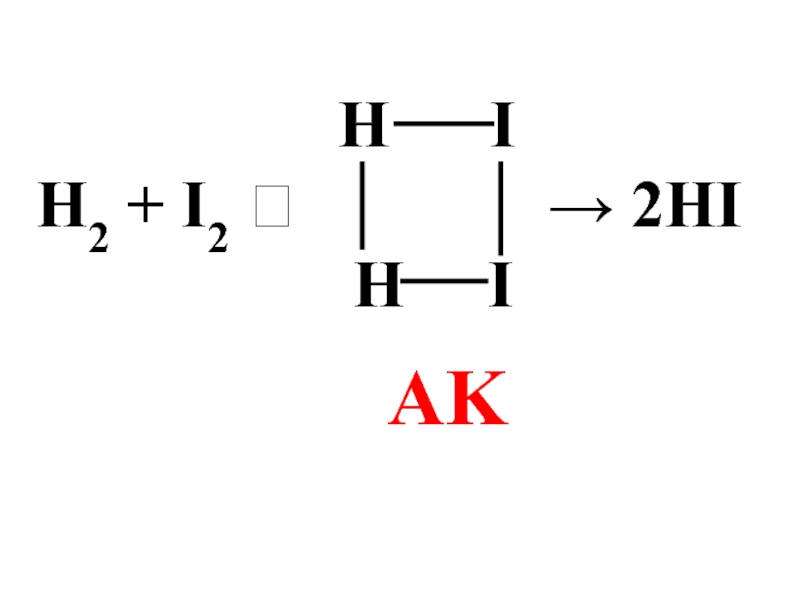
бимолекулярными Н2 + I2 → 2HI
тримолекулярными 2NO + O2 → 2NO2
Слайд 14Химические реакции
простые по механизму представляет собой многократное чередование одной элементарной стадии
сложные
Слайд 156.2 Уравнения, описывающие влияние концентрации реагирующих веществ на скорость химических реакций,
Слайд 16Кинетические уравнения составляют на основе закона действующих масс (Гульдберг и Вааге,1867):
Слайд 17Математическое выражение ЗДМ для реакции:
аА + bВ + cС → Р
υ
где k – константа скорости, являющаяся фундаментальной кинетической характеристикой реакций.
Слайд 18k зависит от температуры и природы веществ и не зависти от
[A], [B], [C] – концентрации реагирующих веществ, моль/л;
x, y и z – порядок реакции по веществам.
Общий порядок реакции (n) равен: n = x + y + z
Слайд 19Порядок реакции определяется только экспериментально. Он является величиной формальной и может
Слайд 21Кинетическое описание простых реакций.
Реакции нулевого порядка (n=0)
Примеры: фотохимические, каталитические и ферментативные
Слайд 22Условное уравнение:
Константа
скорости
[A]0
k =
τ
А → Р
Кинетическое уравнение:
υ = k [A]0= k
Слайд 24Время полуреакции (τ ½) –это время, необходимое для уменьшения концентрации исходного
[A]0
τ ½ =
2k
Слайд 25Реакции первого порядка (n=1)
Примеры: каталитические и ферментативные реакции (при низкой концентрации
Слайд 29Кинетика сложных реакций
1) обратимые реакции
A B
k1
k2
Кинетическое уравнение:
υ = k1[A] – k2[B]
Слайд 30
A
B
C
k1
k2
KClO3
2) Параллельные реакции
KCl + O2
KCl + KClO4
Кинетическое уравнение:
υ = k1 ([A]0
Слайд 31
Скорость реакции равна скорости ее лимитирующей стадии: υ = k2
3) Последовательные реакции
A B C
k1
k2
быстрая
медленная
(лимитирующая)
Слайд 32υ
T
6.3 Влияние температуры на скорость может быть различным. Скорость тримолекулярных
Слайд 35Для большинства химических реакций выполняется правило Вант-Гоффа:
при повышении температуры на каждые
T
υ
Слайд 36
υT
2
=
υT
1
γ
T2 – T1
10
где Т1 и Т2 - начальная и конечная температура,
-
2 < γ < 4
Слайд 37Значительно точнее зависимость скорости и температуры описывается уравнением Аррениуса:
-Еак/RT
υ =
k = k0e
-Еак/RT
Слайд 38где υ0 и k0 - коэффициенты пропорциональности, называемые предэкспоненциальными множителями,
Еак -
Слайд 39С точки зрения теории активного комплекса, энергия активации (энергетический барьер химической
Слайд 40Активный комплекс
- промежуточная частица, в которой старые связи еще не полностью
Слайд 43Энергетическая диаграмма экзотермической реакции
A … B
P
A+B
Eaк
Координата реакции
Энергия, кДж/моль
Слайд 44Энергетическая диаграмма эндотермической реакции
A … B
P
A+B
Eaк
Координата реакции
Энергия, кДж/моль
Слайд 46С повышением температуры в реакционной смеси возрастает доля активных молекул, способных
Слайд 476.4 Катализаторы – это вещества, изменяющие скорость химической реакции, но не
Слайд 48С точки зрения теории активного комплекса механизм действия катализаторов в том,
Слайд 49Координата реакции
Положительный катализатор снижает энергетический барьер реакции
Энергия, кДж/моль
Без катали-затора
С положи-тельным катализато-ром
Слайд 50Под воздействием положи-тельного катализатора в реакционной смеси возрастает доля активных молекул
Слайд 51Координата реакции
Отрицательный катализатор повышает энергетический барьер реакции
Энергия, кДж/моль
Без катали-затора
С отрица-тельным ка-тализатором
Слайд 52Под воздействием отрицательного катализатора в реакционной смеси снижается доля активных молекул
Слайд 53Практически все биохимические реакции являются ферментативными. Фермен-ты (биокатализаторы) – это вещества
Слайд 54Ферменты отличаются от обычных катализаторов:
а) более высокой каталитической активностью;
б) высокой специфичностью,
Слайд 55Механизм односубстратной ферментативной реакции можно представить схемой:
P+
KM
k2
Лимитирующая стадия
Слайд 57Характеристикой первой стадии ферментативной реакции является КМ – константа Михаэлиса.
Слайд 59Кинетическое уравнение ферментативной реакции:
υ = k2 [ES], (1)
где
Слайд 60k2 равна числу молекул субстрата, превращающихся в продукт под воздействием одной
1×104 < k2 < 6×106 мин‾1
Слайд 61Из-за невозможности экспериментального определения [ES], уравнение (1) преобразовали, выразив [ES] через
Слайд 62
υ =
[E]общ [S]
KM + [S]
k2
Кинетическое уравнение ферментативных реакций (уравнение Михаэлиса-Ментен)
Слайд 63Произведение k2×[E]общ является величиной постоянной, которую обозначают υmax (максимальная скорость)
υ
υmax [S]
KM + [S]
Слайд 64При низкой концентрации субстрата KM >> [S],
поэтому
υ
υmax
KM
[S]
Кинетическое уравнение реакции 1-го порядка




![Средняя скорость гомогенной реакции (υ) равна изменению концентрации вещества в единицу времени: υ =[A] - [A]0](/img/tmb/6/510526/3f3acf468ce4c45a3ab6c957f71c2d7b-800x.jpg)
![[A]0_ и [A] – исходная и конечная концентрация вещества, моль/лτ - время реакции, с.,](/img/tmb/6/510526/cb9bd830d9634478b5d5754bea3d5989-800x.jpg)








![Математическое выражение ЗДМ для реакции:аА + bВ + cС → Рυ = k [A]x [B]y](/img/tmb/6/510526/f3541e502d76551dfce30b836aee2904-800x.jpg)
![k зависит от температуры и природы веществ и не зависти от их концентрации;[A], [B], [C]](/img/tmb/6/510526/805bdb918b66b9b7162b0c7dad91fe56-800x.jpg)

![Только для простых реакций порядок и молекулярность совпадают:H2 + I2 → 2HIυ = k [H2][I2]](/img/tmb/6/510526/60715dbeaab1850d53d6d34ff87ef907-800x.jpg)

![Условное уравнение:Константаскорости [A]0 - [A]k =](/img/tmb/6/510526/cc3939a7fabce57a735fd592d45527ea-800x.jpg)
![[A]Кинетическая кривая реакций нулевого порядкаυ](/img/tmb/6/510526/0da00c1845b47015075593952f9a7535-800x.jpg)


![Условное уравнение:Константаскорости k = 1τ[A]0 [A]ℓnА → РКинетическое](/img/tmb/6/510526/bb0878fd5cb51a8adc93daf99575089a-800x.jpg)
![Кинетическая кривая реакции первого порядка[A]υ](/img/tmb/6/510526/30f68bb7dd48a9ee449f2ac5a2f62b06-800x.jpg)

![Кинетика сложных реакций1) обратимые реакцииA B k1k2Кинетическое уравнение: υ = k1[A] – k2[B]](/img/tmb/6/510526/552b9a67fa4ab6f02dfd0665fd2f345b-800x.jpg)
![ABCk1k2KClO32) Параллельные реакцииKCl + O2KCl + KClO4Кинетическое уравнение:υ = k1 ([A]0 – [B]) + k2](/img/tmb/6/510526/95da65b9991208f9ec86765406e43de9-800x.jpg)
![Скорость реакции равна скорости ее лимитирующей стадии: υ = k2 [B]3) Последовательные реакцииA B](/img/tmb/6/510526/4abff66d3aac61d04e936e7967236a4f-800x.jpg)

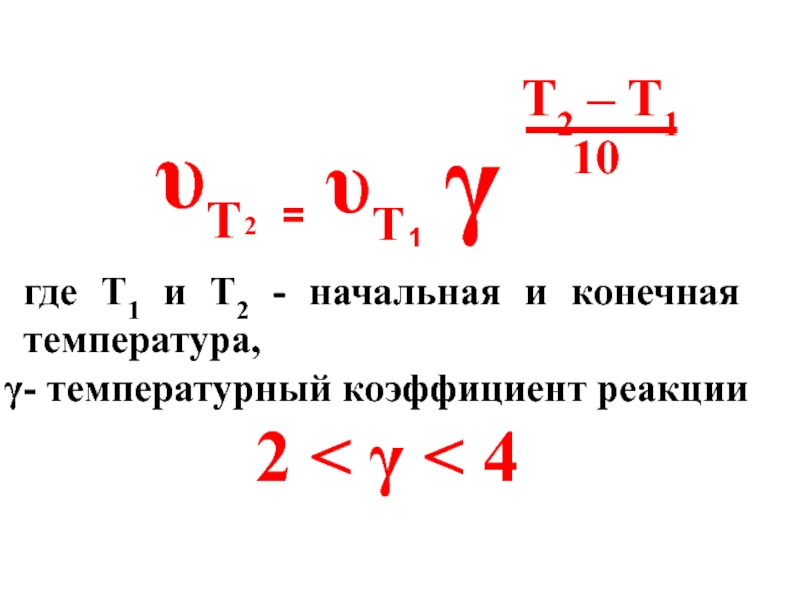

















![Кинетическое уравнение ферментативной реакции:υ = k2 [ES], (1)где k2 – константа скорости, называемая числом](/img/tmb/6/510526/b9947bff37f8c4569432b9040215974b-800x.jpg)

![Из-за невозможности экспериментального определения [ES], уравнение (1) преобразовали, выразив [ES] через легко измеряемые параметры реакции.](/img/tmb/6/510526/b5ca808a099842cb0133f3897f808b3f-800x.jpg)
![υ =[E]общ [S]KM + [S]k2 Кинетическое уравнение ферментативных реакций (уравнение Михаэлиса-Ментен) 1913](/img/tmb/6/510526/104918d9ed85267a2b8dc4e725c68df5-800x.jpg)
![Произведение k2×[E]общ является величиной постоянной, которую обозначают υmax (максимальная скорость) υ =υmax [S] KM + [S]](/img/tmb/6/510526/dcd035ed18be9b8fd1574a4c32af62a7-800x.jpg)
![При низкой концентрации субстрата KM >> [S], поэтомуυ =υmaxKM[S]Кинетическое уравнение реакции 1-го порядка](/img/tmb/6/510526/b4cf562572687f851627c388c5d1054d-800x.jpg)

![Кинетическая кривая ферментативной реакции[S]υРеакция нулевого порядкаРеакция первого порядка](/img/tmb/6/510526/1dea1a001fcd3658f3aac48b1251c74e-800x.jpg)