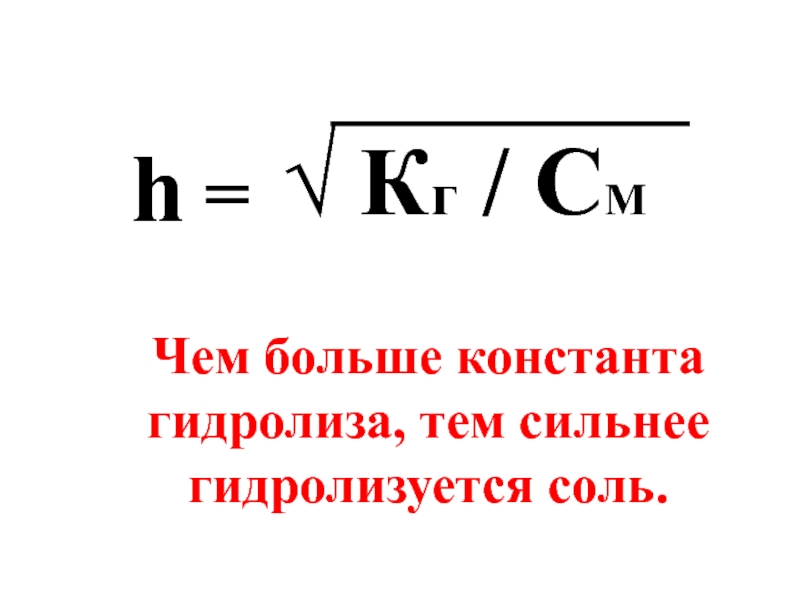- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 3. Химическое равновесие презентация
Содержание
- 1. Лекция 3. Химическое равновесие
- 2. План 3.1. Кинетическое и термодинамическое описание химического
- 3. 3.1 Обратимыми называются химические реакции и физико-химические
- 4. аА + вВ ⇄ сС + dD
- 5. К.Л.Бертолле (1748-1822) Изучая реак-ции выпаде-ния осадков
- 6. Участвуя в Египетском походе французской армии как
- 7. Пределом протекания обратимых процессов является состояние химического равновесия
- 8. Химическое равновесие - это такое состояние обратимого
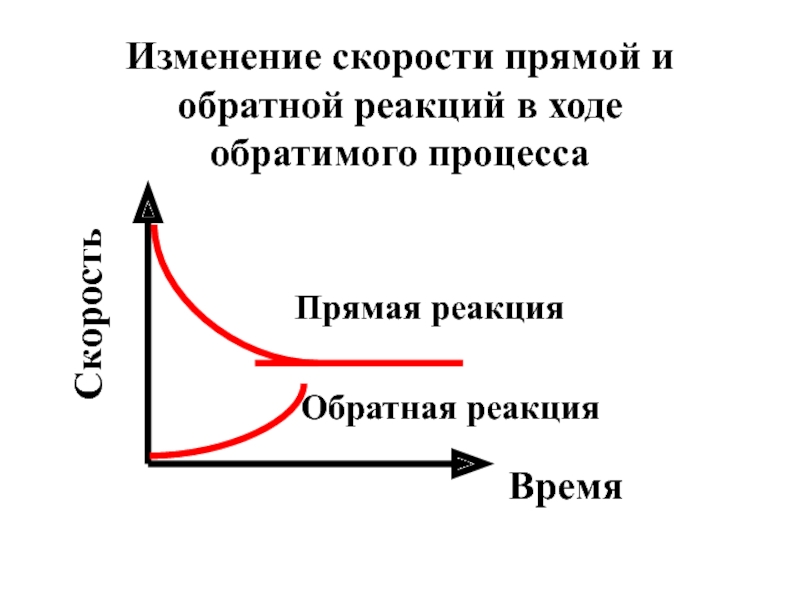
- 9. Изменение скорости прямой и обратной реакций в
- 10. Признаком химического равновесия является постоянство во времени концентраций всех веществ, участвующих в процессе.
- 11. Концентрации веществ в состоянии химического равновесия называются равновесными: [Ā], моль/л.
- 12. Кинетические кривые обратимой реакции а А ⇄
- 13. Кинетическое описание химического равновесия основано на законе
- 15. υпр = υобр, следовательно Так как kпр_ =
- 16. kпр kобр = Кc где Kс – концентрационная константа равновесия
- 19. Если в химической реакции участвуют газообразные, жидкие
- 20. Например: CO2(г) + 2 NH3(г) ⇄H2O (г) + CO(NH2)2 (к) ___[H2O]___ [CO2]×[NH3]2 Kc =
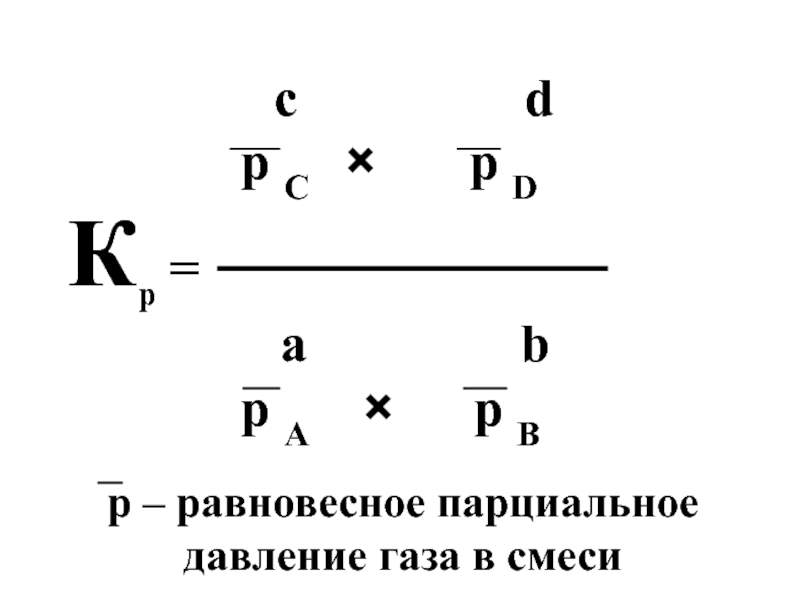
- 21. Для описания обратимых газофазных реакций используют константу химического равновесия, обозначаемую Kp:
- 23. Соотношение Kс и Кр описывается уравнением: Кс = Кр (RT) (а+b-c-d)
- 24. Если К >> 1 → равновесие смещено вправо, υпр > υобр; Если К
- 25.
- 26. В состоянии химического равновесия
- 27. - G0 /RT K = e
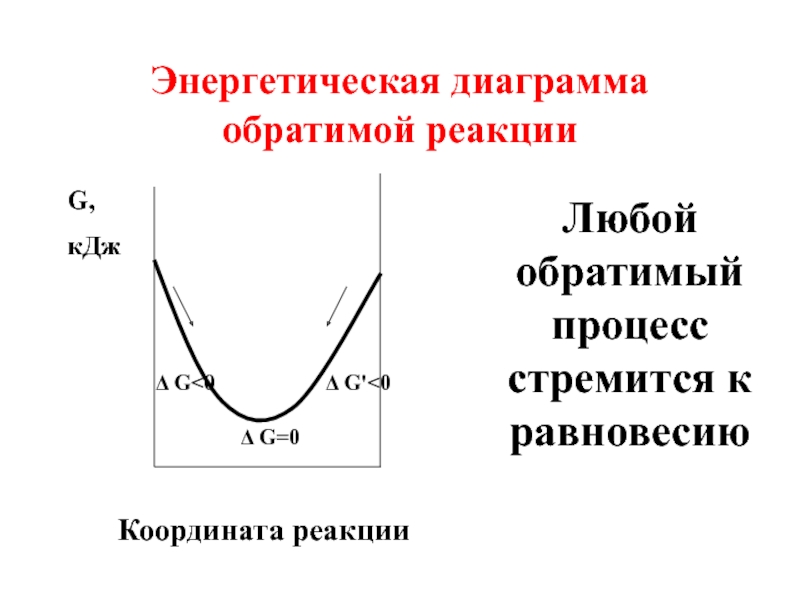
- 28. 3.2 Состояние химического равновесия является наиболее энергетически
- 29. Энергетическая диаграмма обратимой реакции Δ G=0 Δ G
- 30. В 1884 г. французский физико-химик и
- 31. Принцип Ле Шателье: «Если на систему, находящуюся
- 32. В любом случае равновесие будет смещаться до
- 33. A)повышение температуры смещает равновесие в сторону эндотермической,
- 34. Hb + O2 ⇄ HbO2, Δ
- 35. Б) при повышении давления равновесие смещается в
- 36. Изменение давления не влияет на смещение химического
- 37. Венозная кровь поступает в легкие, где испытывает
- 38. B) при увеличении концентрации вещества, участвующего в
- 39. Смещение равновесия in vivo Hb +
- 40. 3.3 Важнейшей биосредой является вода. Описание процессов,
- 41. Многие процессы, играющие важную роль в метаболизме
- 42. Диссоциация воды Вода – слабый электролит, диссоциацию
- 43. При комнатной температуре из
- 44. Поскольку [H2O]>>[H+] ([OH-]), то можно считать, что [H2O] = const
- 45. [H+]×[OH-] ---------------------------------------------------- [H2O] Kc = Кс [H2O] = [H+][OH-]
- 46. Kс [H2O]
- 47. [H+] = Kw -------- [OH-] [OH-]
- 48. Диссоциация слабых кислот CH3COOH⇄ CH3COO-
- 49. Диссоциация слабых оснований NH4OH ⇄
- 50. Чем больше Ка и Kb, тем сильнее диссоциируют кислоты и основания в водных растворах
- 51. Гидролиз (гидролитическое разложение)
- 52. Гидролиз солей - это реакция ионного обмена
- 53. Гидролиз соли, образованной слабым основанием и сильной
- 54. [NH4OH]×[H+] __________________________________ [NH4+]
- 55. Гидролиз соли, образованной слабой кислотой и сильным
- 56. Гидролиз соли, образованной слабым основанием и слабой
- 57. Способность соли к гидролизу характеризуется при помощи
- 58. h = √ Кг / CM Чем больше константа гидролиза, тем сильнее гидролизуется соль.
- 59. Гидролиз солей - один из факторов, регулирующих кислотность внутренней среды организма.
- 60. Благодарим за внимание!!!
Слайд 2План
3.1. Кинетическое и термодинамическое описание химического равновесия
3.2. Смещение химического равновесия (принцип
3.3. Равновесие в биосредах.
Слайд 33.1 Обратимыми называются химические реакции и физико-химические процессы, самопроизвольно протекающие как
Слайд 5
К.Л.Бертолле (1748-1822)
Изучая реак-ции выпаде-ния осадков из растворов, Бертолле первым при-шел к
Слайд 6Участвуя в Египетском походе французской армии как научный консультант Наполеона, Бертолле
Na2CO3 + CaCl2 ⇄ CaCO3 + 2 NaCl
Слайд 8Химическое равновесие - это такое состояние обратимого процесса, в котором скорость
Слайд 9Изменение скорости прямой и обратной реакций в ходе обратимого процесса
Время
Скорость
Прямая реакция
Обратная
Слайд 10Признаком химического равновесия является постоянство во времени концентраций всех веществ, участвующих
Слайд 11Концентрации веществ в состоянии химического равновесия называются равновесными: [Ā], моль/л.
Слайд 13Кинетическое описание химического равновесия основано на законе действующих масс: скорость реакции
Слайд 19Если в химической реакции участвуют газообразные, жидкие и твердые вещества, то
Слайд 21Для описания обратимых газофазных реакций используют константу химического равновесия, обозначаемую Kp:
Слайд 24Если К >> 1 → равновесие смещено вправо, υпр > υобр;
Если
Слайд 25
В основе термодинамического описания обратимого
Слайд 26В состоянии химического равновесия Δ G =
а концентрации веществ А, В, С, D являются равновесными.
Соответственно
Δ Go = - RT ln K
- уравнение химического сродства
Слайд 27- G0 /RT
K = e
Термодинамический расчет константы равновесия:
K зависит только
Слайд 283.2 Состояние химического равновесия является наиболее энергетически выгодным состоянием обратимого процесса,
Слайд 30
В 1884 г. французский физико-химик и металлург
Ле Шателье сформулировал общий
Анри Луи Ле Шателье (1850–1936)
Слайд 31Принцип Ле Шателье: «Если на систему, находящуюся в состоянии химического равновесия,
Слайд 32В любом случае равновесие будет смещаться до тех пор, пока не
Слайд 33A)повышение температуры смещает равновесие в сторону эндотермической, а понижение температуры -
Частные случаи принципа Ле Шателье
Слайд 34Hb + O2 ⇄ HbO2,
Δ rН = - 10 кДж
При повышении температуры равновесие смешается влево (кровь отдает кислород тканям), при понижении температуры равновесие смещается вправо (кровь обогащается кислородом).
Смещение равновесия in vivo
Слайд 35Б) при повышении давления равновесие смещается в сторону меньшего количества газообразных
Частные случаи принципа Ле Шателье
Слайд 36Изменение давления не влияет на смещение химического равновесия, если:
В реакции не
Реакция протекает без изменения количества газообразных веществ
N2 + O2 ⇄ 2 NO
Слайд 37Венозная кровь поступает в легкие, где испытывает повышенное давлении О2. В
Смещение равновесия in vivo
Hb + O2 ⇄ HbO2
Слайд 38B) при увеличении концентрации вещества, участвующего в обратимом превращении, равновесие смещается
Частные случаи принципа Ле Шателье
Слайд 39
Смещение равновесия in vivo
Hb + O2 ⇄ HbO2
При увеличении содержания гемоглобина
Слайд 403.3 Важнейшей биосредой является вода. Описание процессов, протекающих в водных растворах,
Слайд 41Многие процессы, играющие важную роль в метаболизме живых организмов, связаны с
Слайд 42Диссоциация воды
Вода – слабый электролит, диссоциацию которого можно представить схемой:
H2O ⇄
Слайд 45[H+]×[OH-]
----------------------------------------------------
[H2O]
Kc =
Кс [H2O] = [H+][OH-]
Слайд 46
Kс [H2O] = Kw
Kw - ионное произведение
Кw = [H+][OH-] = 10-14
(t = 25oC)
Слайд 48Диссоциация слабых кислот
CH3COOH⇄ CH3COO- + H+
[H+]×[CH3COO-]
________________________________
[ CH3COOH]
Ka =
Ka -
Слайд 49
Диссоциация слабых оснований
NH4OH ⇄ NH4+ + OH-
NH4+ ]×[ OH- ]
[NH4OH]
Kb =
Kb-константа
Слайд 51Гидролиз (гидролитическое разложение)
Слайд 52Гидролиз солей - это реакция ионного обмена между составными частями соли и
Слайд 53Гидролиз соли, образованной слабым основанием и сильной кислотой
NH4Cl+ H2O ⇄
NH4+ + H2O ⇄ NH4OH + H+
Слайд 54[NH4OH]×[H+]
__________________________________
[NH4+]
Кг =
=
[NH4OH]×Kw
________________________________
[NH4+]×[OH-]
Kw
___________
Kb
=
=
Кг – константа равновесия, называемая константой
Слайд 55Гидролиз соли, образованной слабой кислотой и сильным основанием
CH3COONa + H2O ⇄
CH3COO- + H2O ⇄ СH3COOH + OH-
Kw
Ka
Кг =
Слайд 56Гидролиз соли, образованной слабым основанием и слабой кислотой
CH3COONH4 + H2O ⇄
Кг =
Kw
Ka × Kb
Слайд 57Способность соли к гидролизу характеризуется при помощи степени гидролиза (h):
h =
Количество
_______________________________________________________________________________________________
Общее количество соли в растворе



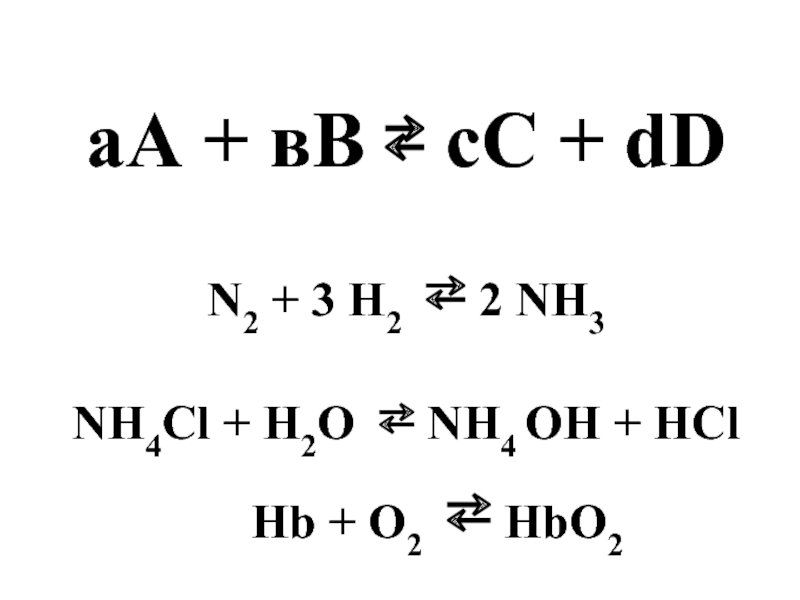





![Концентрации веществ в состоянии химического равновесия называются равновесными: [Ā], моль/л.](/img/tmb/4/326812/ae0ebe076b36dccb29ed2a4567e33b0a-800x.jpg)
![Кинетические кривые обратимой реакции а А ⇄ bВ[Ā]BA[B]Времямоль/л](/img/tmb/4/326812/b4869687929f23b720d8fb561d4fb555-800x.jpg)


![υпр =υобр,следовательноТак какkпр_ = [C]c [D]dkобр [A]a [B]b](/img/tmb/4/326812/29696d74f9bf5fec3ad51d27860a2cd3-800x.jpg)

![[C]c [D]d](/img/tmb/4/326812/b97e2da3a1ee4cb021237f49ad7cabaa-800x.jpg)
![[HbO2]Кс = ----------- = 1300](/img/tmb/4/326812/e1d881b055192d0b419f90e0e3562fc7-800x.jpg)

![Например:CO2(г) + 2 NH3(г) ⇄H2O (г) + CO(NH2)2 (к)___[H2O]___[CO2]×[NH3]2Kc =](/img/tmb/4/326812/764161d54c961ed1f3030cb91eb0b8d9-800x.jpg)





















![Поскольку [H2O]>>[H+] ([OH-]), то можно считать, что [H2O] = const](/img/tmb/4/326812/8bc6263c61e7f8b8adeaac7297647b23-800x.jpg)
![[H+]×[OH-]---------------------------------------------------- [H2O]Kc =Кс [H2O] = [H+][OH-]](/img/tmb/4/326812/6d6903134f91e82f157142a59660abdc-800x.jpg)
![Kс [H2O] = KwKw - ионное произведение воды, константа равновесия, описывающая обратимую диссоциацию](/img/tmb/4/326812/cddd4f883d68aafad8ab998f87a2fead-800x.jpg)
![[H+] = Kw--------[OH-][OH-] = Kw--------- [H+]Для воды и водных растворов:](/img/tmb/4/326812/17f0dc4af3e2f593f1bb76d7ccc1229c-800x.jpg)
![Диссоциация слабых кислот CH3COOH⇄ CH3COO- + H+[H+]×[CH3COO-]________________________________ [ CH3COOH]Ka =Ka - константа равновесия, называемая константой кислотности](/img/tmb/4/326812/e1ffa58c3f51fbcd5a99d964c4b1fe57-800x.jpg)
![Диссоциация слабых оснований NH4OH ⇄ NH4+ + OH-NH4+ ]×[ OH- ][NH4OH]Kb =Kb-константа равновесия, называемая константой основности](/img/tmb/4/326812/50b19cf2e16ce421cd94f6d99e057de2-800x.jpg)




![[NH4OH]×[H+]__________________________________ [NH4+]Кг ==[NH4OH]×Kw________________________________[NH4+]×[OH-]Kw___________Kb==Кг – константа равновесия, называемая константой гидролиза](/img/tmb/4/326812/465ca8661f812b94c8b1c78f411ba35f-800x.jpg)