- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 6. Электрофильное присоединение к кратным связям презентация
Содержание
- 1. Лекция 6. Электрофильное присоединение к кратным связям
- 2. Реакции присоединения Реакции присоединения включают разрыв π-
- 3. Электрофилы Электрофильные реагенты (Е, Е+) – это
- 4. π-связь Двойная углерод-углеродная π-связь является донором электронов
- 5. Электронные переходы в реакциях АЕ
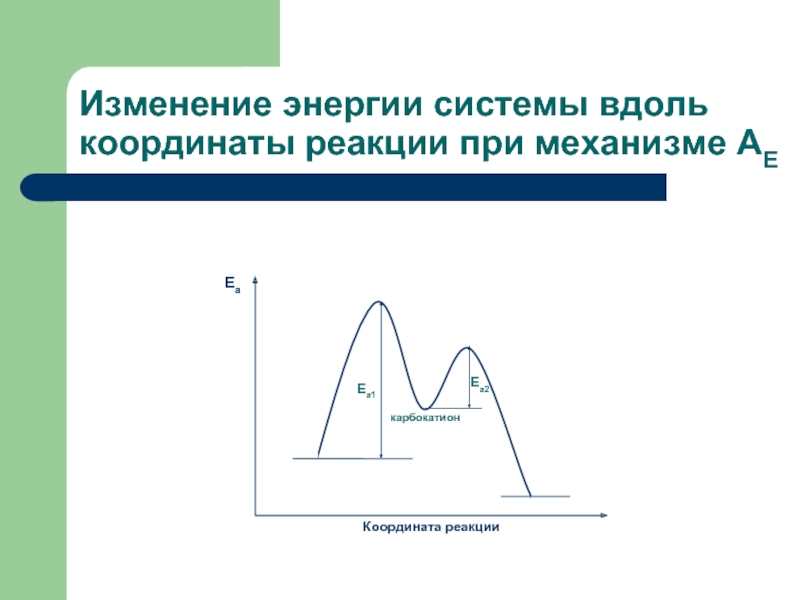
- 6. Изменение энергии системы вдоль координаты реакции при механизме АЕ
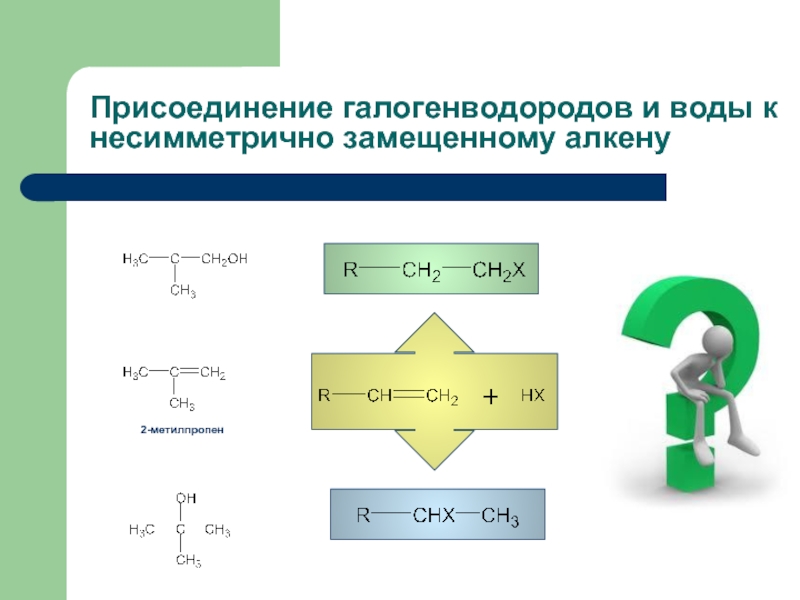
- 7. Присоединение галогенводородов и воды к несимметрично замещенному алкену
- 8. Правило Марковникова В реакциях электрофильного присоединения по
- 9. Устойчивость карбокатионов Устойчивость карбокатиона возрастает с увеличением
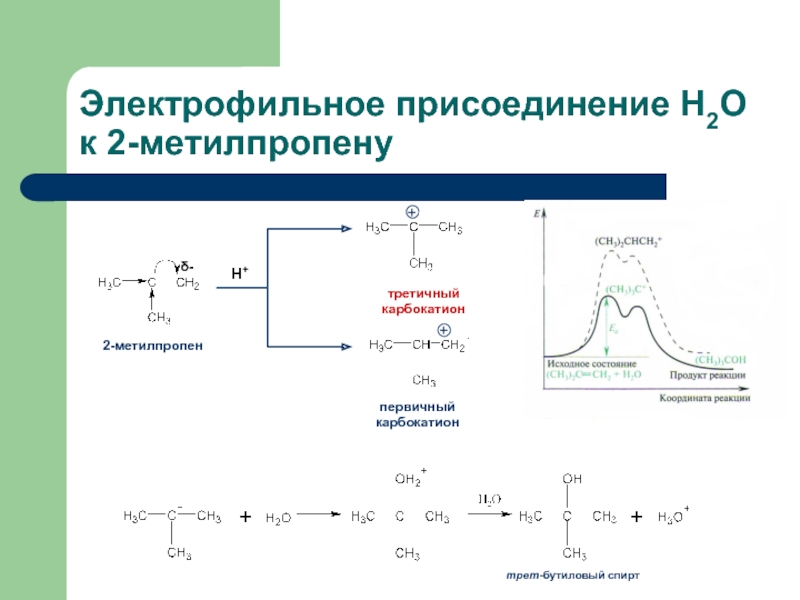
- 10. Электрофильное присоединение Н2О к 2-метилпропену
- 11. Перегруппировки карбокатионов Миграция метильной группы (1,2-сдвиг) может
- 12. Правило Марковникова не выполняется Ненасыщенные соединения, содержащие
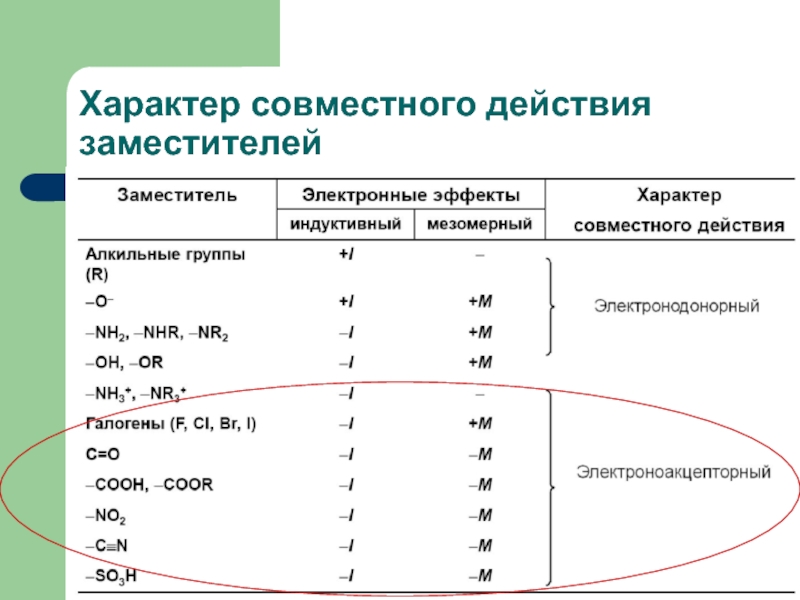
- 13. Характер совместного действия заместителей
- 14. Правило региоселективности АЕ ненасыщенных соединений Направление
- 15. Стереоселективность реакций АЕ Е-Y
- 16. Стереоселективность реакций АЕ Транс-присоединение к двойной связи
- 17. Образование π-комплексов. Присоединение галогенов (галогенирование) 1,2-дибромобутан
- 18. Образование π-комплекса и бромониевого катиона
- 19. Скорости бромирования алкенов
- 20. Сравнительная оценка реакционной способности алкенов в реакциях
- 21. Галогенирование и гидрогалогенирование алкадиенов В диенах с
- 22. Галогенирование и гидрогалогенирование сопряженных алкадиенов
- 23. AЕ в сопряженных алкадиенах На первой стадии
- 24. AЕ в сопряженных алкадиенах Как же можно
- 25. AЕ в сопряженных алкадиенах Таким образом, на
- 26. AЕ в сопряженных алкадиенах Резонансная стабилизация аллильного карбокатиона:
- 27. AЕ в сопряженных алкадиенах В общем виде: Финальная стадия:
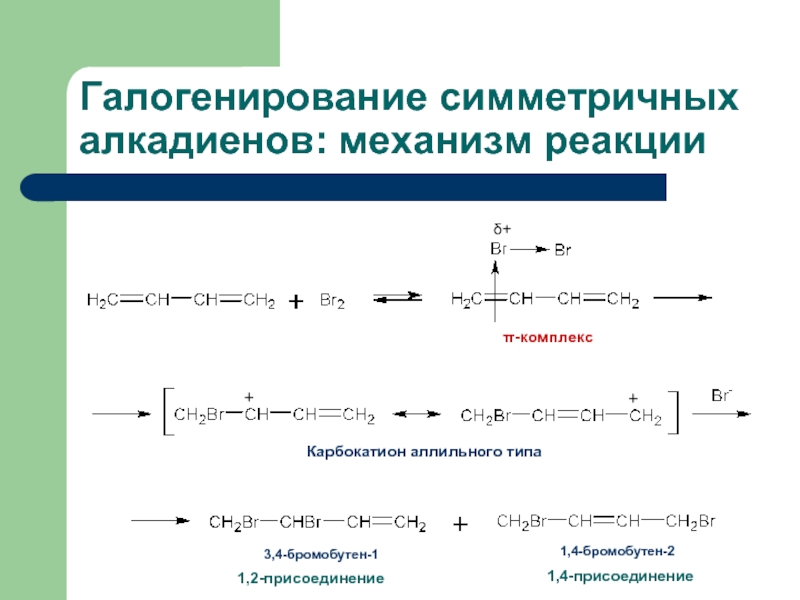
- 28. Галогенирование и гидрогалогенирование симметричных алкадиенов
- 29. Галогенирование симметричных алкадиенов: механизм реакции π-комплекс
- 30. Контроль реакций галогенирования и гидрогалогенирования алкадиенов
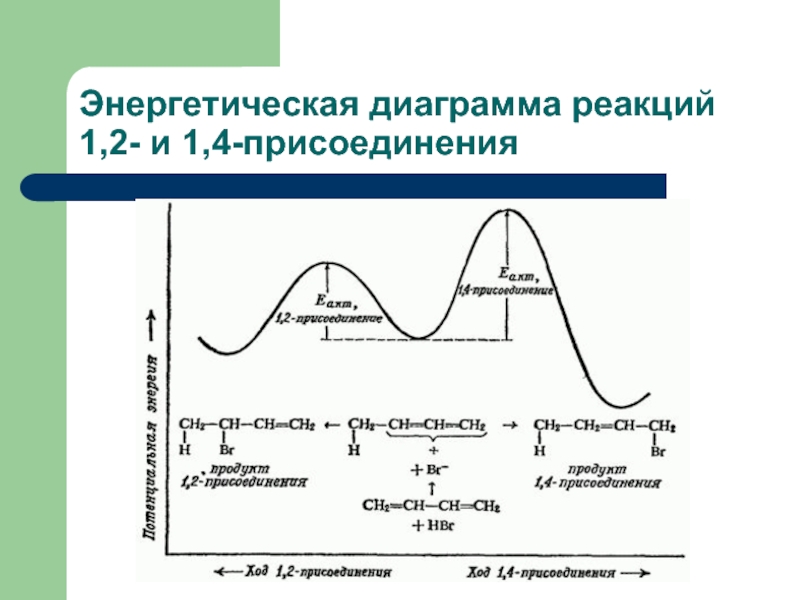
- 31. Энергетическая диаграмма реакций 1,2- и 1,4-присоединения
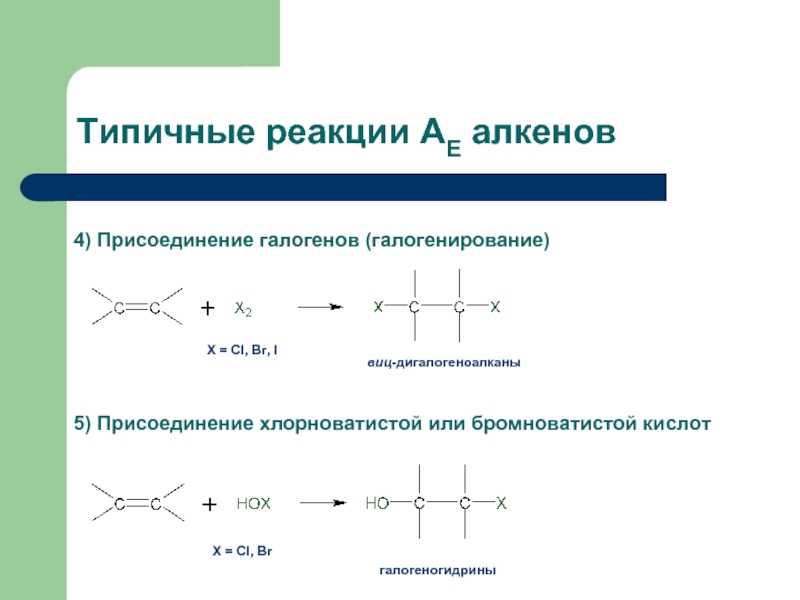
- 32. Типичные реакции АЕ алкенов
- 33. Типичные реакции АЕ алкенов Х
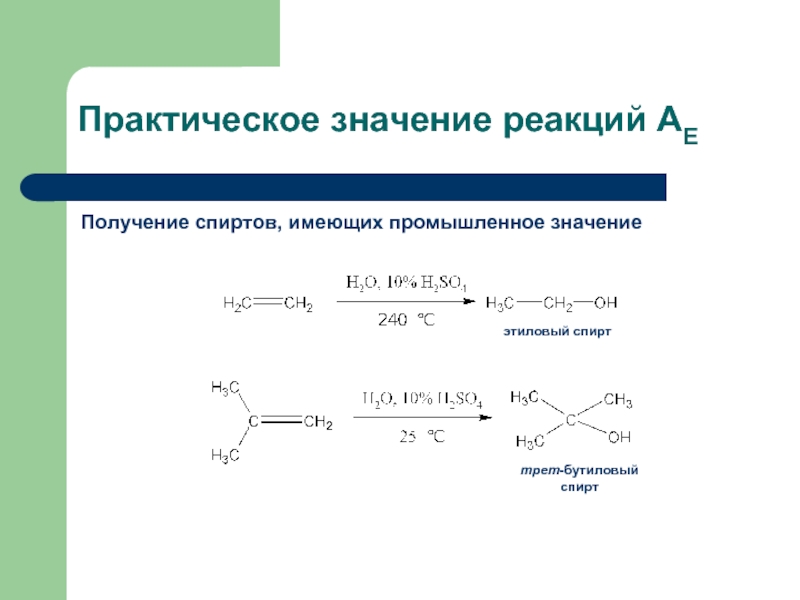
- 34. Практическое значение реакций АЕ Получение спиртов, имеющих промышленное значение этиловый спирт трет-бутиловый спирт
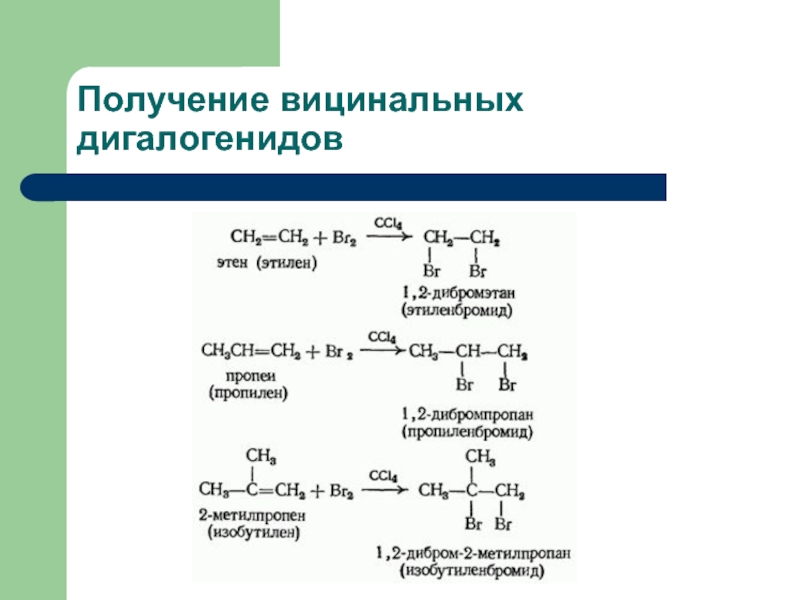
- 35. Получение вицинальных дигалогенидов
- 36. Благодарю за внимание!
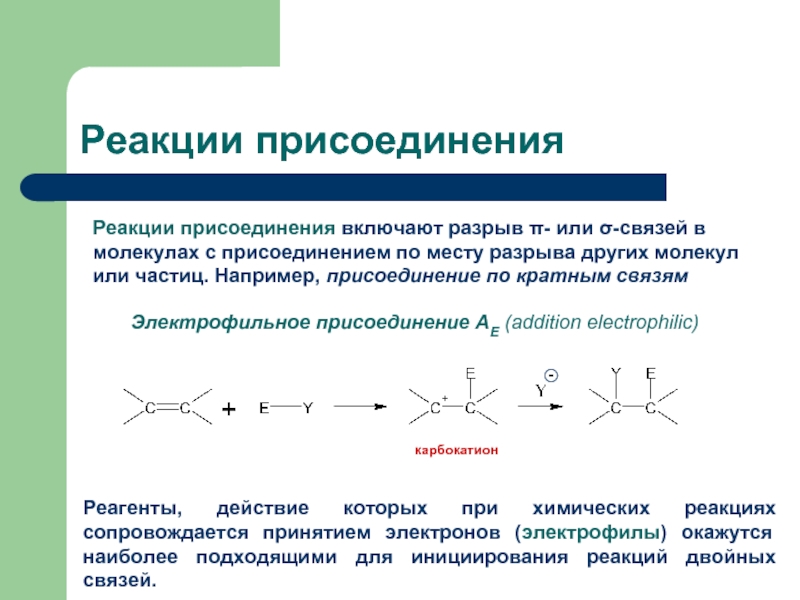
Слайд 2Реакции присоединения
Реакции присоединения включают разрыв π- или σ-связей в молекулах с
Электрофильное присоединение AE (addition electrophilic)
Реагенты, действие которых при химических реакциях сопровождается принятием электронов (электрофилы) окажутся наиболее подходящими для инициирования реакций двойных связей.
карбокатион
Слайд 3Электрофилы
Электрофильные реагенты (Е, Е+) – это частицы, образующие новые ковалентные связи
- положительно заряженные ионы
H+ Hal+ NO2+ NO+
- нейтральные молекулы, имеющие электронодефицитный центр
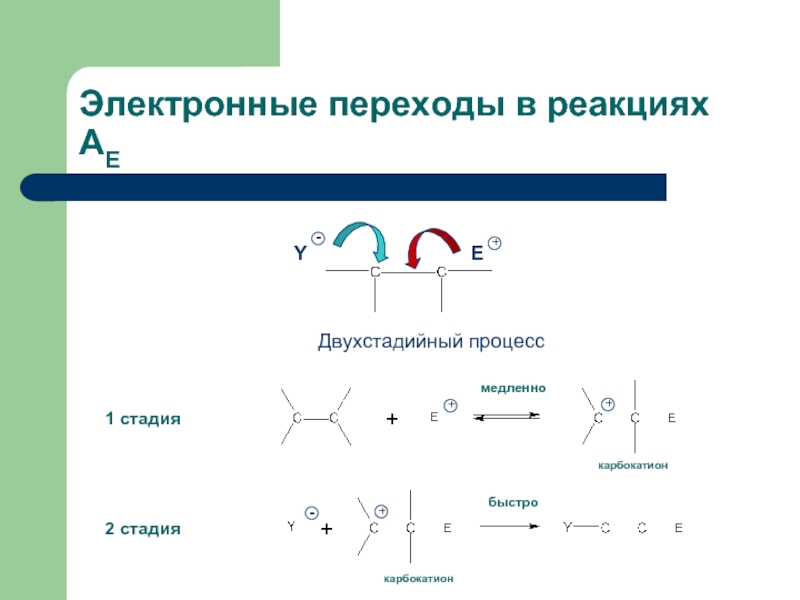
Слайд 5Электронные переходы в реакциях АЕ
1 стадия
2 стадия
карбокатион
карбокатион
Y
Двухстадийный процесс
медленно
быстро
E
Слайд 8Правило Марковникова
В реакциях электрофильного присоединения по двойной связи водород присоединяется к
R-CH=CH2 + HCl → R-CHCl-CH3
Направление присоединения определяется относительной стабильностью промежуточно образующихся карбокатионов.
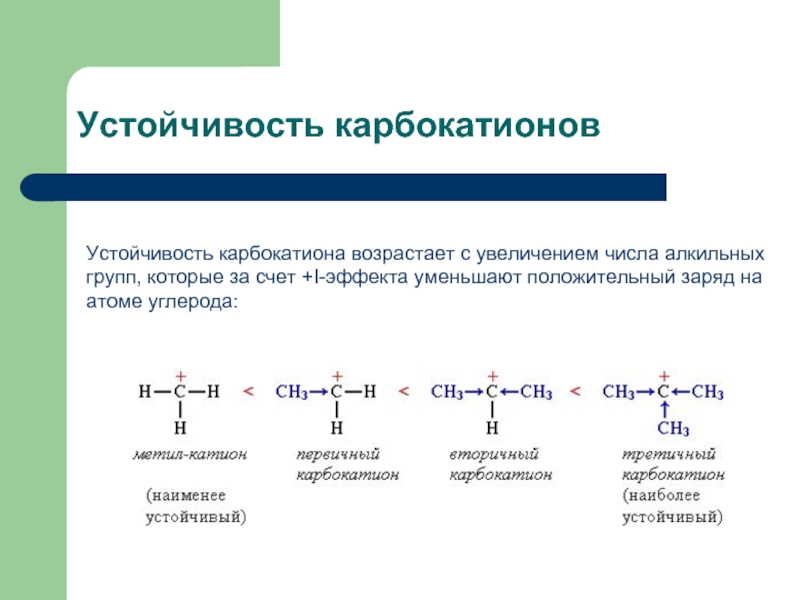
Слайд 9Устойчивость карбокатионов
Устойчивость карбокатиона возрастает с увеличением числа алкильных групп, которые за
Слайд 11Перегруппировки карбокатионов
Миграция метильной группы (1,2-сдвиг) может превратить первоначально образовавшийся вторичный карбокатион
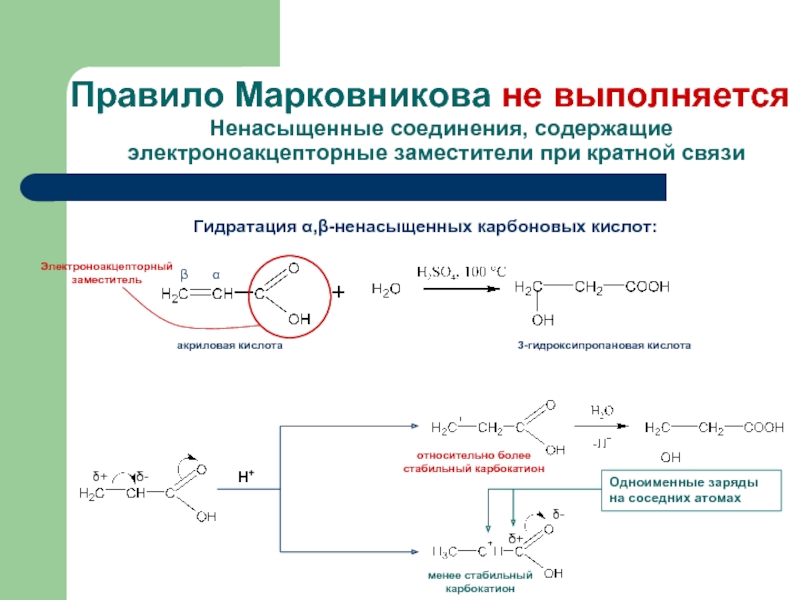
Слайд 12Правило Марковникова не выполняется
Ненасыщенные соединения, содержащие электроноакцепторные заместители при кратной связи
относительно
менее стабильный карбокатион
Гидратация α,β-ненасыщенных карбоновых кислот:
α
β
Слайд 14Правило региоселективности АЕ ненасыщенных соединений
Направление присоединения реагентов типа НХ к
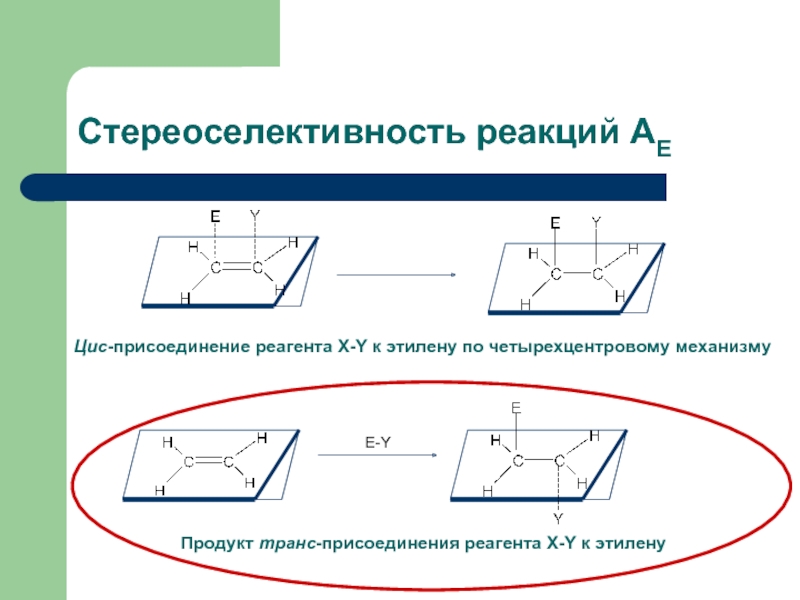
Слайд 15
Стереоселективность реакций АЕ
Е-Y
Цис-присоединение реагента X-Y к этилену по четырехцентровому механизму
Продукт транс-присоединения
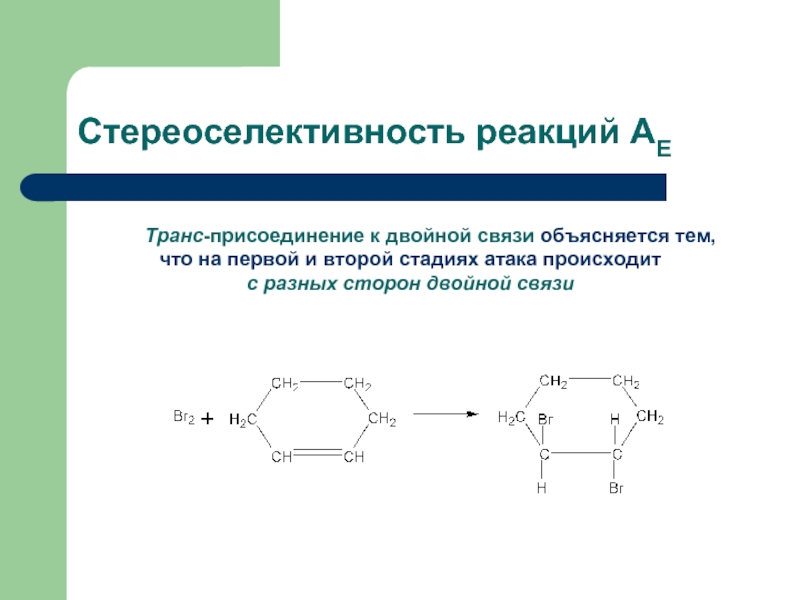
Слайд 16Стереоселективность реакций АЕ
Транс-присоединение к двойной связи объясняется тем,
что на первой и
с разных сторон двойной связи
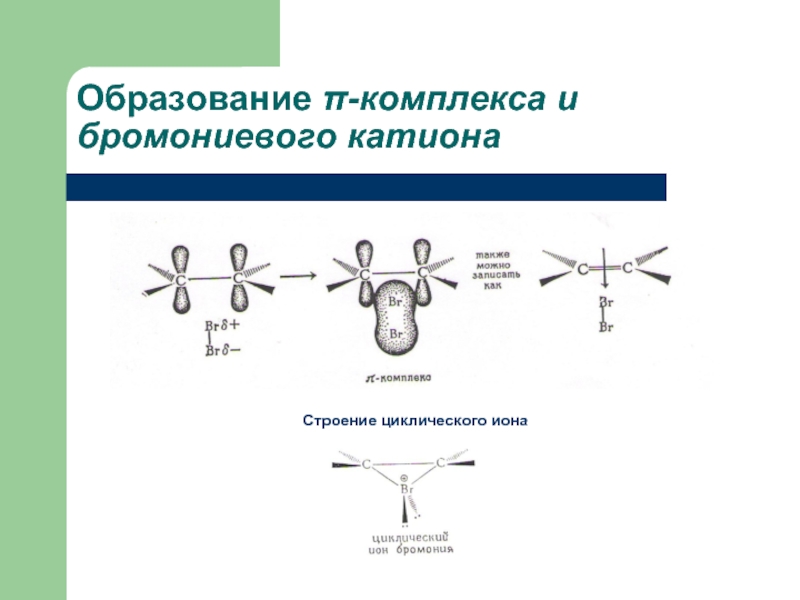
Слайд 17Образование π-комплексов. Присоединение галогенов (галогенирование)
1,2-дибромобутан
бутен-1
Быстрое обесцвечивание раствора брома без выделения бромоводорода
Образуются эквимолярные количества энантиомерных продуктов транс-присоединения
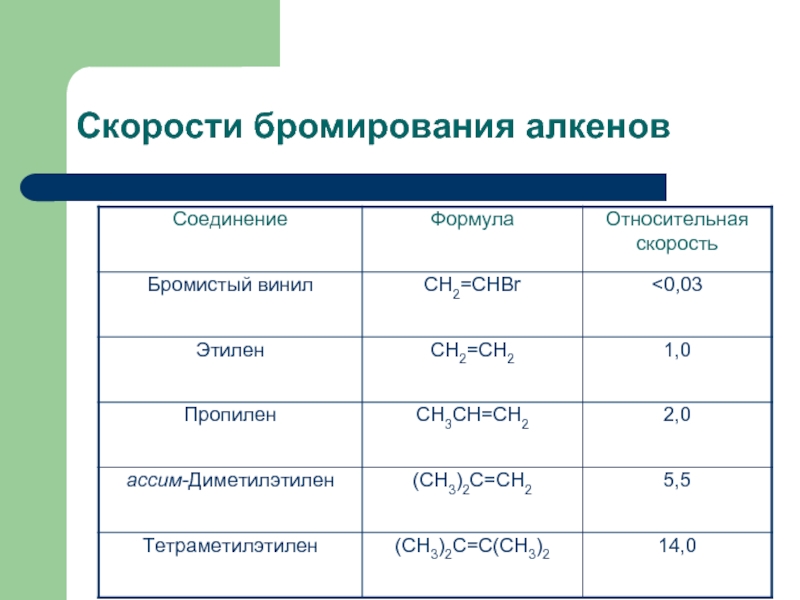
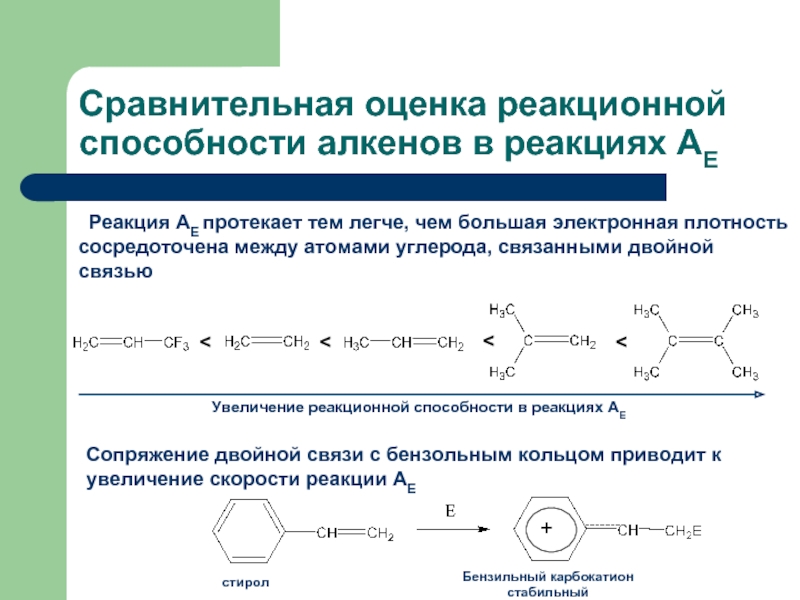
Слайд 20Сравнительная оценка реакционной способности алкенов в реакциях АЕ
Реакция АЕ протекает тем
Сопряжение двойной связи с бензольным кольцом приводит к увеличение скорости реакции АЕ
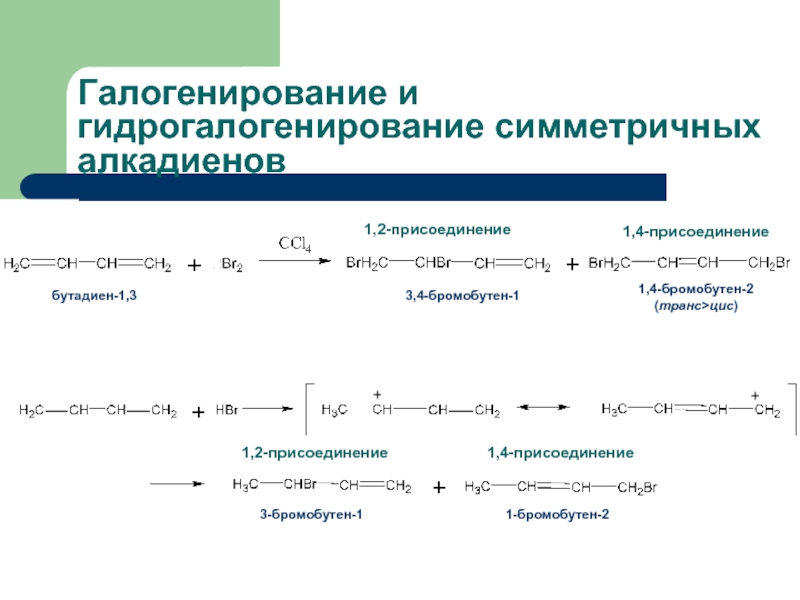
Слайд 21Галогенирование и гидрогалогенирование алкадиенов
В диенах с изолированными двойными связями двойные связи
Слайд 23AЕ в сопряженных алкадиенах
На первой стадии реакции образуется карбокатион I, а
Результаты эксперимента:
Почему?
Слайд 24AЕ в сопряженных алкадиенах
Как же можно объяснить то, что один из
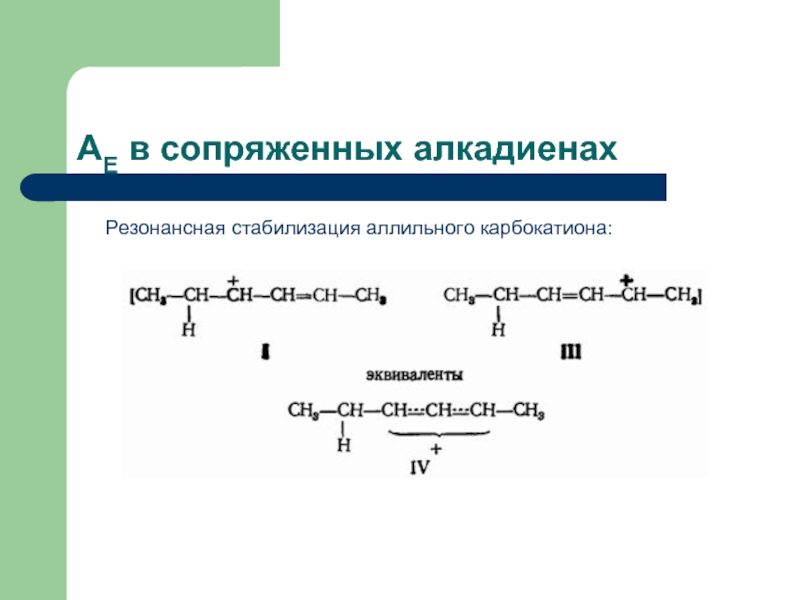
Ион I представляет собой не просто вторичный карбокатион: это аллильный карбокатион. Он очень устойчив за счет резонансной стабилизации.
Аллильный карбокатион почти так же устойчив, как третичный бутильный карбокатион.
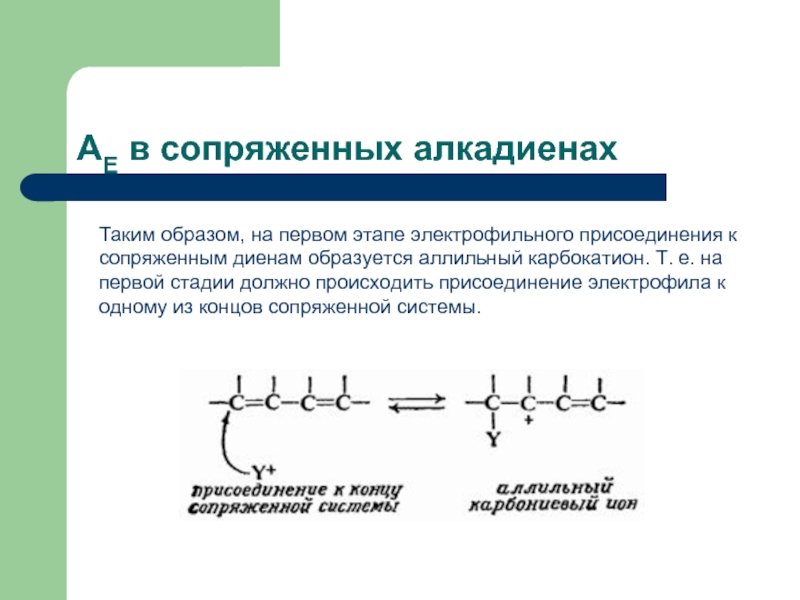
Слайд 25AЕ в сопряженных алкадиенах
Таким образом, на первом этапе электрофильного присоединения к
Слайд 29Галогенирование симметричных алкадиенов: механизм реакции
π-комплекс
δ+
Карбокатион аллильного типа
+
3,4-бромобутен-1
1,4-бромобутен-2
1,2-присоединение
1,4-присоединение
+
Слайд 30Контроль реакций галогенирования и гидрогалогенирования алкадиенов
1,2-присоединение
1,4-присоединение
Температура проведения реакции Содержание изомера
40 ºС 20% 80%
- 80 ºС 80% 20%
Температура проведения реакции Содержание изомера в смеси
40 ºС 15% 85%
0 ºС 71% 29%
Слайд 32Типичные реакции АЕ алкенов
1) Присоединение воды (гидратация)
2) Присоединение серной кислоты
3)
спирты
алкилгидросульфаты
галогеноалканы
Х = Cl, Br, I
Необходимо присутствие сильной кислоты (H2SO4, HNO3, HClO4)
Слайд 33Типичные реакции АЕ алкенов
Х = Cl, Br, I
4) Присоединение галогенов
виц-дигалогеноалканы
5) Присоединение хлорноватистой или бромноватистой кислот
Х = Cl, Br
галогеногидрины