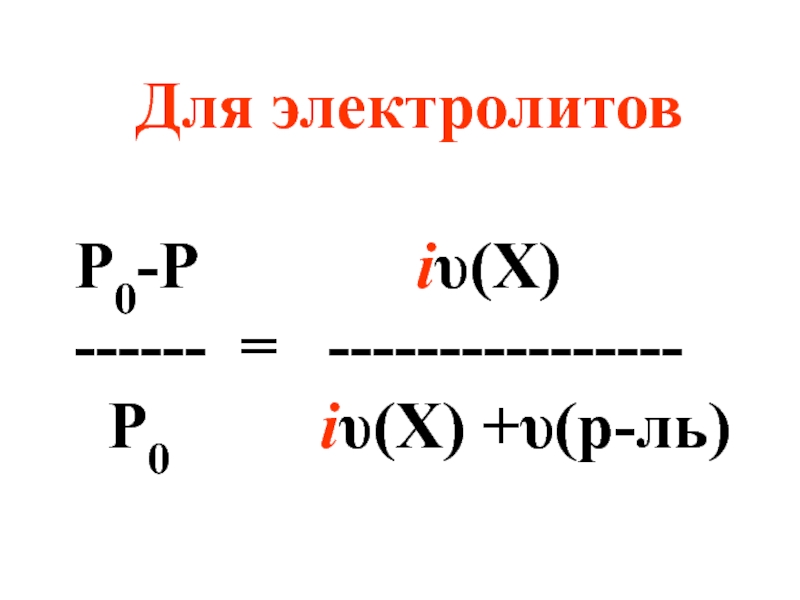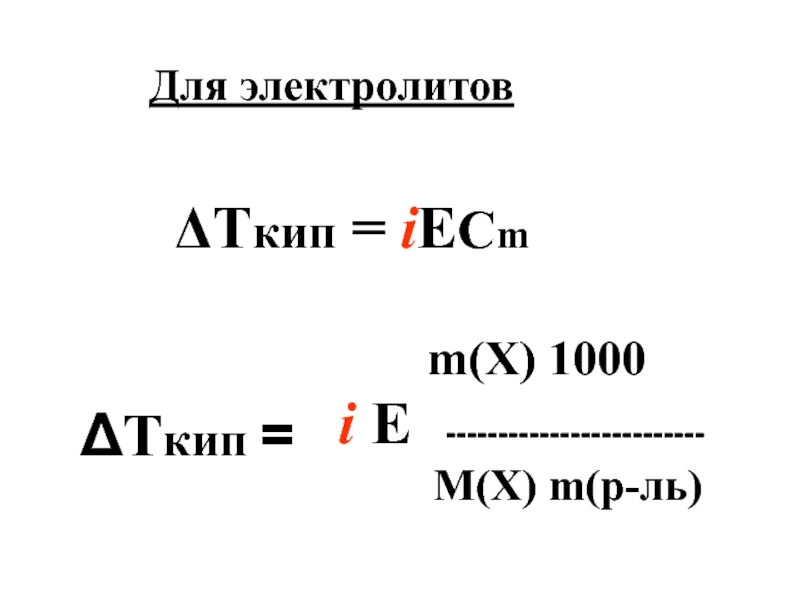- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 5. Коллигативные свойства растворов презентация
Содержание
- 1. Лекция 5. Коллигативные свойства растворов
- 2. План 5.1 Первый закон Рауля 5.2 Эбулиоскопический
- 3. Коллигативными (общими) называются свойства растворов, зависящие только
- 4. Важнейшими коллигативными свойствами растворов являются: 1)
- 5. Франсуа Мари Рауль (1830-1901) Франсуа Мари
- 6. 5.1 Первый закон Рауля: давление пара над
- 7. Это явление объясняется тем, что нелетучее растворенное
- 8. Молекулы, способные переходить в газовую фазу Растворитель
- 9. Для неэлектролитов Р0-Р
- 10. ро – давление насыщенного пара над чистым
- 11. Р0-Р ------ - Р0 относительное понижения давления пара над раствором
- 12. Для электролитов Р0-Р
- 13. i– изотонический коэффициент (коэффициент Вант-Гоффа), характеризующий диссоциацию электролита на ионы.
- 14. Криоскопический ("криос"–холод) и эбулиоскопический ("эбулио"-кипение) законы являются следствием первого закона Рауля.
- 15. 5.2 Эбулиоскопический закон Рауля: раствор нелетучего вещества кипит при более высокой температуре, чем чистый растворитель..
- 16. Температура кипения (Ткип) - это температура, при которой давление пара над жидкостью равно атмосферному давлению.
- 17. давление Температура H2O Раствор Tкип
- 18. Математическое описание эбулиоскопического закона
- 20. Е – эбулиоскопическая константа растворителя Е (Н2О) = 0,52
- 21. 5.3 Криоскопический закон Рауля: раствор нелетучего вещества
- 22. Температура замерзания (Тзам) - это температура, при
- 23. Математическое описание криоскопического закона
- 25. ΔТзам = Tзам(р-ль) - Tзам(р-р) Для
- 26. К – криоскопическая константа растворителя К (Н2О) = 1,86
- 27. Эбуллиоскопия и криоскопия - это методы, позволяющие
- 28. Определение молярной массы лекарственных препаратов криоскопическим методом широко применяется в фармакопейных анализах.
- 29. 5.4 Все растворы обладают способностью к диффузии.
- 30. Можно создать условие, при котором диффузия протекает
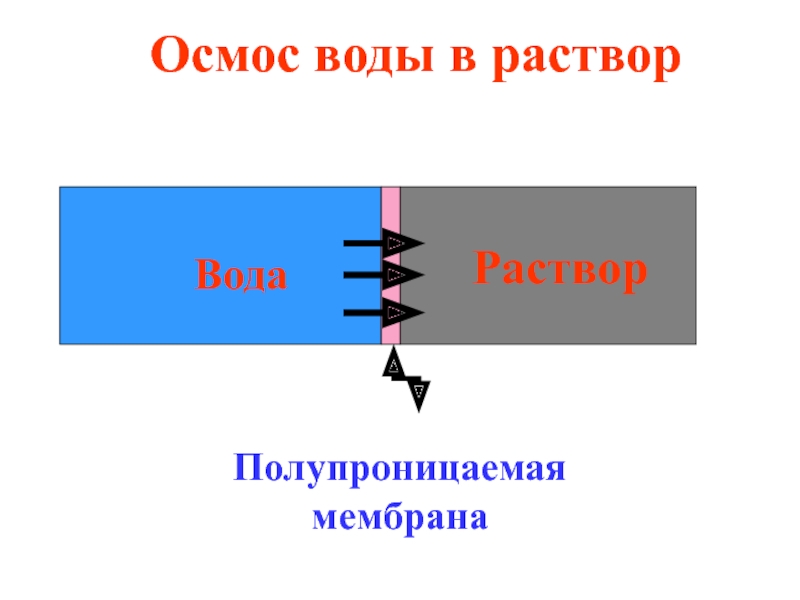
- 31. Осмос - односторонняя диффузия растворителя через полупроницаемую
- 32. Раствор Вода Полупроницаемая мембрана Осмос воды в раствор
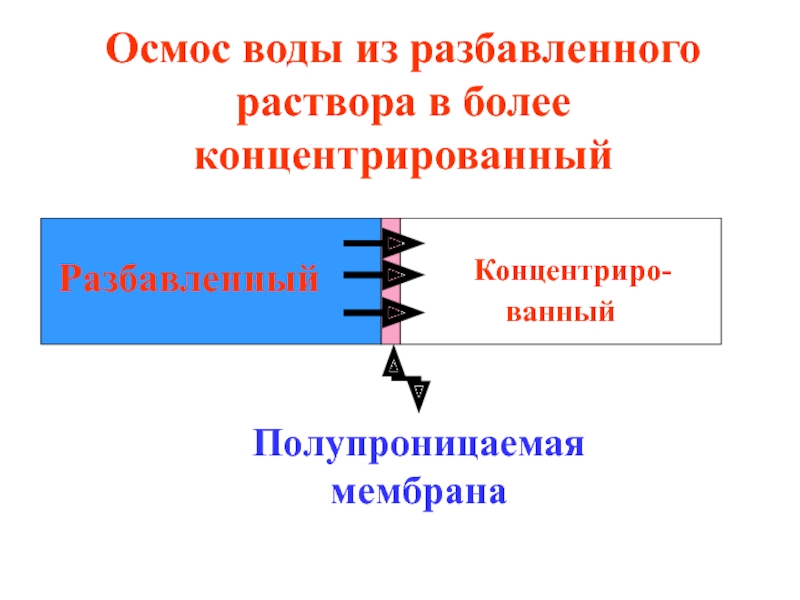
- 33. Концентриро- ванный Разбавленный Полупроницаемая
- 34. Движущей силой осмоса является стремление к выравниванию концентрации растворенного вещества по обе стороны мембраны.
- 35. Процесс протекает само-произвольно и сопровождается увеличением энтропии. Пределом его протекания является состояние равновесия.
- 36. Давление, которое оказывает растворитель на мембрану, называется осмотическим давлением (росм).
- 37. Осмотическое давление описывается уравнением Вант- Гоффа. Для
- 38. Якоб Хендрик Вант-Гофф (1852-1911) Я.Х.Вант-Гофф является одним
- 39. Клеточные мембраны животных и растительных организмов являются
- 40. Осмотическое давление плазмы и других биологических жидкостей обусловлено главным образом присутствием электролитов.
- 41. В меньшей степени давление создается коллоидными
- 42. Осмотический гомеостаз обусловлен работой почек, легких, кожи.
- 43. Осмос лежит в основе целого ряда физиологических
- 44. В медицинской практике используют растворы, изоосмотичные с
- 45. Введение физиологических растворов в кровь, спинномозговую
- 46. При введении гипотонического раствора в кровяное русло
- 47. Начальная стадия гемолиза наблюдается при
- 48. Плазмолиз (сморщивание эритроцитов) имеет место при введении
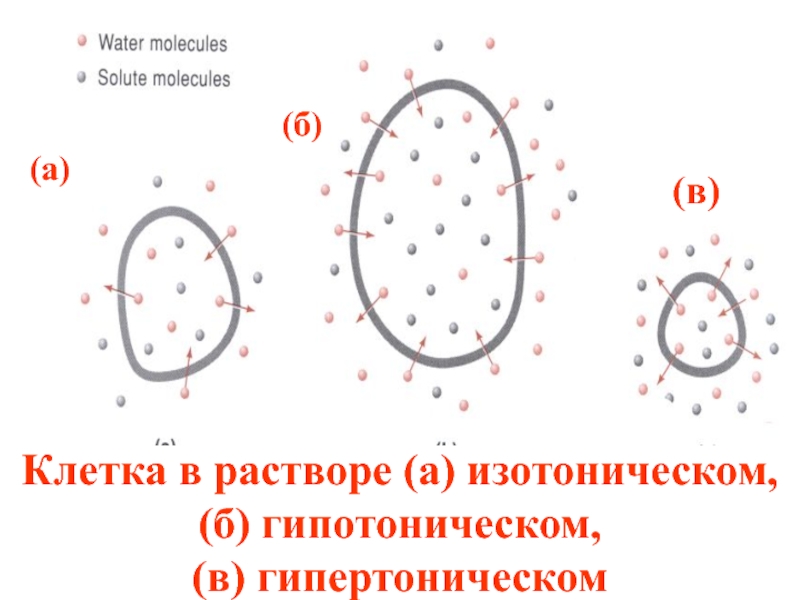
- 49. Клетка в растворе (a) изотоническом, (б) гипотоническом,
- 50. Применение гипертонических растворов в медицине *10
- 51. Важной характеристикой растворов, применяемых для внутривенных инъекций,
- 52. Благодарим за внимание!!!
Слайд 2План
5.1 Первый закон Рауля
5.2 Эбулиоскопический закон Рауля
5.3 Криоскопический закон Рауля
5.4 Осмос.
Слайд 3Коллигативными (общими) называются свойства растворов, зависящие только от их концентрации, точнее
Слайд 4Важнейшими коллигативными свойствами растворов являются:
1) Понижение давления пара над раствором
2) Повышение температуры кипения раствора;
3) Понижение температуры замерзания раствора;
4) Осмос и осмотическое давление.
Слайд 5Франсуа Мари Рауль
(1830-1901)
Франсуа Мари Рауль, работавший в университете в Гренобле,
Слайд 65.1 Первый закон Рауля: давление пара над раствором нелетучего вещества меньше
Слайд 7Это явление объясняется тем, что нелетучее растворенное вещество связывает часть молекул
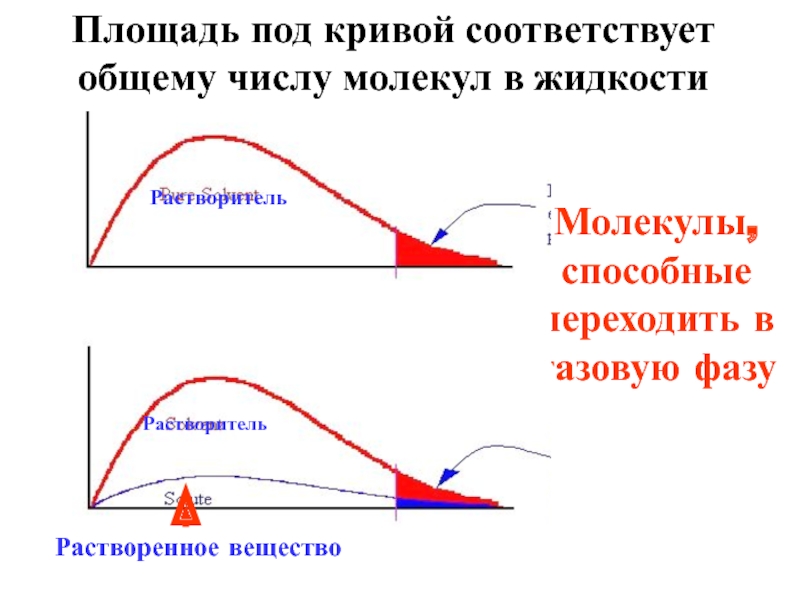
Слайд 8Молекулы, способные
переходить в газовую фазу
Растворитель
Растворитель
Растворенное вещество
Площадь под кривой соответствует общему числу
Слайд 9Для неэлектролитов
Р0-Р υ(X)
------ =
Р0 υ(X) +υ(р-ль)
Математическое описание первого закона Рауля для бинарной системы
Слайд 10ро – давление насыщенного пара над чистым растворителем,
р – давление пара
υ(X) – химическое количество растворенного вещества
Слайд 13i– изотонический коэффициент (коэффициент Вант-Гоффа), характеризующий диссоциацию электролита на ионы.
Слайд 14 Криоскопический ("криос"–холод) и эбулиоскопический ("эбулио"-кипение) законы являются следствием первого закона
Слайд 155.2 Эбулиоскопический закон Рауля: раствор нелетучего вещества кипит при более высокой
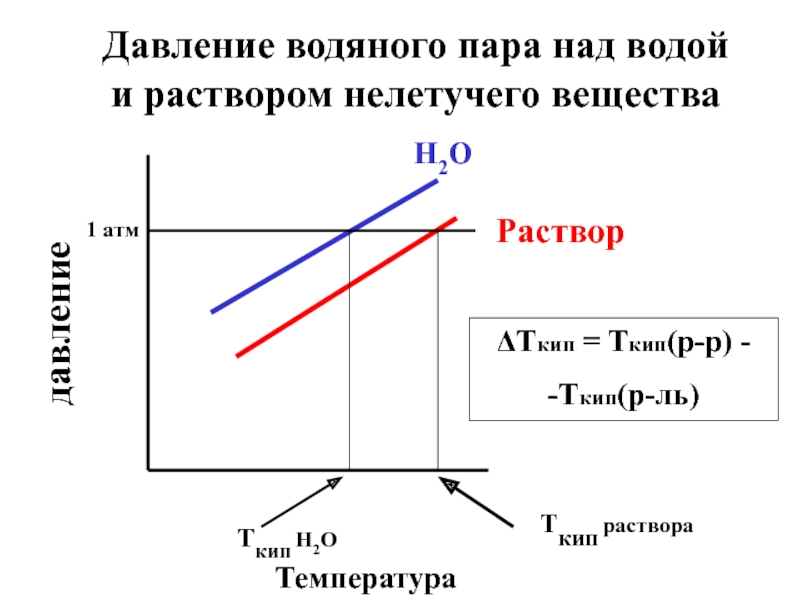
Слайд 16Температура кипения (Ткип) - это температура, при которой давление пара над
Слайд 17
давление
Температура
H2O
Раствор
Tкип H2O
Tкип раствора
1 атм
Давление водяного пара над водой и раствором нелетучего
ΔТкип = Tкип(р-р) -
-Tкип(р-ль)
Слайд 18Математическое описание эбулиоскопического закона
Е -------------------------
М(X) m(р-ль)
Для неэлектролитов
ΔТкип = Е×Cm
ΔТкип =
Слайд 215.3 Криоскопический закон Рауля: раствор нелетучего вещества замерзает при более низкой
Слайд 22Температура замерзания (Тзам) - это температура, при которой давление пара над
Слайд 23Математическое описание криоскопического закона
К -------------------------
М(X)×m(р-ль)
Для неэлектролитов
ΔТзам = К×Cm
ΔТзам =
Слайд 24
i К -------------------------
М(X)×m(р-ль)
Для электролитов
ΔТзам = i×К×Cm
ΔТзам =
Слайд 25
ΔТзам = Tзам(р-ль) - Tзам(р-р)
Для плазмы крови человека
ΔТзам
Для плазмы животных
ΔТзам = 0,580
Слайд 27Эбуллиоскопия и криоскопия - это методы, позволяющие экспериментально определить молярные массы
Слайд 28Определение молярной массы лекарственных препаратов криоскопическим методом широко применяется в фармакопейных
Слайд 295.4 Все растворы обладают способностью к диффузии.
Диффузия - это равномерное распределение
Слайд 30Можно создать условие, при котором диффузия протекает только в одном направлении.
Слайд 31Осмос - односторонняя диффузия растворителя через полупроницаемую мембрану из растворителя в
Слайд 33
Концентриро-
ванный
Разбавленный
Полупроницаемая мембрана
Осмос воды из разбавленного раствора в более концентрированный
Слайд 34Движущей силой осмоса является стремление к выравниванию концентрации растворенного вещества по
Слайд 35Процесс протекает само-произвольно и сопровождается увеличением энтропии. Пределом его протекания является
Слайд 36
Давление, которое оказывает растворитель на мембрану, называется осмотическим давлением (росм).
Слайд 37Осмотическое давление описывается уравнением Вант- Гоффа.
Для неэлектролитов:
росм= См ×R×T
Для
росм= i ×См ×R×T
Слайд 38Якоб Хендрик Вант-Гофф (1852-1911)
Я.Х.Вант-Гофф является одним из основателей физической химии и
Слайд 39Клеточные мембраны животных и растительных организмов являются проницаемыми для воды и
Слайд 40Осмотическое давление плазмы и других биологических жидкостей обусловлено главным образом присутствием
Слайд 41 В меньшей степени давление создается коллоидными частицами белков, не про-ходящих
Слайд 42Осмотический гомеостаз обусловлен работой почек, легких, кожи. Работа по переносу вещества
Слайд 43Осмос лежит в основе целого ряда физиологических процессов: усвоение пищи, выделение
Слайд 44В медицинской практике используют растворы, изоосмотичные с кровью (физиологические растворы).
Например, NaCl
Слайд 45 Введение физиологических растворов в кровь, спинномозговую жидкость и другие биологические
Слайд 46При введении гипотонического раствора в кровяное русло
Слайд 47Начальная стадия гемолиза наблюдается при
полный гемолиз наблюдается при росм = 260 - 300 кПа.
Слайд 48Плазмолиз (сморщивание эритроцитов) имеет место при введении в кровяное русло гипертонического
Слайд 50Применение гипертонических растворов в медицине
*10 %-ный раствор NaCl используется для
*25 %-ный раствор MgSO4 применяется как гипотензивное средство;
*различные гипертонические растворы используются для лечения глаукомы