- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классы неорганических соединений презентация
Содержание
- 1. Классы неорганических соединений
- 2. Химические элементы, в зависимости от строения и свойств их атомов: металлы неметаллы
- 3. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ МЕТАЛЛЫ НЕМЕТАЛЛЫ
- 4. Положение неметаллических элементов в периодической системе химических элементов
- 5. Неметаллы Большое число е на внешнем уровне
- 9. Щелочные металлы – главная подгруппа
- 10. Переходные элементы, проявляющие в соединениях амфотерные свойства
- 11. Сложные вещества по химическим свойствам: Оксиды Гидроксиды (Основания, Кислоты) Соли
- 12. Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является О.
- 13. Оксиды солеобразующие (образуют соли – СuO, SO3)
- 14. Оксиды (по химическим свойствам) основные (гидраты которых являются основаниями – CaO, Na2O)
- 15. Оксиды (по химическим свойствам) кислотные (гидраты которых являются кислотами - SO3, CO2)
- 16. Оксиды (по химическим свойствам) амфотерные (проявляют
- 17. Основания – сложные вещества, молекула которых состоит
- 18. Основания Гидроксиды щелочных и щелочно-земельных Ме – щелочи (КОН, NаОН, Ва(ОН)2)
- 19. Основания по количеству гидроксильных групп: однокислотные (NаОН), двукислотные (Ва(ОН)2), многокислотные (Fe(ОН)3).
- 20. Химические свойства щелочей растворы имеют рН>7
- 21. Химические свойства нерастворимых оснований не изменяют
- 22. Кислоты сложные вещества, молекулы которых состоят
- 23. Кислоты по количеству атомов водорода: одноосновные
- 24. Кислоты по элементному составу: кислородсодержащие (HNO3 , H3PO4) бескислородные (HCl, H2S)
- 25. Номенклатура кислот и солей
- 26. Номенклатура кислот и солей
- 27. Номенклатура кислот и солей
- 28. Химические свойства кислот растворы имеют рН
- 29. Амфотерные гидроксиды две формы Zn(OН)2 –
- 30. Амфотерные гидроксиды и с основаниями, и
- 31. Соли – продукты полного или частичного
- 32. Соли или продукт полного или частичного
- 33. Соли от состава: средние – продукты полного
- 34. Соли от состава: кислые - частичного замещения Н (КН2PO4 , К2НPO4) – гидро-
- 35. Соли от состава: основные – частичного замещения ОН (Al(OH)2Cl , MgOHI) – гидроксо-
- 36. Индикаторы
Слайд 5Неметаллы
Большое число е на внешнем уровне (4-8), иск. водород и бор
Принимают
Кристаллическая решетка: молекулярная (газы), атомная (алмаз, графит, кремний…)
Труднее выделить общие характерные признаки: газы (хлор), жидкости (бром), твердые вещества (иод)
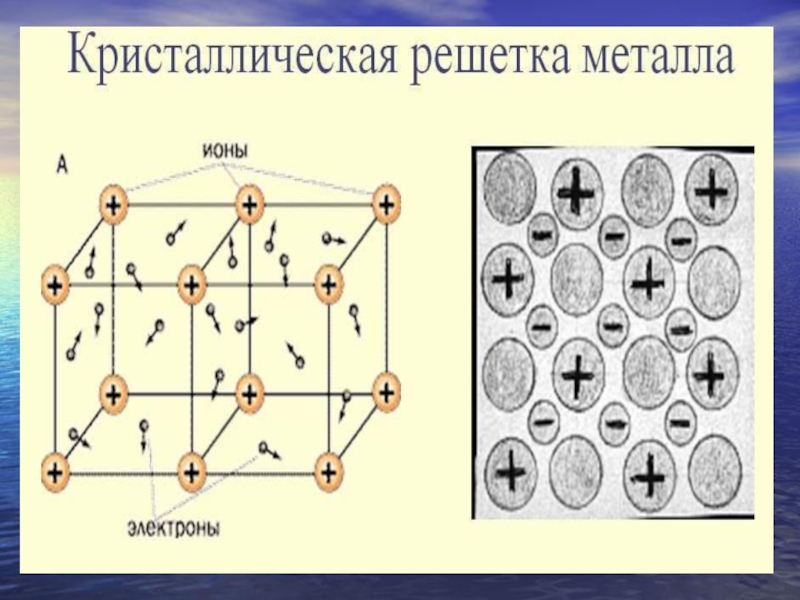
Металлы
Небольшое число е на внешнем уровне (1-3)
Отдают е – восстановительные свойства
Кристаллическая решетка – металлическая
Твердые вещества, кроме ртути
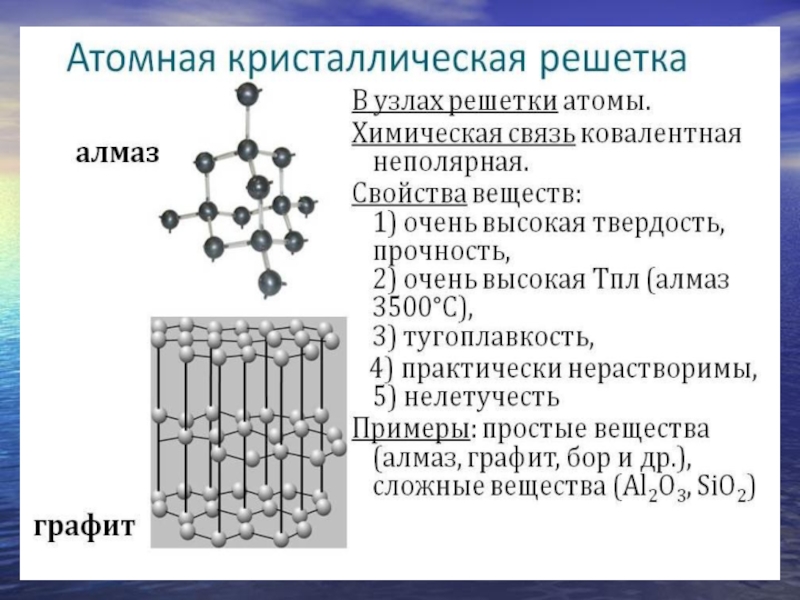
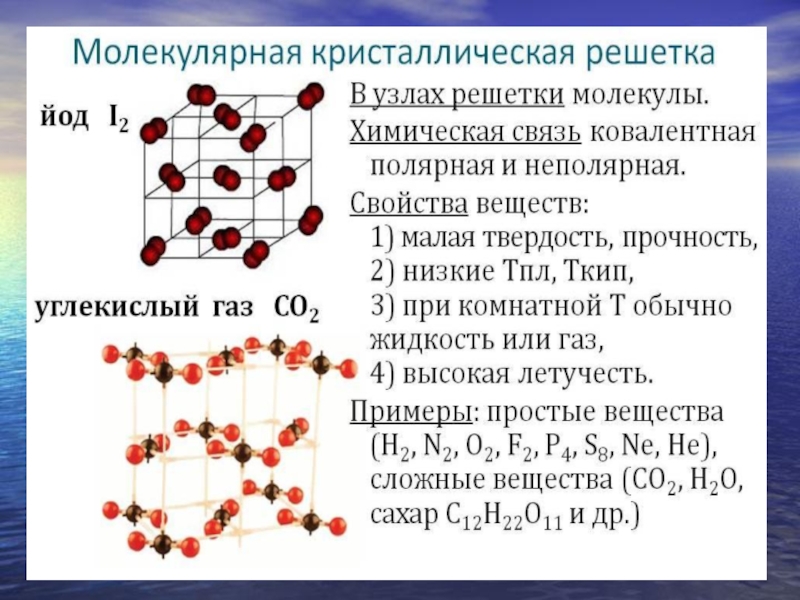
Неметаллы
Большое число е на внешнем уровне (4-8), иск. водород и бор
Принимают недостающие е – окислительные свойства
Кристаллическая решетка: молекулярная (газы), атомная (алмаз, графит, кремний…)
Труднее выделить общие характерные признаки: газы (хлор), жидкости (бром), твердые вещества (иод)
Слайд 9 Щелочные металлы – главная подгруппа I группы – отдают 1 е
Слайд 10Переходные элементы, проявляющие в соединениях амфотерные свойства
9 элементов главных подгрупп:
бериллий(4), алюминий(13),
Все элементы побочных подгрупп, кроме скандия(21), иттрия(39)
Слайд 16Оксиды (по химическим свойствам)
амфотерные
(проявляют либо основные, либо кислотные свойства –
Слайд 17Основания
– сложные вещества, молекула которых состоит из атома Ме и одной
Слайд 19Основания по количеству гидроксильных групп:
однокислотные (NаОН),
двукислотные (Ва(ОН)2),
многокислотные (Fe(ОН)3).
Слайд 20Химические свойства щелочей
растворы имеют рН>7
изменяют окраску индикаторов:
- лакмус –
- фенолфталеин – малиновая,
- метиловый оранжевый – желтая.
устойчивы к нагреванию
Слайд 21Химические свойства нерастворимых оснований
не изменяют окраску индикаторов.
при нагревании разлагаются
Cu(OH)2
Слайд 22Кислоты
сложные вещества, молекулы которых состоят из атомов Н
и кислотного
Общая формула - НnК,
К – кислотный остаток.
Слайд 23Кислоты по количеству атомов водорода:
одноосновные (HCl, HNO3),
двухосновные (H2SO4 , H2S)
многоосновные
Слайд 28Химические свойства кислот
растворы имеют рН
- фенолфталеин – остается бесцветная,
- метиловый оранжевый – розовая.
Слайд 30Амфотерные гидроксиды
и с основаниями, и с кислотами:
Zn(OН)2 + 2NaOH
Zn(OН)2 + 2HCl = ZnCl2 + 2H2O
Слайд 31Соли
– продукты полного или частичного замещения атомов Н в молекуле
(искл. ион аммония)
Например, Na2SO4 и NaНSO4
Слайд 32Соли
или продукт полного или частичного замещения -ОН в основании на
Например, AlOHCl2 и AlCl3, NH4NO3
Слайд 33Соли от состава:
средние – продукты полного замещения атомов Н в молекуле
(MgSO4 , Ca3(PO4)2)