- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 4. Классификация и механизмы органических реакций презентация
Содержание
- 1. Лекция 4. Классификация и механизмы органических реакций
- 2. План 4.1. Классификация органических реакций 4.2. Классификация
- 3. 4.1 Классификация органических реакций по направлению
- 4. Гетеролитические (ионные) * электрофильные * нуклеофильные
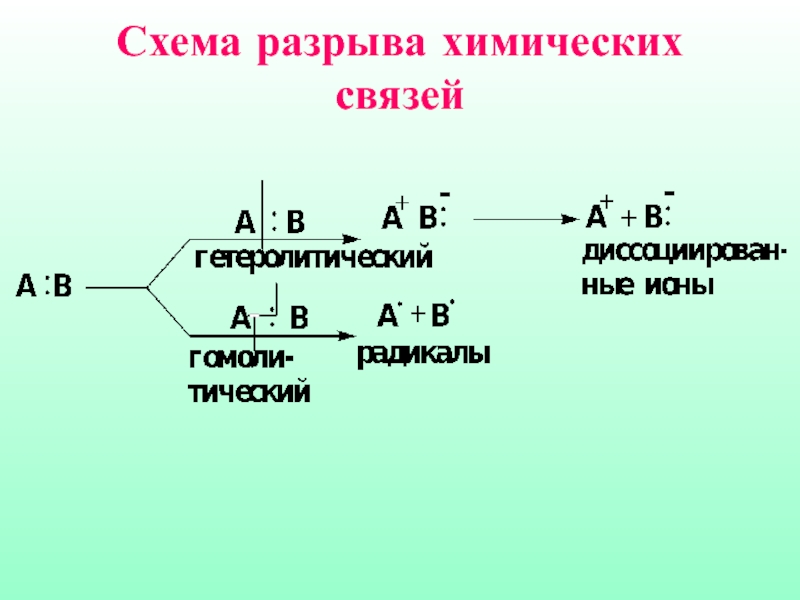
- 5. Схема разрыва химических связей
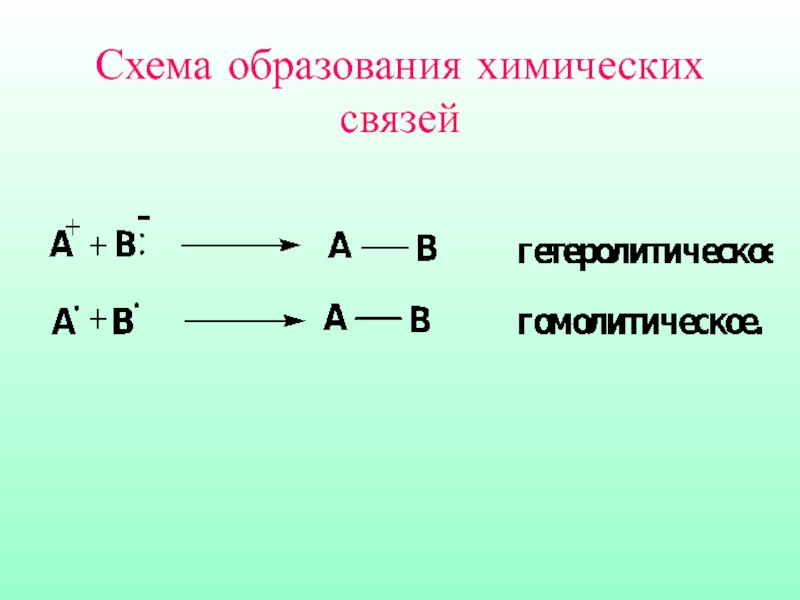
- 6. Схема образования химических связей
- 7. Гетеролитические реакции называют ионными, поскольку они сопровождаются
- 8. Гетеролитические реакции в зависимости от электронной природы
- 9. Субстрат – молекула, которая поставляет атом углерода
- 10. Реагент с неподеленной электронной парой, взаимодействующий с
- 11. Реагент с электронным де-фицитом, взаимодействующий с субстратом,
- 12. Нуклеофильные и электрофильные реакции всегда связаны между
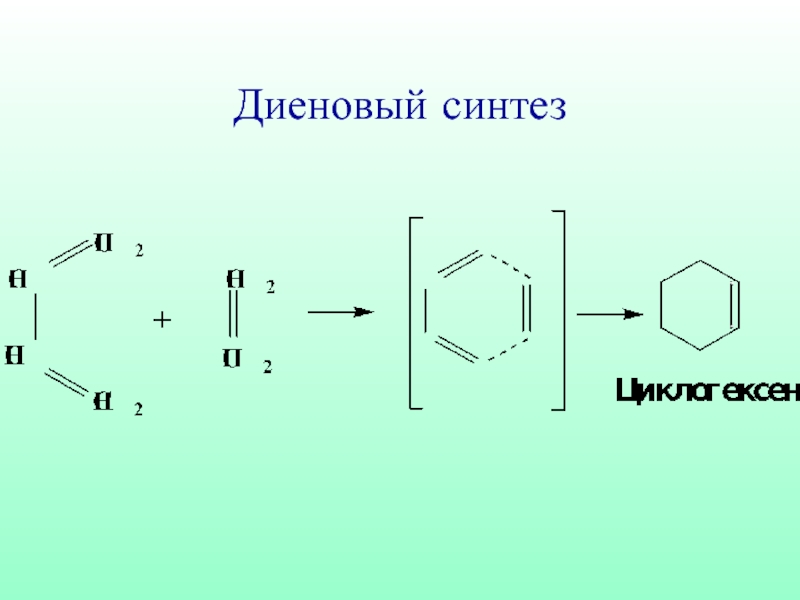
- 13. Диеновый синтез
- 14. 4.2. Классификация реагентов К нуклеофильным реагентам
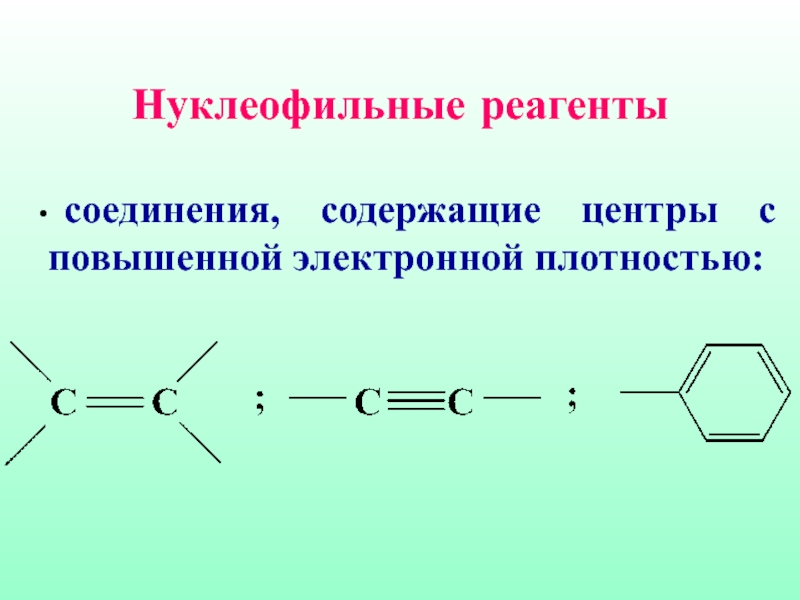
- 15. Нуклеофильные реагенты нейтральные молекулы, имеющие неподеленные пары
- 16. Нуклеофильные реагенты соединения, содержащие центры с повышенной электронной плотностью:
- 17. Электрофильные реагенты нейтральные молекулы, имеющие вакантную
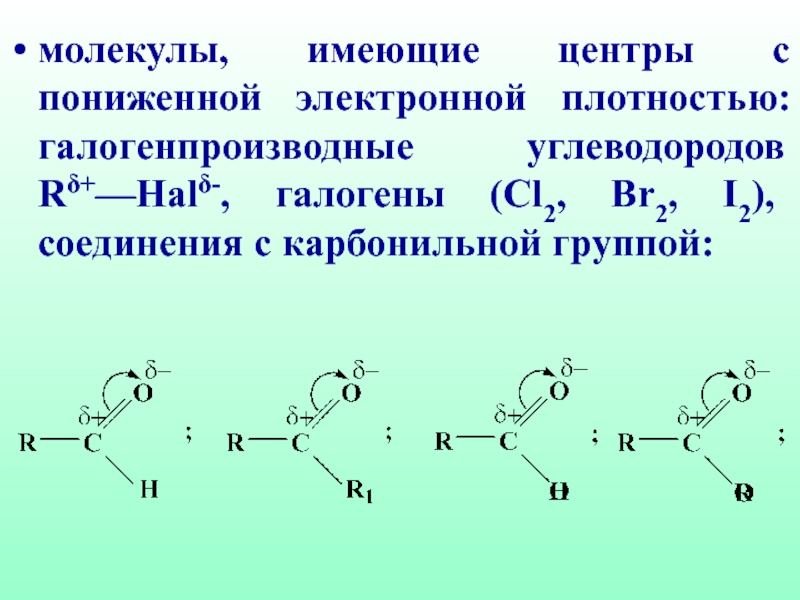
- 18. молекулы, имеющие центры с пониженной электронной плотностью:
- 19. В органической химии реакции, как правило протекают
- 20. Карбкатионы – положительно заряженные частицы, атом углерода,
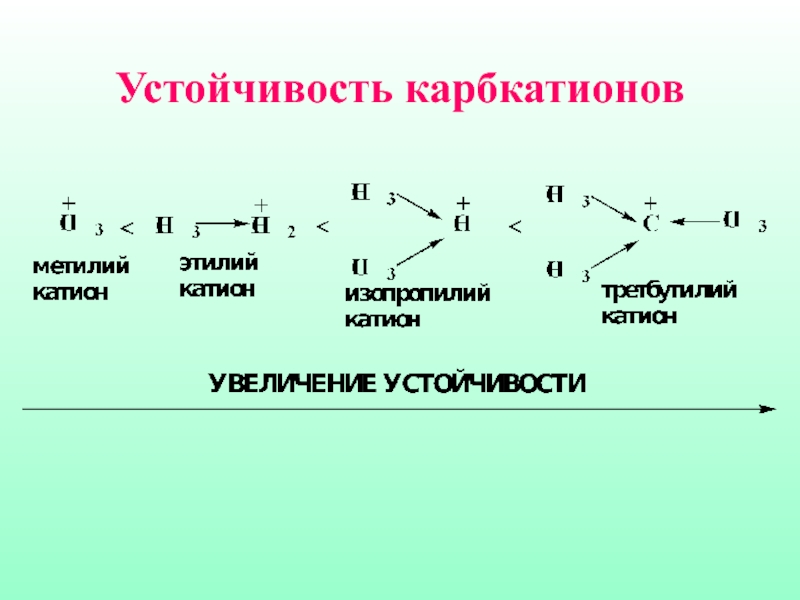
- 21. Важной характеристикой карбкатионов является их устойчивость, которая определяется степенью делокализации положительного заряда
- 22. Устойчивость карбкатионов падает в ряду:
- 23. Устойчивость карбкатионов
- 24. Карбанионы – отрицательно заряженные частицы, заряд которых
- 25. Устойчивость карбанионов зависит от степени делокализации отрицательного
- 26. циклопентадиенил анион
- 27. Свободные радикалы – любая электронейтральная активная частица,
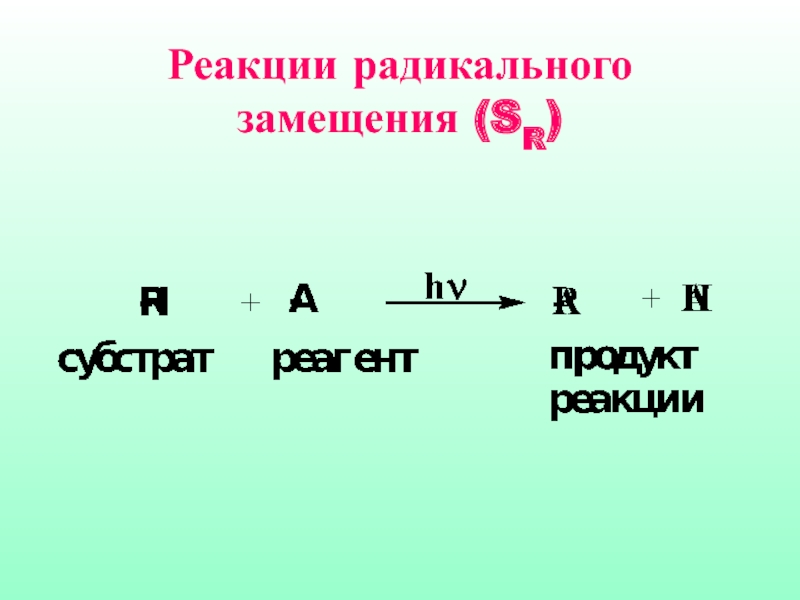
- 28. 4.3. Реакции радикального замещения (SR) Реакции
- 29. На стадии инициирования образуются свободные радикалы, дающие
- 30. Реакции радикального замещения (SR)
- 31. Механизм реакции радикального замещения (SR)
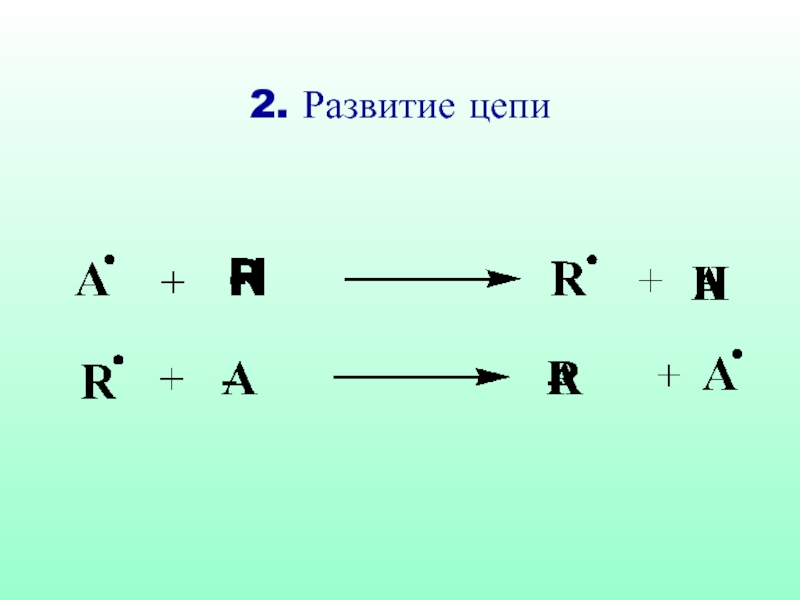
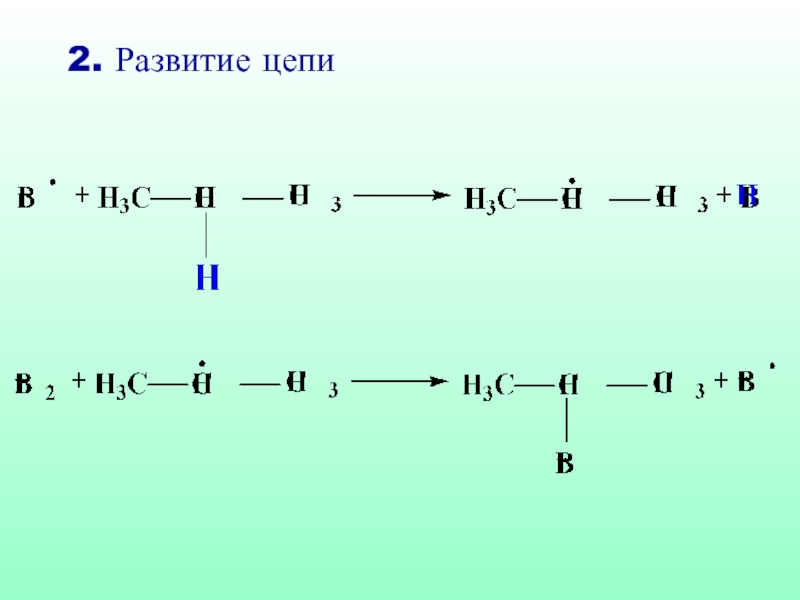
- 32. 2. Развитие цепи
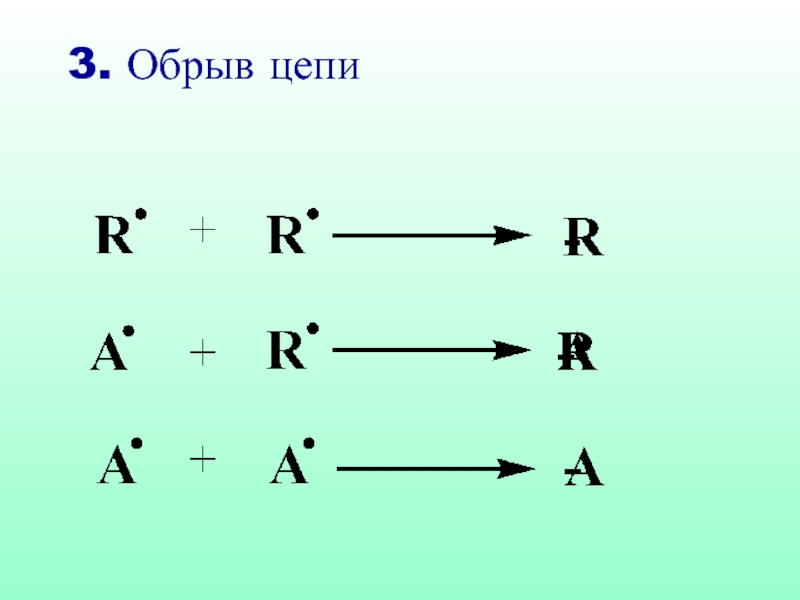
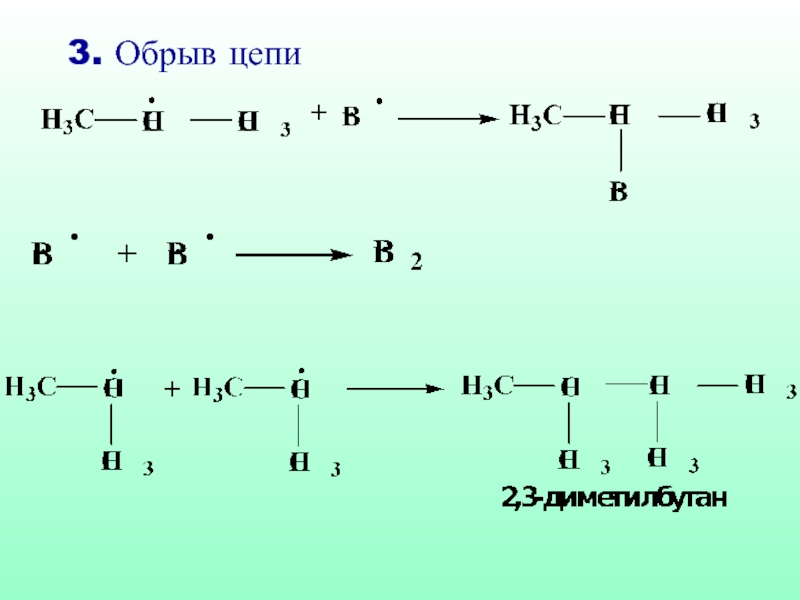
- 33. 3. Обрыв цепи
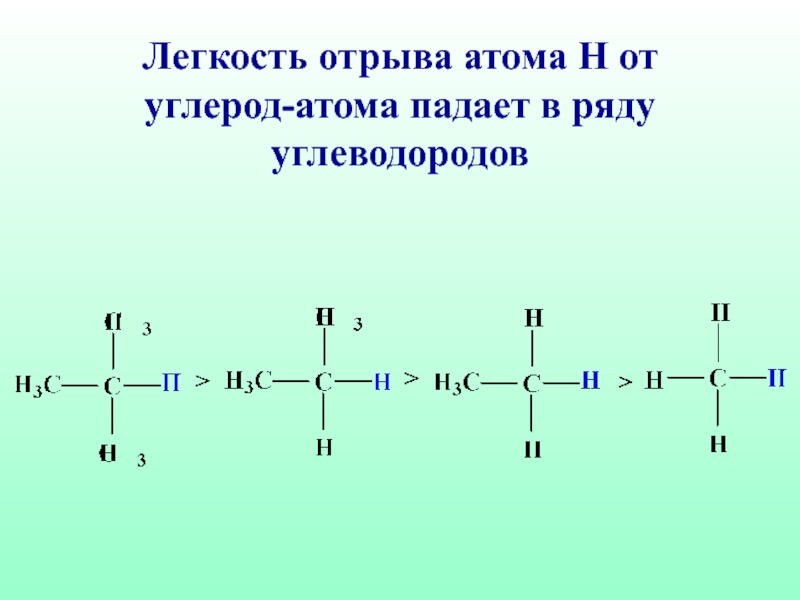
- 34. Легкость отрыва атома Н от углерод-атома падает в ряду углеводородов
- 35. Радикалы брома (Вr˙) обладают высокой избирательностью: если
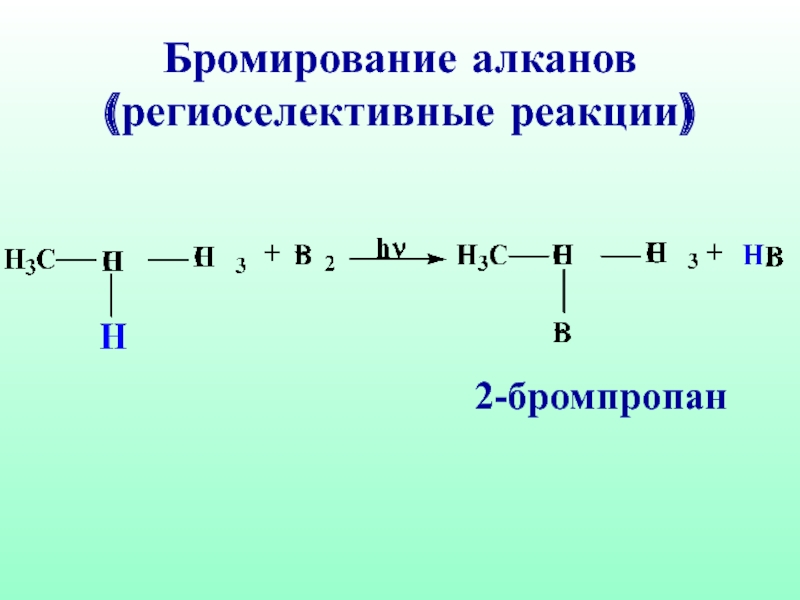
- 36. Бромирование алканов (региоселективные реакции) 2-бромпропан
- 37. 1. Инициирование Механизм реакции бромирования алканов
- 38. 2. Развитие цепи
- 39. 3. Обрыв цепи
- 40. 4.4. Реакции электрофильного присоединения Электрофильное присоединение
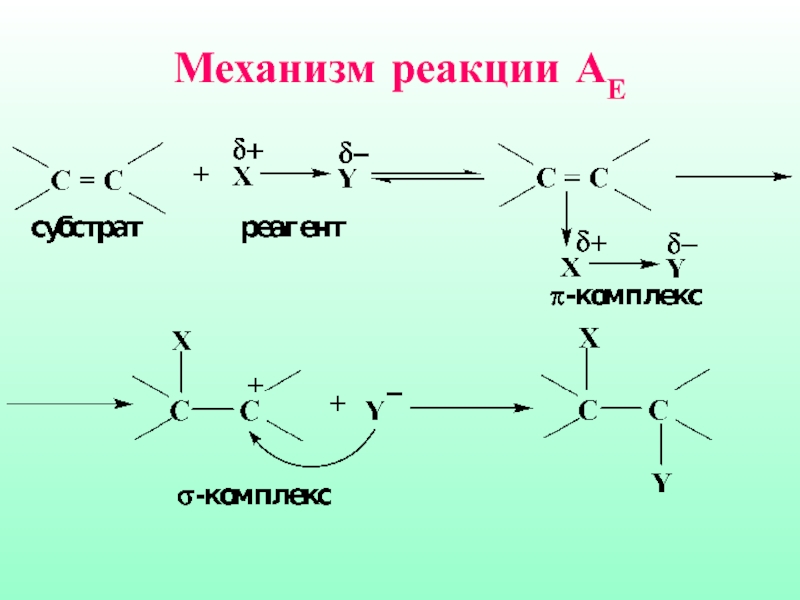
- 41. Механизм реакции АЕ
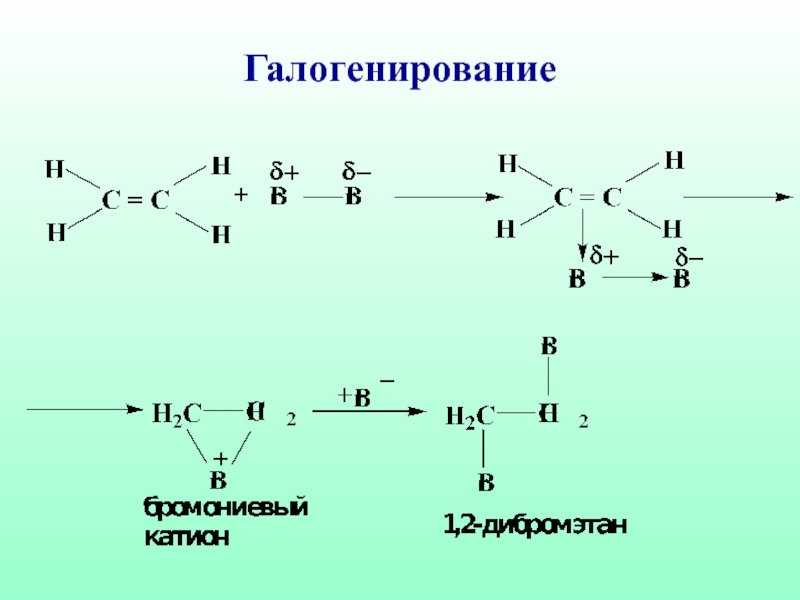
- 42. Галогенирование
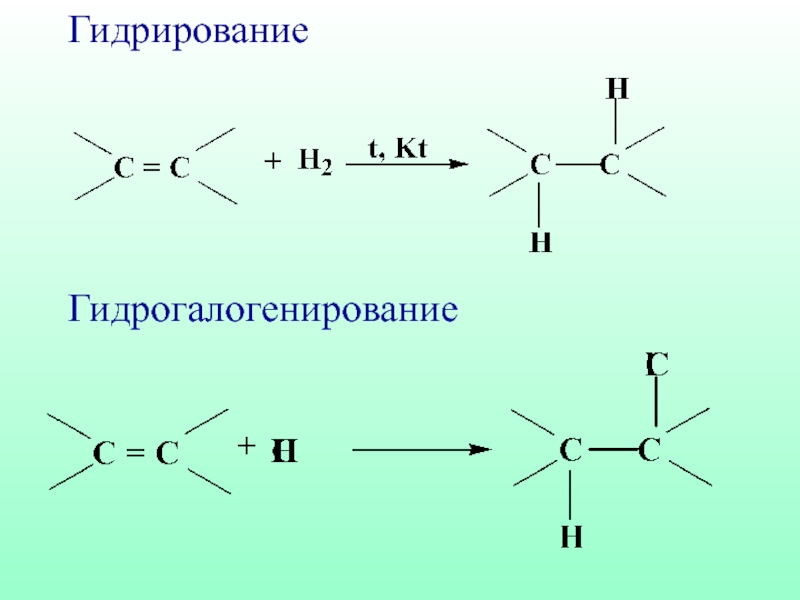
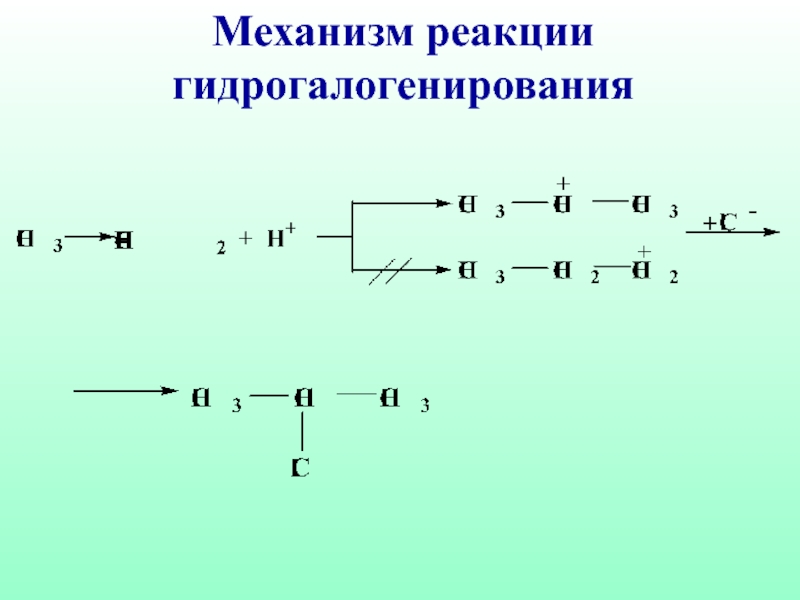
- 43. Гидрирование Гидрогалогенирование
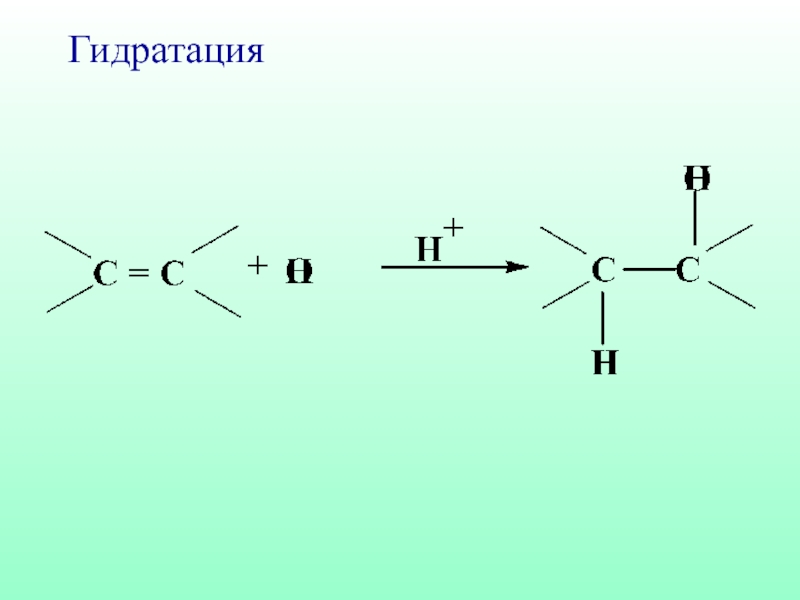
- 44. Гидратация
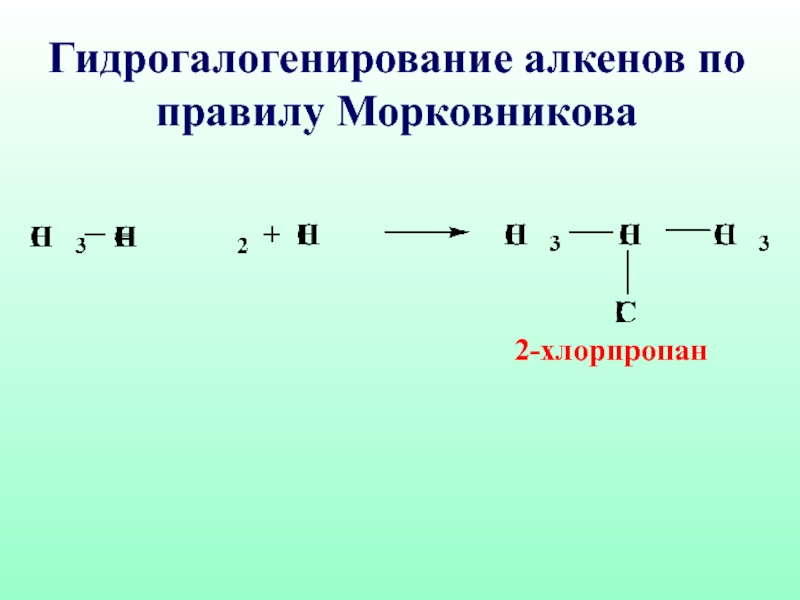
- 45. Правило Марковникова: при взаимодействии реагентов типа НХ
- 46. 2-хлорпропан Гидрогалогенирование алкенов по правилу Морковникова
- 47. Механизм реакции гидрогалогенирования
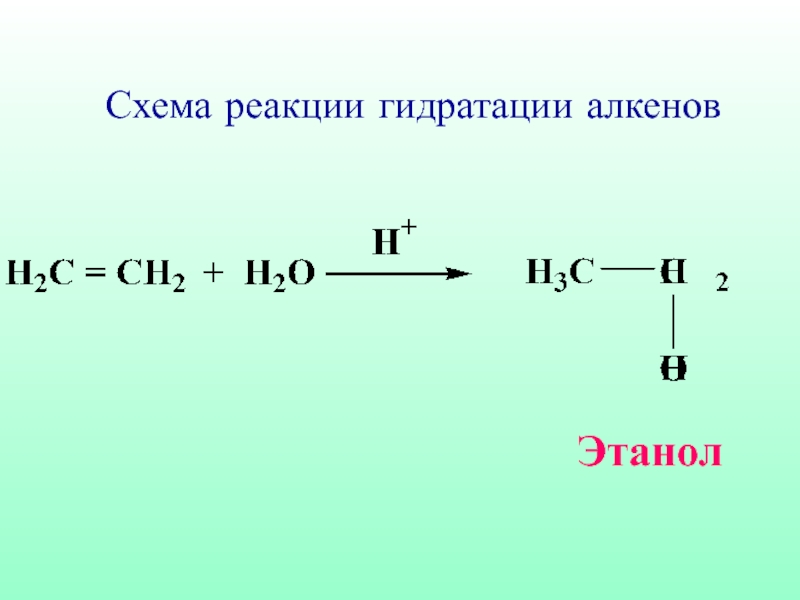
- 48. Схема реакции гидратации алкенов Этанол
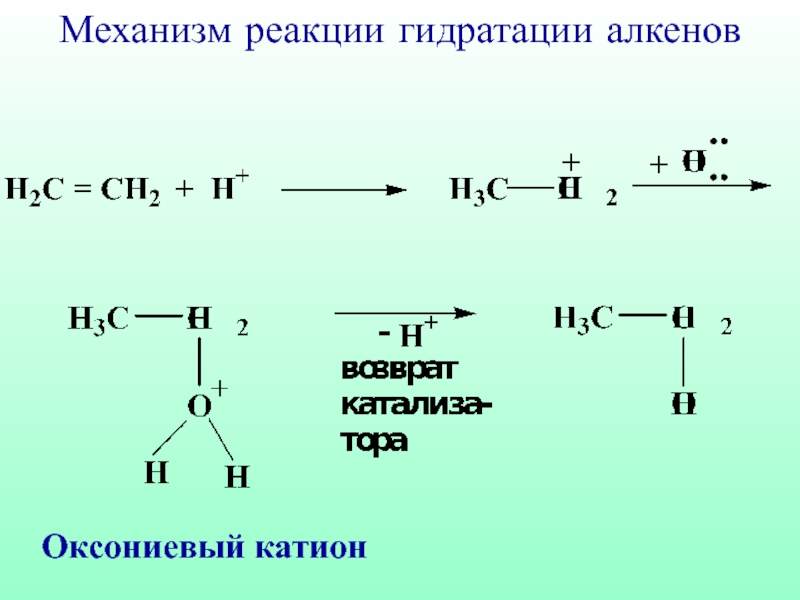
- 49. Оксониевый катион Механизм реакции гидратации алкенов
- 50. Классическое правило Марковникова идеально применимо только к
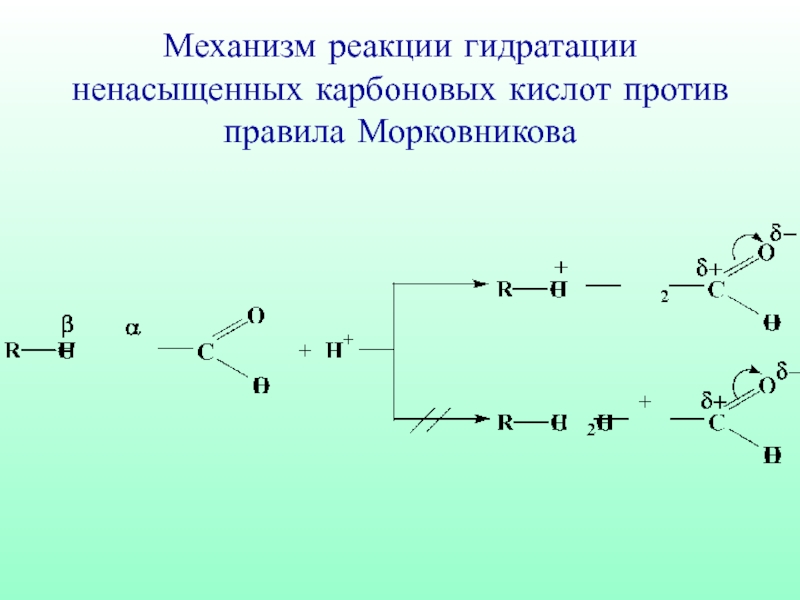
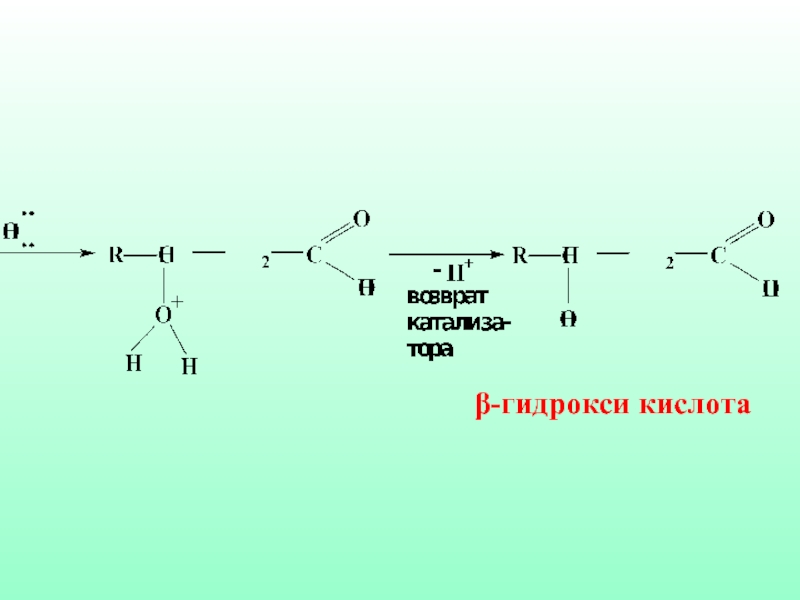
- 51. Механизм реакции гидратации ненасыщенных карбоновых кислот против правила Морковникова
- 52. β-гидрокси кислота
- 53. Такого типа гидратация in vivo является частью процесса β-окисления ненасыщенных жирных кислот в организме
- 54. Сопряженные системы (алкадиены) термодинамически наиболее устойчивы, поэтому
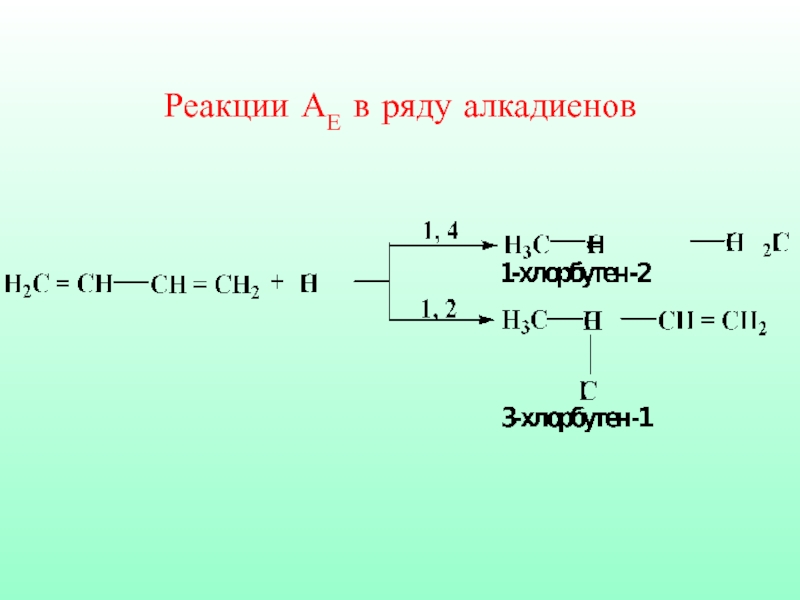
- 55. Реакции АЕ в ряду алкадиенов
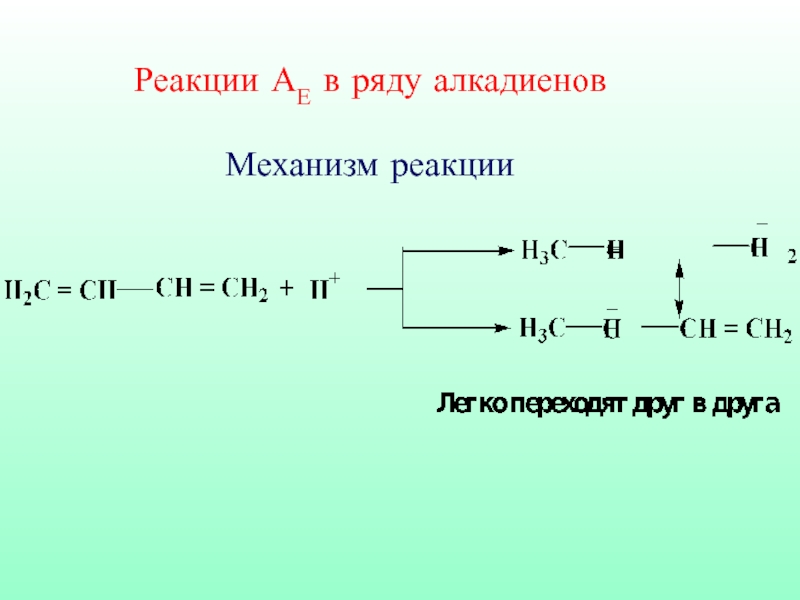
- 56. Реакции АЕ в ряду алкадиенов Механизм реакции
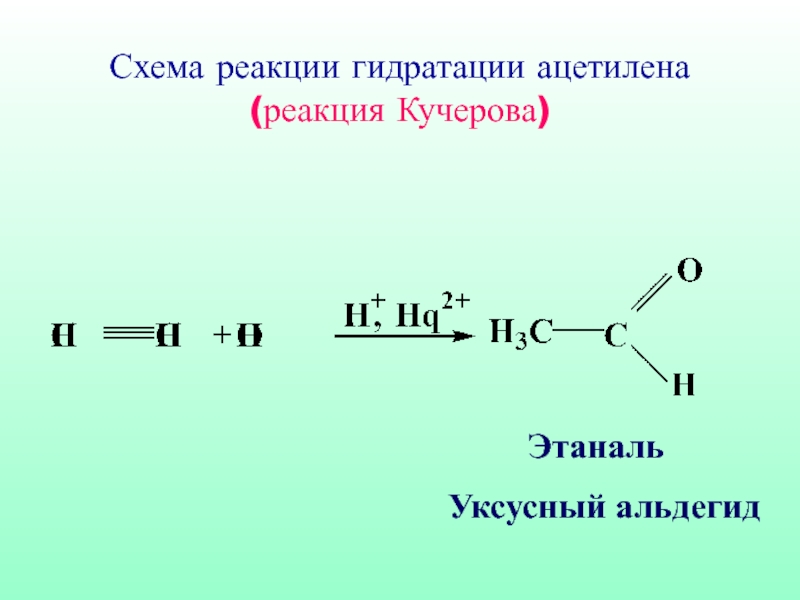
- 57. Схема реакции гидратации ацетилена (реакция Кучерова) Этаналь Уксусный альдегид
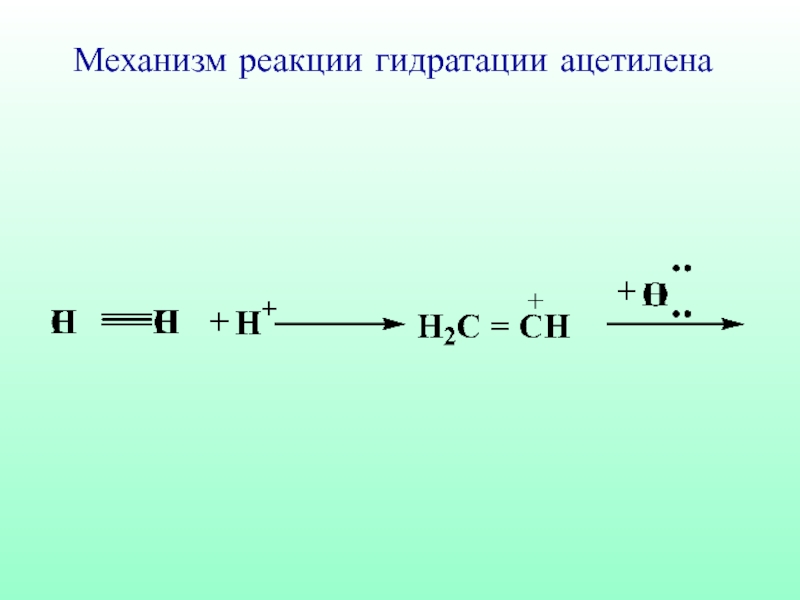
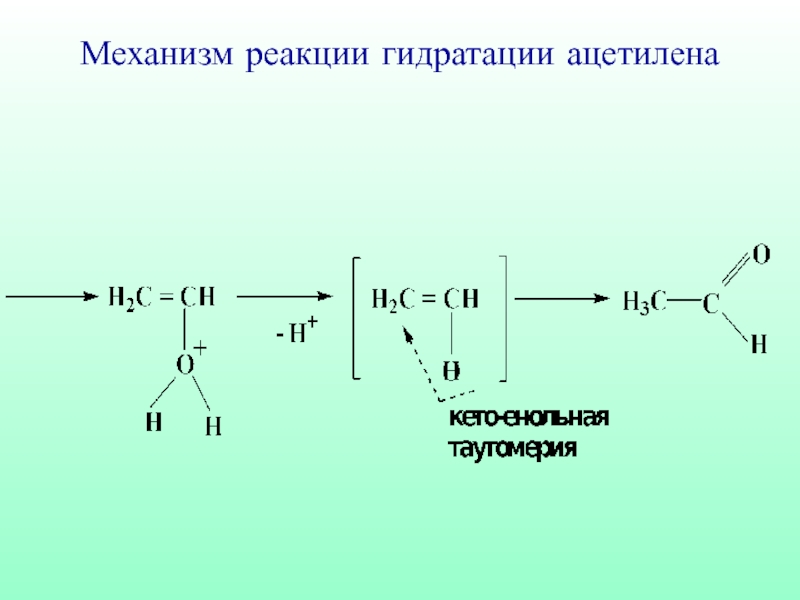
- 58. Механизм реакции гидратации ацетилена
- 59. Механизм реакции гидратации ацетилена
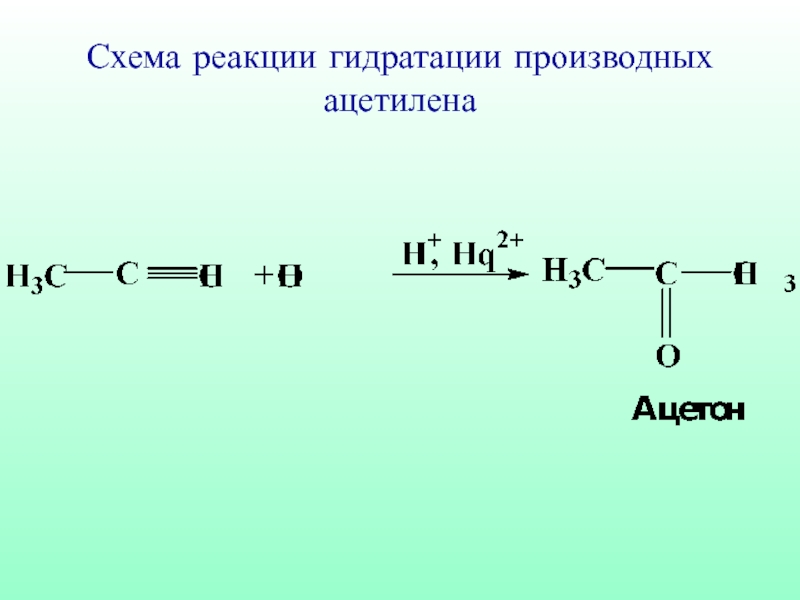
- 60. Схема реакции гидратации производных ацетилена
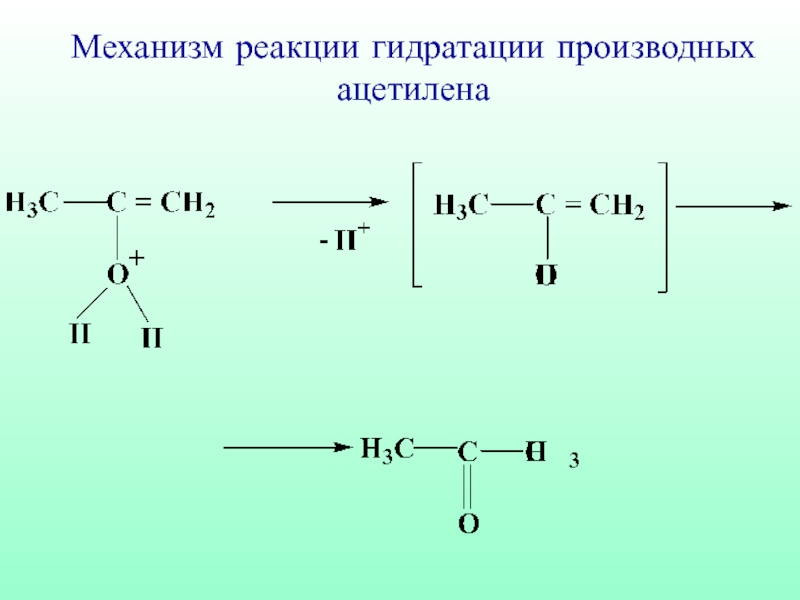
- 61. Механизм реакции гидратации производных ацетилена
- 62. Механизм реакции гидратации производных ацетилена
- 63. Благодарим за внимание !
Слайд 2План
4.1. Классификация органических реакций
4.2. Классификация реагентов
4.3.Реакции радикального заме-щения (SR)
4.4 Реакции электрофильного
при-соединения (АЕ)
Слайд 34.1 Классификация
органических реакций
по направлению
Реакции замещения S
Реакции присоединения A
Реакции элиминирования E
Молекулярные
перегруппировки
по молекулярности
Мономолекулярные
Бимолекулярные
Тримолекулярные
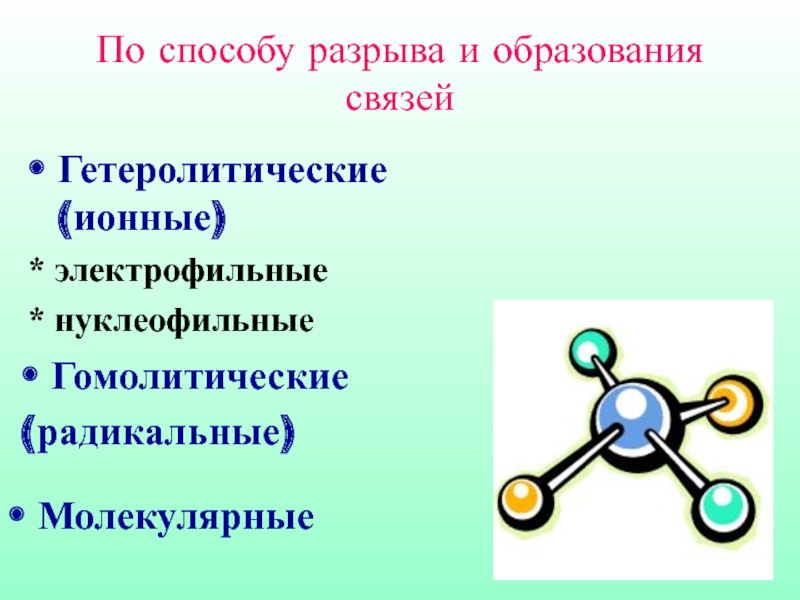
Слайд 4Гетеролитические (ионные)
* электрофильные
* нуклеофильные
Гомолитические
(радикальные)
Молекулярные
По способу разрыва и образования связей
Слайд 7Гетеролитические реакции называют ионными, поскольку они сопровождаются образованием органических ионов, протекают
в органических растворителях
Гомолитические реакции протекают преимущественно в газовой фазе
Гомолитические реакции протекают преимущественно в газовой фазе
Слайд 8Гетеролитические реакции в зависимости от электронной природы атакующей частицы делят на
нуклеофильные (символ N) и электрофильные (символ Е). При этом условно принято считать одну из взаимодействующих частиц реагентом, а другую субстратом, на которую действует реагент
Слайд 9Субстрат – молекула, которая поставляет атом углерода для образования новой связи
Тип
реакции (нуклеофильный или электрофильный) опре-деляется характером реагента
Слайд 10Реагент с неподеленной электронной парой, взаимодействующий с субстратом, имеющим недостаток электронов,
называют «нуклеофильным» (любящим, ищущим ядро), а реакции нуклеофильными
Слайд 11Реагент с электронным де-фицитом, взаимодействующий с субстратом, обладающим из-бытком электронов, называют
«электрофильным», а реакцию электрофильной
Слайд 12Нуклеофильные и электрофильные реакции всегда связаны между собой
Реакции, сопровождающиеся одновременным (согласованным)
разрывом и образованием связей, называют молекулярными (синхронными, согласованными)
Слайд 144.2. Классификация реагентов
К нуклеофильным реагентам относят молекулы, содержащие одну или более
неподеленных пар электронов; ионы, несущие отрицательный заряд (анионы); молекулы, имеющие центры с повышенной плотностью
Слайд 15Нуклеофильные реагенты
нейтральные молекулы, имеющие неподеленные пары электронов:
анионы:
OH— ; CN—;
NH2—; RCOO—; RS—; Cl—; Br—; I—; HSO3—;
Слайд 17Электрофильные реагенты
нейтральные молекулы, имеющие вакантную орбиталь: SO3, кислоты Льюиса (AlCl3,
SnCl4, FeBr3, BF3)
катионы: протон (Н+), ионы металлов (Меn+), SO3H+, NO2+, NO+
катионы: протон (Н+), ионы металлов (Меn+), SO3H+, NO2+, NO+
Слайд 18молекулы, имеющие центры с пониженной электронной плотностью: галогенпроизводные углеводородов Rδ+—Halδ-, галогены
(Cl2, Br2, I2), соединения с карбонильной группой:
Слайд 19В органической химии реакции, как правило протекают в несколько стадий, т.е.
с образованием промежуточных, короткоживущих частиц (интермедиаты): карбкатионы, карбанионы, радикалы
Слайд 20Карбкатионы – положительно заряженные частицы, атом углерода, несущий положительный заряд находится
в sр2 – гибридизации.
Атом углерода с приобретением положительного заряда изменяет свое валентное состояние от sр3 до sр2, что энергетически более выгодно.
Атом углерода с приобретением положительного заряда изменяет свое валентное состояние от sр3 до sр2, что энергетически более выгодно.
Слайд 21Важной характеристикой карбкатионов является их устойчивость, которая определяется степенью делокализации положительного
заряда
Слайд 24Карбанионы – отрицательно заряженные частицы, заряд которых обусловлен наличием в их
структуре атома С с неподеленной электронной парой. При этом атом углерода, несущий отрицательный заряд, может быть как в sp2, так и в sр3-гибридизации
Слайд 25Устойчивость карбанионов зависит от степени делокализации отрицательного заряда на атоме углерода.
Чем она выше, тем выше их устойчивость и тем ниже их реакционная способность. Наиболее устойчивы циклические карбанионы, в структуре которых имеется общая π-электронная плотность, включающая в себя
4n+2 π-электрона
4n+2 π-электрона
Слайд 27Свободные радикалы – любая электронейтральная активная частица, содержащая одноэлектронную орбиталь.
К свободным
радикалам могут быть отнесены частицы, содержащие неспаренный электрон не только на атоме углерода (С·), но и на других атомах: R2N· ; RО·
Слайд 284.3. Реакции радикального замещения (SR)
Реакции SR характерны для соединений алифатического и
алициклического рядов. Как правило, они протекают по цепному механизму, основными стадиями которого являются: инициирование, развитие (рост цепи) и обрыв цепи.
Слайд 29На стадии инициирования образуются свободные радикалы, дающие начало цепному процессу
Свободные радикалы
могут возникать за счет термического или фотохимического инициирования, а также в результате ОВ реакций
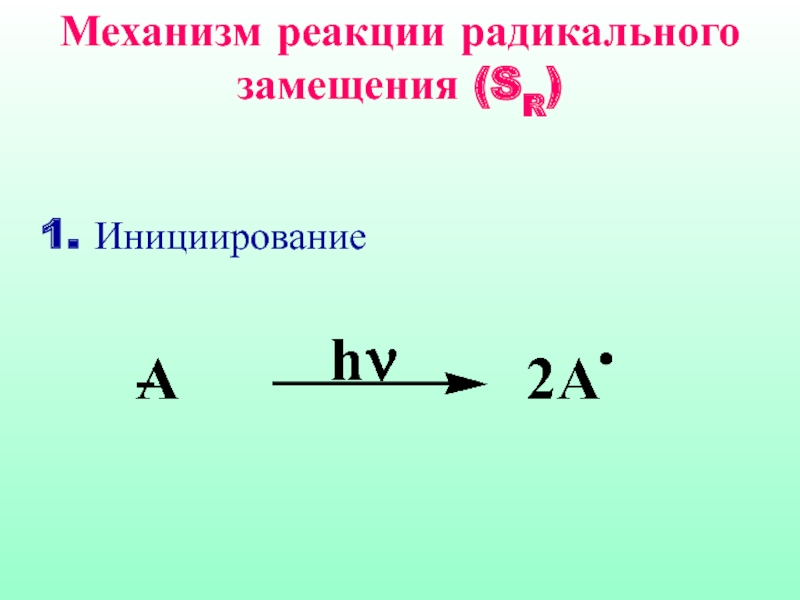
Слайд 31Механизм реакции радикального замещения (SR)
Механизм реакции радикального замещения (SR)
1. Инициирование
Слайд 35Радикалы брома (Вr˙) обладают высокой избирательностью: если в молекуле имеются вторичный,
а тем более третичный атом углерода, то бромирование преимущественно идет у третичного (вторичного) атома углерода. Такие реакции называются региоселективными (избирательными по месту действия) реакциями
Слайд 404.4. Реакции электрофильного присоединения
Электрофильное присоединение (АЕ) характерно для ненасыщенных систем, содержащих
двойные или тройные связи. Нуклеофильный характер таких соединений обусловлен наличием π-связи, которая представляет собой область с повышенной электронной плотностью, обладает поляризуемостью и легко разрывается под действием электрофильных реагентов
Слайд 45Правило Марковникова: при взаимодействии реагентов типа НХ с несимметричными алкенами, водород
присоединяется к
наиболее гидрогенизированному атому углерода
Владимир Марковников
( 1837 – 1904)
Слайд 50Классическое правило Марковникова идеально применимо только к самим алкенам, в случае
их производных необходимо учитывать и механизм реакции и устойчивость образующихся интермедиатов
Слайд 53Такого типа гидратация in vivo является частью процесса β-окисления ненасыщенных жирных
кислот в организме
Слайд 54Сопряженные системы (алкадиены) термодинамически наиболее устойчивы, поэтому часто встречаются в природе.
Реакции АЕ с такими диенами протекают с образованием двух продуктов
1,4- и 1,2-присоединения