образуются соединения, обладающие совершенно иными свойствами, чем сами металлы. В обычной жизни мы часто употребляем слова «ржавчина», «ржавление», видя коричнево-рыжий налет на изделиях из железа и его сплавов. Ржавление — это частый случай коррозии.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Коррозия металлов презентация
Содержание
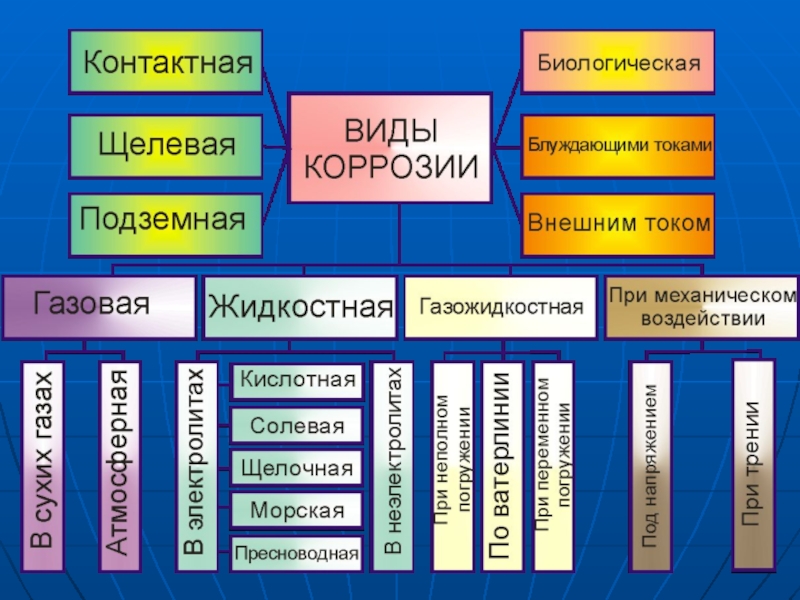
- 1. Коррозия металлов
- 2. Разрушению подвергаются практически все металлы, в
- 4. ХИМИЧЕСКАЯ КОРРОЗИЯ Данная коррозия протекает в среде
- 5. 4 Fe + 3 O2 =
- 6. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ Происходит в токопроводящей
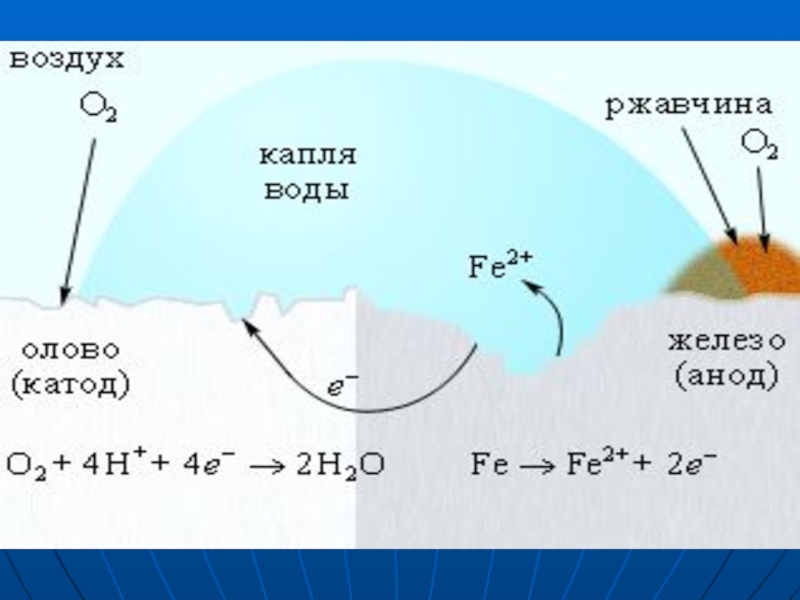
- 7. Разрушение железного образца
- 8. На железе, как более активном металле, при
- 9. Поток электронов перемещается к катодному участку (примесь)
- 10. Далее катионы Fe2+ и гидроксид-ионы соединяются. Образуется
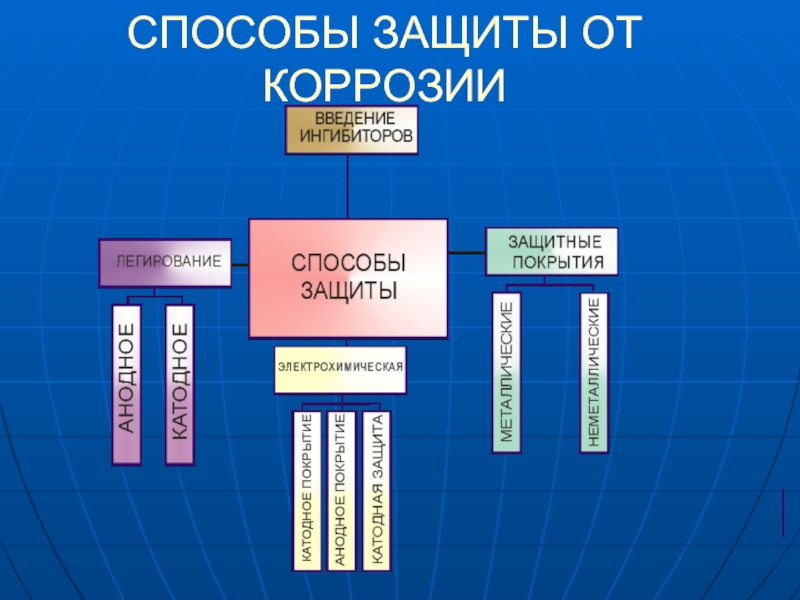
- 11. СПОСОБЫ ЗАЩИТЫ ОТ КОРРОЗИИ
- 12. ЭЛЕКТРОХИМИЧЕСКАЯ ЗАЩИТА КАТОДНЫЕ ПОКРЫТИЯ
- 14. АНОДНЫЕ ПОКРЫТИЯ покрытия более
- 16. КАТОДНАЯ ЗАЩИТА Конструкция подключается к
- 18. ПРОТЕКТОРНАЯ ЗАЩИТА К защищаемому металлу присоединяется
- 19. Протектор
- 20. Результат коррозии: 20% от ежегодного получения металлов уничтожается коррозией
Слайд 2 Разрушению подвергаются практически все металлы, в результате чего многие их
свойства ухудшаются (или совсем теряются): уменьшаются прочность, пластичность, блеск, снижается электропроводность, а также возрастает трение между движущимися деталями машин, изменяются размеры деталей и т. д.
Коррозия — это процесс самопроизвольного разрушения металлов и сплавов под влиянием внешней среды (от лат. corrosio — разъедание).
Слайд 4ХИМИЧЕСКАЯ КОРРОЗИЯ
Данная коррозия протекает в среде окислительного газа при повышенных температурах
или в жидких неэлектролитах. Сущность процессов коррозии этого вида сводится к окислительно-восстановительной реакции, осуществляемой непосредственным переходом электронов металла на окислитель:
Слайд 5
4 Fe + 3 O2 = 2 Fe2O3
К химической
коррозии относятся процессы взаимодействия металлов с сухими газами /например, продуктами сгорания топлива в тепловых двигателях/ или жидкими органическими веществами /нефтепродуктами в резервуарах нефтеналивных судов/.
Слайд 6ЭЛЕКТРОХИМИЧЕСКАЯ
КОРРОЗИЯ
Происходит в токопроводящей среде (в электролите) с возникновением внутри
системы электрического тока. Скорость такой коррозии увеличивается с присутствием примесей в образце. При этом одни участки поверхности выполняют роль анода (отдают электроны), а другие — роль катода (принимают электроны).
Слайд 8На железе, как более активном металле, при соприкосновении с электролитом происходят
процессы окисления (растворения) металла и перехода его катионов в электролит:
Слайд 9Поток электронов перемещается к катодному участку (примесь) с меньшей активностью, на
нем накапливается избыточное количество электронов. Таким образом, данные участки могут «поделиться» электронами, поэтому на них возможны процессы восстановления:
Слайд 10Далее катионы Fe2+ и гидроксид-ионы соединяются.
Образуется гидроксид железа(II), который в присутствии
кислорода и воды переходит в гидроксид железа (III):
Слайд 12ЭЛЕКТРОХИМИЧЕСКАЯ ЗАЩИТА
КАТОДНЫЕ ПОКРЫТИЯ
покрытия менее активными металлами более
активных, например, Sn на Fe (луженое железо). При повреждении покрытия возникает коррозионный элемент, в котором основной металл служит анодом и растворяется, а металл покрытия – катодом, на котором выделяется Н2 или восстанавливается О2.
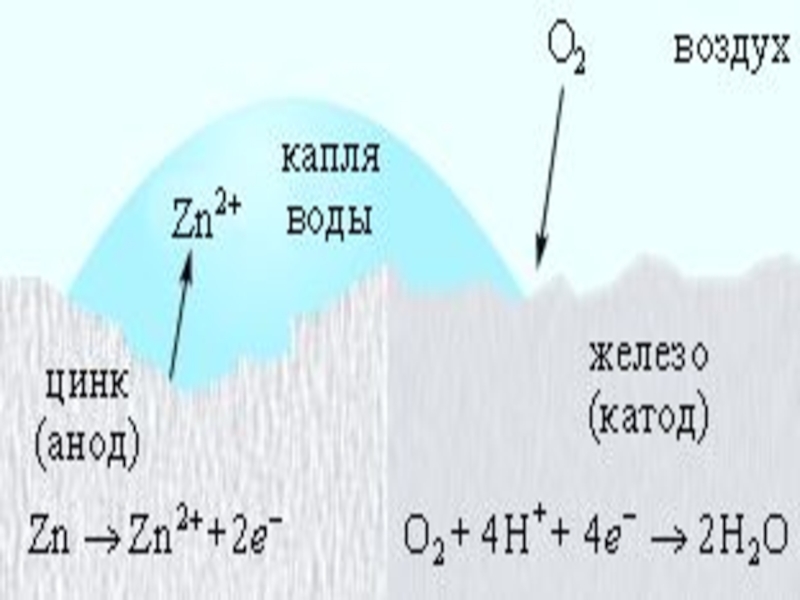
Слайд 14АНОДНЫЕ ПОКРЫТИЯ
покрытия более активными металлами менее активных, например,
Zn на Fe (оцинкованное железо). При повреждении покрытия возникает коррозионный элемент, в котором основной металл служит катодом, на котором выделяется Н2 или восстанавливается О2, а металл покрытия – анодом, который растворяется:
Слайд 16КАТОДНАЯ ЗАЩИТА
Конструкция подключается к отрицательному полюсу постоянного тока. Используется
в сочетании с лакокрасочными и другими изоляционными покрытиями. Катодная защита широко используется для уменьшения коррозии подземных и подводных трубопроводов и стальных опор высоковольтных передач, нефтяных платформ и причалов.
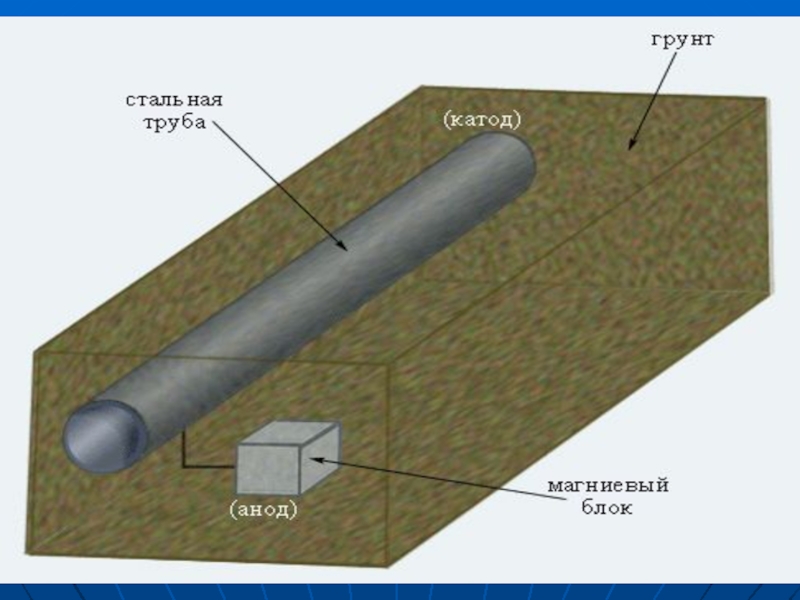
Слайд 18ПРОТЕКТОРНАЯ ЗАЩИТА
К защищаемому металлу присоединяется большой образец другого, более активного
металла, выполняющего роль анода и окисляющегося. Протектор, в частности, применяется для защиты от коррозии подводных частей морских судов.