- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Матеріалознавство. Будова твердих тіл та вплив на їх властивості презентация
Содержание
- 1. Матеріалознавство. Будова твердих тіл та вплив на їх властивості
- 2. УМОВИ УСПІШНОЇ ЗДАЧІ ІСПИТУ З МАТЕРІАЛОЗНАВСТВА ВІДВІДУВАННЯ
- 3. 1.Молекулярна будова, типи зв'язків у твердих тілах.
- 4. 3.Поняття про кристалічні та аморфні тіла. 4.Градація
- 5. ЛІТЕРАТУРА НМП для самостійного вивчення
- 6. 1. Молекулярна будова, типи зв'язків у твердих тілах.
- 7. Знання складу та будови вихідної сировини необхідне
- 8. Знання складу та будови вихідної сировини
- 9. Знання складу та будови вихідної сировини
- 10. ВЛАСТИВОСТІ МАТЕРІАЛІВ ОБУМОВЛЕНІ:
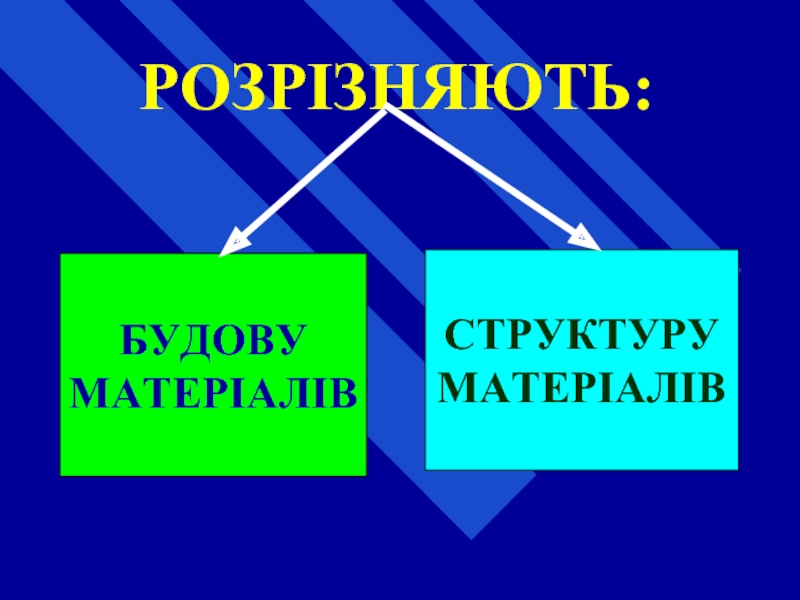
- 11. РОЗРІЗНЯЮТЬ: БУДОВУ МАТЕРІАЛІВ СТРУКТУРУ МАТЕРІАЛІВ
- 12. БУДОВА (хімічна) - характер зв'язку та послідовність
- 13. СТРУКТУРА - просторове розміщення структурних одиниць (молекул),
- 14. Хімічний зв'язок між атомами в молекулах
- 15. Які типи зв'язків атомів в молекулах
- 16. ІНДИВІДУАЛЬНЕ ЗАВДАННЯ №1 ДАТИ ХАРАКТЕРИСТИКУ ОСНОВНИХ ВИДІВ
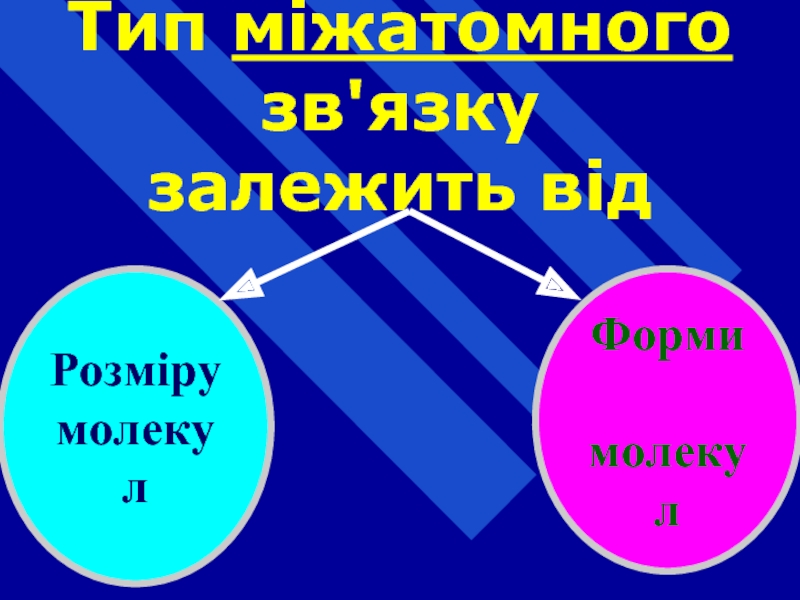
- 17. Тип міжатомного зв'язку залежить від Розміру молекул Форми молекул
- 18. Геометрична конфігурація молекули визначається
- 19. ВПЛИВ ТИПУ ЗВ'ЯЗКУ НА БУДОВУ ТА
- 21. АЛМАЗ БЕЗКОЛЬОРОВИЙ ПРОЗОРИЙ НЕ ПРОВОДИТЬ ЕЛЕКТРИЧНИЙ СТРУМ МАЄ ЗНАЧНУ ТВЕРДІСТЬ ГУСТИНА 3,5 Г/СМ
- 22. БАЛАСИ – АЛМАЗИ ІЗ ВКРАПЛЕННЯМИ, НАПІВПРОЗОРІ ТА НЕПРОЗОРІ
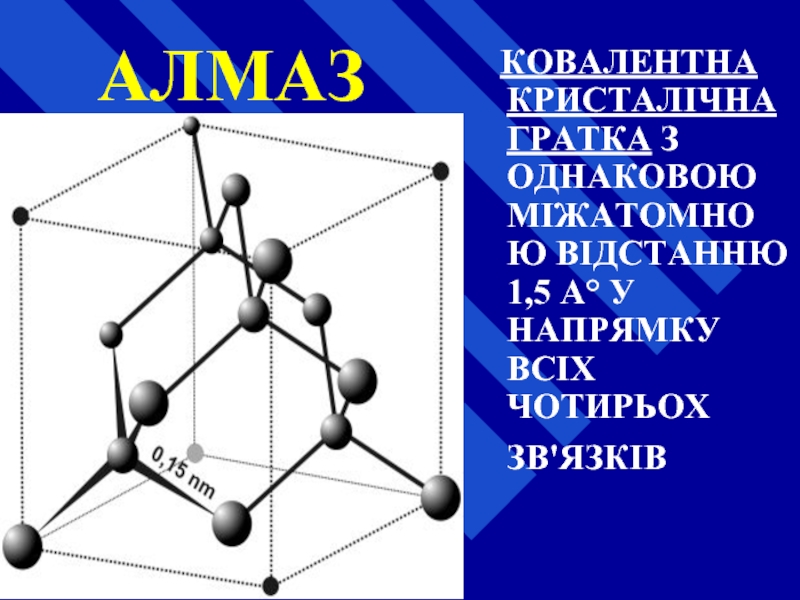
- 23. АЛМАЗ КОВАЛЕНТНА КРИСТАЛІЧНА ГРАТКА З
- 24. http://ru.wikipedia.org/wiki/Файл:Diamant_tropfen.jpg ОБРОБЛЕНИЙ АЛМАЗ
- 25. http://ru.wikipedia.org/wiki/Файл:SyntheticDiamonds.jpg ЗОБРАЖЕННЯ СИНТЕТИЧНИХ АЛМАЗІВ, ОТРИМАНЕ НА РАСТРОВОМУ ЕЛЕКТРОННОМУ МІКРОСКОПІ
- 26. ГРАФІТ характерна "мастильна" властивість жирний на
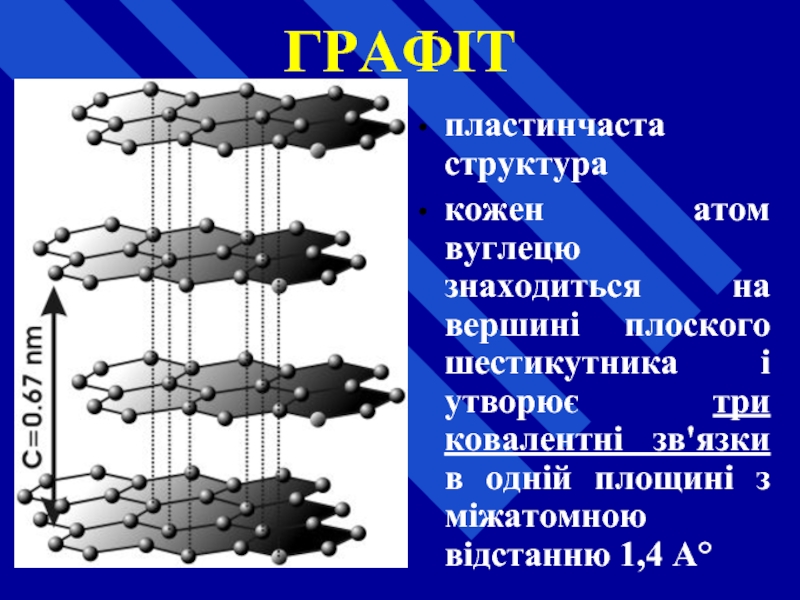
- 27. ГРАФІТ пластинчаста структура кожен атом вуглецю знаходиться
- 28. ГРАФІТ четвертий валентний електрон атома вуглецю локалізований
- 29. ГРАФІТ паралельні площини із шестикутників знаходиться на
- 30. http://ru.wikipedia.org/wiki/Файл:Diamond_animation.gif СХЕМАТИЧНЕ ЗОБРАЖЕННЯ КРИСТАЛІЧНОЇ ГРАТКИ АЛМАЗУ
- 31. http://en.wikipedia.org/wiki/File:Graphite_stereo_animation.gif СХЕМАТИЧНЕ ЗОБРАЖЕННЯ КРИСТАЛІЧНОЇ ГРАТКИ ГРАФІТУ
- 32. ГРАФЕН – двомірна алотропна модифікація
- 33. ЗАГАЛЬНИЙ ВИГЛЯД БАКІБОЛА C60, ЩО ОБЕРТАЄТЬСЯ молекула
- 34. http://commons.wikimedia.org/wiki/File:Kohlenstoffnanoroehre_Animation.gif ВУГЛЕЦЕВА НАНОТРУБКА
- 35. 2.Агрегатний стан речовин, його вплив на властивості.
- 36. Агрегатний стан речовин
- 37. Агрегатний стан речовин Визначається силами
- 38. ВАНДЕРВААЛЬСОВІ СИЛИ: ЕЛЕКТРО СТАТИЧНІ ДИСПЕРСІЙНІ ІНДУКЦІЙНІ
- 39. ЕЛЕКТРОСТАТИЧНІ виникають між протилежними зарядами полярних молекул.
- 40. ІНДУКЦІЙНІ проявляються під час утворення диполя, наведеного іншою полярною молекулою,яка має постійний дипольний момент.
- 41. ДИ́ПОЛЬ СУКУПНІСТЬ ДВОХ РІВНИХ ЗА АБСОЛЮТНОЮ
- 42. ДИСПЕРСІЙНІ виникають незалежно від полярності молекул, внаслідок
- 43. РЕЧОВИНИ У ПРИРОДІ газоподібному рідкому твердому у вигляді плазми
- 44. ВЛАСТИВОСТІ ГАЗОПОДІБНОГО СТАНУ частинки речовини практично не
- 45. ВЛАСТИВОСТІ РІДИНИ: немає власної форми, але є
- 46. ВЛАСТИВОСТІ РІДИНИ: в рідинах існує ближній
- 47. ВЛАСТИВОСТІ РІДИНИ: рідина стискається мало; щільність
- 48. ВЛАСТИВОСТІ ТВЕРДОГО СТАНУ спостерігається формування значної
- 49. ВЛАСТИВОСТІ ТВЕРДОГО СТАНУ частинки не можуть
- 50. ВЛАСТИВОСТІ ТВЕРДОГО СТАНУ спостерігається досить стійка рівновага,
- 51. ПЛАЗМА утворюється з іонізованих атомів і електронів,
- 52. Плазма: ХОЛОДНА ТА ГАРЯЧА ІДЕАЛЬНА ТА НЕІДЕАЛЬНА НИЗЬКОТЕМПЕРАТУРНА ТА ВИСОКОТЕМПЕРАТУРНА РІВНОВАЖНА ТА НЕ РІВНОВАЖНА
- 54. 3.Поняття про кристалічні та аморфні тверді тіла.
- 55. АМОРФНИЙ СТАН у термодинамічному відношенні не є
- 56. КРИСТАЛІЧНИЙ СТАН найбільш стійкий у термодинамічному відношенні.
- 57. ПОНЯТТЯ ПРО КРИСТАЛІЧНІ АМОРФНІ ТВЕРДІ
- 58. 4.Градація структури твердих тіл.
- 59. ГРАДАЦІЯ СТРУКТУРИ макроструктура
- 60. МАКРОСТРУКТУРА - це сполучення відносно великих
- 61. МІКРОСТРУКТУРА - сполучення структурних елементів видимих за
- 62. ТОНКА ВНУТРІШНЯ СТРУКТУРА - це сполучення атомів,
- 63. МЕТОДИ ВИВЧЕННЯ ТОНКОЇ СТРУКТУРИ рентгено
- 64. ДЕФЕКТИ СТРУКТУРИ порушення чіткого просторового
- 65. ДЕФЕКТИ СТРУКТУРИ
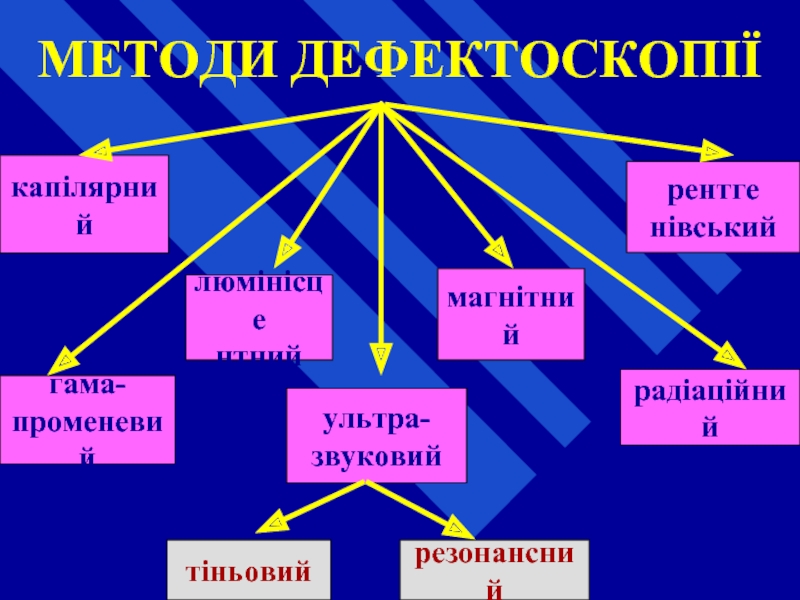
- 66. МЕТОДИ ДЕФЕКТОСКОПІЇ
- 67. ІНДИВІДУАЛЬНЕ ЗАВДАННЯ №2 дати коротку характеристику кожному
Слайд 2УМОВИ УСПІШНОЇ ЗДАЧІ ІСПИТУ З МАТЕРІАЛОЗНАВСТВА
ВІДВІДУВАННЯ ЗАНЯТЬ (лекцій та лабораторних)
НАЯВНІСТЬ КОНСПЕКТІВ ЛЕКЦІЙ (10)
НАЯВНІСТЬ ЗАХИЩЕНИХ ЗВІТІВ З ЛАБОРАТОРНИХ ЗАНЯТЬ (6)
НАЯВНІСТЬ КОНСПЕКТУ ІНДИВІДУАЛЬНИХ ЗАВДАНЬ ТА ЗДАЧА ЗРАЗКІВ ПІД ЧАС ІКР
ЗДАЧА ПІДСУКОВИХ МОДУЛЬНИХ РОБІТ (2)
НАЯВНІСТЬ КОНСПЕКТУ ВІДПОВІДЕЙ НА ПИТАННЯ, ЯКІ ВИНОСЯТЬСЯ НА ІСПИТ
Слайд 31.Молекулярна будова, типи зв'язків у твердих тілах.
2. Агрегатний стан речовин, вплив
Будова твердих тіл та вплив на їх властивості
Слайд 43.Поняття про кристалічні та аморфні тіла.
4.Градація структури твердих тіл. Дефекти структури,
Будова твердих тіл та вплив на їх властивості
Слайд 5
ЛІТЕРАТУРА
НМП для самостійного вивчення дисципліни «МОТВ ТНС» за КМСОНП для студентів за
Закусілов А.П. та інш. Матеріалознавство і технологія виробництва товарів народного споживання . К. 1994р. с.5-41.
Ещенко В.Ф., Леженин Е.Д. Товароведение хозяйственных товаров.т.2 М.Экономика. 1984г.с.5-8,11-14.
Алексеев Н.С., Ганцов Ш.К., Кутянин Г.И. Теоретические основы товароведения непродовольственных товаров.М.Экономика. 1988.
Глинка Н.Л. Общая химия. М. Высшая школа.
Слайд 7Знання складу та будови вихідної сировини необхідне для:
засвоєння закономірностей формування структури
розуміння закономірностей формування споживних властивостей та якості товарів
Слайд 8
Знання складу та будови вихідної сировини необхідне для:
особливостей зміни властивостей
Слайд 9
Знання складу та будови вихідної сировини необхідне для:
вибору найбільш раціональної конструкції
визначення оптимального режиму технологічних процесів виготовлення товарів
Слайд 10
ВЛАСТИВОСТІ МАТЕРІАЛІВ ОБУМОВЛЕНІ:
Природою
атомів
Характером
з'єднання
атомів між
собою
Типом і
ступінню
досконалості
структури
Слайд 12БУДОВА (хімічна)
- характер зв'язку та послідовність з'єднання атомів у молекулі, як
Слайд 13СТРУКТУРА
- просторове розміщення структурних одиниць (молекул), характер їх об'єднання у більш
Слайд 14 Хімічний зв'язок між атомами в молекулах обумовлений
Взаємодією
електричних
зарядів
електронів
Взаємодією
атомних
ядер
Перерозподі
лом
електронів
зовнішньої
оболонки
атомів
Слайд 15
Які типи зв'язків атомів в молекулах Вам відомі:
ковалентний
електровалентний (іонний)
координаційний (донорно-акцепторний)
Слайд 16ІНДИВІДУАЛЬНЕ ЗАВДАННЯ №1
ДАТИ ХАРАКТЕРИСТИКУ ОСНОВНИХ ВИДІВ ЗВ'ЯЗКІВ У ТВЕРДИХ ТІЛАХ ЗА
в яких молекулах і за рахунок чого утворюється кожен вид зв'язку?
для яких сполук, речовин або матеріалів характерний кожен вид зв'язку?
які властивості притаманні сполукам, речовинам або матеріалам з різними видами зв'язку?
Слайд 18Геометрична конфігурація молекули визначається
лінійне;
у вигляді зиґзаґу тощо.
Довжиною
зв'язку
між атомами
Довжиною
зв'язку
валентними
кутами
Слайд 19
ВПЛИВ ТИПУ ЗВ'ЯЗКУ НА БУДОВУ ТА ВЛАСТИВОСТІ МАТЕРІАЛІВ ТА ВИРОБІВ
КЛАСИЧНИЙ ПРИКЛАД
АЛМАЗ ТА ГРАФІТ
Слайд 21АЛМАЗ
БЕЗКОЛЬОРОВИЙ
ПРОЗОРИЙ
НЕ ПРОВОДИТЬ ЕЛЕКТРИЧНИЙ СТРУМ
МАЄ ЗНАЧНУ ТВЕРДІСТЬ
ГУСТИНА 3,5 Г/СМ
Слайд 23АЛМАЗ
КОВАЛЕНТНА КРИСТАЛІЧНА ГРАТКА З ОДНАКОВОЮ МІЖАТОМНОЮ ВІДСТАННЮ 1,5 А°
Слайд 25http://ru.wikipedia.org/wiki/Файл:SyntheticDiamonds.jpg
ЗОБРАЖЕННЯ СИНТЕТИЧНИХ АЛМАЗІВ, ОТРИМАНЕ НА РАСТРОВОМУ ЕЛЕКТРОННОМУ МІКРОСКОПІ
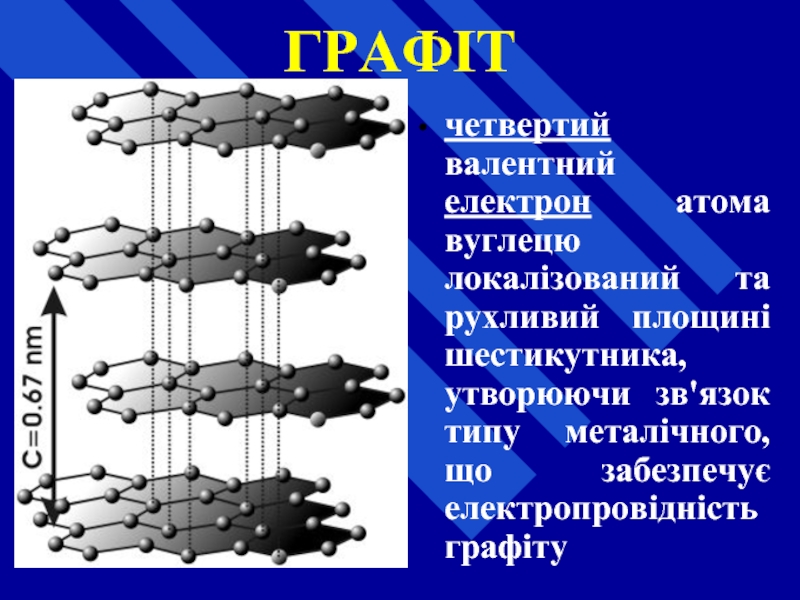
Слайд 26ГРАФІТ
характерна "мастильна" властивість
жирний на дотик
сіро-чорного кольору
з металічним блиском
з
Слайд 27ГРАФІТ
пластинчаста структура
кожен атом вуглецю знаходиться на вершині плоского шестикутника і утворює
Слайд 28ГРАФІТ
четвертий валентний електрон атома вуглецю локалізований та рухливий площині шестикутника, утворюючи
Слайд 29ГРАФІТ
паралельні площини із шестикутників знаходиться на відстані 3,35 А° один від
Слайд 30http://ru.wikipedia.org/wiki/Файл:Diamond_animation.gif
СХЕМАТИЧНЕ ЗОБРАЖЕННЯ КРИСТАЛІЧНОЇ ГРАТКИ АЛМАЗУ
Слайд 31http://en.wikipedia.org/wiki/File:Graphite_stereo_animation.gif
СХЕМАТИЧНЕ ЗОБРАЖЕННЯ КРИСТАЛІЧНОЇ ГРАТКИ ГРАФІТУ
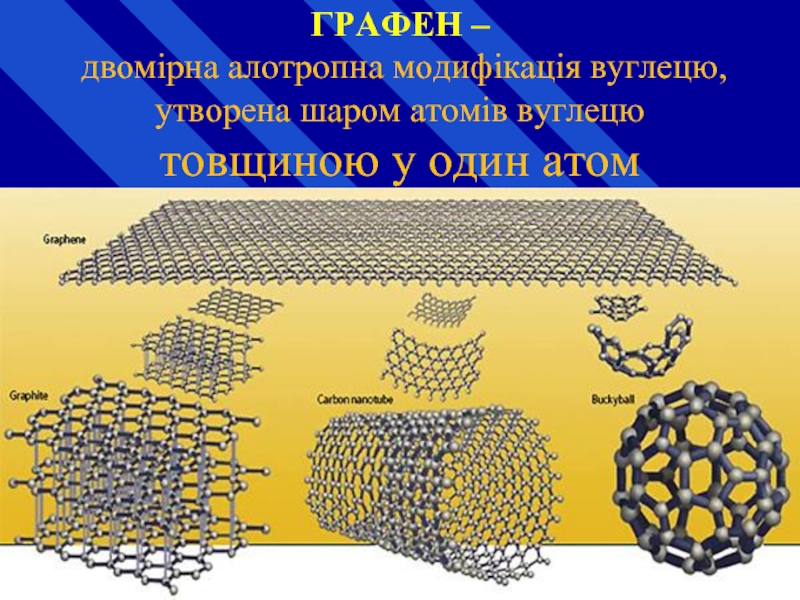
Слайд 32 ГРАФЕН – двомірна алотропна модифікація вуглецю, утворена шаром атомів вуглецю товщиною
Слайд 33ЗАГАЛЬНИЙ ВИГЛЯД БАКІБОЛА C60, ЩО ОБЕРТАЄТЬСЯ
молекула із 60 атомів вуглецю, що
Слайд 34http://commons.wikimedia.org/wiki/File:Kohlenstoffnanoroehre_Animation.gif
ВУГЛЕЦЕВА НАНОТРУБКА
Слайд 36 Агрегатний стан речовин
Стани однієї і тієї
Слайд 37 Агрегатний стан речовин
Визначається силами взаємодії між молекулами (вандерваальсовими), які:
стають значними лише на відстані менш ніж 5 А°
в 50-100 разів слабші за сили зв'язків між атомами.
Слайд 40ІНДУКЦІЙНІ
проявляються під час утворення диполя, наведеного іншою полярною молекулою,яка має постійний
Слайд 41ДИ́ПОЛЬ
СУКУПНІСТЬ ДВОХ РІВНИХ ЗА АБСОЛЮТНОЮ ВЕЛИЧИНОЮ РІЗНОЙМЕННИХ ЗАРЯДІВ, ЯКІ ЗНАХОДЯТЬСЯ
МОЛЕКУЛИ БАГАТЬОХ РЕЧОВИН МОЖНА РОЗГЛЯДАТИ ЯК ДИПОЛІ.
Слайд 42ДИСПЕРСІЙНІ
виникають незалежно від полярності молекул, внаслідок поляризації сусідніх частинок в результаті
Слайд 44ВЛАСТИВОСТІ ГАЗОПОДІБНОГО СТАНУ
частинки речовини практично не пов'язані одна із одною, знаходяться
спостерігається велика стисливість газу
мала густина, яка дуже змінюється при зміні температури
відсутня упорядкованість розміщення частинок ( відсутня структура)
Слайд 45ВЛАСТИВОСТІ РІДИНИ:
немає власної форми, але є власний об'єм
виникає слабо фіксована структура
молекули можуть коливатися, обертатися та переміщуватися, що свідчить про відсутність фіксованої структури
Слайд 46ВЛАСТИВОСТІ РІДИНИ:
в рідинах існує ближній порядок, тобто упорядкованість спостерігається у
Слайд 47ВЛАСТИВОСТІ РІДИНИ:
рідина стискається мало;
щільність близька до щільності твердих тіл;
при коливаннях
Слайд 48
ВЛАСТИВОСТІ ТВЕРДОГО СТАНУ
спостерігається формування значної упорядкованості структури , обумовленої тим, що
Слайд 49
ВЛАСТИВОСТІ ТВЕРДОГО СТАНУ
частинки не можуть переміщуватися, вони лише коливаються з обмеженою
стискання тіл незначне;
густина висока, мало змінюється при коливаннях температури;
Слайд 50ВЛАСТИВОСТІ ТВЕРДОГО СТАНУ
спостерігається досить стійка рівновага, яка вище у низькомолекулярних речовин
для твердих (кристалічних) тіл характерний дальній порядок - упорядкованість на досить великих відстанях.
Слайд 51ПЛАЗМА
утворюється з іонізованих атомів і електронів, при яких загальний заряд дорівнює
СКЛАДАЄТЬСЯ З:
ЕЛЕКТРОНІВ
ІОНІВ
ЗАРЯДЖЕНИХ МОЛЕКУЛ
НЕЙТРАЛЬНИХ АТОМІВ АБО МОЛЕКУЛ, ЯКІ ПЕРЕБУВАЮТЬ У ТЕРМОДИНАМІЧНІЙ РІВНОВАЗІ.
Слайд 52Плазма:
ХОЛОДНА ТА ГАРЯЧА
ІДЕАЛЬНА ТА НЕІДЕАЛЬНА
НИЗЬКОТЕМПЕРАТУРНА ТА ВИСОКОТЕМПЕРАТУРНА
РІВНОВАЖНА ТА НЕ РІВНОВАЖНА
Слайд 55АМОРФНИЙ СТАН
у термодинамічному відношенні не є стійким;
у звичайних умовах відбувається довільний
аморфні речовини зустрічаються взагалі рідко (це скло, смоли).
Слайд 56КРИСТАЛІЧНИЙ СТАН
найбільш стійкий у термодинамічному відношенні.
перехід із аморфного стану у кристалічний
Слайд 57
ПОНЯТТЯ ПРО КРИСТАЛІЧНІ АМОРФНІ ТВЕРДІ ТІЛА.
ВЛАСТИВОСТІ:
АМОРФНІ
- геометрично вірна
форма
- анізотропія
індивідуальних
кристалів
КРИСТАЛІЧНІ
тіла ізотропні (тобто
незалежність багатьох
властивостей від форми
та напрямку)
відсутність чітко
вираженої точки
плавлення
Слайд 60МАКРОСТРУКТУРА
- це сполучення відносно великих структурних елементів (ниток, шарів, пучків)
Слайд 61МІКРОСТРУКТУРА
- сполучення структурних елементів видимих за допомогою оптичного мікроскопу (із збільшенням
Це порядок сполучення волокон, зерен кристалів, клітинних утворень, розмір видимих структурних елементів, вимірювання кутів нахилу і т.п.
Слайд 62ТОНКА ВНУТРІШНЯ СТРУКТУРА
- це сполучення атомів, іонів та молекул,або більш великих
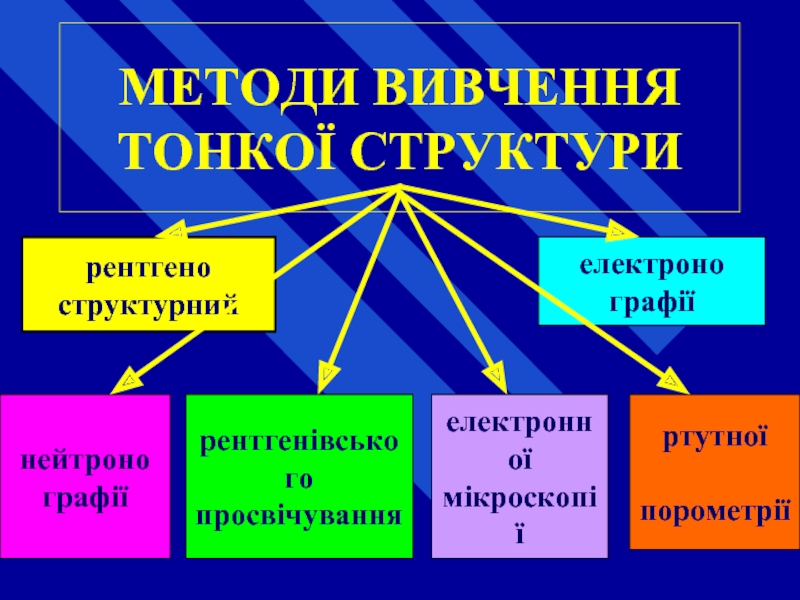
Слайд 63МЕТОДИ ВИВЧЕННЯ ТОНКОЇ СТРУКТУРИ
рентгено
структурний
електронної
мікроскопії
електроно
графії
нейтроно
графії
рентгенівського
просвічування
ртутної
порометрії
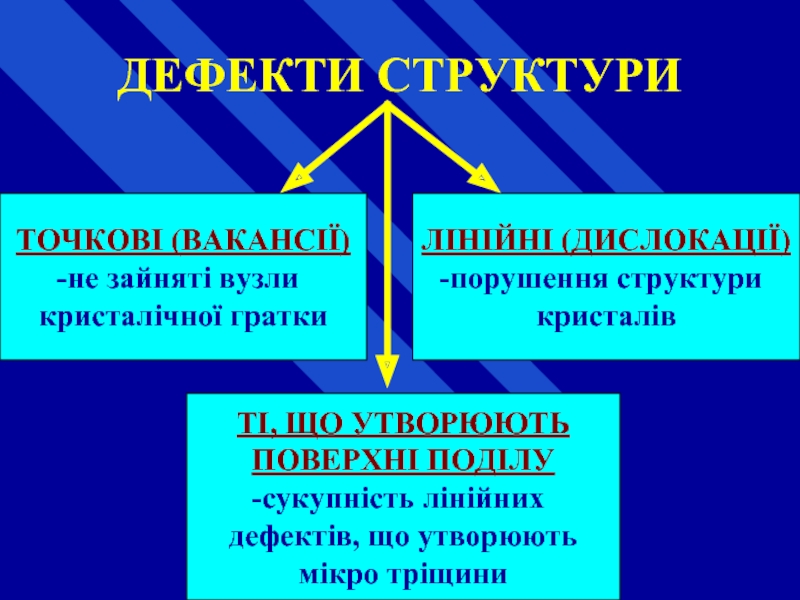
Слайд 64ДЕФЕКТИ СТРУКТУРИ
порушення чіткого просторового упорядкування (періодичності) кристалічної ґратки,
Ці порушення притаманні всім реальним кристалічним речовинам (матеріалам).
Слайд 65ДЕФЕКТИ СТРУКТУРИ
ТОЧКОВІ (ВАКАНСІЇ)
не зайняті вузли
кристалічної
ЛІНІЙНІ (ДИСЛОКАЦІЇ)
порушення структури
кристалів
ТІ, ЩО УТВОРЮЮТЬ
ПОВЕРХНІ ПОДІЛУ
сукупність лінійних
дефектів, що утворюють
мікро тріщини