- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комплексные соединения презентация
Содержание
- 1. Комплексные соединения
- 2. [Cu(NH3)4]SO4 Комплексными соединениями, или просто
- 3. Наиболее удачно строение и свойства таких соединений
- 4. Основные положения координационной теории Комплексообразователь (центральный катион)
- 5. Вокруг комплексообразователя расположены лиганды – частицы, обладающие
- 6. Основные положения координационной теории Координационное число –
- 7. Основные положения координационной теории Комплексообразователь и лиганды
- 8. РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ:
- 9. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Cu Cl +2 -
- 10. Строение комплексных соединений Координационные соединения образованы металлами
- 11. Строение комплексных соединений Для образования прочных связей
- 12. Классификация комплексных соединений по заряду
- 13. Классификация По заряду комплекса [Cr(H2O)4]3+Cl3 [PtCl4(NH3)2] K2[PtCl6]2- [Cu(NH3)4]2+[PtCl4]2-
- 14. Классификация По составу внешней сферы H2[PtCl6] Na3[AlF6] [Pt(NH3)2Cl2] [Ag(NH3)2]OH
- 15. Классификация По виду лигандов [Fe(H2O)6]SO4 K[Au(CN)4] [Zn(NH3)4]Cl2 [CoCl(NH3)3(H2O)2](NO3)2
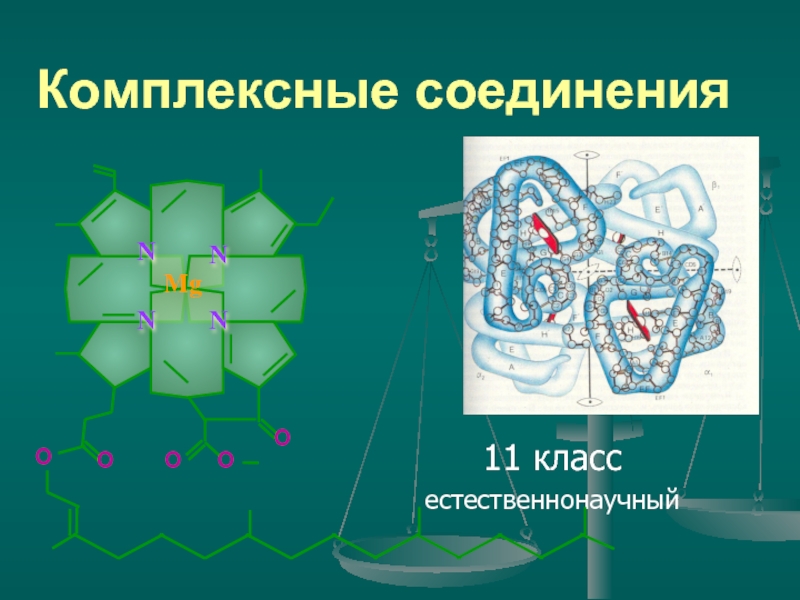
- 16. Комплексные соединения 11 класс естественнонаучный
- 17. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2- 4- 3- 5-
- 18. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ НАЗВАНИЯ КОМПЛЕКСНЫХ АНИОНОВ: Fe
- 19. тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2
- 20. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия
- 21. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3
- 22. Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Нитрат хлоронитротетраамминкобальта
- 23. Получение и свойства комплексных соединений Оборудование и
- 24. Опыт № 1 ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Получение
- 25. [Cu(NH3)4](OH)2 CuSO4+NH4OH → Cu(OH)2↓+(NH4)2SO4 Cu(OH)2 + 4NH3 → Подсказка
- 26. Опыт №2. ХИМИЧЕСКИЕ СВОЙСТВА 1. Реакции
- 27. Значение комплексов Аналитическая химия: для идентификации неорганических
- 28. Спасибо за внимание! Данная презентация была создана
Слайд 2[Cu(NH3)4]SO4
Комплексными соединениями, или просто комплексами, мы будем называть и
Комплексным соединением называют сложное соединение, образующееся при взаимодействии более простых неизменных частиц (атомов, ионов или молекул), каждая из которых способна существовать независимо в обычных условиях.
Na[Al(OH)4]
NaOH
Al(OH)3
Слайд 3Наиболее удачно строение и свойства таких соединений объясняет координационная теория.
Предложена в
(1866 – 1919)
Слайд 4Основные положения координационной теории
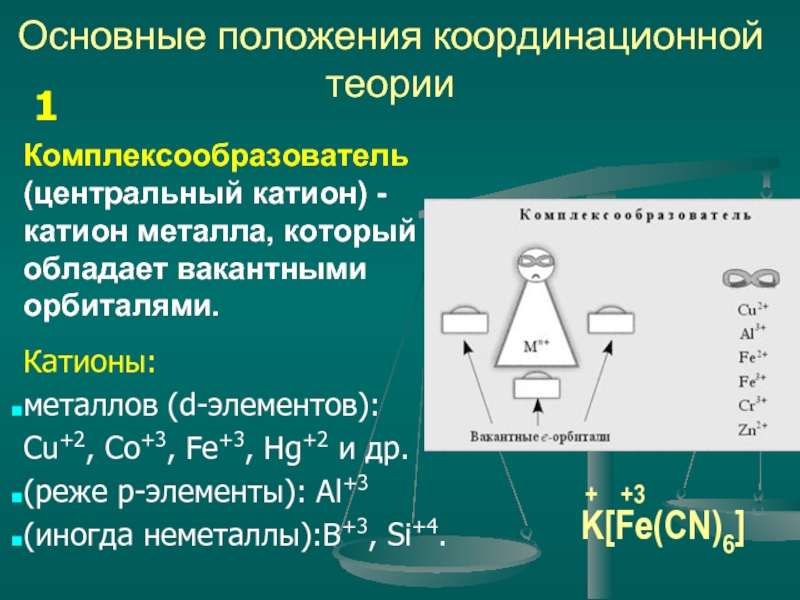
Комплексообразователь (центральный катион) - катион металла, который обладает
Катионы:
металлов (d-элементов):
Сu+2, Co+3, Fe+3, Hg+2 и др.
(реже р-элементы): Al+3
(иногда неметаллы):В+3, Si+4.
1
K[Fe(CN)6]
Fe
+3
+
Слайд 5Вокруг комплексообразователя расположены лиганды – частицы, обладающие неподеленными электронными парами.
Основные положения
2.
Молекулы:
H2O, NH3,
Анионы:
CN-, OH-,
Cl-, Br-, NO2-
..
..
..
Слайд 6Основные положения координационной теории
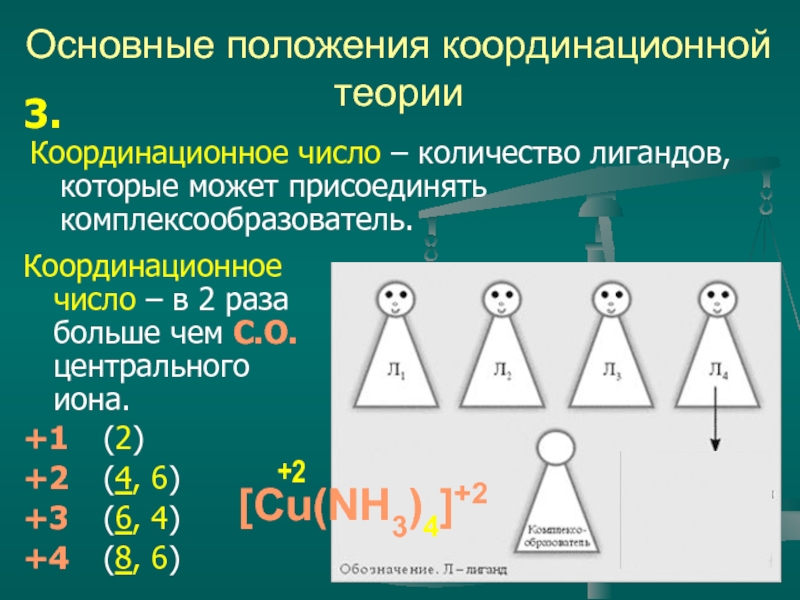
Координационное число – количество лигандов, которые может присоединять
3.
Координационное число – в 2 раза больше чем С.О. центрального иона.
+1 (2)
+2 (4, 6)
+3 (6, 4)
+4 (8, 6)
[Cu(NH3)4]+2
+2
Слайд 7Основные положения координационной теории
Комплексообразователь и лиганды составляют внутреннюю сферу комплекса.
4.
[Cu(NH3)4]+2
Как определить
Слайд 8РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:
Na3[AlF6]
Ответ: Na+3[Al+3F-6]
K[MgCl3]
Na[Al(OH)4]
Na4[Fe(CN)6]
Na3[Al(OH)6]
[Cu(NH3)4]Cl2
Ответ: Na+[Al+3(OH)-4]
Ответ: K+[Mg+2Cl-3]
Ответ:Na+4[Fe+2(CN)-6]
Ответ:Na+3[Al+3(OH)-6]
Ответ:[Cu+2(NH3)04]Cl-2
Слайд 9СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Cu
Cl
+2
-
[
[
[Cu(NH3)4]Cl2
КОМПЛЕКСООБРАЗОВАТЕЛЬ
ЛИГАНДЫ
КООРДИНАЦИОННОЕ ЧИСЛО - 4
ВНУТРЕННЯЯ СФЕРА
ВНЕШНЯЯ СФЕРА
КОМПЛЕКСНЫЙ ИОН
2
NH
3
NH
3
NH
3
+2
Слайд 10Строение комплексных соединений
Координационные соединения образованы металлами побочных подгрупп, имеющими, как правило,
Метод валентных связей (ВС) принимает во внимание донорно-акцепторное происхождение связей в комплексных соединениях. Образование комплексного иона можно объяснить наличием у катионов d-металлов вакантных орбиталей на s-, p-, d- и f- подуровнях:
Co3+
Co0
4s
4р
3d
Слайд 11Строение комплексных соединений
Для образования прочных связей внутри комплексного соединения энергетически выгодно
Co3+
Свободные орбитали атомов кобальта, в свою очередь, являются вакансиями для неподелённой электронной пары азота в молекуле аммиака. Так происходит образование внутренней координационной сферы комплексного соединения:
Co3+
Слайд 12Классификация комплексных соединений
по заряду комплекса
по виду лигандов
по составу внешней сферы
Слайд 13Классификация
По заряду комплекса
[Cr(H2O)4]3+Cl3
[PtCl4(NH3)2]
K2[PtCl6]2-
[Cu(NH3)4]2+[PtCl4]2-
Слайд 17НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
2-
4-
3-
5-
6-
ди-
три-
тетра-
пента-
гекса-
ЧИСЛИТЕЛЬНЫЕ:
НАЗВАНИЯ ЛИГАНДОВ:
H2O - аква
NH3 - амин
СO - карбонил
OН- -
(СN)- - циано
F-, Cl-, Br-, I- - фторо-, хлоро-, бромо-, йодо-
(NO2)- - нитро
Слайд 18НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
НАЗВАНИЯ КОМПЛЕКСНЫХ АНИОНОВ:
Fe - феррат
Cu - купрат
Ag - аргентат
Au
Hg - меркурат
Al - алюминат
Zn - цинкат
От латинского названия комплексообразователя с добавлением суффикса
ат
+3
+2
+3
+
+2
+3
+2
Слайд 19тетра
гидроксо
цинкат
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Na+2
4]
(OH)-
[Zn+2
натрия
[Cr+3
(H2O)0
6]
Cl-3
хлорид
аква
гекса
xрома (III)
K+2
[Hg+2
I-
4]
тетра
йодо
меркурат (II)
калия
Слайд 20НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Na3[AlF6]
Na[Al(OH)4]
K4[Fe(CN)6]
Гексафтороалюминат натрия
Тетрагидроксоалюминат натрия
Гексационоферрат (II) калия
Слайд 21НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
[Cu(NH3)4]SO4
Сульфат тетраамминмеди (II)
[Ag(NH3)2]Cl
Хлорид диамминсеребра
Хлорид гексааквахрома (III)
[Cr(H2O)6]Cl3
Слайд 22Ответ: K2[PtCl6]
Гексахлороплатинат (IV) калия
Нитрат хлоронитротетраамминкобальта (III)
Гексагидроксохромат (III) натрия
СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ
Ответ: [Co(NH3)4(NO2)Cl]NO3
Ответ:
Нитрат гексаамминникеля (II)
Ответ: [Ni(NH3)6](NO3)2
Слайд 23Получение и свойства комплексных соединений
Оборудование и посуда: пробирки
планшет
Реактивы:
Лабораторная работа
Слайд 24Опыт № 1 ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Получение гидроксида тетраамминмеди (II)
CuSO4+ NH4OH →
Cu(OH)2
Получение хлорида диамминсеребра (I)
AgCl+ NH4OH →
Слайд 26Опыт №2. ХИМИЧЕСКИЕ СВОЙСТВА
1. Реакции по внешней сфере
FeSO4+K3[Fe(CN)6]→
2. Реакции
[Cu(NH3)4]SO4+ 4HCl→
3. Реакции по центральному иону
[Ag(NH3)2]NO3 + HCl →
4. Разрушение комплексов:
[Co(H2O)6]SO4· H2O→
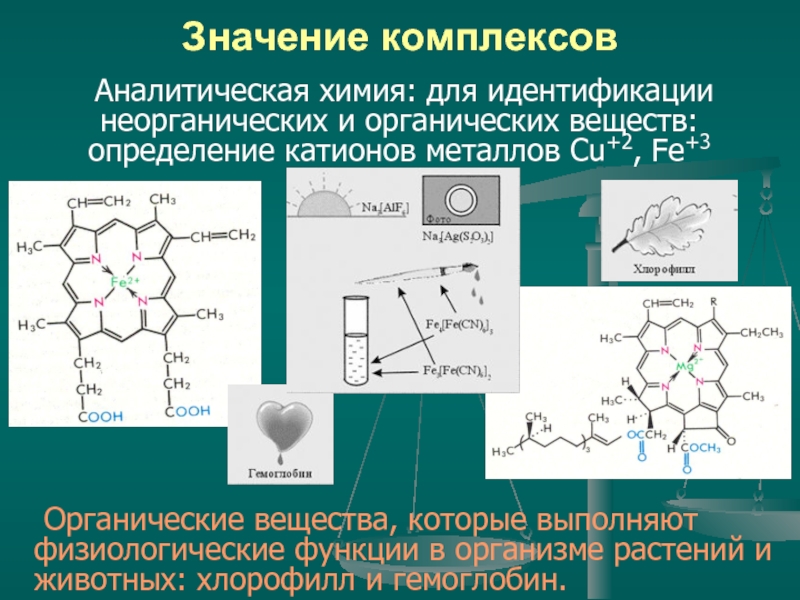
Слайд 27Значение комплексов
Аналитическая химия: для идентификации неорганических и органических веществ: определение катионов
Органические вещества, которые выполняют физиологические функции в организме растений и животных: хлорофилл и гемоглобин.
![[Cu(NH3)4]SO4 Комплексными соединениями, или просто комплексами, мы будем называть и комплексные ионы, и комплексные молекулы.](/img/tmb/1/11834/ace57172401398b4dfac7a7f713fc9a6-800x.jpg)


![Основные положения координационной теорииКомплексообразователь и лиганды составляют внутреннюю сферу комплекса.4.[Cu(NH3)4]+2Как определить суммарный заряд внутренней сферы?](/img/tmb/1/11834/9078d7f2e827cf8bba2873a7de632c26-800x.jpg)
![РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:Na3[AlF6]Ответ: Na+3[Al+3F-6]K[MgCl3]Na[Al(OH)4]Na4[Fe(CN)6]Na3[Al(OH)6][Cu(NH3)4]Cl2Ответ: Na+[Al+3(OH)-4]Ответ: K+[Mg+2Cl-3]Ответ:Na+4[Fe+2(CN)-6]Ответ:Na+3[Al+3(OH)-6]Ответ:[Cu+2(NH3)04]Cl-2](/img/tmb/1/11834/94aa45f4b5d5cc04885935a2a7cf3785-800x.jpg)
![СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙCuCl+2-[[[Cu(NH3)4]Cl2КОМПЛЕКСООБРАЗОВАТЕЛЬЛИГАНДЫКООРДИНАЦИОННОЕ ЧИСЛО - 4ВНУТРЕННЯЯ СФЕРАВНЕШНЯЯ СФЕРАКОМПЛЕКСНЫЙ ИОН2NH3NH3NH3+2](/img/tmb/1/11834/face0864779058fa8ebe15bb66bad454-800x.jpg)



![Классификация По заряду комплекса[Cr(H2O)4]3+Cl3[PtCl4(NH3)2]K2[PtCl6]2-[Cu(NH3)4]2+[PtCl4]2-](/img/tmb/1/11834/0f2864c85f703ef147f332deb25e9ea3-800x.jpg)
![Классификация По составу внешней сферыH2[PtCl6]Na3[AlF6][Pt(NH3)2Cl2][Ag(NH3)2]OH](/img/tmb/1/11834/3aca74496d529788a599ef4b9ac4dcd9-800x.jpg)
![Классификация По виду лигандов[Fe(H2O)6]SO4K[Au(CN)4][Zn(NH3)4]Cl2[CoCl(NH3)3(H2O)2](NO3)2](/img/tmb/1/11834/d36d566ca08f302cefb5c596ea4fef14-800x.jpg)


-[Zn+2натрия[Cr+3(H2O)06]Cl-3хлоридаквагексаxрома (III)K+2[Hg+2I-4]тетрайодомеркурат (II)калия](/img/tmb/1/11834/bc4a13fc0bceec8308d4dd2a6e9686a7-800x.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]Na[Al(OH)4]K4[Fe(CN)6]Гексафтороалюминат натрияТетрагидроксоалюминат натрияГексационоферрат (II) калия](/img/tmb/1/11834/8d5c8d1f21b2463102031d9b0a79039a-800x.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4Сульфат тетраамминмеди (II)[Ag(NH3)2]ClХлорид диамминсеребраХлорид гексааквахрома (III)[Cr(H2O)6]Cl3](/img/tmb/1/11834/1af5a53b31a8c25f5e13e85cd3da7e9a-800x.jpg)
![Ответ: K2[PtCl6]Гексахлороплатинат (IV) калияНитрат хлоронитротетраамминкобальта (III)Гексагидроксохромат (III) натрияСОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВОтвет: [Co(NH3)4(NO2)Cl]NO3Ответ: Na3[Cr(OH)6]Нитрат гексаамминникеля (II)Ответ: [Ni(NH3)6](NO3)2](/img/tmb/1/11834/dd8ffea8099b2687bc51cf5b77086ac9-800x.jpg)
![Получение и свойства комплексных соединенийОборудование и посуда: пробирки планшетРеактивы: HCl, CuSO4, NH4OH, K3[Fe(CN)6], FeSO4,](/img/tmb/1/11834/b4d3729f86260e9f36dcea44f54a3bc4-800x.jpg)

2CuSO4+NH4OH → Cu(OH)2↓+(NH4)2SO4Cu(OH)2 + 4NH3 →Подсказка](/img/tmb/1/11834/efbe6c00a8bbc5ca8e36117e18b6d3f5-800x.jpg)
![Опыт №2. ХИМИЧЕСКИЕ СВОЙСТВА 1. Реакции по внешней сфереFeSO4+K3[Fe(CN)6]→ 2. Реакции с участием лигандов[Cu(NH3)4]SO4+ 4HCl→3.](/img/tmb/1/11834/5377dd007267e42028e323b41be5cb72-800x.jpg)