ЛЕКЦИЯ 2.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классификация реакций и реагентов. Кислотные и основные свойства биомолекул презентация
Содержание
- 1. Классификация реакций и реагентов. Кислотные и основные свойства биомолекул
- 2. План
- 3. Основные закономерности протекания реакций Термины
- 4. Основные закономерности протекания реакций Термины
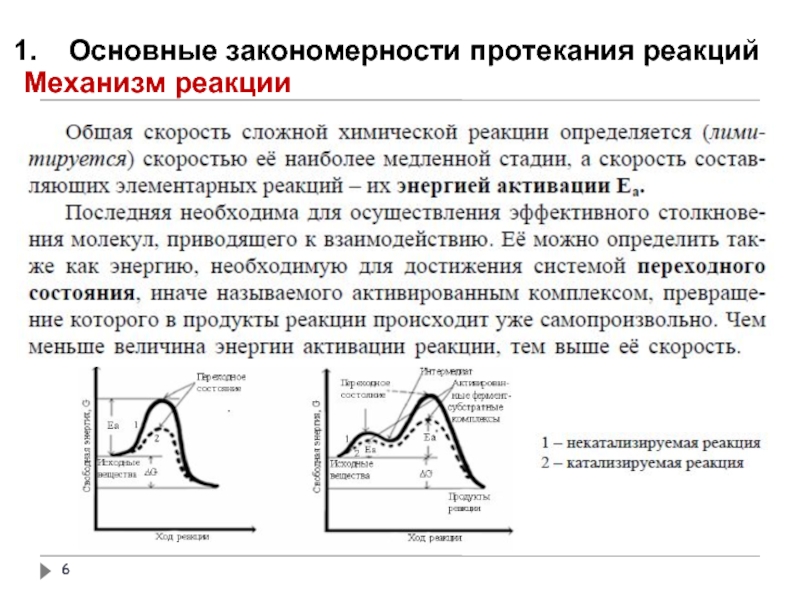
- 5. Основные закономерности протекания реакций Механизм реакции
- 6. Основные закономерности протекания реакций Механизм реакции
- 7. 2. Классификация реакций и реагентов Типы реагентов
- 8. 2. Классификация реакций и реагентов Типы реагентов
- 9. 2. Классификация реакций и реагентов Типы реагентов
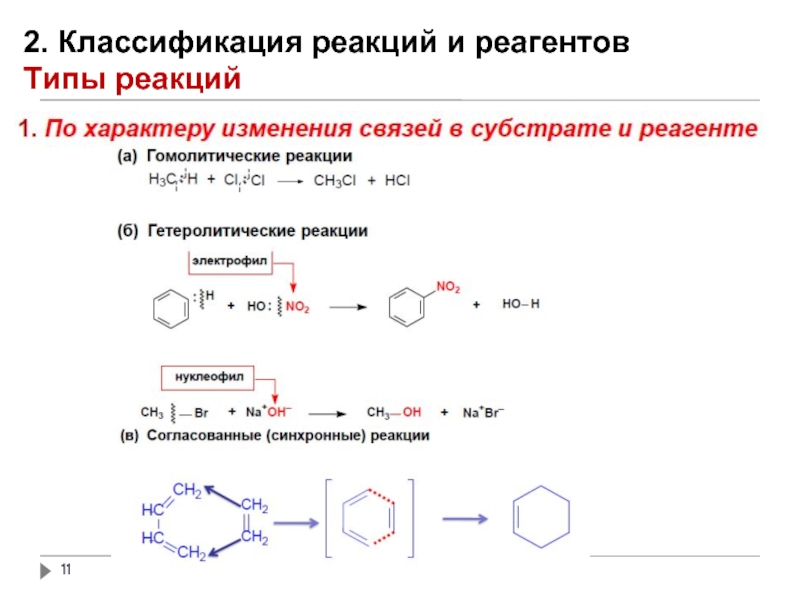
- 11. 2. Классификация реакций и реагентов Типы реакций
- 12. 2. Классификация реакций и реагентов Типы реакций
- 13. 2. Классификация реакций и реагентов Типы реакций
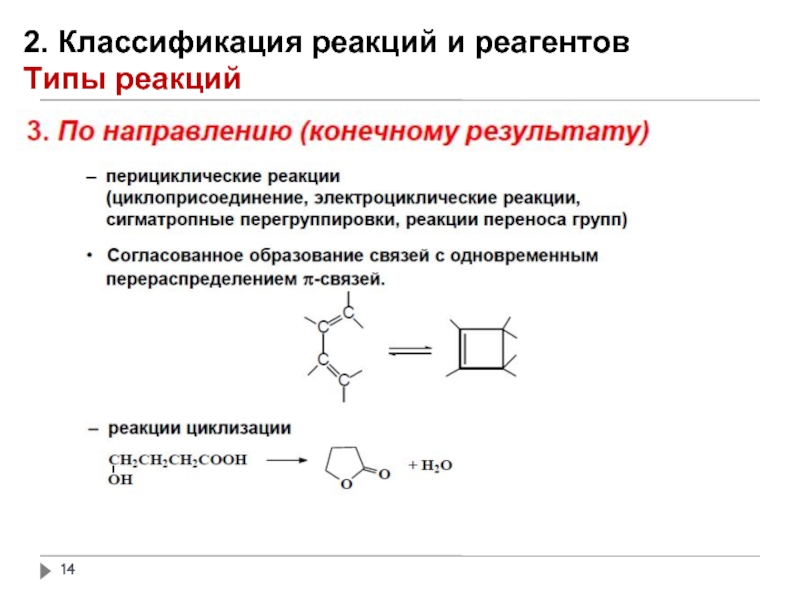
- 14. 2. Классификация реакций и реагентов Типы реакций
- 15. 2. Классификация реакций и реагентов Типы реакций
- 16. 2. Классификация реакций и реагентов Типы реакций
- 17. 3. Факторы, определяющие реакционную способность
- 18. 3. Факторы, определяющие реакционную способность
- 19. 4. Кислотные и основные свойства биомолекул
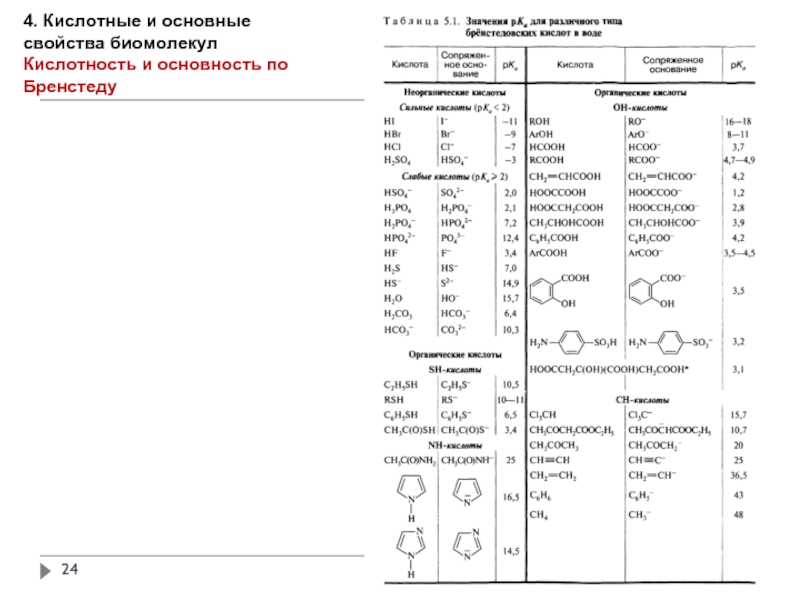
- 20. 4. Кислотные и основные свойства биомолекул Кислотность
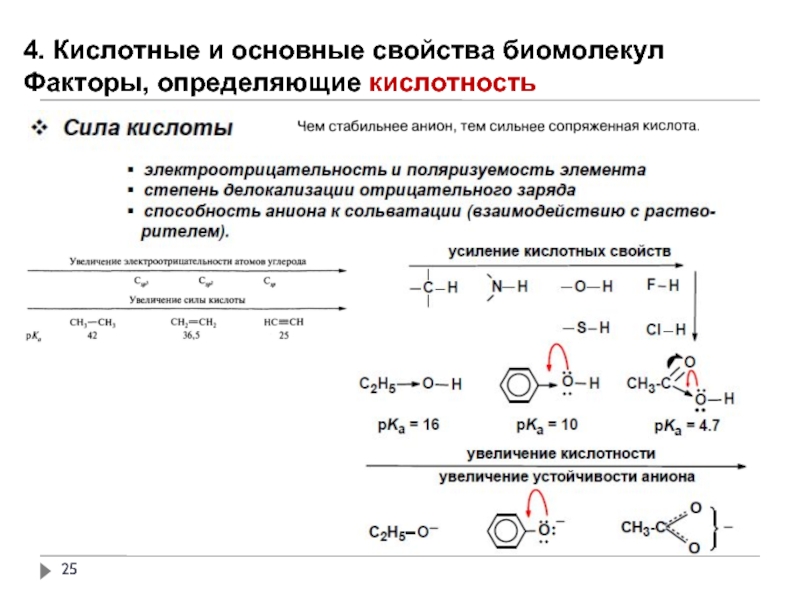
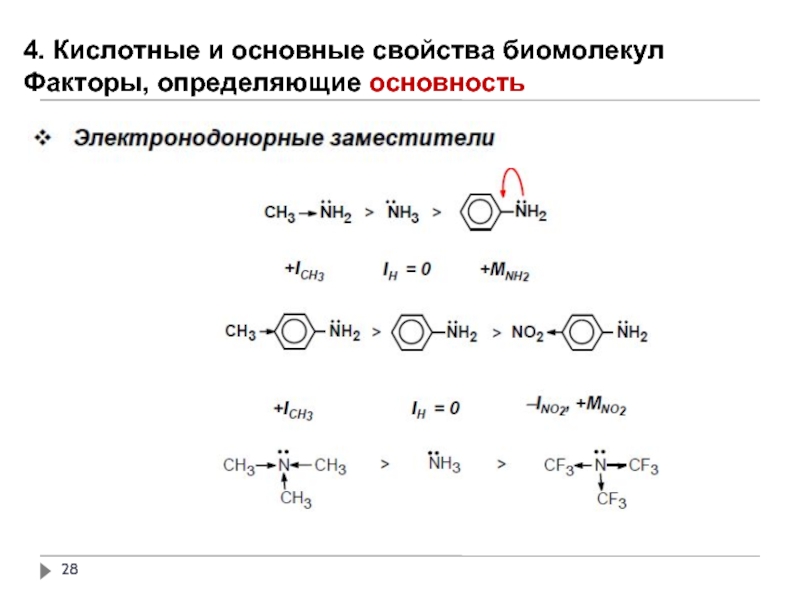
- 25. 4. Кислотные и основные свойства биомолекул Факторы,
- 26. 4. Кислотные и основные свойства биомолекул Факторы,
- 30. 4. Кислотные и основные свойства биомолекул Кислоты
- 33. 4. Кислотные и основные свойства биомолекул
Слайд 1
КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ.
КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА БИОМОЛЕКУЛ
СТРУКТУРА И ФУНКЦИИ БИОЛЕКУЛ.
Слайд 2План
1. Основные закономерности протекания реакций
2. Классификация реакций и реагентов
3. Факторы, определяющие
реакционную способность
4. Кислотные и основные свойства биомолекул
4. Кислотные и основные свойства биомолекул
Слайд 3Основные закономерности протекания реакций
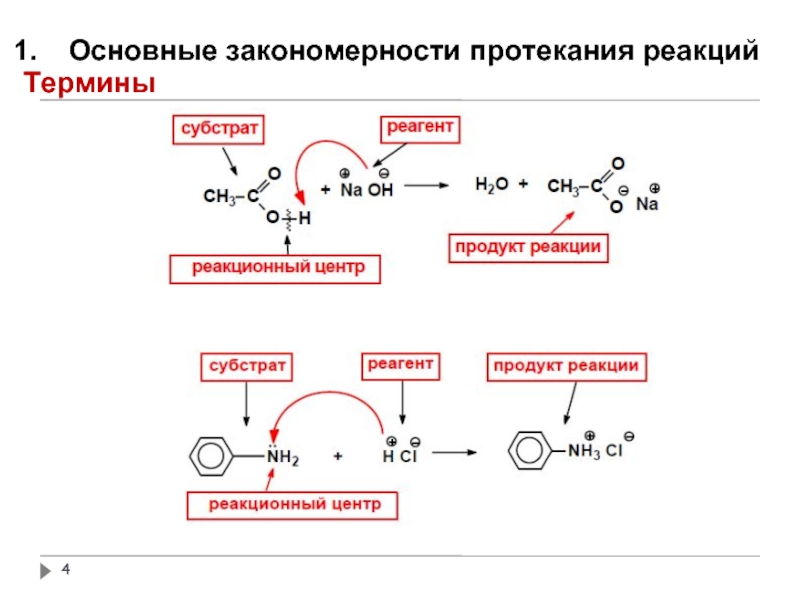
Термины
Реакционная способность – способность вещества вступать в химическую
реакцию и реагировать с большей или меньшей скоростью.
Субстрат – вещество, вступающее в реакцию.
Как правило, это вещество, в котором у атома углерода происходит разрыв старой и образование новой связи.
Реагент – соединение, действующее на субстрат
Реакционный центр – это атом или группа атомов, непосредственно участвующие в данной химической реакции.
В биохимических процессах реагентами считают ферменты (биокатализаторы), а вещества, подвергающиеся их действию, называют субстратами.
Субстрат – вещество, вступающее в реакцию.
Как правило, это вещество, в котором у атома углерода происходит разрыв старой и образование новой связи.
Реагент – соединение, действующее на субстрат
Реакционный центр – это атом или группа атомов, непосредственно участвующие в данной химической реакции.
В биохимических процессах реагентами считают ферменты (биокатализаторы), а вещества, подвергающиеся их действию, называют субстратами.
Слайд 162. Классификация реакций и реагентов
Типы реакций
Мономолекулярные (диссоциативные)
Бимолекулярные (ассоциативные)
Слайд 194. Кислотные и основные свойства биомолекул
Теории кислот и оснований:
- теория электролитической диссоциации (Аррениус);
- протолитическая теория (Бренстед-Лоури, 1923 г.);
- теория Льюиса (1925 г.).
- протолитическая теория (Бренстед-Лоури, 1923 г.);
- теория Льюиса (1925 г.).
Слайд 21
Чем сильнее кислота, тем слабее сопряженное ей основание
4. Кислотные и основные
свойства биомолекул
Кислотность и основность по Бренстеду
Кислотность и основность по Бренстеду
Слайд 29
4. Кислотные и основные свойства биомолекул
Кислоты и основания по Льюису (перенос
пары электронов)
Слайд 34
Для контроля усвоения темы
1. Сравните основность атомов азота в молекуле
гистамина
2. Составьте диаграммы распределения электронной плотности и сравните кислотность двух природных соединений:
2-аминоэтанола-1( коламина ) и 2-аминоэтантиола-1 (меркамина).
НО - СН 2– СН2 - NН 2 НS- СН2 –СН2- N Н2
коламин меркамин
3. Составьте диаграммы распределения электронной плотности и сравните кислотность двух природных соединений: коламина и холина. Холин в нейронах превращается в ацетилхолин и является медиатором парасимпатической нервной системы и встречается в некоторых отделах симпатической нервной системы.
НО - СН 2– СН2 - NН 2 НО - СН 2– СН2 – N+( СН 3) 3
коламин холин
4. Сравните основные свойства метиламина и аммиака; пиридина и анилина.
5. Сравните кислотные свойства этанола и фенола. Объясните причину отличия кислотных свойств.
6. Значение рКа бензойной кислоты = 4,19. Значение рКа 4-гидроксибензойной кислоты равно 4,58 , а 4-метилбензойной кислоты 4,34. Каким эффектом обладают эти две группы : донорным или акцепторным? Какая из двух групп оказывает большее влияние?
2. Составьте диаграммы распределения электронной плотности и сравните кислотность двух природных соединений:
2-аминоэтанола-1( коламина ) и 2-аминоэтантиола-1 (меркамина).
НО - СН 2– СН2 - NН 2 НS- СН2 –СН2- N Н2
коламин меркамин
3. Составьте диаграммы распределения электронной плотности и сравните кислотность двух природных соединений: коламина и холина. Холин в нейронах превращается в ацетилхолин и является медиатором парасимпатической нервной системы и встречается в некоторых отделах симпатической нервной системы.
НО - СН 2– СН2 - NН 2 НО - СН 2– СН2 – N+( СН 3) 3
коламин холин
4. Сравните основные свойства метиламина и аммиака; пиридина и анилина.
5. Сравните кислотные свойства этанола и фенола. Объясните причину отличия кислотных свойств.
6. Значение рКа бензойной кислоты = 4,19. Значение рКа 4-гидроксибензойной кислоты равно 4,58 , а 4-метилбензойной кислоты 4,34. Каким эффектом обладают эти две группы : донорным или акцепторным? Какая из двух групп оказывает большее влияние?