- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислоты. Повторение презентация
Содержание
Слайд 3
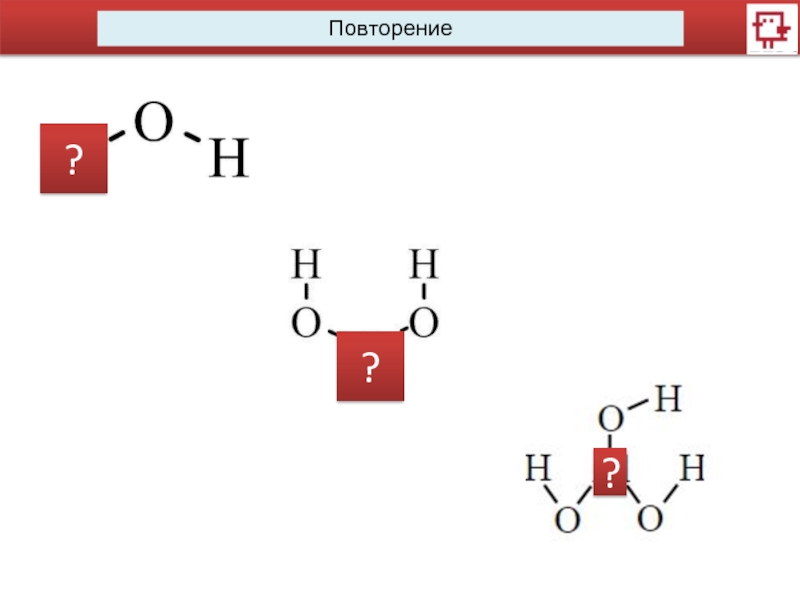
Повторение
CaO + H2O →
CuCl2 + NaOH →
Li2O + H2O →
CaCO3
+ SiO2 →
Cu(OH)2 →
Ca(OH)2 + CO2 →
CO2 + KOH →
Cu(OH)2 →
Ca(OH)2 + CO2 →
CO2 + KOH →
Слайд 4
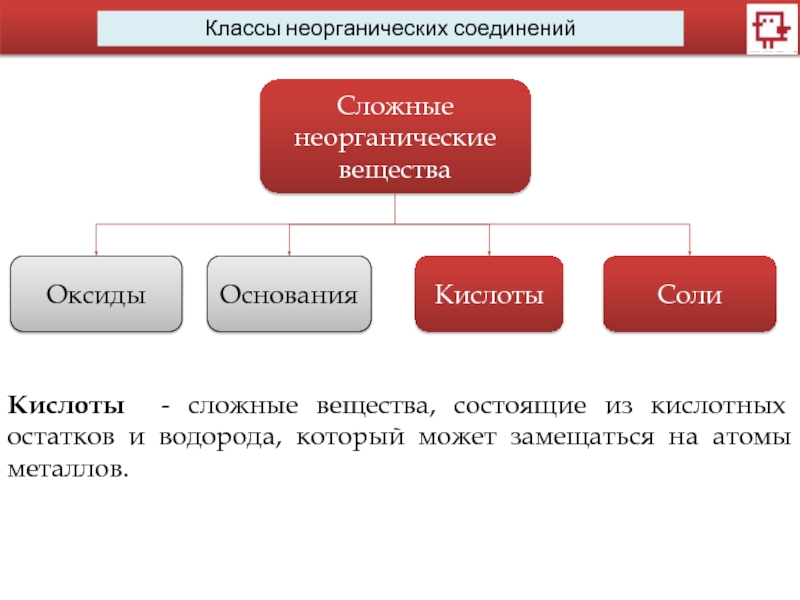
Классы неорганических соединений
Сложные неорганические вещества
Оксиды
Основания
Кислоты
Соли
Кислоты - сложные вещества, состоящие из кислотных
остатков и водорода, который может замещаться на атомы металлов.
Слайд 5
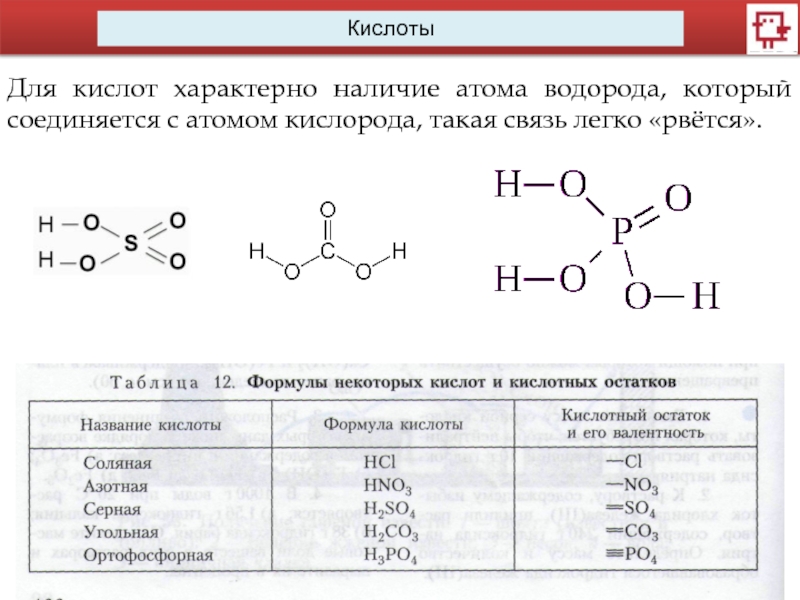
Кислоты
Для кислот характерно наличие атома водорода, который соединяется с атомом кислорода,
такая связь легко «рвётся».
Слайд 6
Кислоты
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3
+ 3H2
Кислотный остаток - это анион, который является второй частью формулы кислоты.
Кислотный остаток - это анион, который является второй частью формулы кислоты.
Слайд 7
Кислоты
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3
+ 3H2
Кислотные остатки в химических реакциях обычно сохраняются и переходят из одних соединений в другие;
Валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металлов.
Кислотные остатки в химических реакциях обычно сохраняются и переходят из одних соединений в другие;
Валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металлов.
Слайд 8
Кислоты
Физические свойства.
Многие кислоты – жидкости: серная, азотная и т.д.
Некоторые твёрдые: кремниевая
H2SiO3, ортофосфорная H3PO4, метафосфорная HPO3, борная H3BO3.
Многие из них растворимые, кроме …
Многие из них растворимые, кроме …
Слайд 9
Кислоты
Физические свойства.
Многие кислоты – жидкости: серная, азотная и т.д.
Некоторые твёрдые: кремниевая
H2SiO3, ортофосфорная H3PO4, метафосфорная HPO3, борная H3BO3.
Многие из них растворимые, кроме кремниевой. Вспоминаем: Na2SiO3 + 2HCl = H2SiO3↓ +2NaCl
Многие из них растворимые, кроме кремниевой. Вспоминаем: Na2SiO3 + 2HCl = H2SiO3↓ +2NaCl
Слайд 10
Кислоты
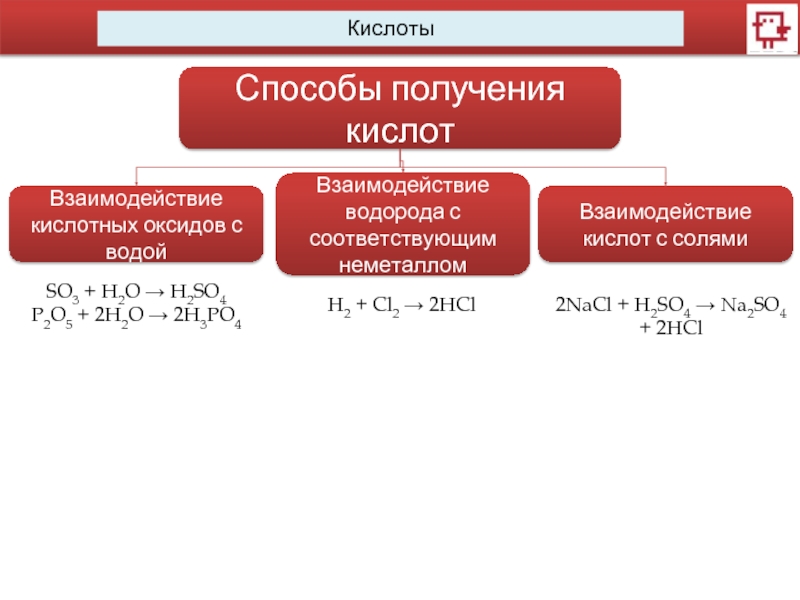
Способы получения кислот
Взаимодействие кислотных оксидов с водой
Взаимодействие водорода с соответствующим неметаллом
Взаимодействие
кислот с солями
SO3 + H2O → H2SO4
P2O5 + 2H2O → 2H3PO4
H2 + Cl2 → 2HCl
2NaCl + H2SO4 → Na2SO4 + 2HCl
Слайд 11
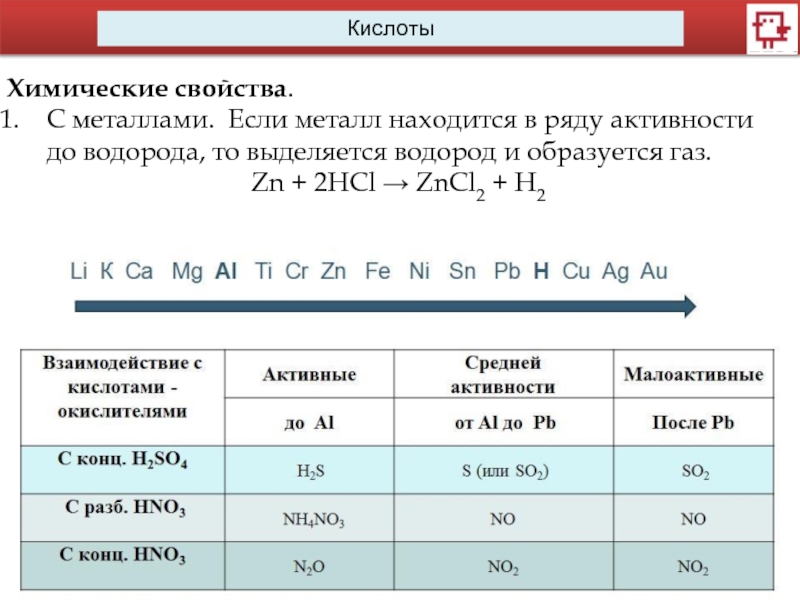
Кислоты
Химические свойства.
C металлами. Если металл находится в ряду активности до водорода,
то выделяется водород и образуется газ.
Zn + 2HCl → ZnCl2 + H2
Zn + 2HCl → ZnCl2 + H2
Слайд 12
Кислоты
Химические свойства.
2. C основными оксидами. Образуется соль и вода.
CuO +
H2SO4 → CuSO4 + H2O
Слайд 14
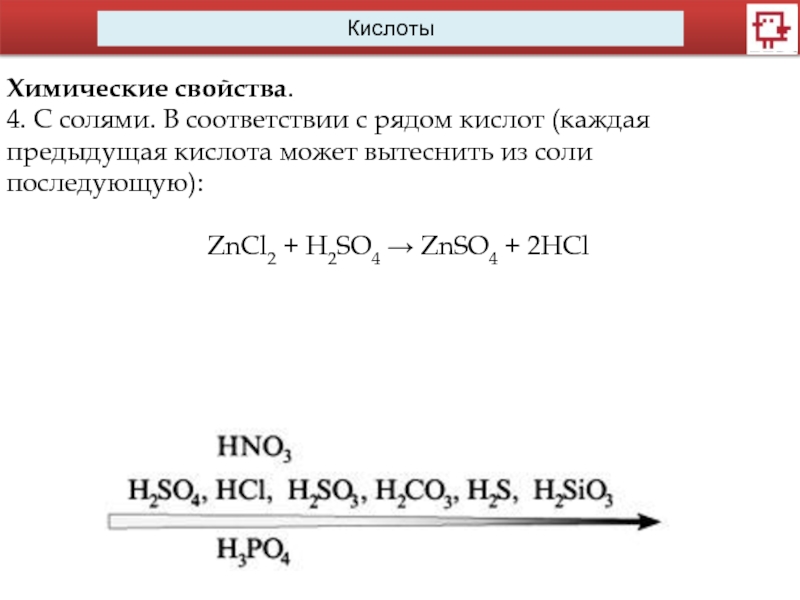
Кислоты
Химические свойства.
4. С солями. В соответствии с рядом кислот (каждая предыдущая
кислота может вытеснить из соли последующую):
ZnCl2 + H2SO4 → ZnSO4 + 2HCl
ZnCl2 + H2SO4 → ZnSO4 + 2HCl
Слайд 15
Кислоты
Химические свойства.
5. При нагревании некоторые кислоты разлагаются.
H2SO3 → H2O +
SO2