- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислоты, их состав и названия презентация
Содержание
- 1. Кислоты, их состав и названия
- 2. Запомните! Каждому кислотному оксиду соответствует определенная
- 3. Запомните! Каждому основному оксиду соответствует определенное
- 4. СаО + Н2O → Ca(OH)2 (Осн. оксид
- 5. Самостоятельная работа Напишите уравнения реакций химических свойств следующих оксидов:
- 6. Домашнее задание: Выучить схему. Составить
- 7. Содержание Тема урока №1: «Кислоты, их
- 8. Состав кислот HCl
- 9. H Cl = H+ + Cl
- 10. Классификация кислот по количеству атомов водорода Одноосновные
- 11. Классификация кислот по строению кислотного остатка кислоты
- 12. Нахождение кислот в природе Лимонная кислота
- 13. Физические свойства Жидкости, неограниченно
- 14. Правила техники безопасности при работе с кислотами
- 15. Действие кислот на растворы индикаторов
- 16. Взаимодействие кислот с металлами
- 17. Na
- 18. основный оксид + кислота = соль
- 19. Взаимодействие кислот с растворами
- 20. H2CO3 = H2O + CO2
- 21. Способы получения кислот 1. Взаимодействие кислотных оксидов
- 22. Проверьте свои знания (№1) 1.С
- 23. Пора отправится в гости .Однако, чтобы попасть
- 24. Мы попали в комнату, где много гостей.
- 25. Чтобы вы не скучали, кислоты придумали
- 26. Один рассеянный человек писал уравнения реакций и
- 27. 3. Закончите молекулярные уравнения возможных реакций
- 28. Список литературы 1. Габриелян О.С. Химия 8.-
Слайд 2 Запомните!
Каждому кислотному оксиду соответствует определенная кислота. Например:
СО2 → Н2СО3
SО2 → H2SО3
SО3 → Н2SО4
P2О5 → H3PO4
Слайд 3 Запомните!
Каждому основному оксиду соответствует определенное основание. Например:
Na2O → NaOH
CaO → Ca(OH)2
FeO → Fe(OH)2
Fe2O3 → Fe(OH)3
Слайд 4СаО + Н2O → Ca(OH)2
(Осн. оксид + вода = основание)
СаО +
(Осн. оксид + кислота = соль + вода)
SO3 + H2O → H2SO4
(Кисл. оксид + вода = кислота)
SO3 + Са(ОН)2 → CaSO4 + Н2O
(Кисл. оксид + осн-е = соль + вода)
СаО + SO3 → CaSO4
(Осн. оксид + кисл. оксид = соль)
Слайд 6Домашнее задание:
Выучить схему.
Составить уравнения реакций химических свойств следующих оксидов: N2O5
Слайд 7Содержание
Тема урока №1: «Кислоты, их состав и названия»
Состав кислот
Что
Классификация кислот по количеству атомов водорода
Классификация кислот по строению кислотного остатка
Нахождение кислот в природе
Физические свойства
Правила техники безопасности при работе с кислотами
Действие кислот на индикаторы
Тема урока №2: «Свойства кислот»
Кислоты – электролиты
Классификация кислот по степени электролитической диссоциации
Действие кислот на растворы индикаторов
Взаимодействие кислот с металлами
Взаимодействие кислот с основаниями
Взаимодействие кислот с основными и амфотерными оксидами
Взаимодействие кислот с растворами солей
Разложение кислот
Способы получения
Проверьте свои знания (№1)
Проверьте свои знания (№2)
Список литературы
Слайд 8Состав кислот
HCl H2SO4
1. Кислоты – это простые или сложные вещества?
2. Что общего в составе кислот?
3. Сформулируйте определение данного класса.
Слайд 9H Cl = H+ + Cl –
H2 SO 4 =
Кислоты – это электролиты,
которые при диссоциации образуют катионы водорода
и анионы кислотного остатка.
Что такое кислоты?
Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на
атомы металлов, и кислотных остатков.
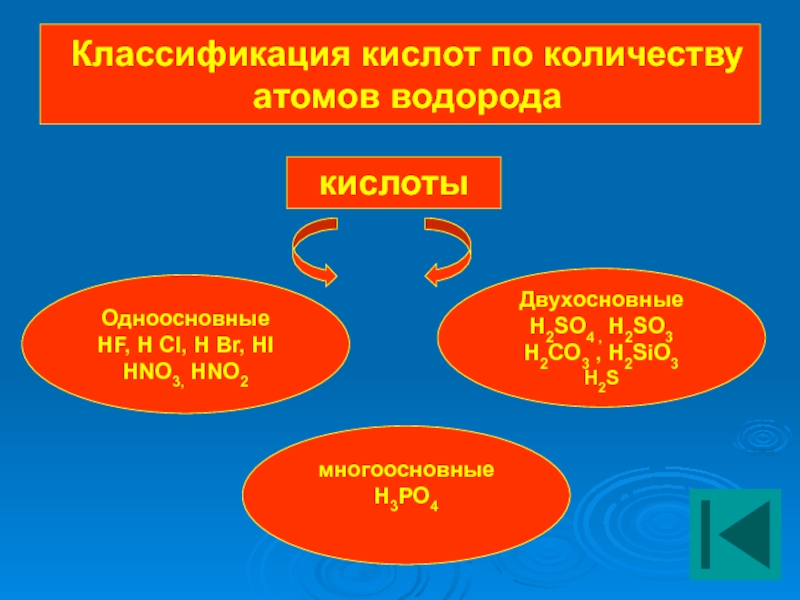
Слайд 10Классификация кислот по количеству атомов водорода
Одноосновные
HF, H Cl, H Br, HI
HNO3,
кислоты
Двухосновные
H2SO4 , H2SO3
H2CO3 , H2SiO3
H2S
многоосновные
H3PO4
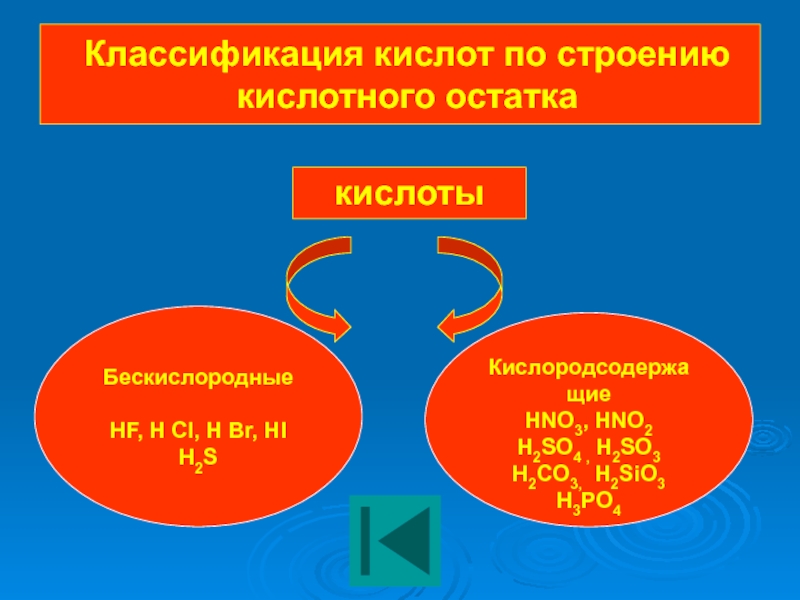
Слайд 11Классификация кислот по строению кислотного остатка
кислоты
Бескислородные
HF, H Cl, H Br, HI
H2S
Кислородсодержащие
HNO3, HNO2
H2SO4 , H2SO3
H2CO3, H2SiO3
H3PO4
Слайд 12Нахождение кислот в природе
Лимонная кислота содержится в лимонах, яблочная кислота -
В пчелином яде, в волосках крапивы, в иголках сосны и ели содержится муравьиная кислота. Муравьи, защищаясь от врагов, разбрызгивают капельки муравьиной кислоты.
При скисании виноградного сока и молока, при квашении капусты образуется молочная кислота.
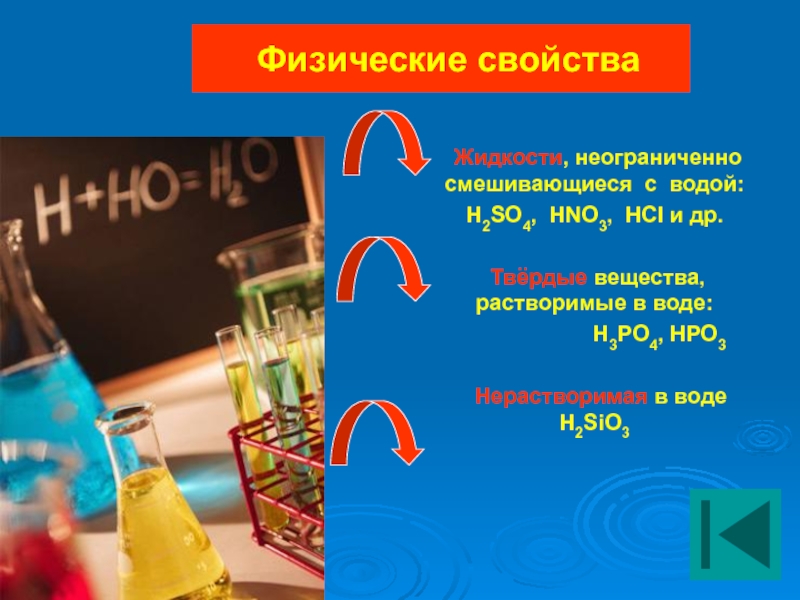
Слайд 13Физические свойства
Жидкости, неограниченно смешивающиеся с водой:
Твёрдые вещества, растворимые в воде:
H3PO4, HPO3
Нерастворимая в воде H2SiO3
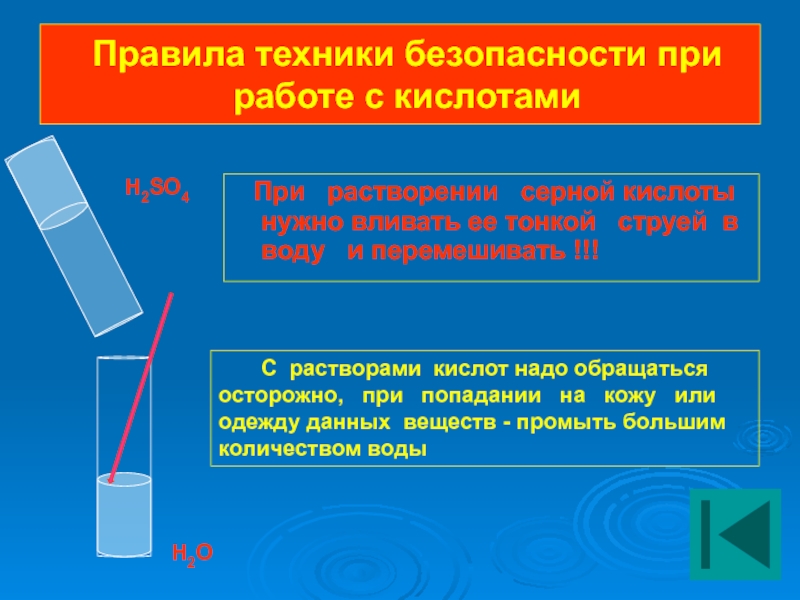
Слайд 14Правила техники безопасности при работе с кислотами
При растворении
H2SO4
Н2О
С растворами кислот надо обращаться
осторожно, при попадании на кожу или одежду данных веществ - промыть большим количеством воды
Слайд 15
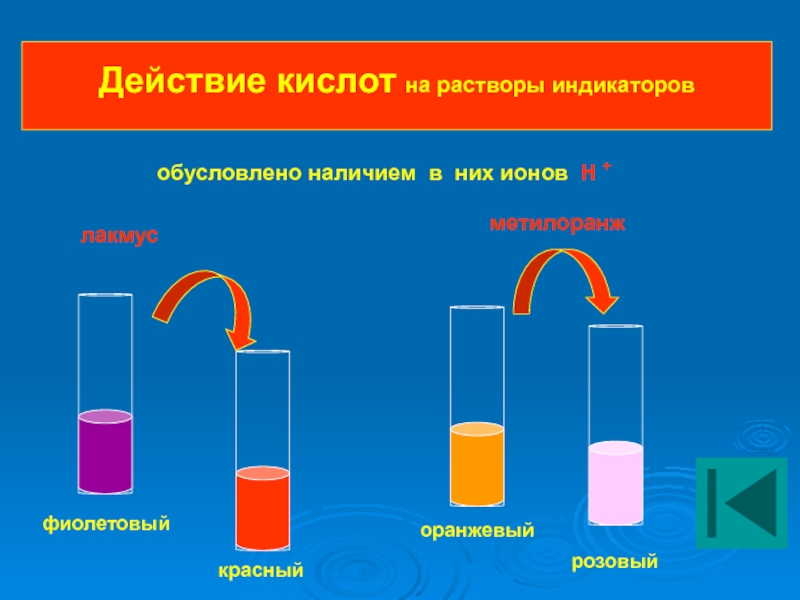
Действие кислот на растворы индикаторов
фиолетовый
красный
оранжевый
розовый
лакмус
метилоранж
обусловлено наличием в них ионов Н +
Слайд 16 Взаимодействие кислот с металлами
Zn + 2 HCI =
Zn +2H+ + 2Cl - = Zn 2+ + 2Cl - + H2
Zn + 2H+ = Zn 2+ + H2
Определите тип химической реакции.
металл + кислота = соль + водород
Продолжите уравнения химических реакций самостоятельно:
H2SO4 + Fe =
Mg + HCl =
Zn
HCl
H 2
Слайд 17
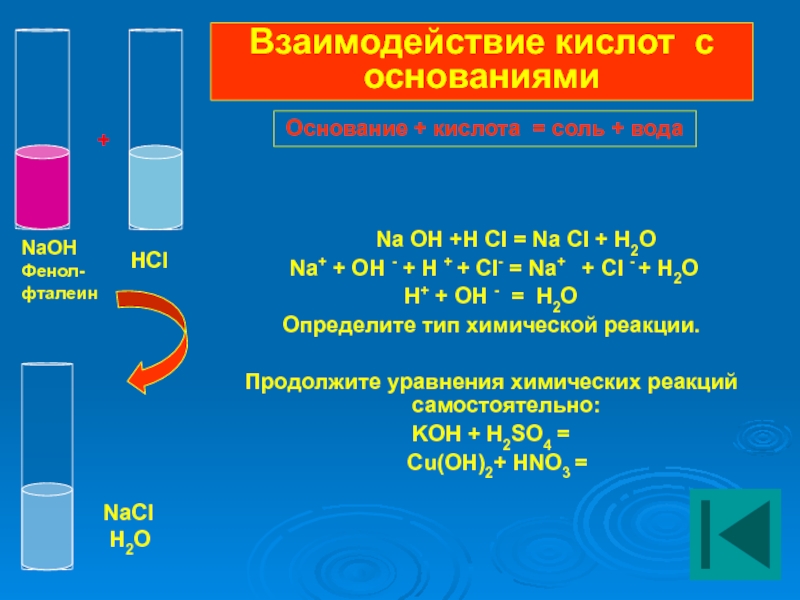
Na OH +H CI = Na CI
Na+ + OH - + H + + CI- = Na+ + CI - + H2O
Н+ + OH - = H2O
Определите тип химической реакции.
Продолжите уравнения химических реакций самостоятельно:
KOH + H2SO4 =
Cu(OH)2+ HNO3 =
NaOH
Фенол-
фталеин
HCl
+
NaCl
H2O
Взаимодействие кислот с основаниями
Основание + кислота = соль + вода
Слайд 18
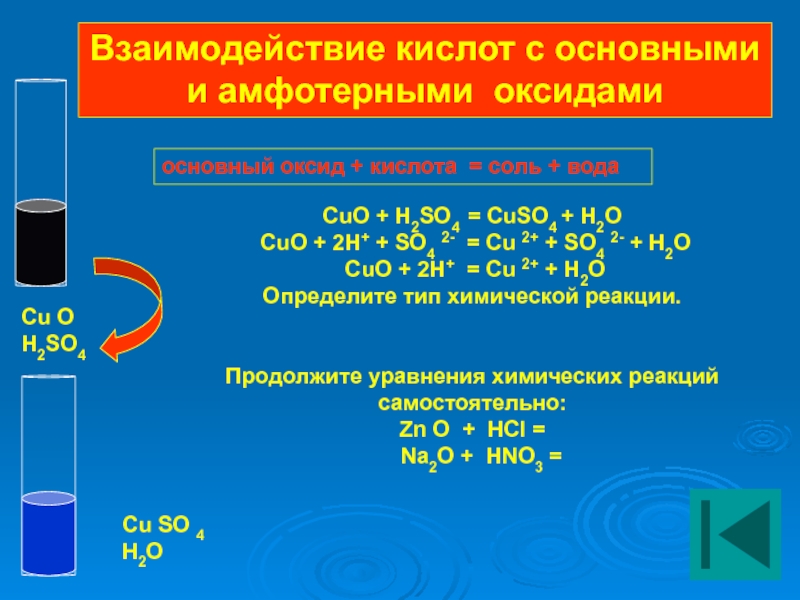
основный оксид + кислота = соль + вода
CuO + H2SO4 =
CuO + 2H+ + SO4 2- = Cu 2+ + SO4 2- + H2O
CuO + 2H+ = Cu 2+ + H2O
Определите тип химической реакции.
Продолжите уравнения химических реакций самостоятельно:
Zn O + HCl =
Na2O + HNO3 =
Взаимодействие кислот с основными и амфотерными оксидами
Cu O
H2SO4
Cu SO 4
H2O
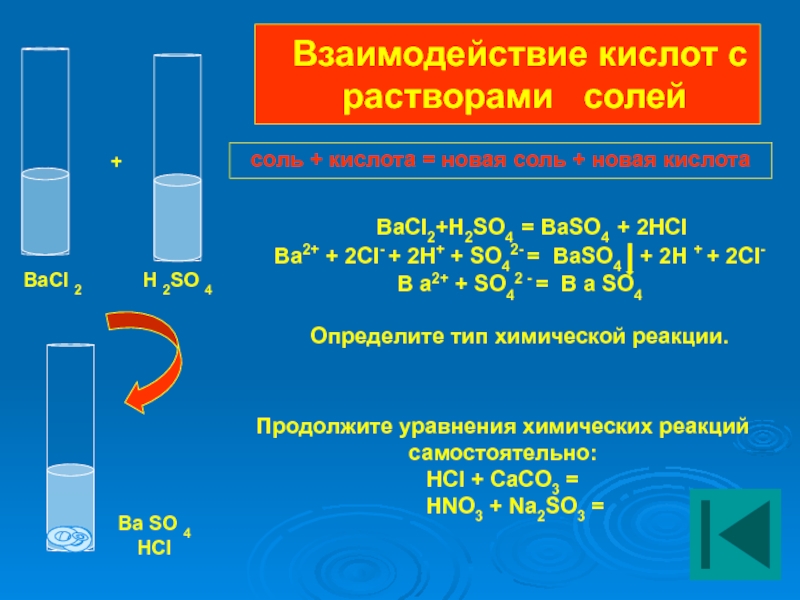
Слайд 19 Взаимодействие кислот с растворами солей
BaCI2+H2SO4
Ba2+ + 2CI- + 2Н+ + SО42- = BaSO4 + 2H + + 2CI-
B a2+ + SО42 - = B a SО4
Определите тип химической реакции.
Продолжите уравнения химических реакций самостоятельно:
HCl + CaCO3 =
HNO3 + Na2SO3 =
+
BaCI 2
H 2SO 4
Ba SO 4
HCI
соль + кислота = новая соль + новая кислота
Слайд 20
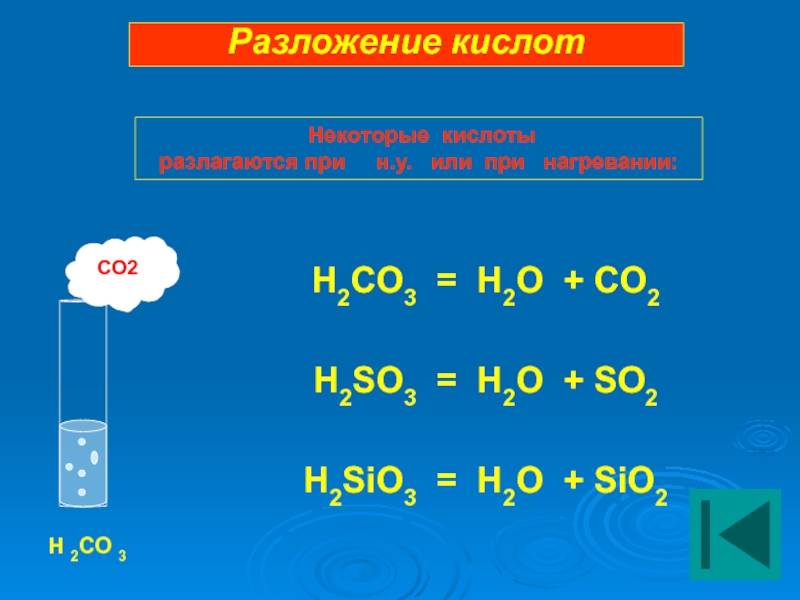
H2CO3 = H2O + CO2
H2SO3 = H2O + SO2
H2SiO3 = H2O
CO2
H 2CO 3
Разложение кислот
Некоторые кислоты
разлагаются при н.у. или при нагревании:
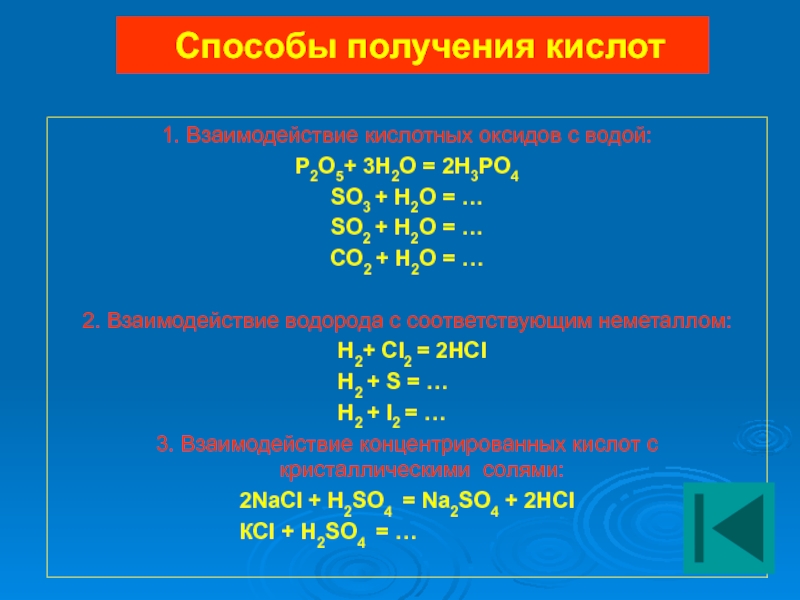
Слайд 21Способы получения кислот
1. Взаимодействие кислотных оксидов с водой:
P2O5+ 3H2O = 2H3PO4
SO3
SO2 + H2O = …
СO2 + H2O = …
2. Взаимодействие водорода с соответствующим неметаллом:
H2+ CI2 = 2HCI
H2 + S = …
H2 + I2 = …
3. Взаимодействие концентрированных кислот с кристаллическими солями:
2NaCI + H2SO4 = Na2SO4 + 2HCI
КCI + H2SO4 = …
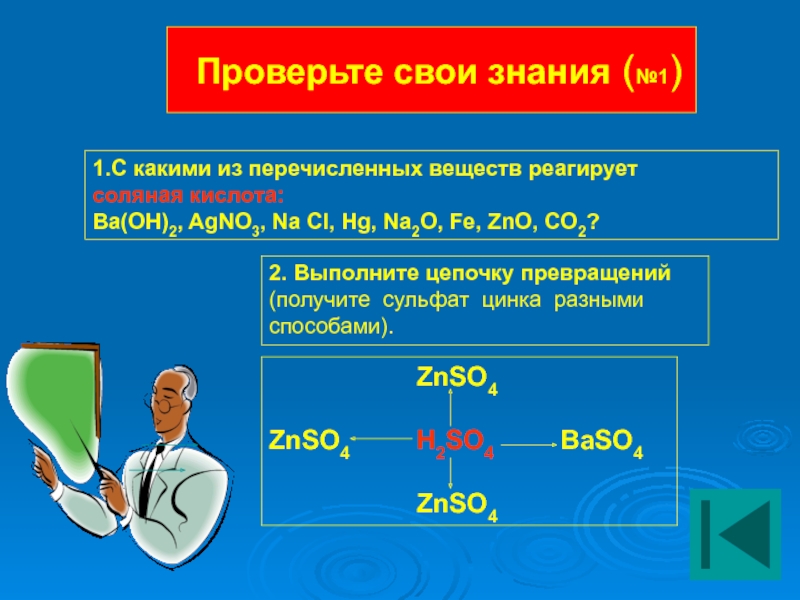
Слайд 22Проверьте свои знания (№1)
1.С какими из перечисленных веществ реагирует
соляная кислота:
Ba(OH)2,
ZnSO4
ZnSO4 H2SO4 BaSO4
ZnSO4
2. Выполните цепочку превращений
(получите сульфат цинка разными способами).
Слайд 23Пора отправится в гости .Однако, чтобы попасть в дом, необходимо вспомнить
1.Что общего у всех кислот:
H2SO4, HCL, H2CO3, HNO3, H3PO4, H2S ?
2.Чем различаются следующие кислоты?
H2CO3 и HCL, H2SO4 и H2S, H3PO4 и НF?
3. По какому ещё признаку можно разделить кислоты на группы?
Слайд 24Мы попали в комнату, где много гостей. Необходимо найти хозяев и
MgCL2, H2SO4, Ca(OH)2, CuSO4, H2O, HCL, Fe2O3, NaOH, HF, ZnCL2, H2CO3, MgO, O2, H3PO4, KOH, H2, H2SiO4.
Кислоты – большие затейники и решили поиграть с вами в игру «третий лишний»:
А) BaO, HNO3, HCL; B) Na2SO4,H2S,H2SO4;
Б) H2CO3, HF, H2O; Г) H3PO4, H2, H2SiO3.
Слайд 25 Чтобы вы не скучали, кислоты придумали игру «Угадай».
1) AL+ HCL=
2) Cu + H2SO4=
3) CuO + H2SO4=
4) Ag + H3PO4=
5) KOH + HCL=
6) SO3 + H2SO4=
А теперь игра «Мои друзья».
могут ли одновременно находиться в растворе:
А) NaOH и KOH; в) Ca(OH)2 и HCL;
Б) NaOH и HNO3; г) Ba(OH)2 и LiOH.
Слайд 26Один рассеянный человек писал уравнения реакций и потерял свои записи, остались
А) ? + ? = Na2SO4 + ? ;
Б) ? + ? =ZnCL2 + H2 ;
B) MgO + ? = MgSO4 + ? ;
Г) K2CO3 +? = KCL +? + ?
. С какой «тройкой» этих металлов может реагировать соляная кислота?
a) Na, Ba, Ag;
б) K, Ca, Au;
в) Mg, AL, Zn;
г) Pb, Cr, Cu.
Слайд 273. Закончите молекулярные уравнения возможных реакций
и запишите соответствующие им ионные
Al2О3 + H Cl = H Cl + Cu S =
Mg + H2SO4 = FeCl 3 + KOH =
HNO3 + Zn SO4 = Ca CO3 + HNO3 =
4 Выполните цепочку превращений:
S SO2 SO3 H2SO4 CuSO4
CuSO4
CuSO4
Проверьте свои знания (№2)
Слайд 28Список литературы
1. Габриелян О.С. Химия 8.- М.: Дрофа, 2007.
2. Габриелян О.С.,
3. Зеленин К.Н., Сергутина В.П., Солод О.В. Сдаем экзамен по химии. – ЭЛБИ-СПБ, 2005.
Автор проекта желает
всем успеха
в изучении данной темы !
Город на Волге - Сызрань