ФУНКЦИОНАЛЬНЫХ КАРБОКСИЛЬНЫХ ГРУПП -COOH.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Карбо́новые кисло́ты презентация
Содержание
- 1. Карбо́новые кисло́ты
- 2. КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТ По числу
- 4. Физические свойства Низшие карбоновые кислоты — жидкости с
- 5. Характерные химические реакции Наиболее важные химические свойства,
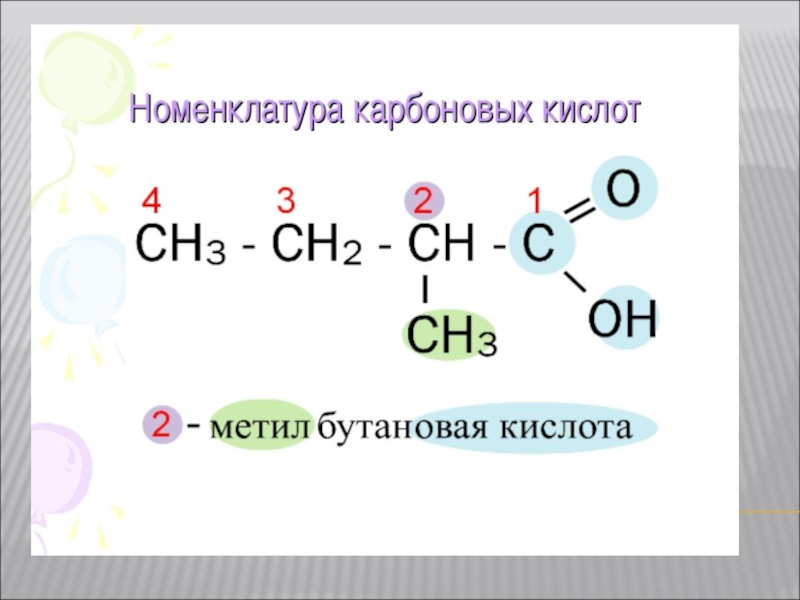
- 6. Изомерия карбоновых кислот. Cтруктурная изомерия: изомерия
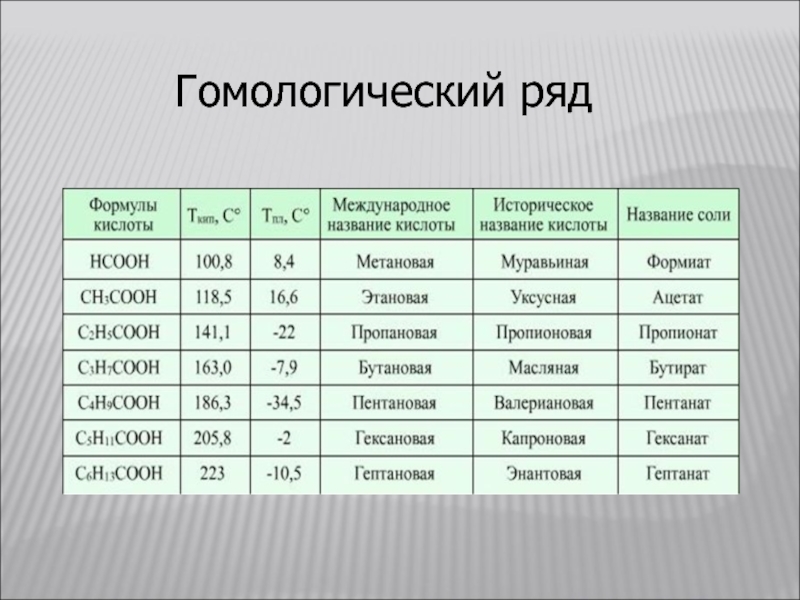
- 8. Гомологический ряд
- 9. Применение карбоновых кислот.
Слайд 1КАРБО́НОВЫЕ КИСЛО́ТЫ — КЛАСС ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, МОЛЕКУЛЫ КОТОРЫХ СОДЕРЖАТ ОДНУ ИЛИ НЕСКОЛЬКО
Слайд 2КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТ
По числу карбоксильных
групп
непредельные
ароматические
одноосновные
двухосновные
многоосновные
предельные
По типу углеводородного
радикала
Слайд 4 Физические свойства
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в
воде. С повышением относительной молекулярной массы растворимость кислот в воде уменьшается, а температура кипения повышается.
Высшие кислоты — твердые вещества, без запаха, нерастворимые в воде.
Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
Слайд 5 Характерные химические реакции
Наиболее важные химические свойства, характерные для большинства карбоновых кислот:
1)
Карбоновые кислоты при реакции с металлами или их осно́вными гидроксидами дают соли соответствующих металлов:
Также карбоновые кислоты могут вытеснять более слабую кислоту из её соли (потом разлагается на углекислый газ и воду)
2) Карбоновые кислоты в присутствии катализатора 2) Карбоновые кислоты в присутствии катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
CH3COOH + СН3СН2ОН = CH3COOCH2СН3 + H2O
3) При нагревании аммонийных солей карбоновых кислот образуются их амиды.
Также карбоновые кислоты могут вытеснять более слабую кислоту из её соли (потом разлагается на углекислый газ и воду)
2) Карбоновые кислоты в присутствии катализатора 2) Карбоновые кислоты в присутствии катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
CH3COOH + СН3СН2ОН = CH3COOCH2СН3 + H2O
3) При нагревании аммонийных солей карбоновых кислот образуются их амиды.
Слайд 6
Изомерия карбоновых кислот.
Cтруктурная изомерия:
изомерия скелета в углеводородном радикале (начиная с C4).
межклассовая изомерия, начиная с C2.
Например, формуле C2H4O2 соответствуют 3 изомера, относящиеся к различным классам органических соединений.
Пространственная изомерия: Возможна цис-транс изомерия в случае непредельных карбоновых кислот. Например:
Пространственная изомерия: Возможна цис-транс изомерия в случае непредельных карбоновых кислот. Например: