- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования презентация
Содержание
- 1. Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
- 2. Карбоновые кислоты – органические соединения,содержащие СООН-
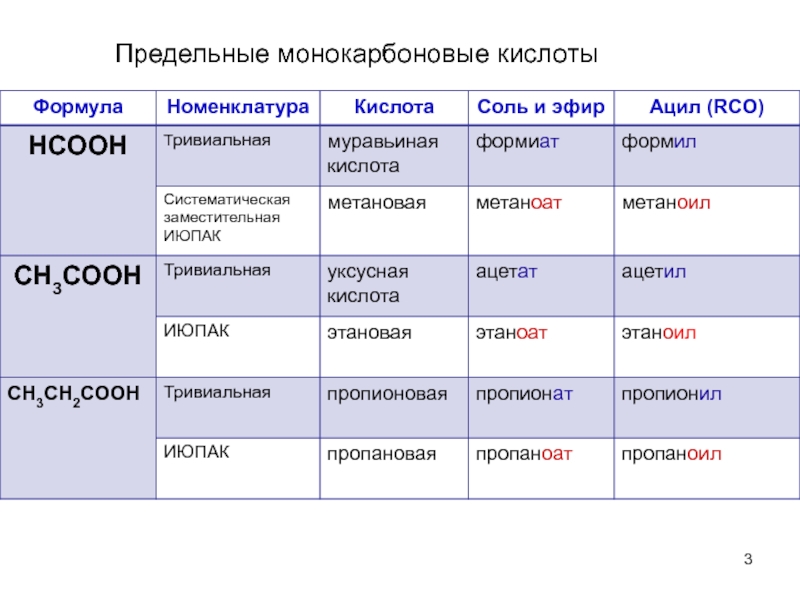
- 3. Предельные монокарбоновые кислоты
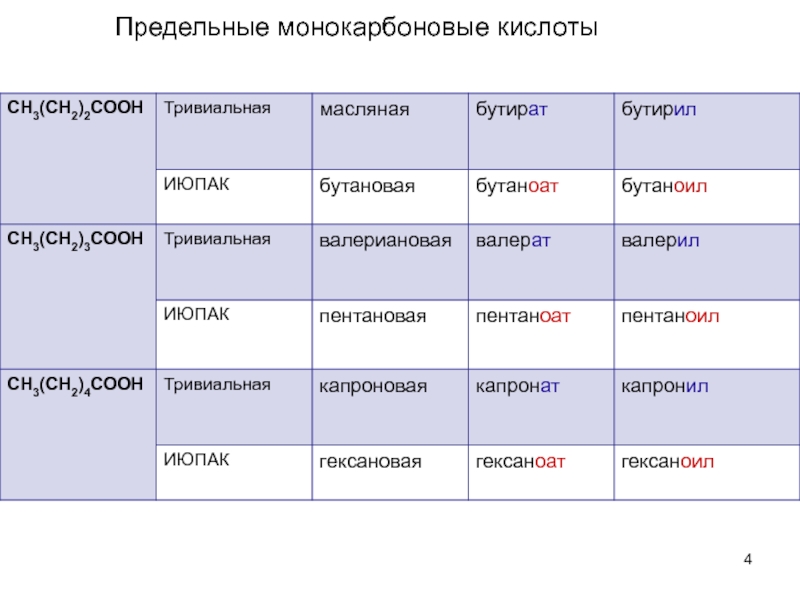
- 4. Предельные монокарбоновые кислоты
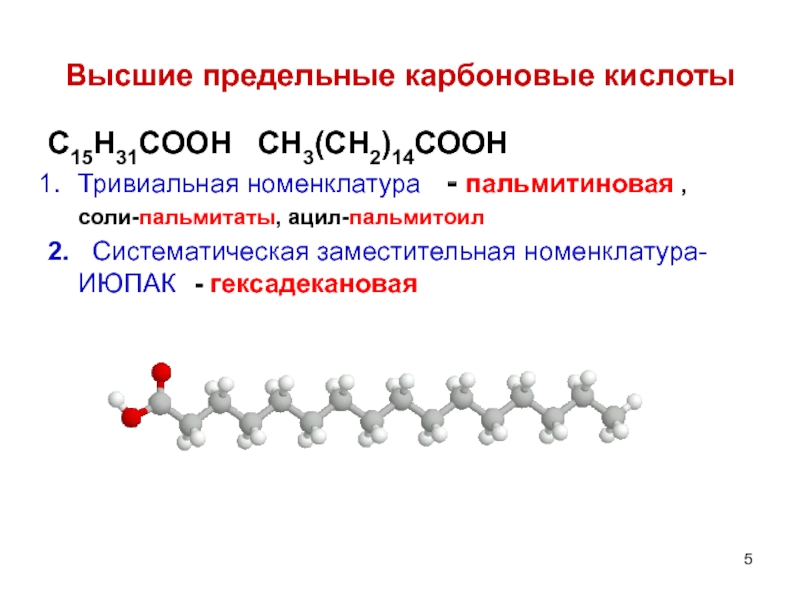
- 5. Высшие предельные карбоновые кислоты C15H31COOH CH3(CH2)14COOH
- 6. C17H35COOH CH3(CH2)16COOH Тривиальная номенклатура
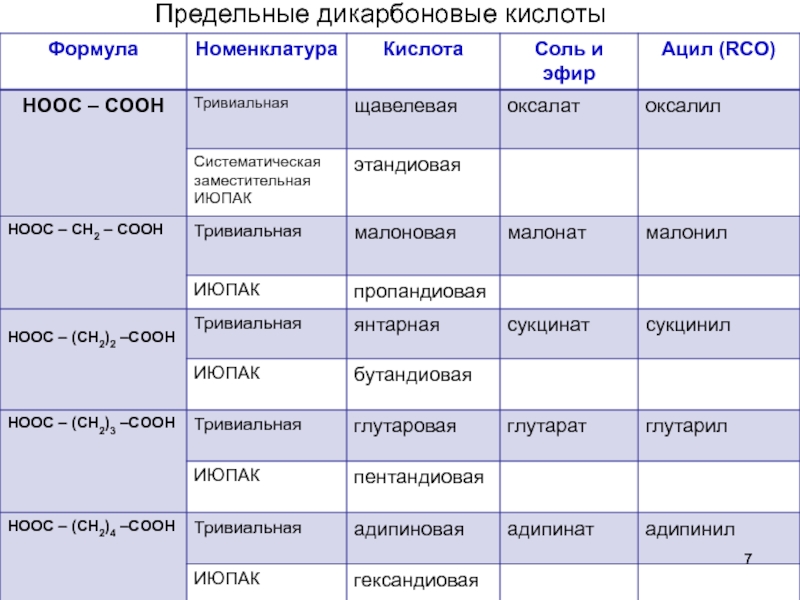
- 7. Предельные дикарбоновые кислоты
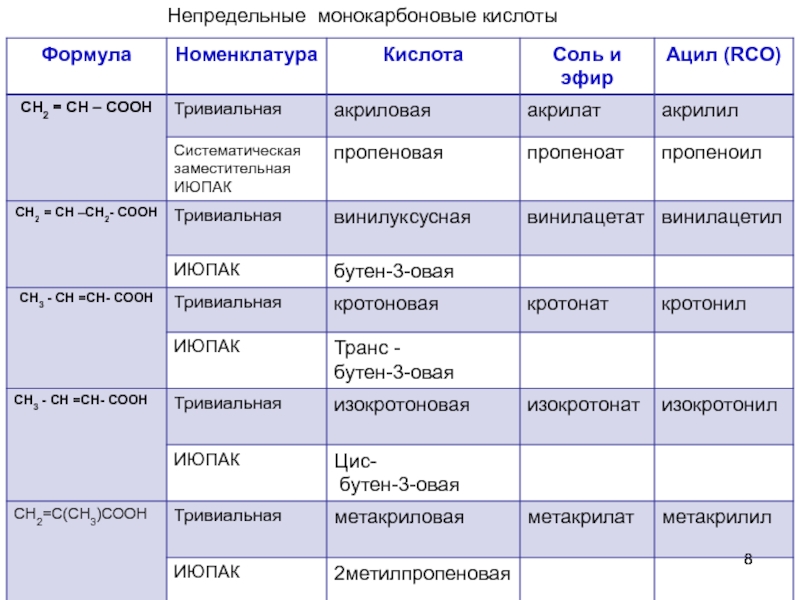
- 8. Непредельные монокарбоновые кислоты
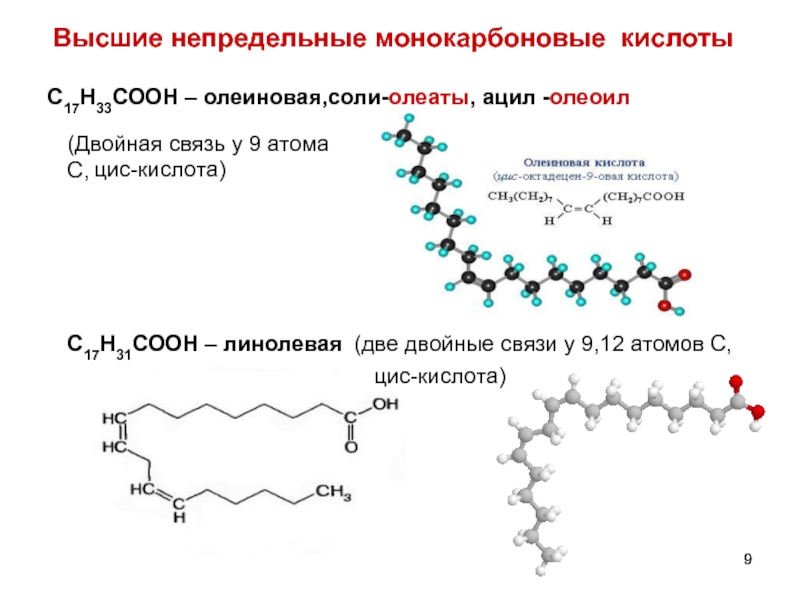
- 9. Высшие непредельные монокарбоновые кислоты С17Н33СООН – олеиновая,соли-олеаты,
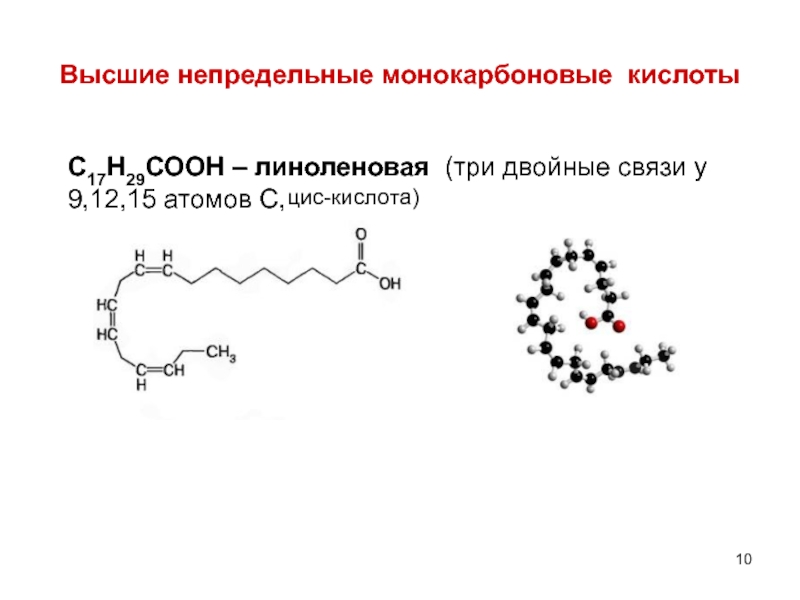
- 10. Высшие непредельные монокарбоновые кислоты С17Н29СООН – линоленовая
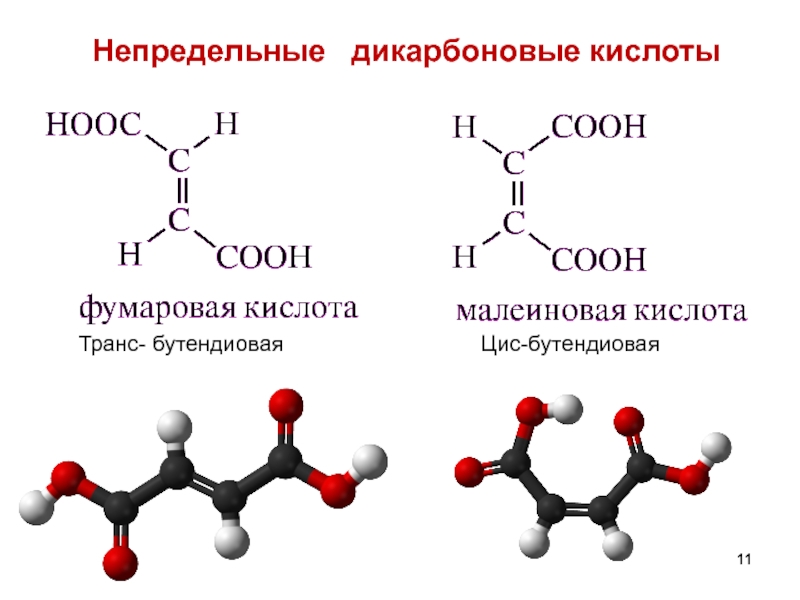
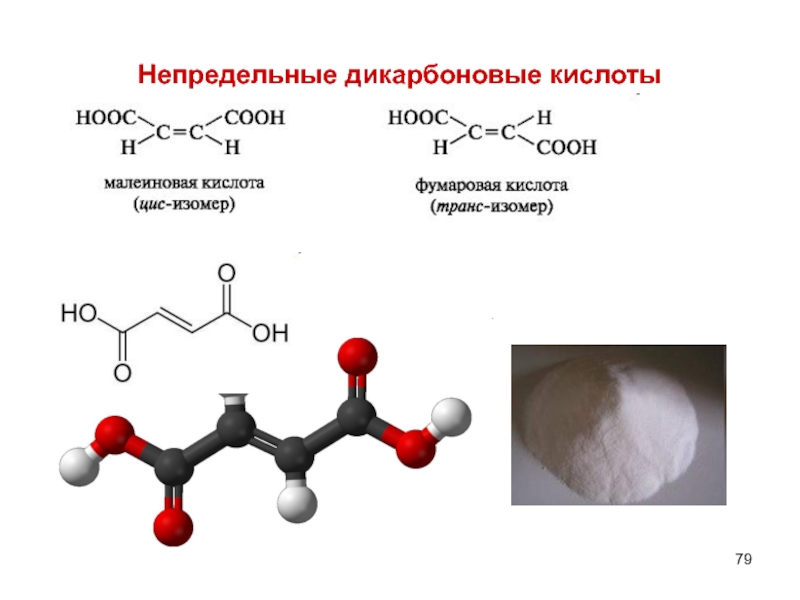
- 11. Непредельные дикарбоновые кислоты Транс- бутендиовая Цис-бутендиовая
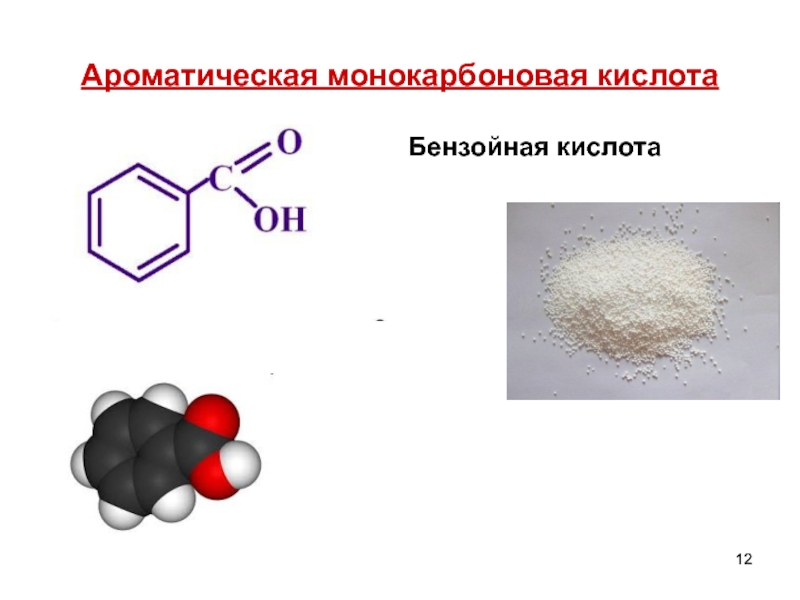
- 12. Ароматическая монокарбоновая кислота Бензойная кислота
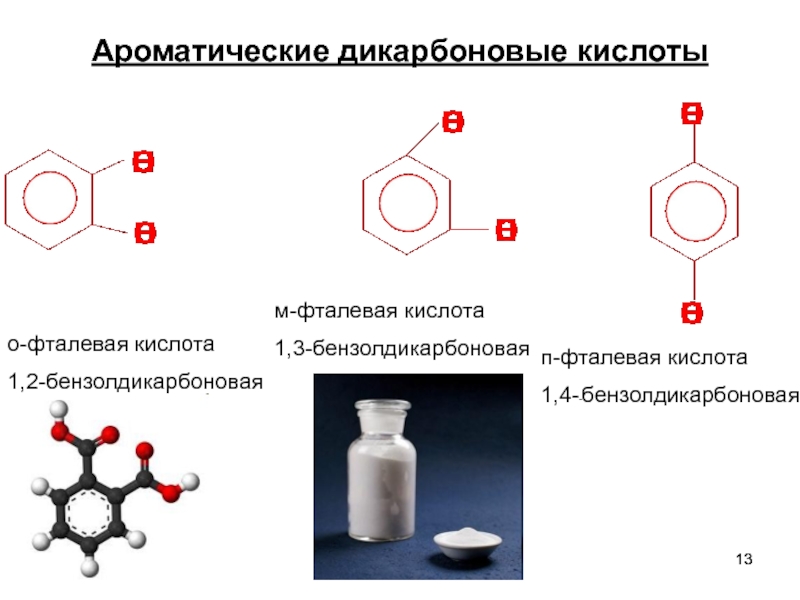
- 13. Ароматические дикарбоновые кислоты о-фталевая кислота 1,2-бензолдикарбоновая м-фталевая кислота 1,3-бензолдикарбоновая п-фталевая кислота 1,4--бензолдикарбоновая
- 14. ПРИРОДА
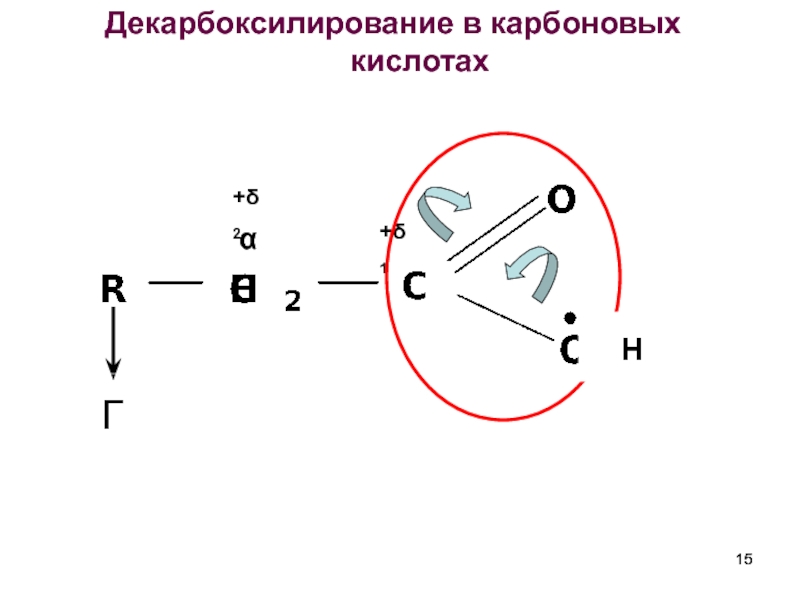
- 15. Декарбоксилирование в карбоновых кислотах
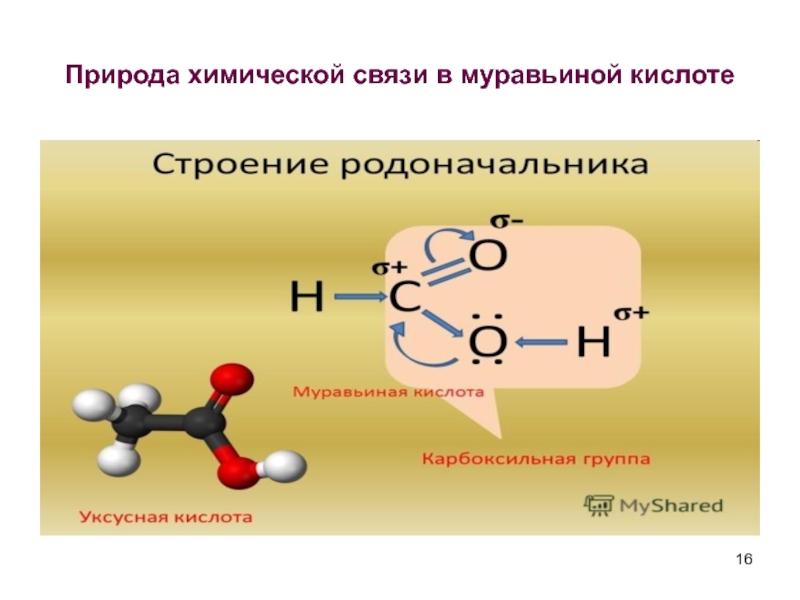
- 16. Природа химической связи в муравьиной кислоте
- 17. Большинство химических реакций карбоновых кислот можно разделить
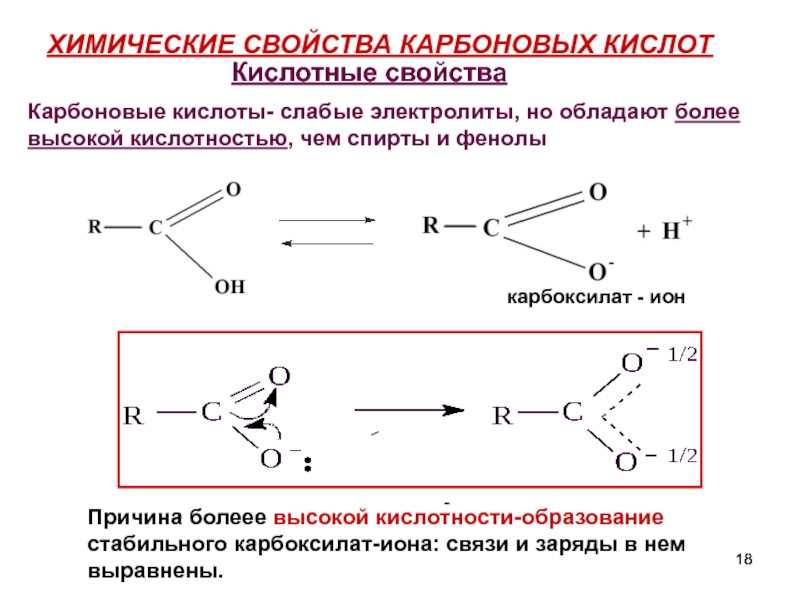
- 18. ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ карбоксилат
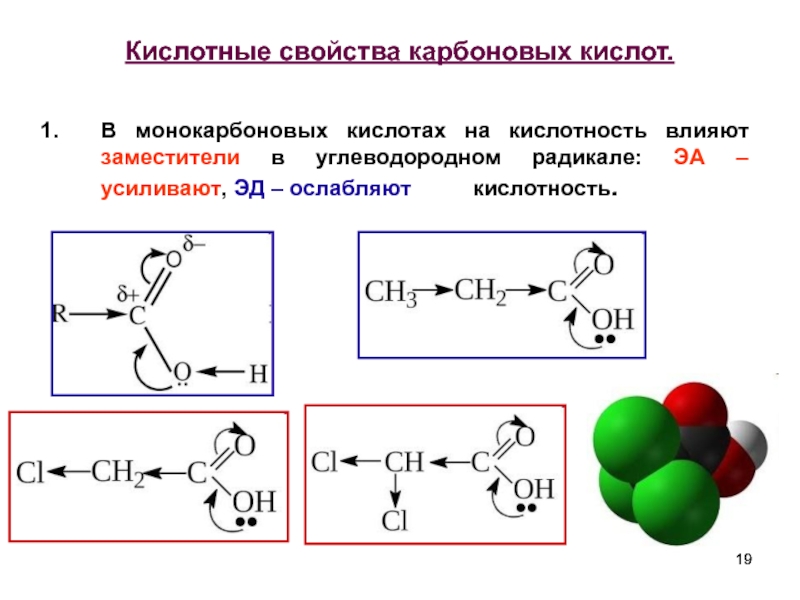
- 19. Кислотные свойства карбоновых кислот. В монокарбоновых
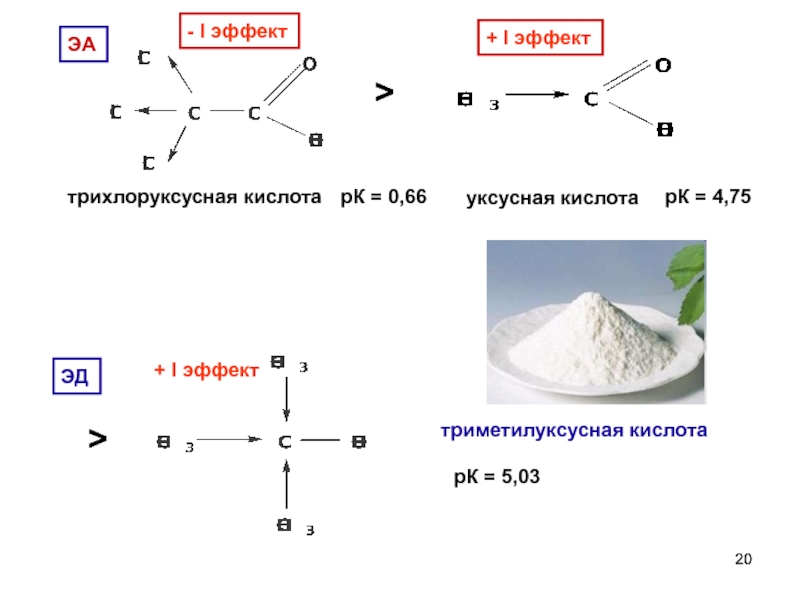
- 20. - I эффект трихлоруксусная кислота рК
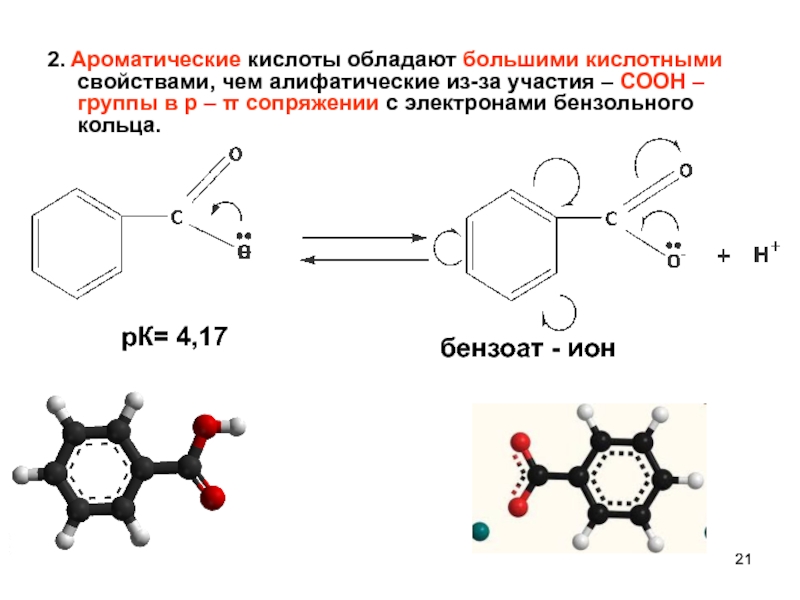
- 21. 2. Ароматические кислоты обладают большими кислотными свойствами,
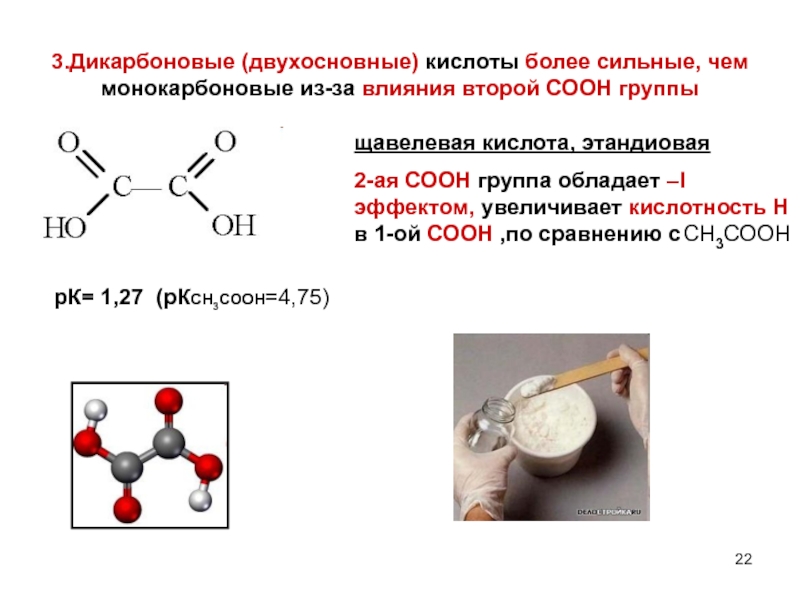
- 22. 3.Дикарбоновые (двухосновные) кислоты более сильные, чем монокарбоновые
- 23. Щавелевая кислота Щавелевая кислота накапливается, когда листья
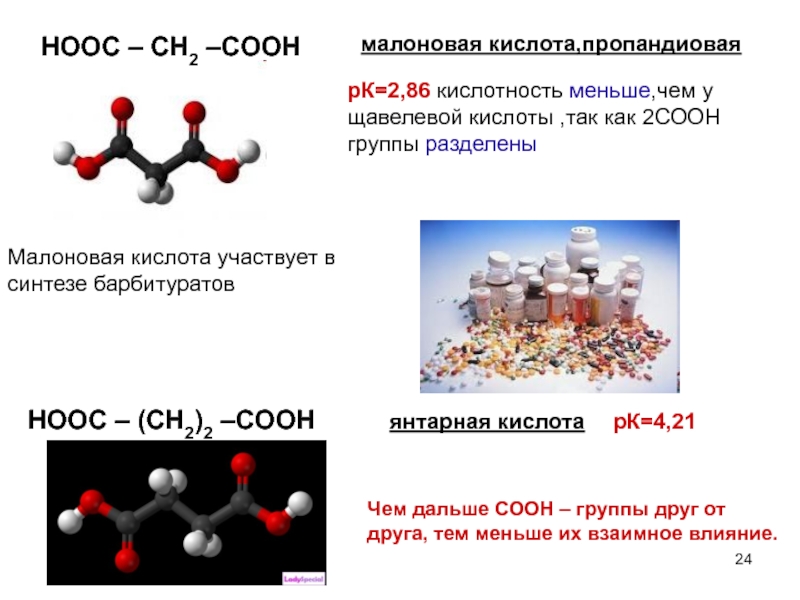
- 24. малоновая кислота,пропандиовая рК=2,86 кислотность меньше,чем у
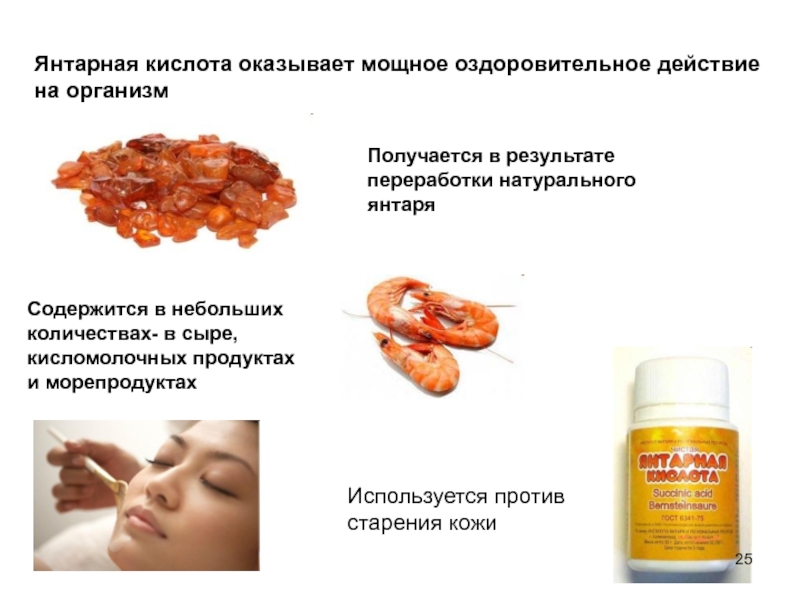
- 25. Янтарная кислота оказывает мощное оздоровительное действие
- 26. Образование солей КАРБОНОВЫХ КИСЛОТ
- 27. Ледяная уксусная кислота (концентрация близка к 100%)
- 28. II. Реакции SN – образование функциональных производных
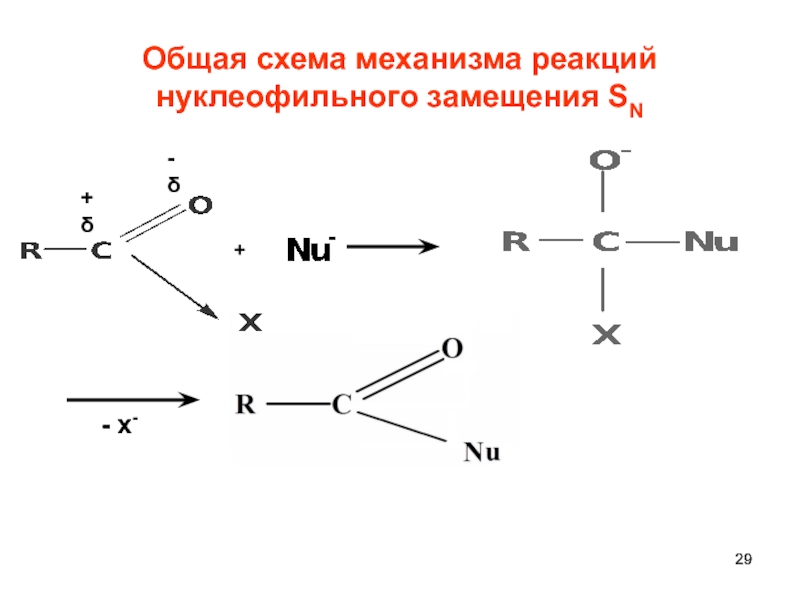
- 29. Общая схема механизма реакций нуклеофильного замещения SN +δ -δ + - х-
- 30. Сложные эфиры. Образование сложных
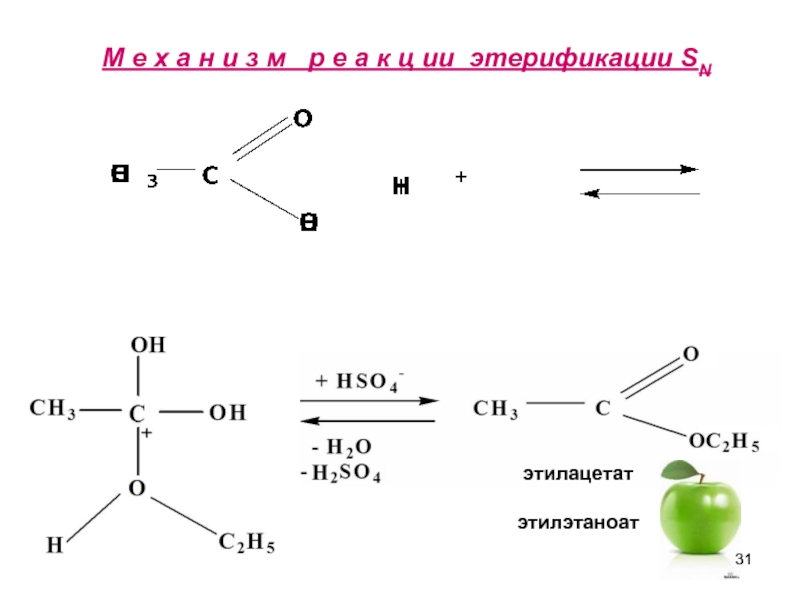
- 31. М е х а н и з
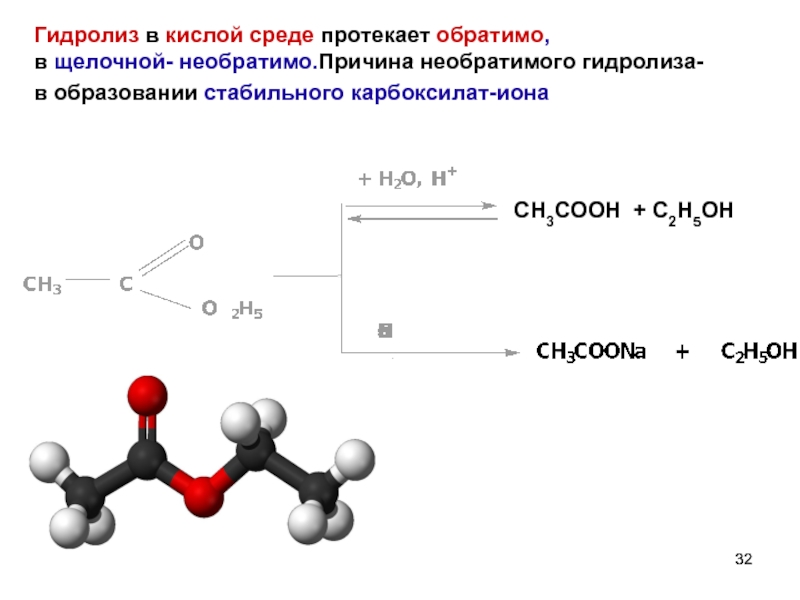
- 32. Гидролиз в кислой среде протекает обратимо, в
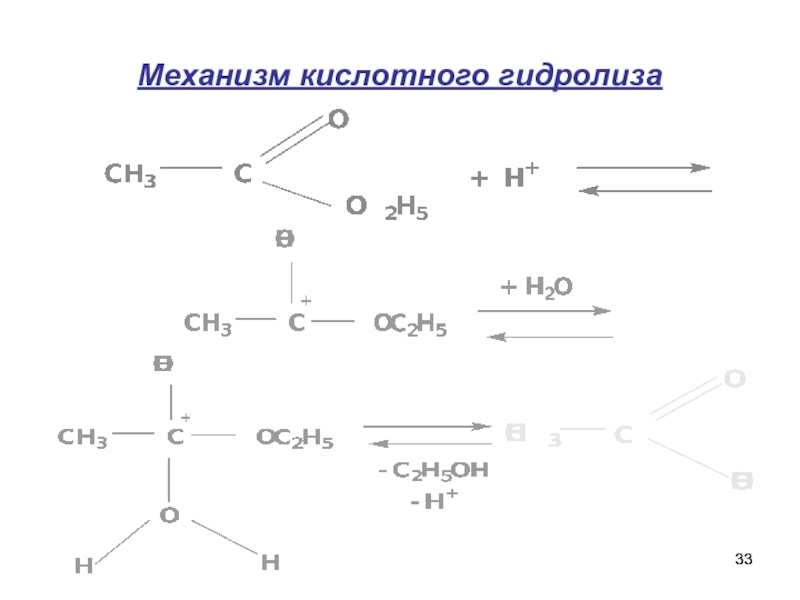
- 33. Механизм кислотного гидролиза
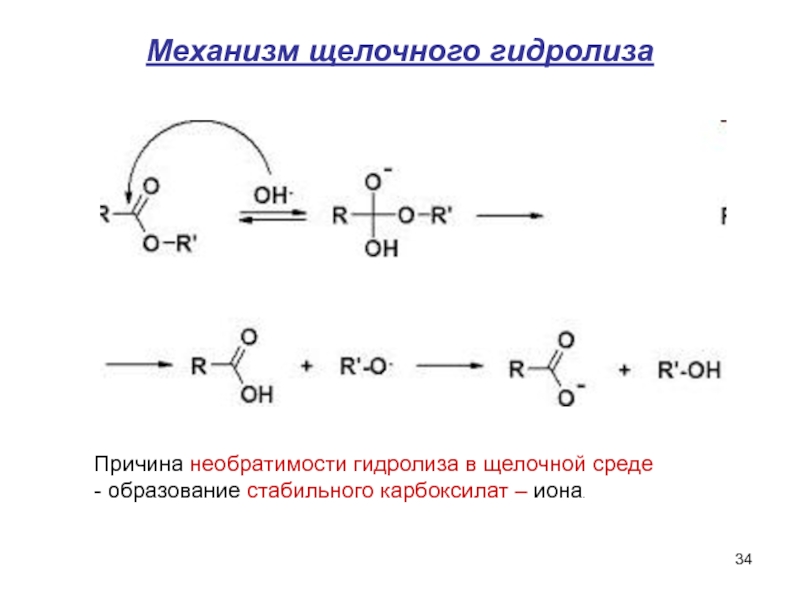
- 34. Механизм щелочного гидролиза Причина необратимости
- 35. СЛОЖНЫЕ ЭФИРЫ в природе и нашей жизни
- 36. Когда число атомов С в исходных карбоновой
- 37. Если в образовании сложного эфира участвует
- 38. Многие лекарственные препараты – это сложные
- 39. Диметилфталаты - сложные эфиры о-фталевой кислоты. спасают от клеща спасают от комаров (репелленты)
- 40. Но фталаты – вредные составляющие косметических средств
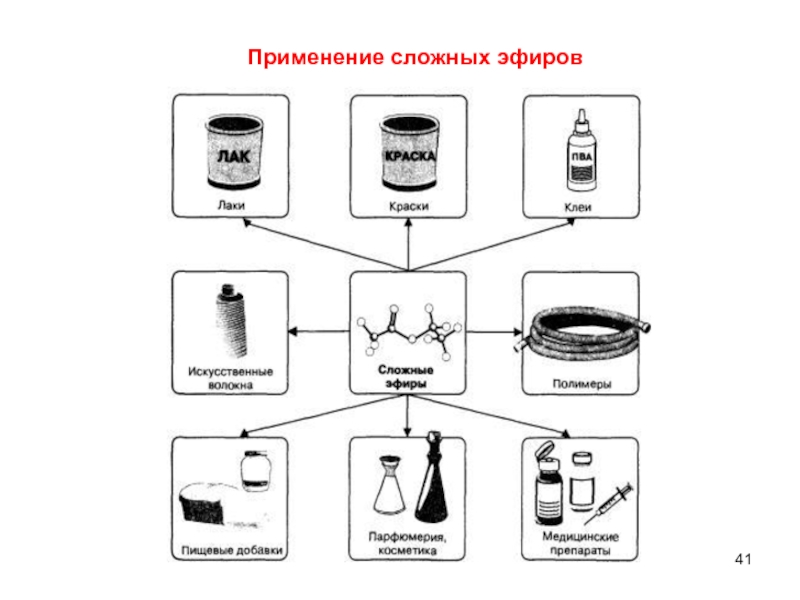
- 41. Применение сложных эфиров
- 42. 2. Тиоэфиры. Образование тиоэфиров. Реакции
- 43. Н А П Р И М Е
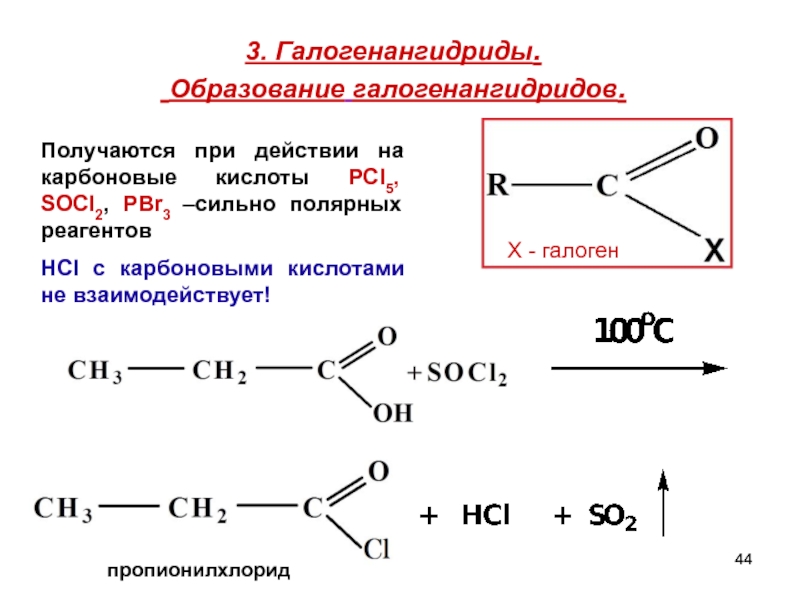
- 44. 3. Галогенангидриды. Образование галогенангидридов.
- 45. Хлорангидриды или ацилхлориды простых карбоновых кислот –
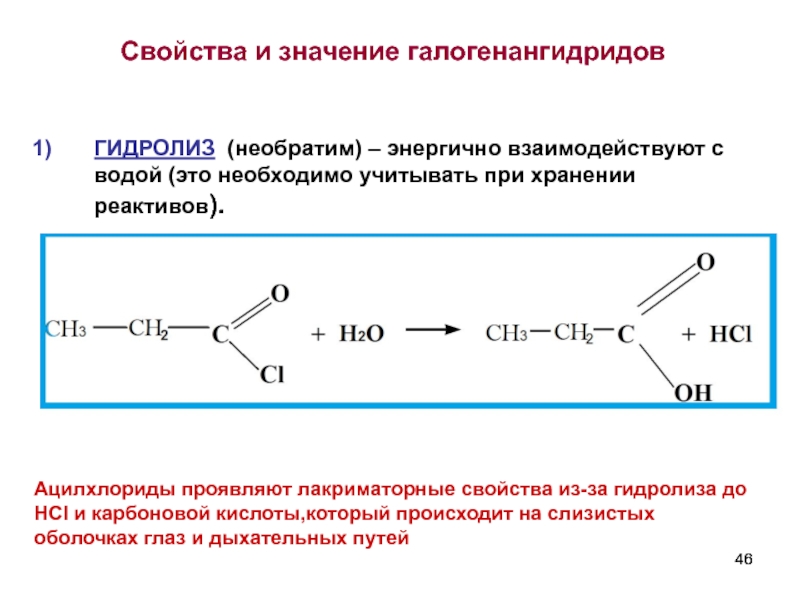
- 46. Свойства и значение галогенангидридов ГИДРОЛИЗ
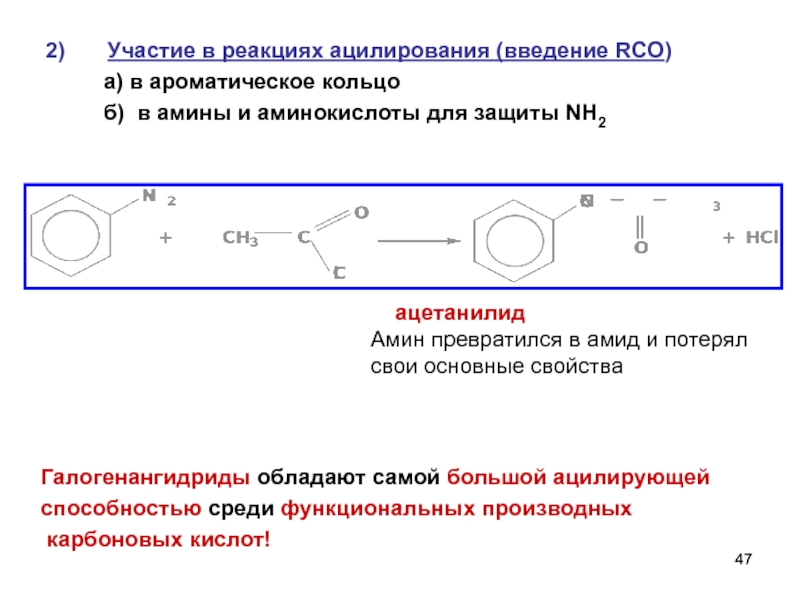
- 47. Участие в реакциях ацилирования (введение RCO)
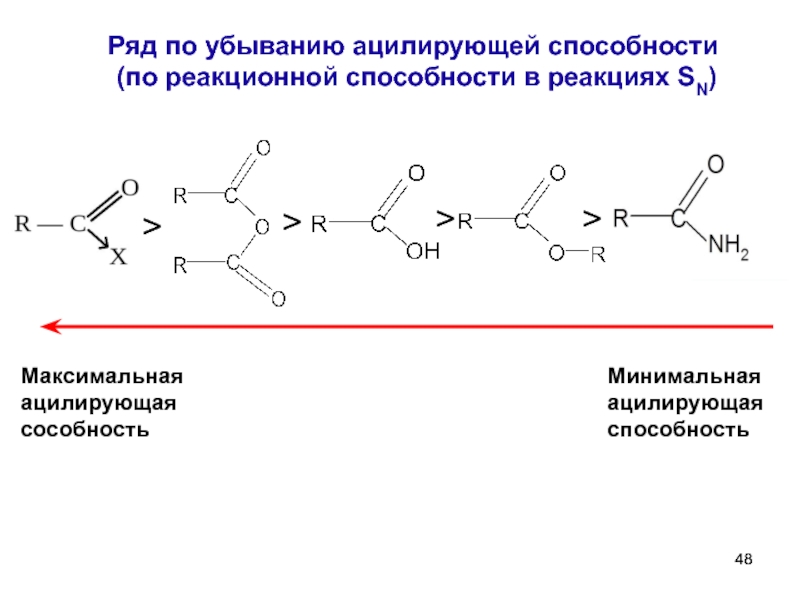
- 48. Ряд по убыванию ацилирующей способности (по
- 51. 4. Амиды. Образование амидов. бутират
- 52. 2 способ получения амидов - ацилирование аммиака (аминирование ацилхлоридов) Масляная кислота бутирамид
- 53. Амиды содержат амидную группировку, которая встречается в
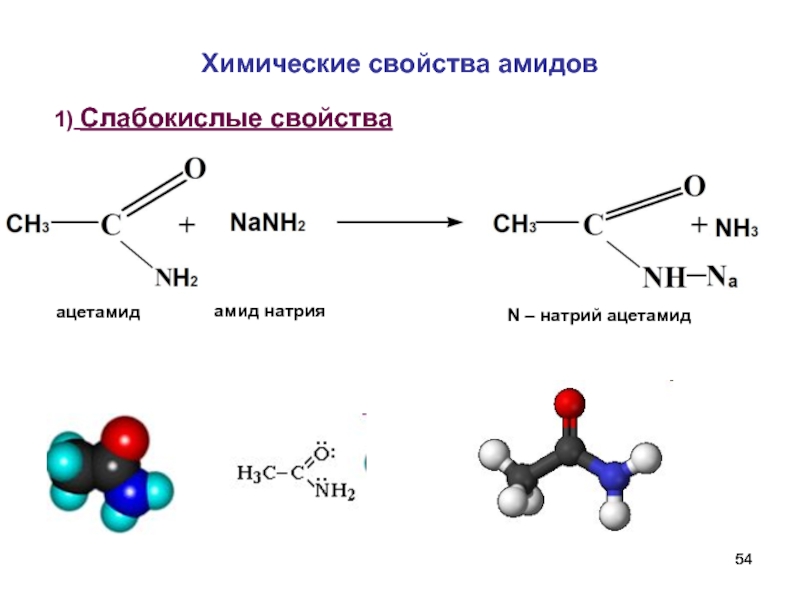
- 54. Химические свойства амидов 1) Слабокислые свойства
- 55. Образование нитрилов этанонитрил
- 56. Мочевина –диамид угольной кислоты
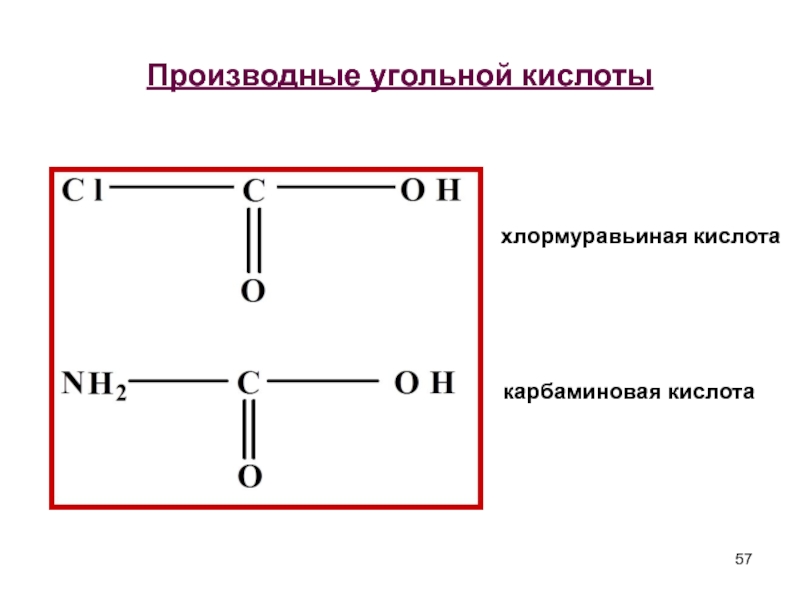
- 57. Производные угольной кислоты хлормуравьиная кислота карбаминовая кислота
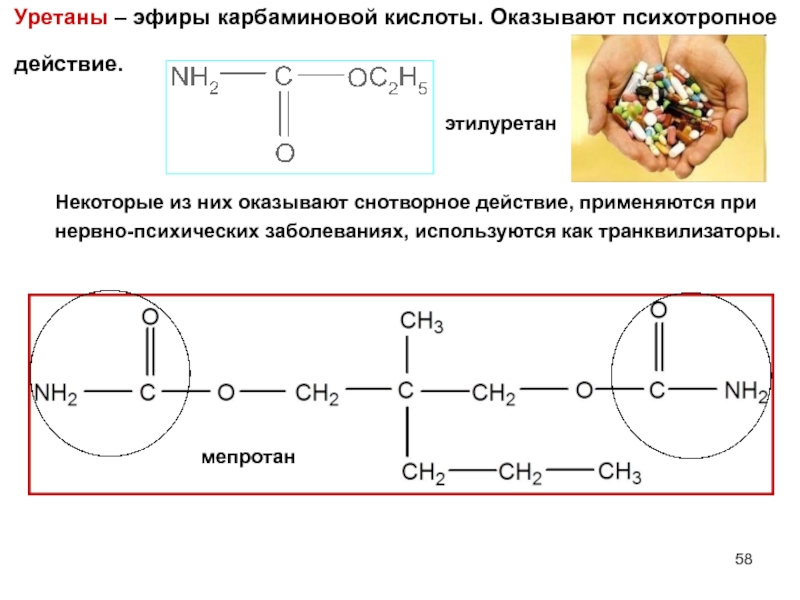
- 58. Уретаны – эфиры карбаминовой кислоты. Оказывают психотропное
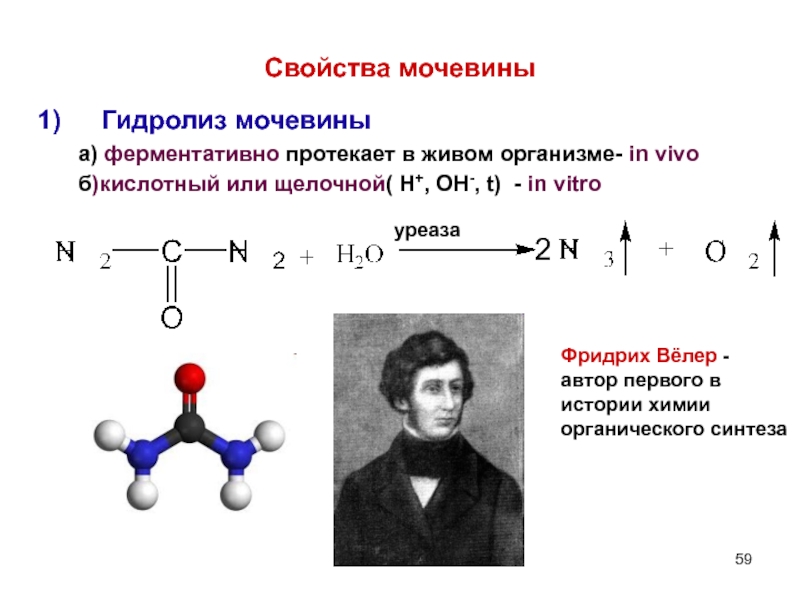
- 59. Свойства мочевины Гидролиз мочевины
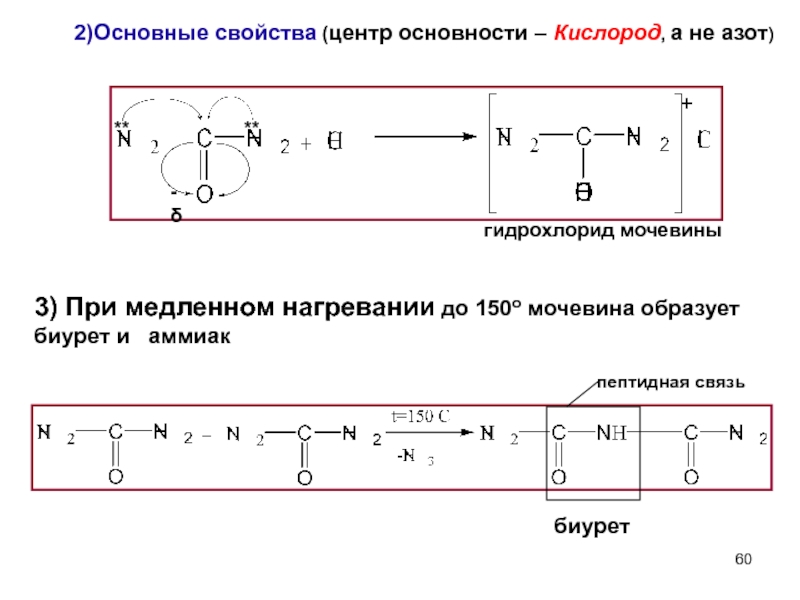
- 60. 2)Основные свойства (центр основности – Кислород, а
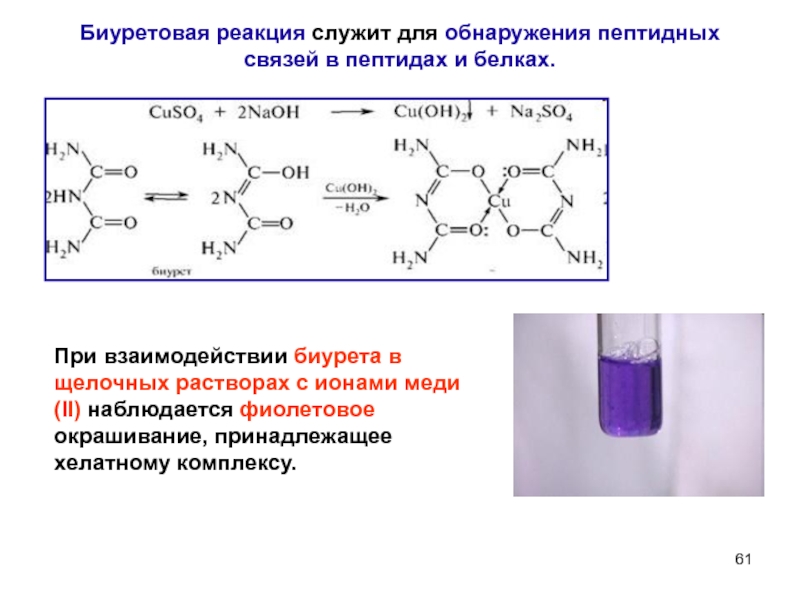
- 61. Биуретовая реакция служит для обнаружения пептидных связей
- 62. 5. Уреиды. Образование уреидов. уреид
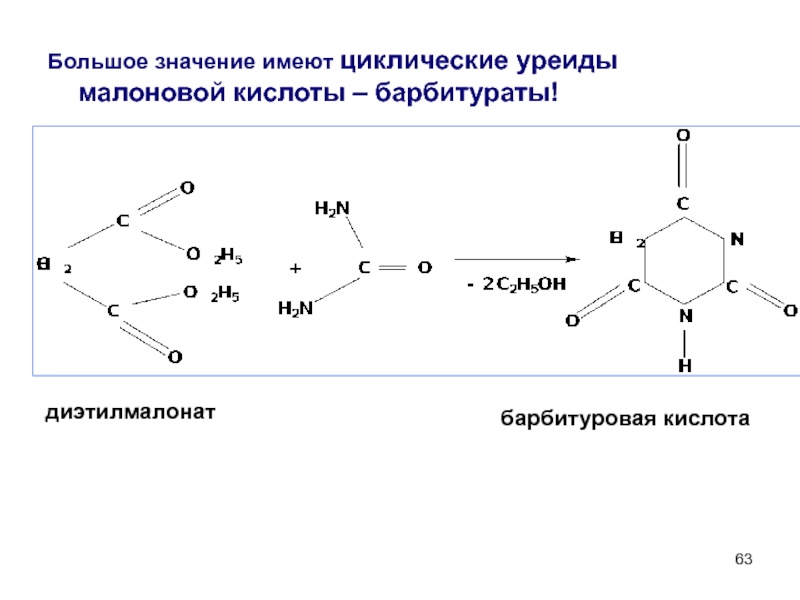
- 63. Большое значение имеют циклические уреиды малоновой кислоты
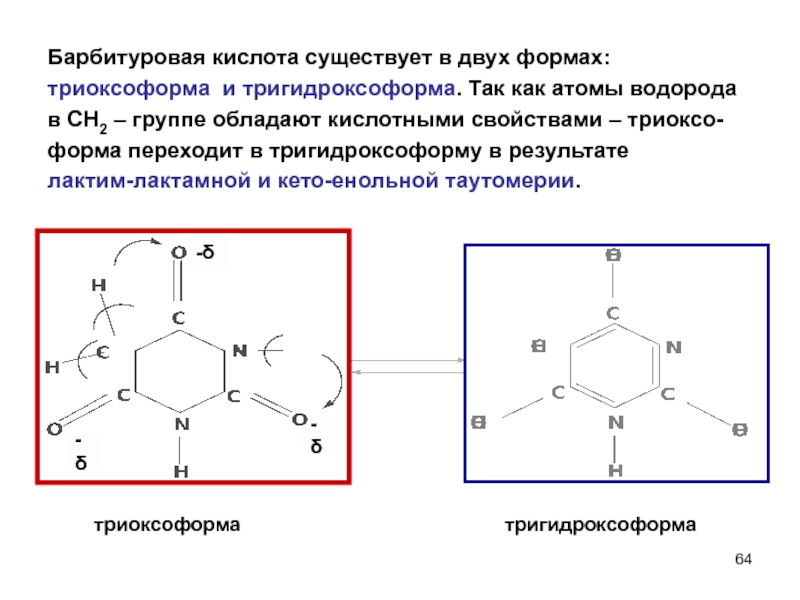
- 64. -δ -δ Барбитуровая кислота существует в двух
- 65. Лекарственные препараты (барбитураты)
- 66. Действие на организм Барбитуровая кислота не
- 67. Сон вызываемый барбитуратами отличается от естественного сна.
- 69. 6. ОБРАЗОВАНИЕ АНГИДРИДОВ (RCO)2O
- 70. ОБРАЗОВАНИЕ АНГИДРИДОВ (RCO)2O малеиновая кислота малеиновый ангидрид
- 71. III РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ Реакции декарбоксилирования характерны для
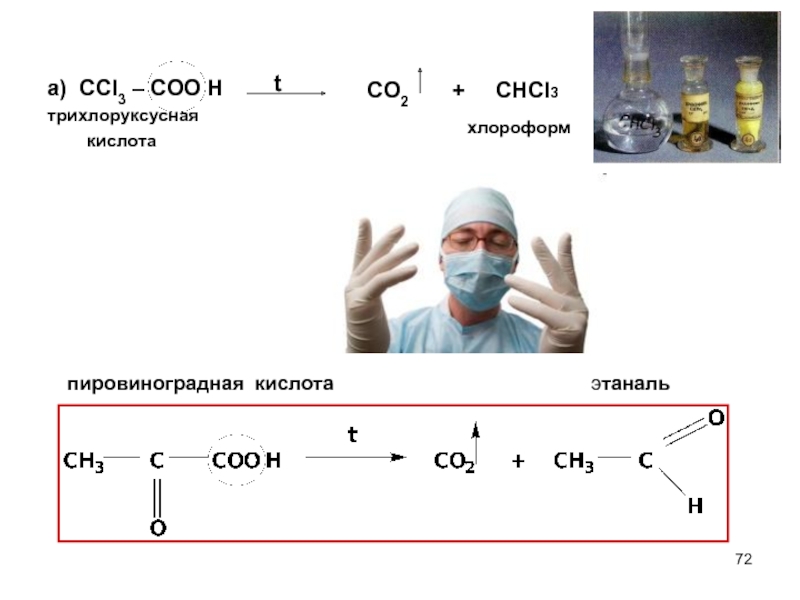
- 72. а) ССl3 – COO H трихлоруксусная
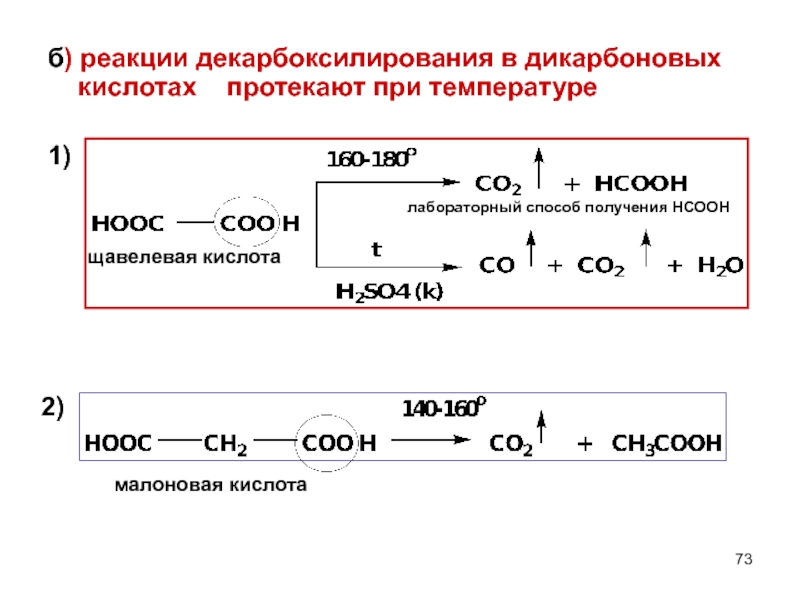
- 73. б) реакции декарбоксилирования в дикарбоновых кислотах
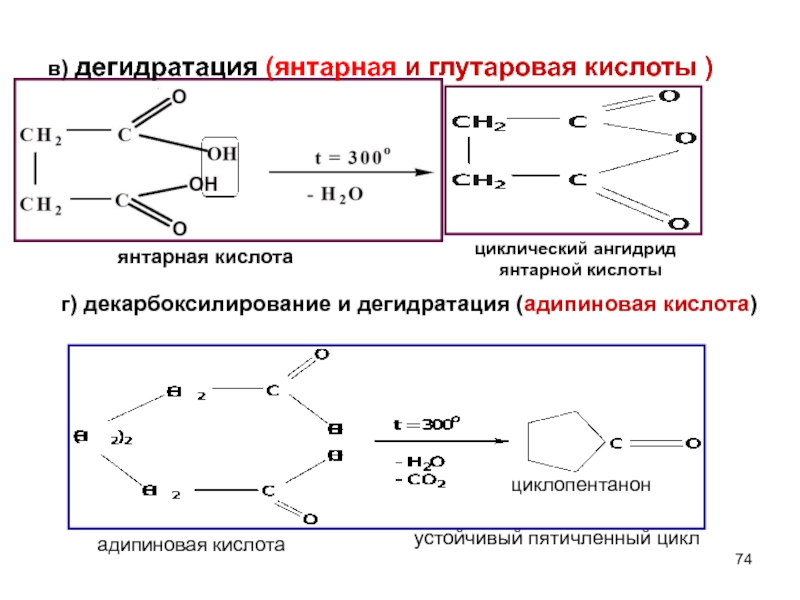
- 74. в) дегидратация (янтарная и глутаровая кислоты )
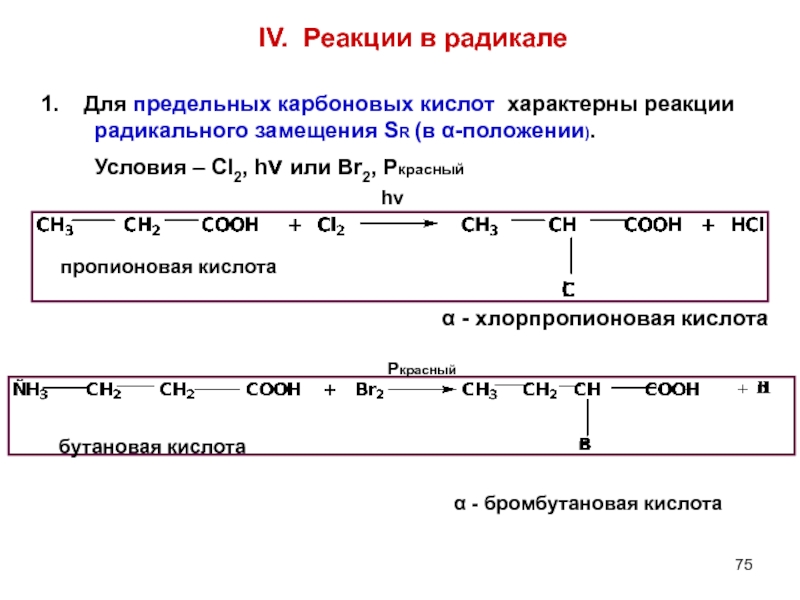
- 75. IV. Реакции в радикале 1. Для
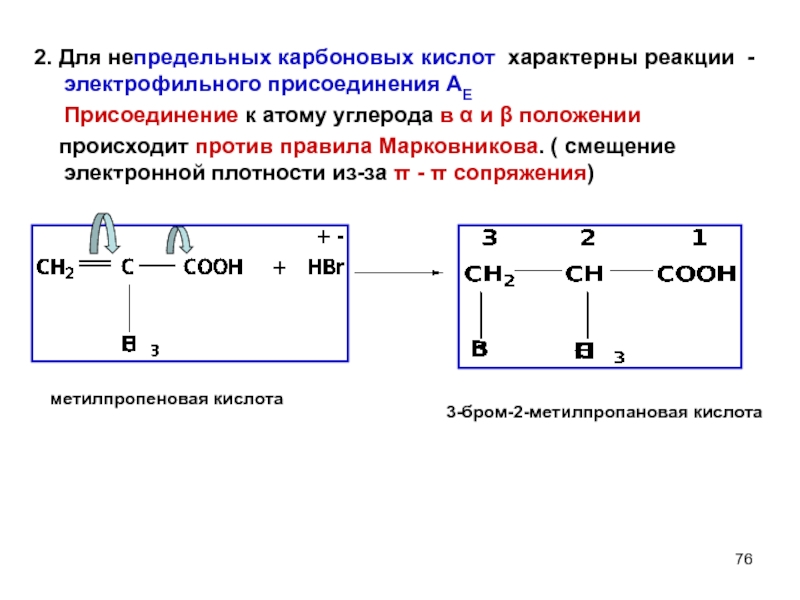
- 76. 2. Для непредельных карбоновых кислот характерны реакции
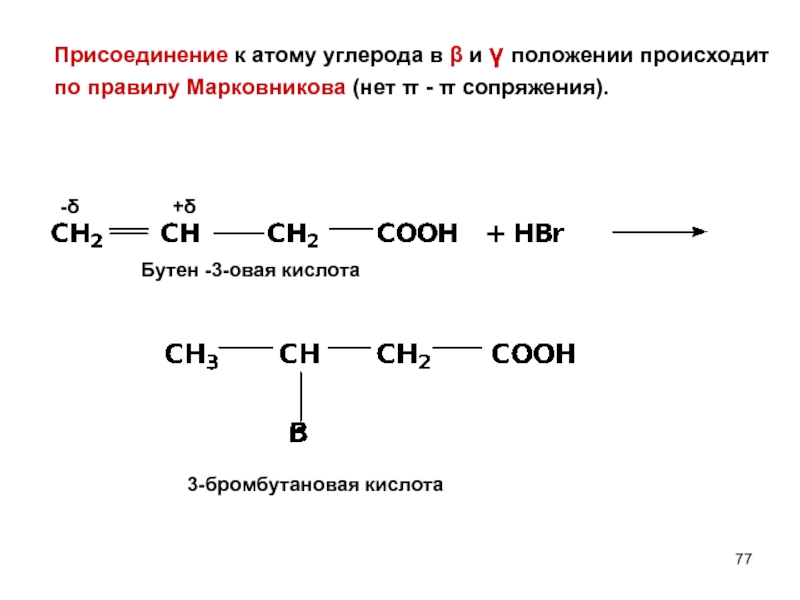
- 77. Присоединение к атому углерода в β и
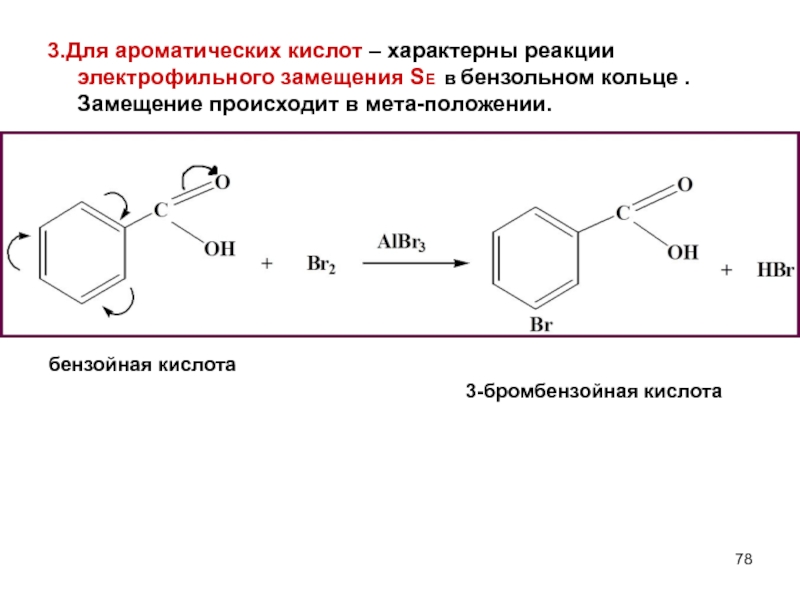
- 78. 3.Для ароматических кислот – характерны реакции электрофильного
- 79. Непредельные дикарбоновые кислоты
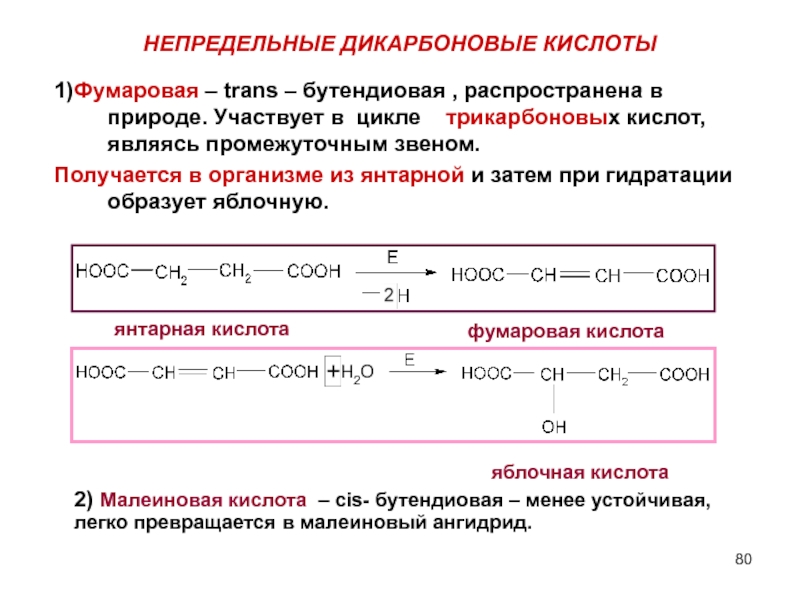
- 80. НЕПРЕДЕЛЬНЫЕ ДИКАРБОНОВЫЕ КИСЛОТЫ 1)Фумаровая – trans –
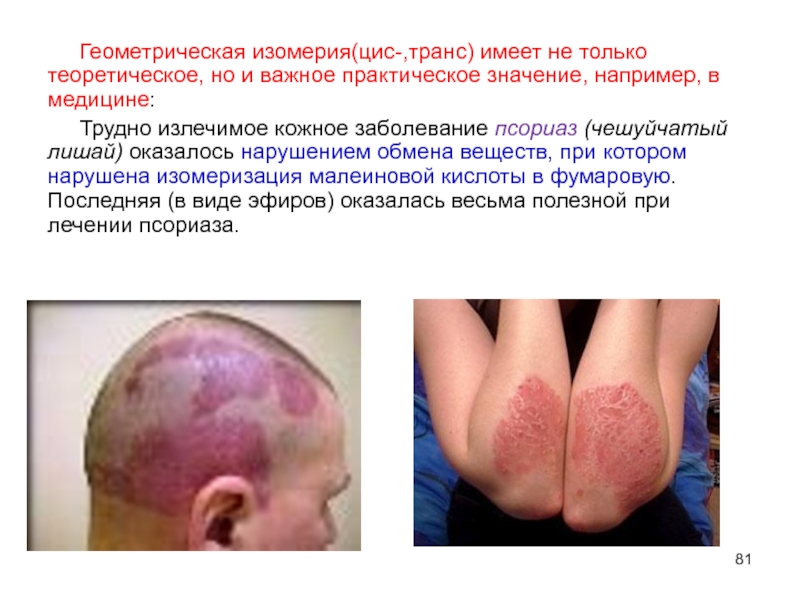
- 81. Геометрическая изомерия(цис-,транс) имеет не только теоретическое, но
- 82. Для анализа и идентификации
- 83. Высокоэффективная жидкостная хроматография является незаменимым методом при
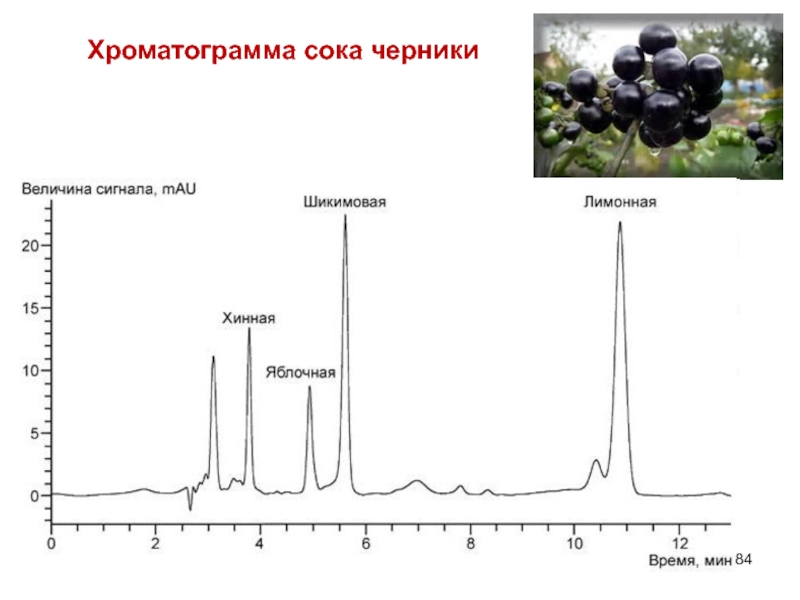
- 84. Хроматограмма сока черники
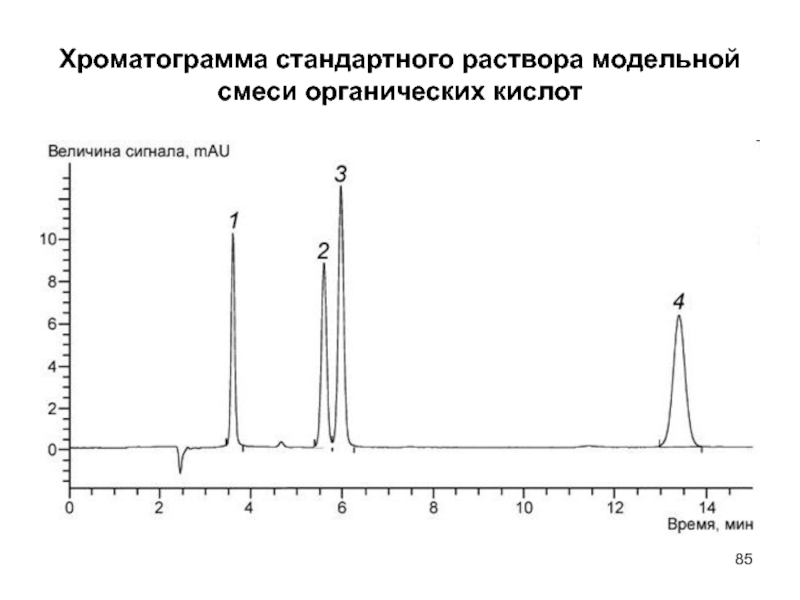
- 85. Хроматограмма стандартного раствора модельной смеси органических кислот
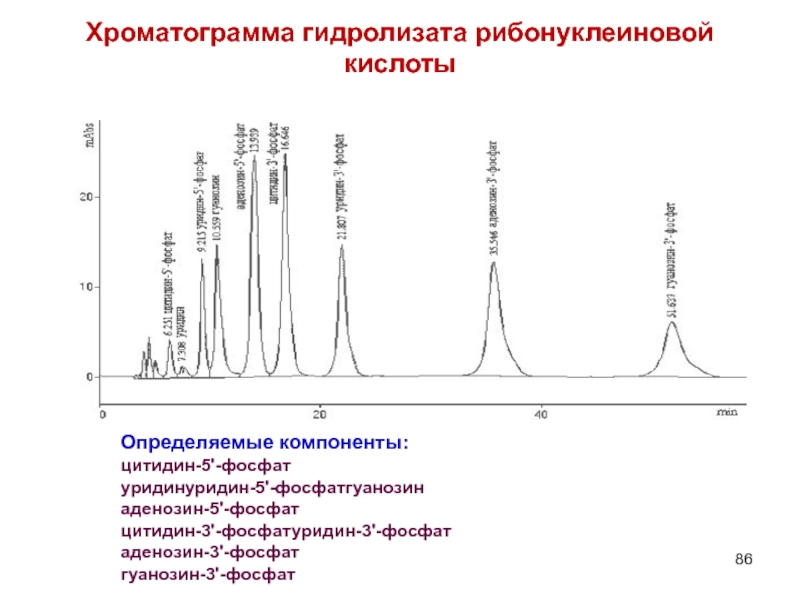
- 86. Хроматограмма гидролизата рибонуклеиновой кислоты Определяемые компоненты: цитидин-5'-фосфат уридинуридин-5'-фосфатгуанозин аденозин-5'-фосфат цитидин-3'-фосфатуридин-3'-фосфат аденозин-3'-фосфат гуанозин-3'-фосфат
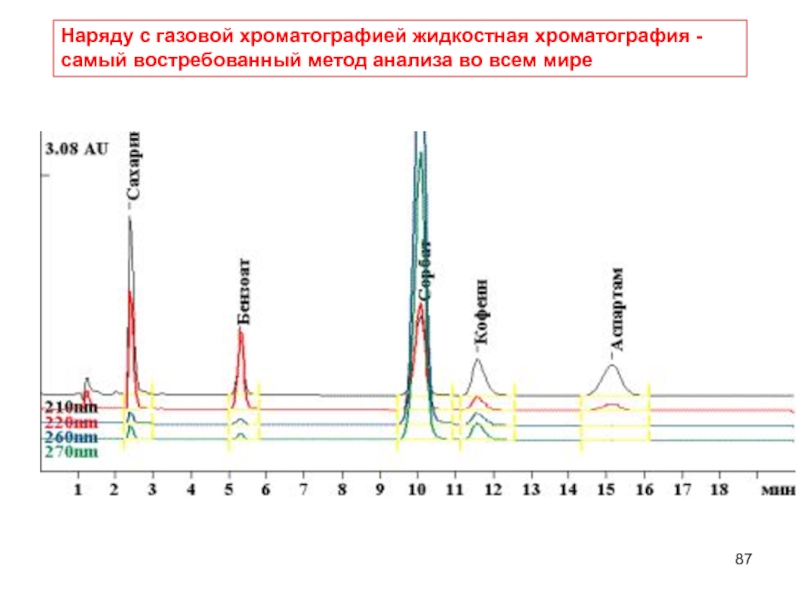
- 87. Наряду с газовой хроматографией жидкостная хроматография - самый востребованный метод анализа во всем мире
- 88. Жиры. Фосфолипиды Липиды –
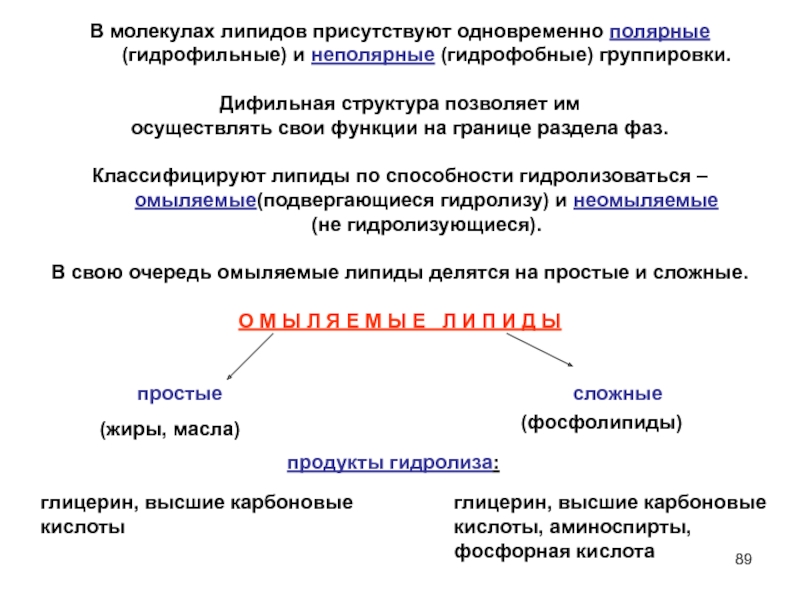
- 89. В молекулах липидов присутствуют одновременно полярные (гидрофильные)
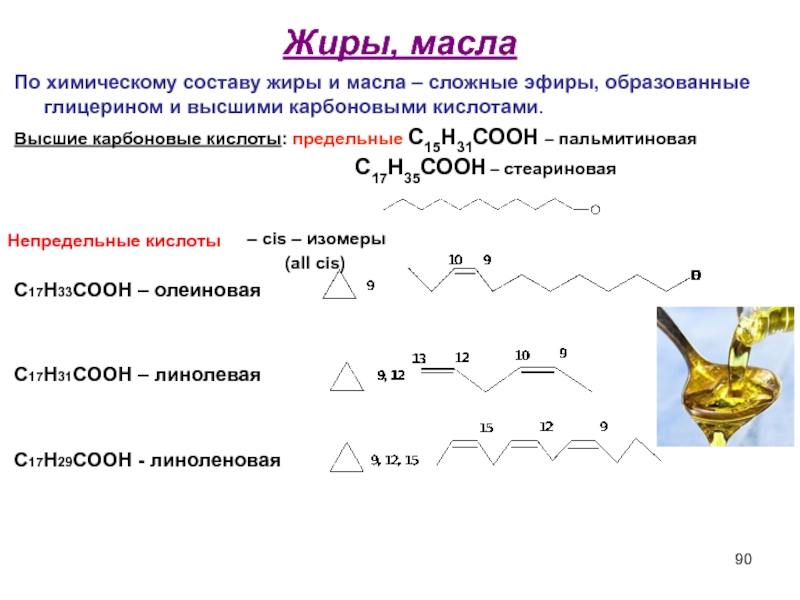
- 90. Жиры, масла По химическому составу жиры и
- 91. Значение жирных кислот липидов Особо следует подчеркнуть
- 94. ХИМИЧЕСКИЕ СВОЙСТВА ЖИРОВ Из химических свойств особенно
- 95. 1) Гидрирование или гидрогенизация - для получения твердых жиров из масел триолеилглицерин тристеароилглицерин
- 96. 2) Гидролиз имеет большое значение в технологических
- 97. ФОСФОЛИПИДЫ При гидролизе фосфолипидов кроме высших карбоновых
- 98. Коламин НО – СН2
- 99. Молекулярная модель фосфолипида. Молекулы фосфолипидов имеют полярную
- 100. Структура фосфатидилколаминов
- 101. Структура фосфатидилсеринов
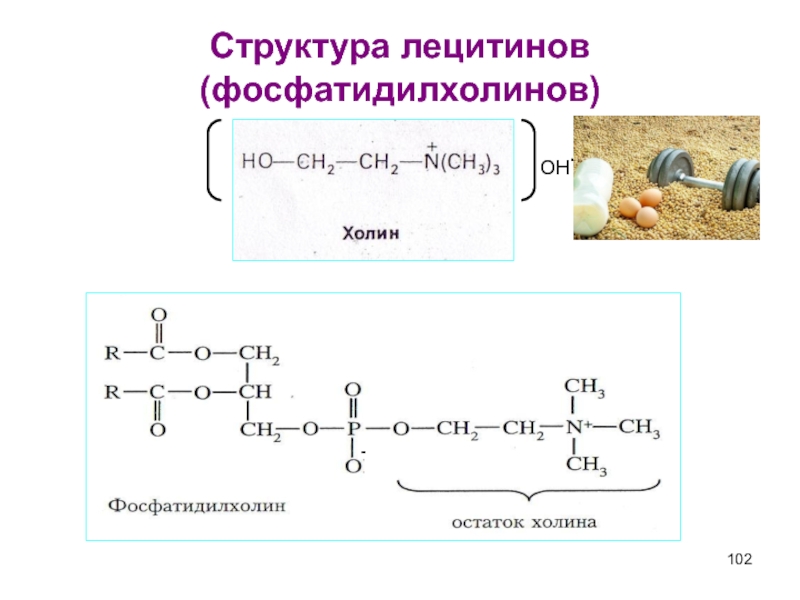
- 102. Структура лецитинов (фосфатидилхолинов) - OH-
- 103. Фосфатидилхолины Наиболее распространенные глицерофосфолипиды –
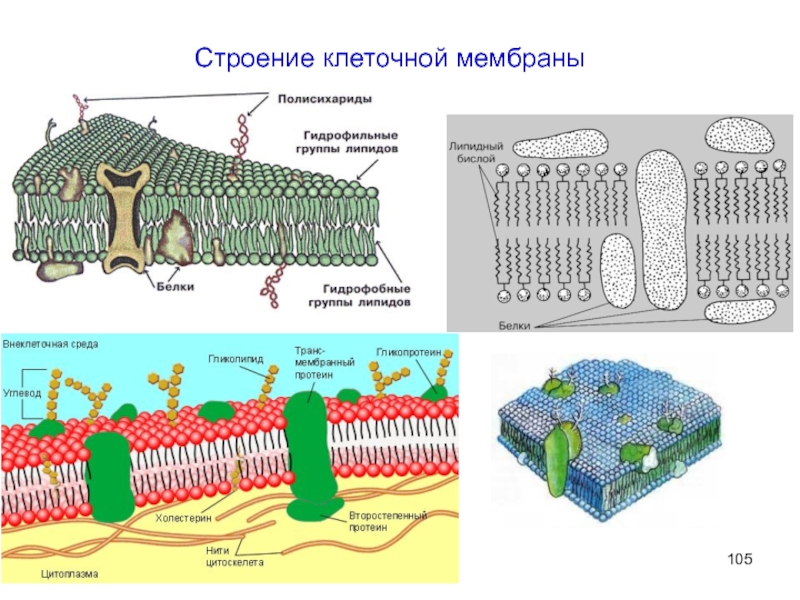
- 105. Строение клеточной мембраны
- 106. СПАСИБО ЗА ВНИМАНИЕ!
Слайд 1
Лекция 3-II
Карбоновые кислоты и их функциональные производные.
Хроматографические методы исследования
Кафедра общей
Слайд 2Карбоновые кислоты – органические соединения,содержащие
СООН- карбоксильную группу.
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА КАРБОНОВЫХ
классификация карбоновых кислот:
а) по строению углеводородного радикала:
предельные (уксусная, стеариновая)
непредельные (акриловая, олеиновая, линолевая)
ароматические (бензойная, фенилуксусная)
гетероциклические (никотиновая)
алициклические
б) по числу карбоксильных групп:
монокарбоновые (муравьиная)
дикарбоновые (щавелевая)
поликарбоновые (аконитовая)
Слайд 5Высшие предельные карбоновые кислоты
C15H31COOH CH3(CH2)14COOH
Тривиальная номенклатура - пальмитиновая ,
2. Систематическая заместительная номенклатура- ИЮПАК - гексадекановая
Слайд 6C17H35COOH CH3(CH2)16COOH
Тривиальная номенклатура -
стеариновая ,соли-стеараты, ацил-стеароил
2.
Высшие предельные карбоновые кислоты
Слайд 9Высшие непредельные монокарбоновые кислоты
С17Н33СООН – олеиновая,соли-олеаты, ацил -олеоил
С17Н31СООН
(две двойные связи у 9,12 атомов С,
(Двойная связь у 9 атома С,
цис-кислота)
цис-кислота)
Слайд 10Высшие непредельные монокарбоновые кислоты
С17Н29СООН – линоленовая (три двойные связи у 9,12,15
цис-кислота)
Слайд 13Ароматические дикарбоновые кислоты
о-фталевая кислота
1,2-бензолдикарбоновая
м-фталевая кислота
1,3-бензолдикарбоновая
п-фталевая кислота
1,4--бензолдикарбоновая
Слайд 17Большинство химических реакций карбоновых кислот можно разделить на 4 типа:
Реакции, связанные
Реакции SN – образование сложных эфиров, амидов, ангидридов и т.д .- функциональных
производных карбоновых кислот
Реакции декарбоксилирования (потеря СО2)
IV. Реакции с участием R (особенно по α-С атому)
Слайд 18ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ
карбоксилат - ион
-
Кислотные свойства
Карбоновые кислоты- слабые электролиты, но обладают более высокой кислотностью, чем спирты и фенолы
Причина болеее высокой кислотности-образование стабильного карбоксилат-иона: связи и заряды в нем выравнены.
Слайд 19Кислотные свойства карбоновых кислот.
В монокарбоновых кислотах на кислотность влияют заместители
Слайд 20
- I эффект
трихлоруксусная кислота
рК = 0,66
>
+ I эффект
уксусная кислота
рК = 4,75
>
+ I эффект
триметилуксусная кислота
рК = 5,03
ЭА
ЭД
Слайд 212. Ароматические кислоты обладают большими кислотными свойствами, чем алифатические из-за участия
бензоат - ион
рК= 4,17
Слайд 223.Дикарбоновые (двухосновные) кислоты более сильные, чем монокарбоновые из-за влияния второй СООН
щавелевая кислота, этандиовая
2-ая СООН группа обладает –I эффектом, увеличивает кислотность Н в 1-ой СООН ,по сравнению с CH3COOH
рК= 1,27 (рКCH3COOH=4,75)
Слайд 23Щавелевая кислота
Щавелевая кислота накапливается, когда листья стареют, в молодых листьях ее
Оксалатные камни в почках
Щавелевая кислота и ее соли токсичны
Слайд 24
малоновая кислота,пропандиовая
рК=2,86 кислотность меньше,чем у щавелевой кислоты ,так как 2СООН группы
Малоновая кислота участвует в синтезе барбитуратов
HOOC – (CH2)2 –COOH янтарная кислота рК=4,21
Чем дальше СООН – группы друг от друга, тем меньше их взаимное влияние.
HOOC – CH2 –COOH
Слайд 25Янтарная кислота оказывает мощное оздоровительное действие
на организм
Используется против старения кожи
Получается
Содержится в небольших количествах- в сыре, кисломолочных продуктах и морепродуктах
Слайд 27Ледяная уксусная кислота (концентрация близка к 100%)
Действие уксусной кислоты на биологические
Безводная СН3СООН при 15 С переходит в кристаллическое состояние,похожее на лед
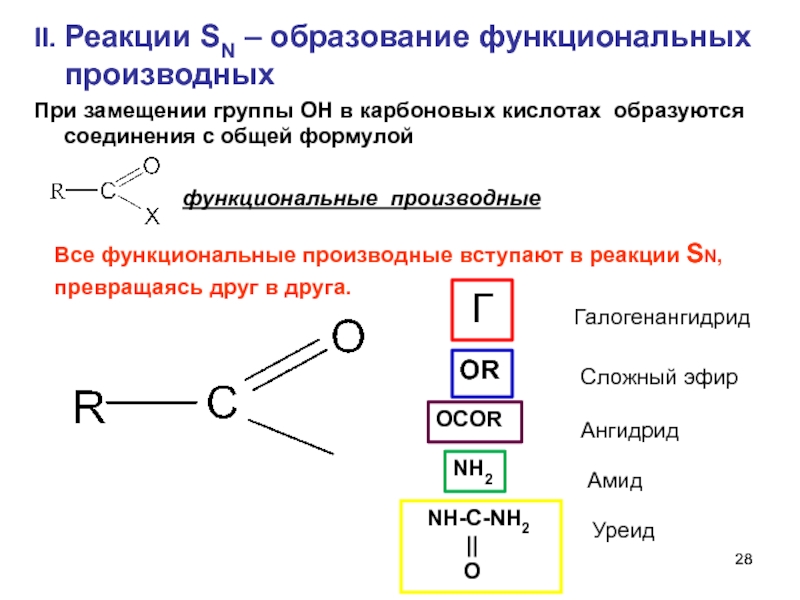
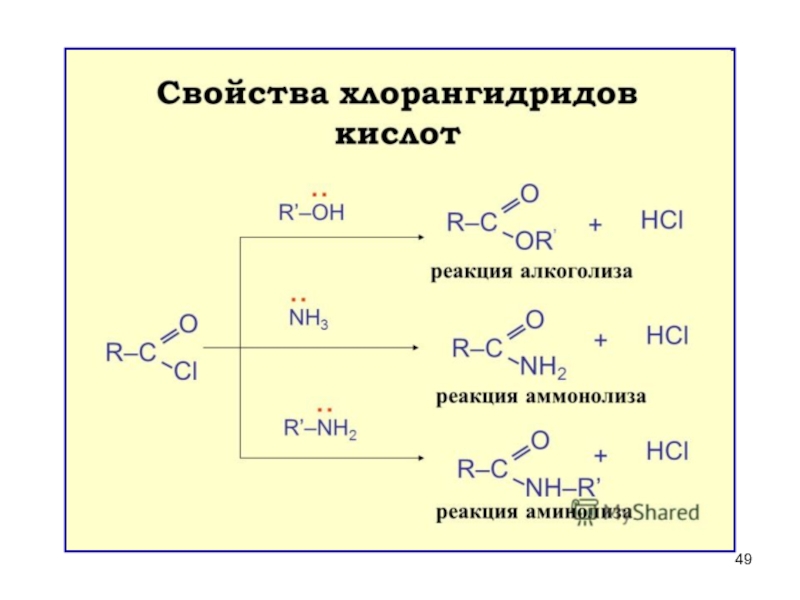
Слайд 28II. Реакции SN – образование функциональных производных
При замещении группы ОН в
функциональные производные
Все функциональные производные вступают в реакции SN,
превращаясь друг в друга.
Г
Галогенангидрид
OR
Сложный эфир
OCOR
Ангидрид
NH2
Амид
NH-C-NH2
||
O
Уреид
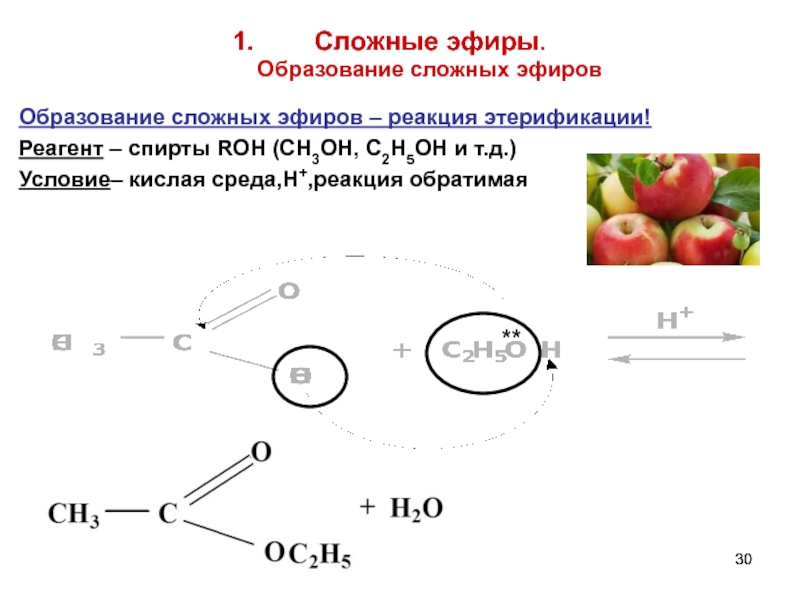
Слайд 30
Сложные эфиры.
Образование сложных эфиров
Образование сложных эфиров – реакция этерификации!
Реагент –
Условие– кислая среда,Н+,реакция обратимая
**
Слайд 32Гидролиз в кислой среде протекает обратимо,
в щелочной- необратимо.Причина необратимого гидролиза-
в образовании
CH3COOH + C2H5OH
Слайд 34Механизм щелочного гидролиза
Причина необратимости гидролиза в щелочной среде
- образование стабильного карбоксилат
Слайд 35СЛОЖНЫЕ ЭФИРЫ в природе и нашей жизни
Распространены в живой
пентилацетат – банановый
этилбутират – абрикосовый
бензилацетат – жасминовый
этилбутаноат- ананасовый
Слайд 36Когда число атомов С в исходных карбоновой кислоте и спирте не
Бутилацетат-
грушевый аромат
Метилбутират-яблочный
Этилизовалерат-малиновый
Слайд 37
Если в образовании сложного эфира участвует ароматический спирт (содержащий ароматическое ядро),
Бензилацетат-жасминовый
Некоторые из них вначале были выделены
из растений, а позже синтезированы
искусственно.
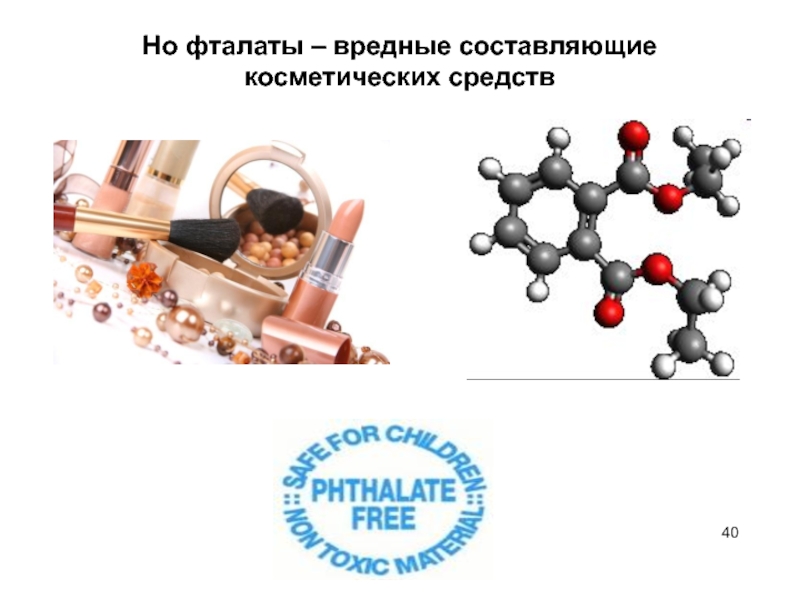
Слайд 39Диметилфталаты - сложные эфиры о-фталевой кислоты.
спасают от клеща
спасают от комаров (репелленты)
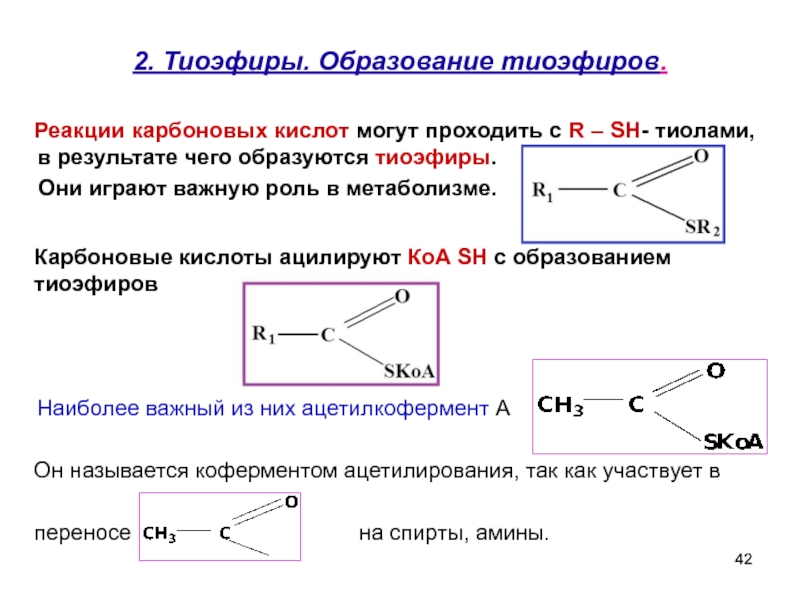
Слайд 422. Тиоэфиры. Образование тиоэфиров.
Реакции карбоновых кислот могут проходить с
Они играют важную роль в метаболизме.
Он называется коферментом ацетилирования, так как участвует в
переносе на спирты, амины.
Наиболее важный из них ацетилкофермент А
Карбоновые кислоты ацилируют КоА SH с образованием тиоэфиров
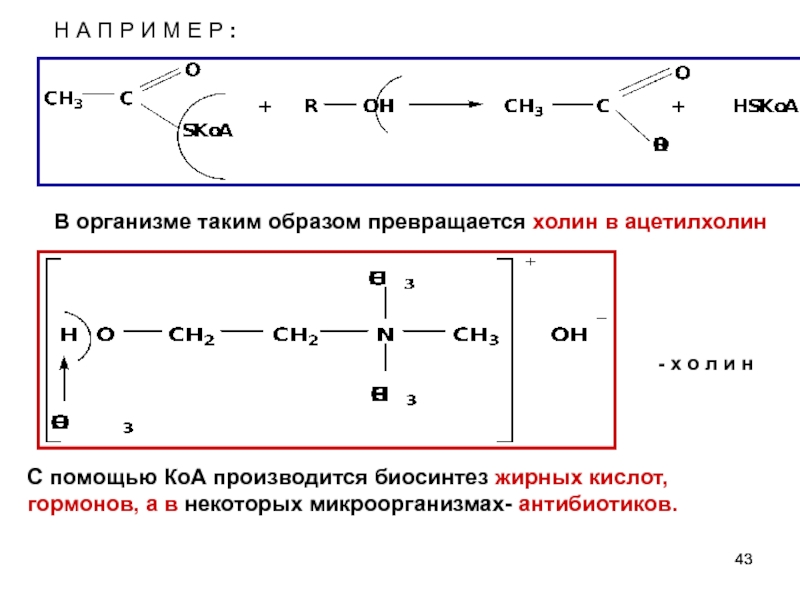
Слайд 43Н А П Р И М Е Р :
- х
С помощью КоА производится биосинтез жирных кислот, гормонов, а в некоторых микроорганизмах- антибиотиков.
В организме таким образом превращается холин в ацетилхолин
Слайд 443. Галогенангидриды.
Образование галогенангидридов.
пропионилхлорид
Х - галоген
Получаются при действии на карбоновые кислоты
HCI c карбоновыми кислотами не взаимодействует!
Слайд 45Хлорангидриды или ацилхлориды простых карбоновых кислот – жидкости, часто лакриматоры (вызывают
Хлорангидрид уксусной кислоты
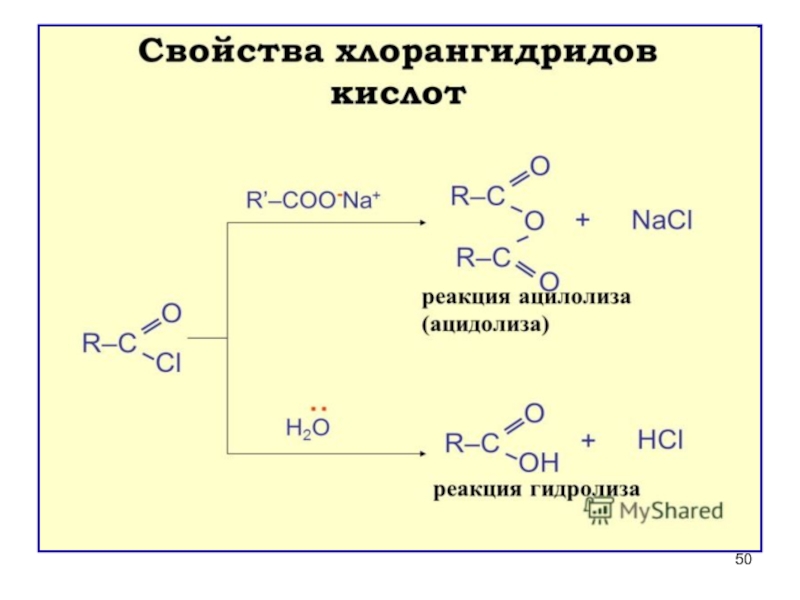
Слайд 46Свойства и значение галогенангидридов
ГИДРОЛИЗ (необратим) – энергично взаимодействуют с водой (это
Ацилхлориды проявляют лакриматорные свойства из-за гидролиза до HCI и карбоновой кислоты,который происходит на слизистых оболочках глаз и дыхательных путей
Слайд 47Участие в реакциях ацилирования (введение RCO)
а) в
б) в амины и аминокислоты для защиты NH2
ацетанилид
Амин превратился в амид и потерял
свои основные свойства
Галогенангидриды обладают самой большой ацилирующей
способностью среди функциональных производных
карбоновых кислот!
Слайд 48Ряд по убыванию ацилирующей способности
(по реакционной способности в реакциях SN)
>
>
>
>
Максимальная
Минимальная ацилирующая способность
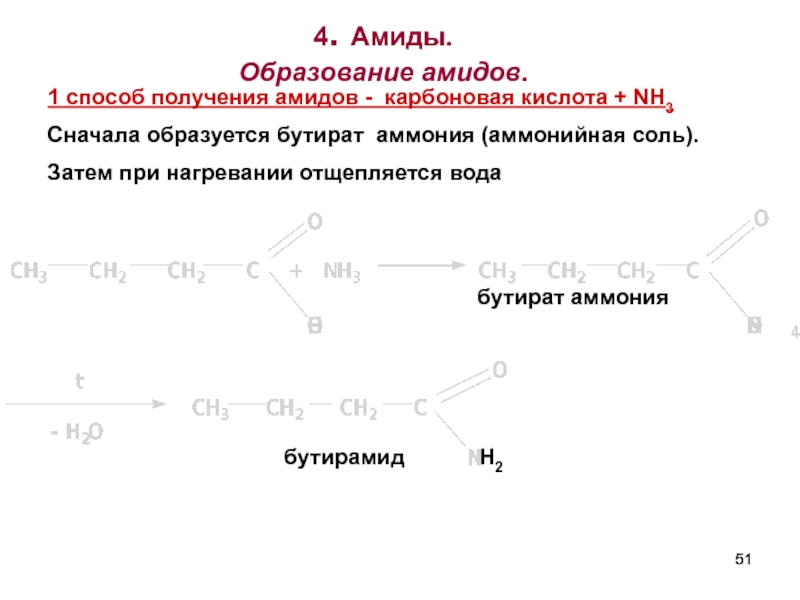
Слайд 514. Амиды.
Образование амидов.
бутират аммония
бутирамид
1 споcоб получения амидов - карбоновая кислота
Сначала образуется бутират аммония (аммонийная соль).
Затем при нагревании отщепляется вода
Н2
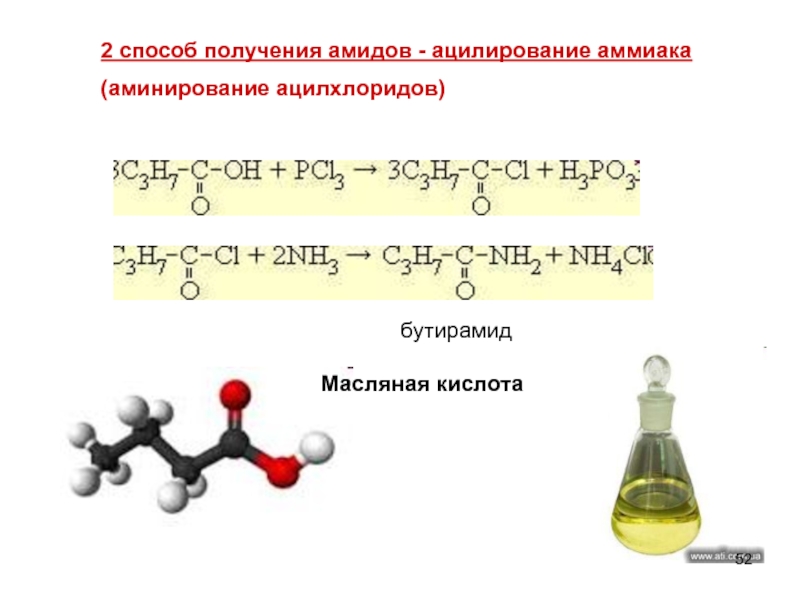
Слайд 522 способ получения амидов - ацилирование аммиака
(аминирование ацилхлоридов)
Масляная кислота
бутирамид
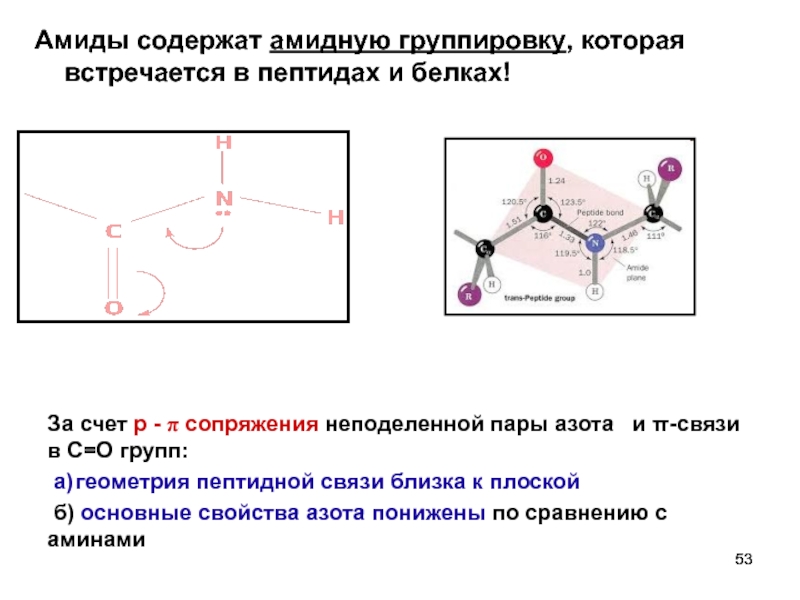
Слайд 53Амиды содержат амидную группировку, которая встречается в пептидах и белках!
За счет
а) геометрия пептидной связи близка к плоской
б) основные свойства азота понижены по сравнению с аминами
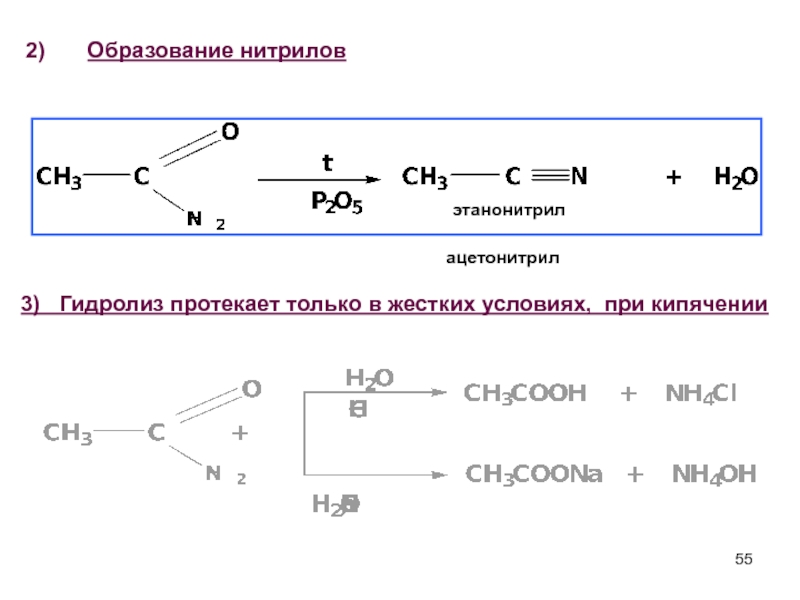
Слайд 55Образование нитрилов
этанонитрил
ацетонитрил
3) Гидролиз протекает только в жестких условиях,
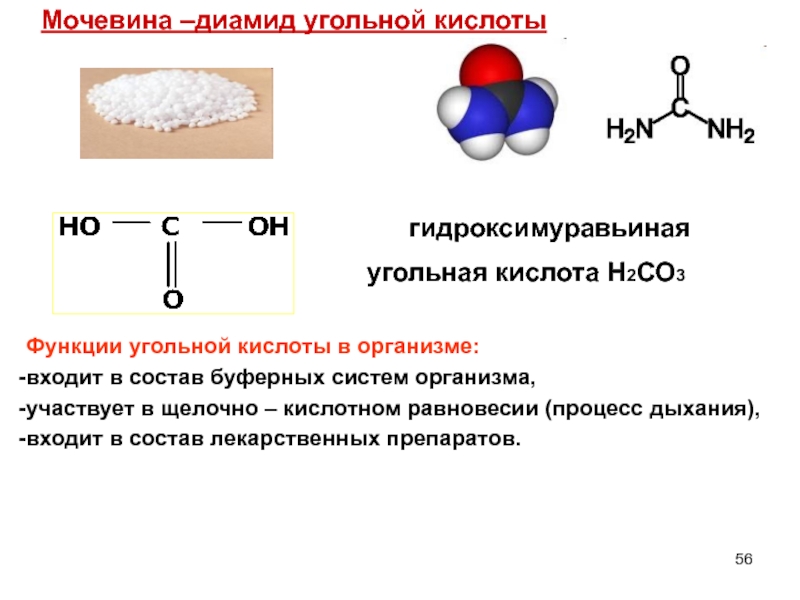
Слайд 56Мочевина –диамид угольной кислоты
Функции угольной кислоты в организме:
входит в состав буферных систем организма,
участвует в щелочно – кислотном равновесии (процесс дыхания),
входит в состав лекарственных препаратов.
гидроксимуравьиная
угольная кислота Н2СО3
Слайд 58Уретаны – эфиры карбаминовой кислоты. Оказывают психотропное
действие.
этилуретан
мепротан
Некоторые из них оказывают снотворное действие, применяются при
нервно-психических заболеваниях, используются как транквилизаторы.
Слайд 59Свойства мочевины
Гидролиз мочевины
а) ферментативно протекает в живом организме-
б)кислотный или щелочной( Н+, ОН-, t) - in vitro
уреаза
Фридрих Вёлер - автор первого в истории химии органического синтеза
2
Слайд 602)Основные свойства (центр основности – Кислород, а не азот)
гидрохлорид
пептидная связь
биурет
**
**
-δ
3) При медленном нагревании до 150о мочевина образует биурет и аммиак
+
Слайд 61Биуретовая реакция служит для обнаружения пептидных связей в пептидах и белках.
При
Слайд 625. Уреиды.
Образование уреидов.
уреид α - бромизовалерьяновой кислоты
Важными производными карбоновых кислот,
Некоторые уреиды кислот, замещенных в α-положении на галоген, применяются как снотворные средства: уреид α-бромизовалериановой кислоты, или бромурал (т. пл. 154).
Слайд 63Большое значение имеют циклические уреиды малоновой кислоты – барбитураты!
диэтилмалонат
барбитуровая кислота
Слайд 64-δ
-δ
Барбитуровая кислота существует в двух формах:
триоксоформа и тригидроксоформа. Так как атомы
в СН2 – группе обладают кислотными свойствами – триоксо-
форма переходит в тригидроксоформу в результате
лактим-лактамной и кето-енольной таутомерии.
-δ
триоксоформа
тригидроксоформа
Слайд 66Действие на организм
Барбитуровая кислота не оказывает ни снотворного ни наркотического действия;
Барбитураты оказывают тормозящие влияние на ЦНС и используются в медицине в качестве успокаивающих средств, снотворных, противосудорожных средств( бензонал, бензобамил) и средств для наркоза( гексенал, тиопенталнатрий)
Слайд 67Сон вызываемый барбитуратами отличается от естественного сна. Они облегчают засыпание, но
В механизме действия барбитуратов играет роль их влияние на метаболические процессы мозга и на синоптическую передачу нервных импульсов, оказывают стимулирующие влияние на систему тормозного медиатора – ГАМК (гамма-аминомаслянной кислоты).
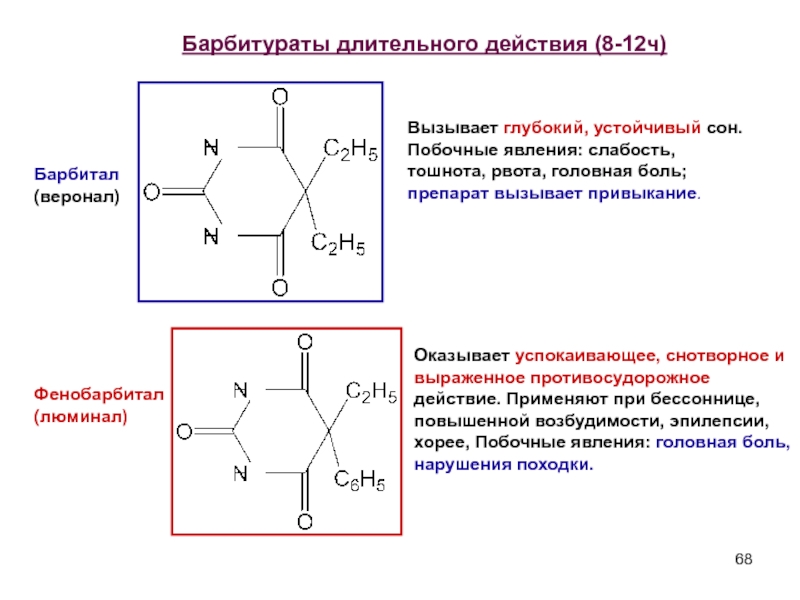
Слайд 68
Барбитал (веронал)
Фенобарбитал (люминал)
Вызывает глубокий, устойчивый сон. Побочные явления: слабость, тошнота, рвота, головная боль; препарат вызывает привыкание.
Оказывает успокаивающее, снотворное и выраженное противосудорожное действие. Применяют при бессоннице, повышенной возбудимости, эпилепсии, хорее, Побочные явления: головная боль, нарушения походки.
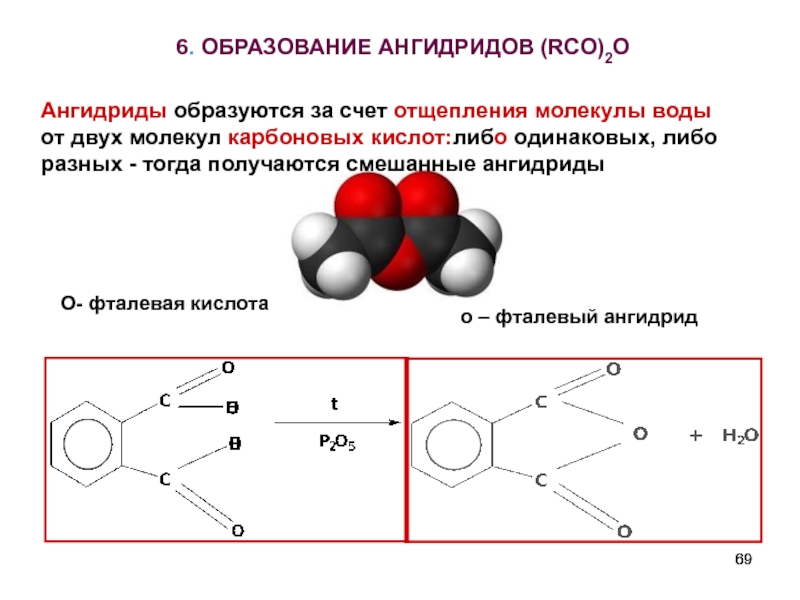
Слайд 696. ОБРАЗОВАНИЕ АНГИДРИДОВ (RCO)2O
О- фталевая кислота
о – фталевый ангидрид
Ангидриды образуются за
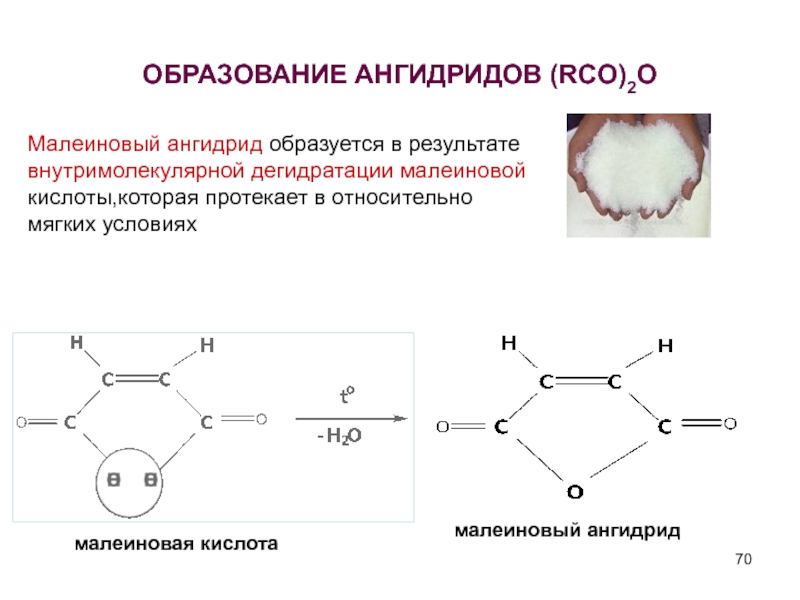
Слайд 70ОБРАЗОВАНИЕ АНГИДРИДОВ (RCO)2O
малеиновая кислота
малеиновый ангидрид
Малеиновый ангидрид образуется в результате внутримолекулярной дегидратации
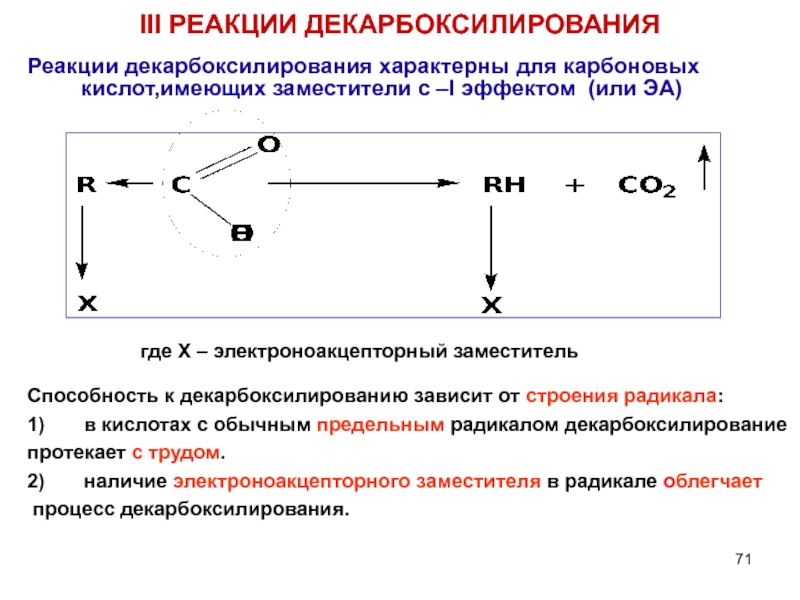
Слайд 71III РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ
Реакции декарбоксилирования характерны для карбоновых кислот,имеющих заместители с –I
где Х – электроноакцепторный заместитель
Способность к декарбоксилированию зависит от строения радикала:
1) в кислотах с обычным предельным радикалом декарбоксилирование
протекает с трудом.
2) наличие электроноакцепторного заместителя в радикале облегчает
процесс декарбоксилирования.
Слайд 73б) реакции декарбоксилирования в дикарбоновых кислотах протекают при температуре
1)
щавелевая кислота
малоновая кислота
лабораторный способ получения НСООН
2)
Слайд 74в) дегидратация (янтарная и глутаровая кислоты )
циклический ангидрид
янтарной кислоты
адипиновая кислота
циклопентанон
устойчивый пятичленный цикл
г) декарбоксилирование и дегидратация (адипиновая кислота)
Слайд 75IV. Реакции в радикале
1. Для предельных карбоновых кислот характерны реакции
Условия – Cl2, hν или Br2, Pкрасный
hν
Pкрасный
пропионовая кислота
бутановая кислота
α - хлорпропионовая кислота
α - бромбутановая кислота
Слайд 762. Для непредельных карбоновых кислот характерны реакции - электрофильного присоединения АЕ
происходит против правила Марковникова. ( смещение электронной плотности из-за π - π сопряжения)
+δ
-δ
3-бром-2-метилпропановая кислота
метилпропеновая кислота
Слайд 77Присоединение к атому углерода в β и γ положении происходит
по правилу
-δ
+δ
Бутен -3-овая кислота
3-бромбутановая кислота
Слайд 783.Для ароматических кислот – характерны реакции электрофильного замещения SE в бензольном
бензойная кислота
3-бромбензойная кислота
Слайд 80НЕПРЕДЕЛЬНЫЕ ДИКАРБОНОВЫЕ КИСЛОТЫ
1)Фумаровая – trans – бутендиовая , распространена в природе.
Получается в организме из янтарной и затем при гидратации образует яблочную.
Н2О
янтарная кислота
фумаровая кислота
яблочная кислота
2) Малеиновая кислота – cis- бутендиовая – менее устойчивая, легко превращается в малеиновый ангидрид.
Слайд 81Геометрическая изомерия(цис-,транс) имеет не только теоретическое, но и важное практическое значение,
Трудно излечимое кожное заболевание псориаз (чешуйчатый лишай) оказалось нарушением обмена веществ, при котором нарушена изомеризация малеиновой кислоты в фумаровую. Последняя (в виде эфиров) оказалась весьма полезной при лечении псориаза.
Слайд 82 Для анализа и идентификации карбоновых кислот и их
Электронной спектроскопии.
ИК-спектроскопии
Спектроскопия ЯМР
Хроматография
Хроматографические методы исследования
Хроматограф газовый входит в состав
лабораторного комплекса и осуществляет
хроматографический анализ сложных
веществ.
Хроматографические методы исследования
Слайд 83Высокоэффективная жидкостная хроматография является незаменимым методом при проведении исследований в различных
Жидкостную хроматографию можно использовать для разделения веществ, которые растворимы в каком-либо растворителе, таких как нуклеотиды, нуклеозиды, антибиотики, витамины, пищевые добавки, косметические средства, лекарственные препараты, гигиенические средства, продукты органического синтеза, пестициды, биологические жидкости и т.д.
Слайд 86Хроматограмма гидролизата рибонуклеиновой кислоты
Определяемые компоненты:
цитидин-5'-фосфат
уридинуридин-5'-фосфатгуанозин
аденозин-5'-фосфат
цитидин-3'-фосфатуридин-3'-фосфат
аденозин-3'-фосфат
гуанозин-3'-фосфат
Слайд 87
Наряду с газовой хроматографией жидкостная хроматография - самый востребованный метод анализа
Слайд 88Жиры. Фосфолипиды
Липиды – большая и довольно разнообразная группа
- Липиды – структурные компоненты клеточных мембран
- Выполняют защитную функцию
- В форме липидов транспортируется и запасается энергетическое топливо
Слайд 89В молекулах липидов присутствуют одновременно полярные (гидрофильные) и неполярные (гидрофобные) группировки.
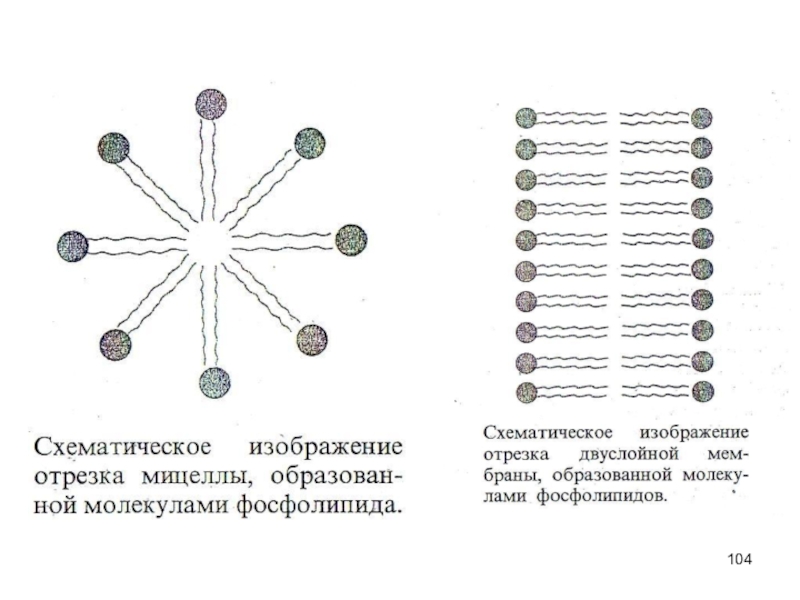
Дифильная структура позволяет им
осуществлять свои функции на границе раздела фаз.
Классифицируют липиды по способности гидролизоваться – омыляемые(подвергающиеся гидролизу) и неомыляемые (не гидролизующиеся).
В свою очередь омыляемые липиды делятся на простые и сложные.
О М Ы Л Я Е М Ы Е Л И П И Д Ы
простые сложные
(жиры, масла)
(фосфолипиды)
продукты гидролиза:
глицерин, высшие карбоновые
кислоты
глицерин, высшие карбоновые кислоты, аминоспирты,
фосфорная кислота
Слайд 90Жиры, масла
По химическому составу жиры и масла – сложные эфиры, образованные
Высшие карбоновые кислоты: предельные С15Н31СООН – пальмитиновая
С17Н35СООН – стеариновая
– cis – изомеры
(all cis)
С17Н33СООН – олеиновая
С17Н31СООН – линолевая
С17Н29СООН - линоленовая
Непредельные кислоты
Слайд 91Значение жирных кислот липидов
Особо следует подчеркнуть роль полиненасыщенных линолевой и линоленовой
Эти кислоты содержатся в основном в растительных маслах. Они способствуют снижению содержания в крови холестерина – одного из факторов развития атеросклероза, для профилактики и лечения которого применяется линетол – смесь этиловых эфиров высших жирных непредельных кислот льняного масла.
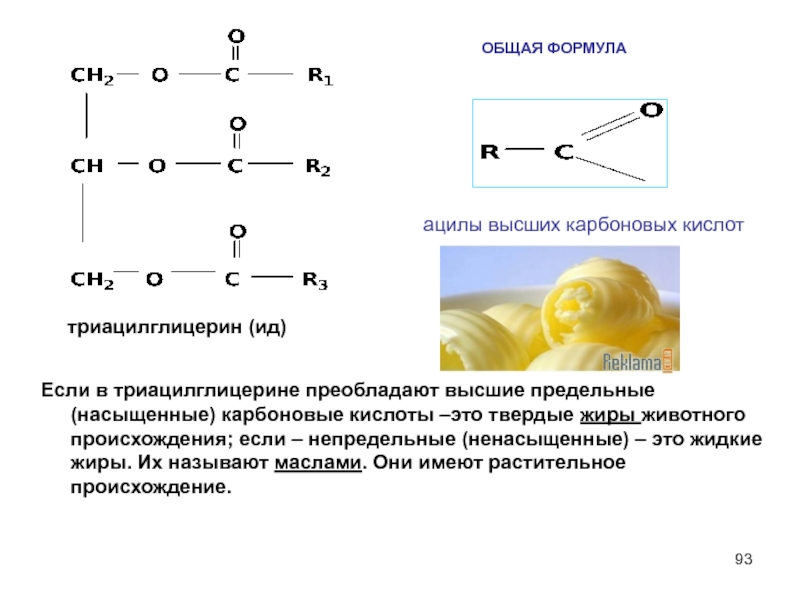
Слайд 93
Если в триацилглицерине преобладают высшие предельные (насыщенные) карбоновые кислоты –это твердые жиры животного происхождения; если – непредельные (ненасыщенные) – это жидкие жиры. Их называют маслами. Они имеют растительное происхождение.
триацилглицерин (ид)
ацилы высших карбоновых кислот
Слайд 94ХИМИЧЕСКИЕ СВОЙСТВА ЖИРОВ
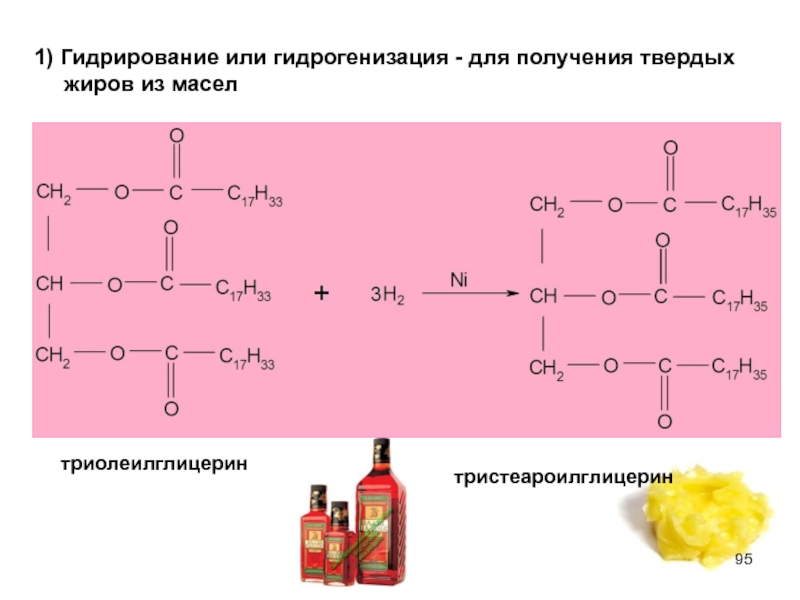
Из химических свойств особенно интересны гидрирование (присоединение) по двойной
Гидрирование или гидрогенизация для получения твердых жиров из масел
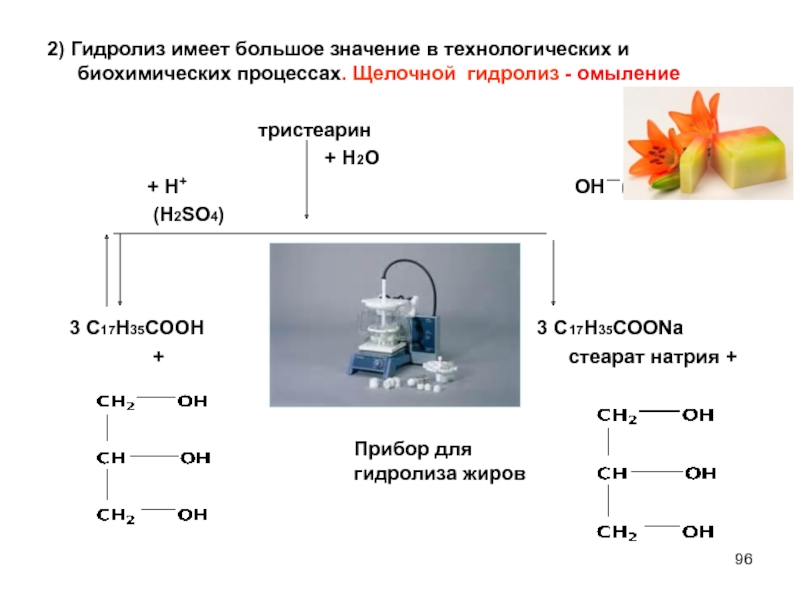
2) Гидролиз имеет большое значение в технологических и биохимических процессах
При гидролизе фосфолипидов получается больше веществ, чем при гидролизе жиров: кроме высших карбоновых кислот и глицерина, образуются Н3РО4 и аминоспирты, то есть 4 типа разных веществ.
Слайд 951) Гидрирование или гидрогенизация - для получения твердых жиров из масел
триолеилглицерин
тристеароилглицерин
Слайд 962) Гидролиз имеет большое значение в технологических и биохимических процессах. Щелочной
тристеарин
+ Н2О
+ Н+ ОН (NaOH)
(H2SO4)
3 С17Н35СООН 3 С17Н35СООNa
+ стеарат натрия +
Прибор для гидролиза жиров
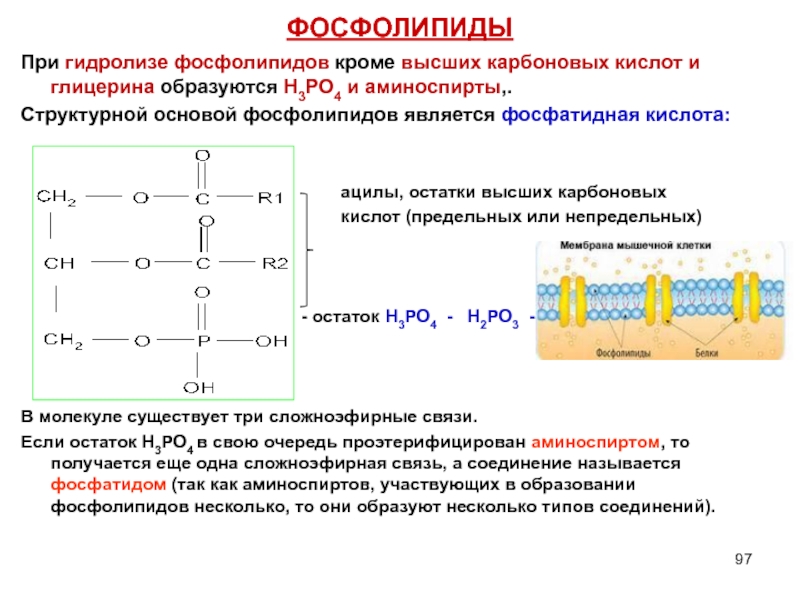
Слайд 97ФОСФОЛИПИДЫ
При гидролизе фосфолипидов кроме высших карбоновых кислот и глицерина образуются Н3РО4
Структурной основой фосфолипидов является фосфатидная кислота:
ацилы, остатки высших карбоновых
кислот (предельных или непредельных)
- остаток Н3РО4 - Н2РО3 -
В молекуле существует три сложноэфирные связи.
Если остаток Н3РО4 в свою очередь проэтерифицирован аминоспиртом, то получается еще одна сложноэфирная связь, а соединение называется фосфатидом (так как аминоспиртов, участвующих в образовании фосфолипидов несколько, то они образуют несколько типов соединений).
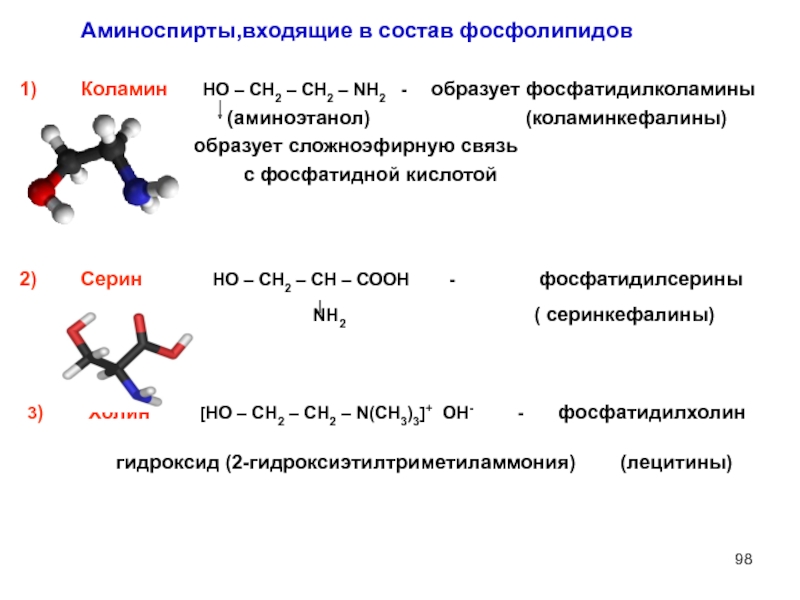
Слайд 98Коламин НО – СН2 – СН2 – NH2
(аминоэтанол) (коламинкефалины)
образует сложноэфирную связь
с фосфатидной кислотой
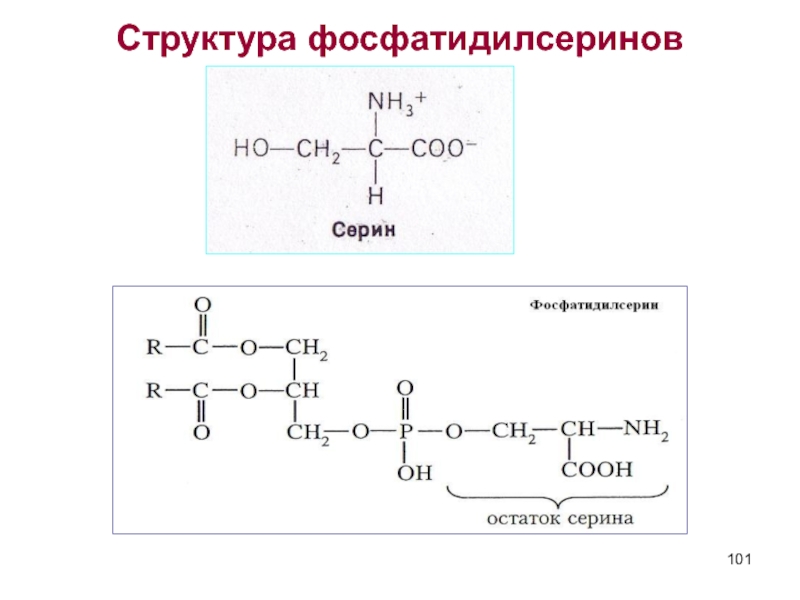
Серин НО – СН2 – СН – СООН - фосфатидилсерины
NH2 ( серинкефалины)
3) Холин [НО – СН2 – СН2 – N(CH3)3]+ ОН- - фосфатидилхолин
гидроксид (2-гидроксиэтилтриметиламмония) (лецитины)
Аминоспирты,входящие в состав фосфолипидов
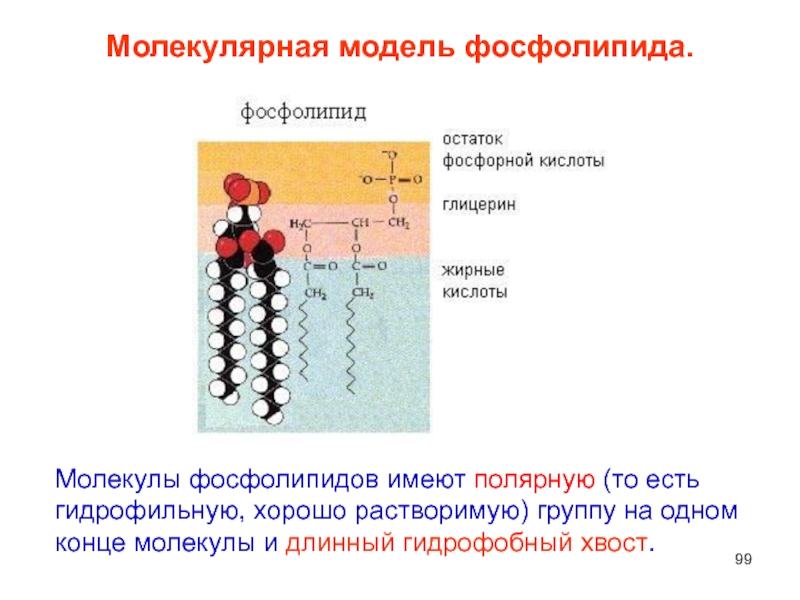
Слайд 99Молекулярная модель фосфолипида.
Молекулы фосфолипидов имеют полярную (то есть гидрофильную, хорошо растворимую)
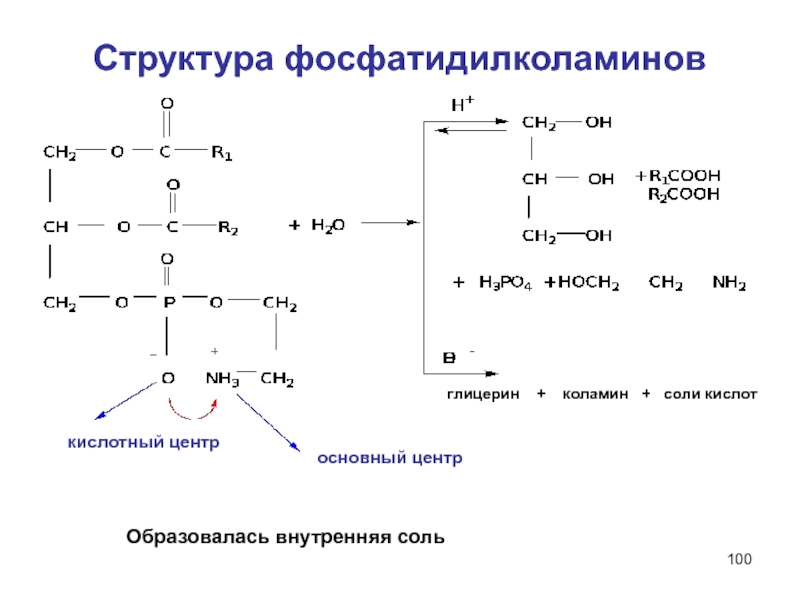
Слайд 100Структура фосфатидилколаминов
глицерин + коламин
Образовалась внутренняя соль
основный центр
кислотный центр