- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Карбонилсодержащие соединения. Строение и химические свойства карбоновых кислот. Липиды. Фосфолипиды презентация
Содержание
- 1. Карбонилсодержащие соединения. Строение и химические свойства карбоновых кислот. Липиды. Фосфолипиды
- 2. Альдегиды, кетоны, карбоновые кислоты, сложные эфиры, галогено ангидриды, амиды относятся к карбонил содержащим соединениям.
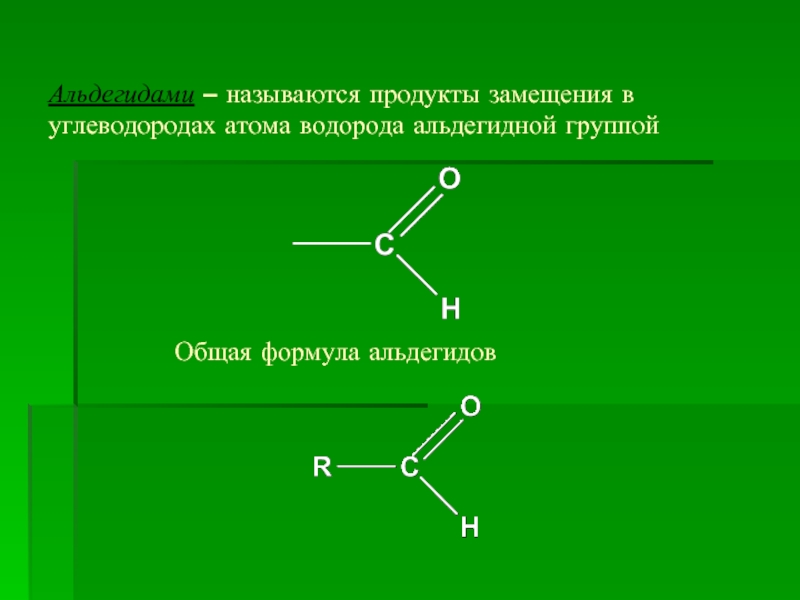
- 3. Альдегидами – называются продукты замещения в углеводородах атома водорода альдегидной группой Общая формула альдегидов
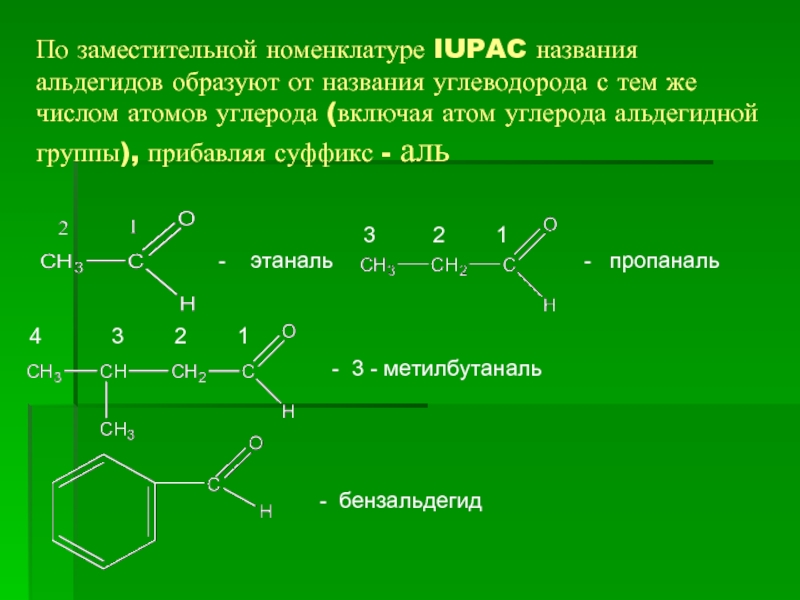
- 4. По заместительной номенклатуре IUPAC названия альдегидов образуют
- 5. Кетоны – углеводороды, содержащие карбонильную группу, связанную
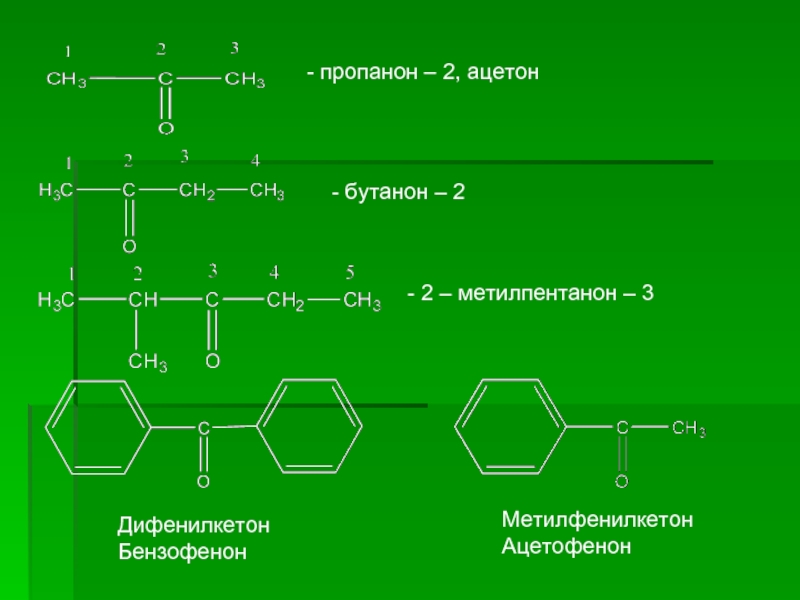
- 6. - пропанон – 2, ацетон
- 7. В зависимости от строения
- 8. Строение оксо группы:
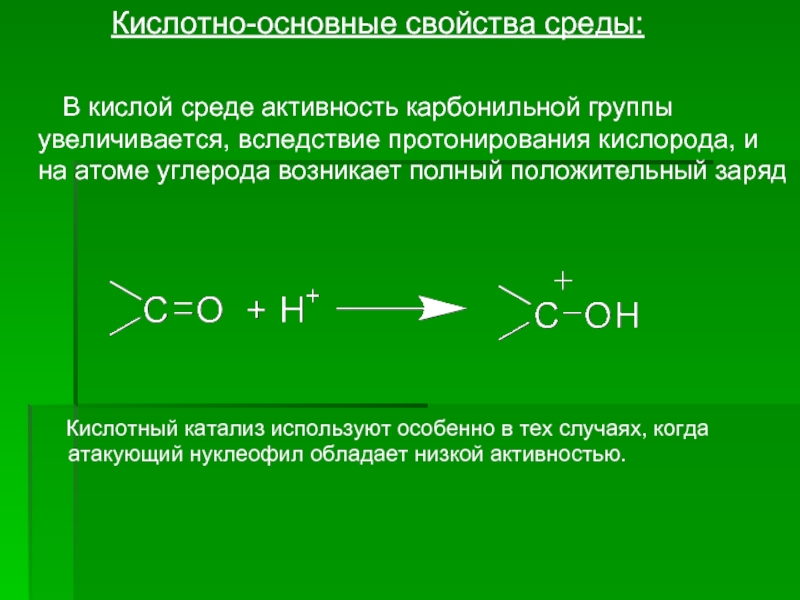
- 10. Кислотно-основные
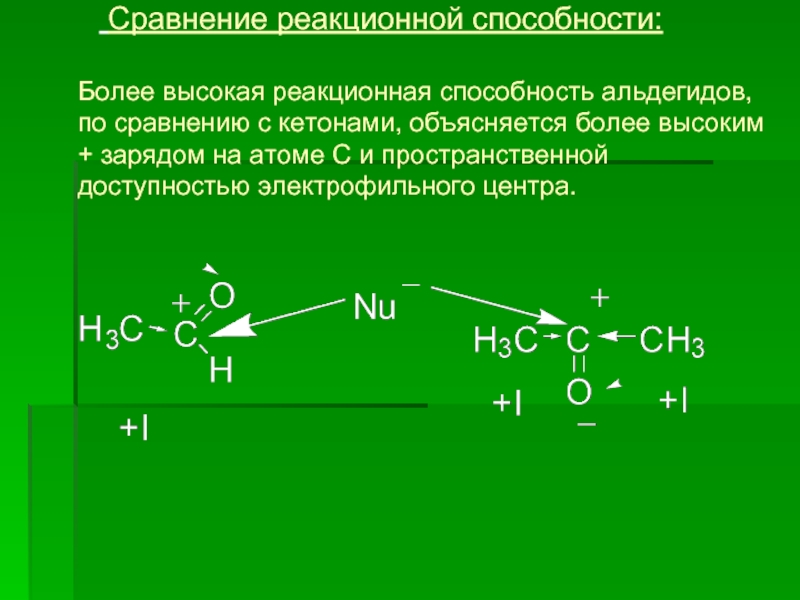
- 11. Сравнение реакционной способности:
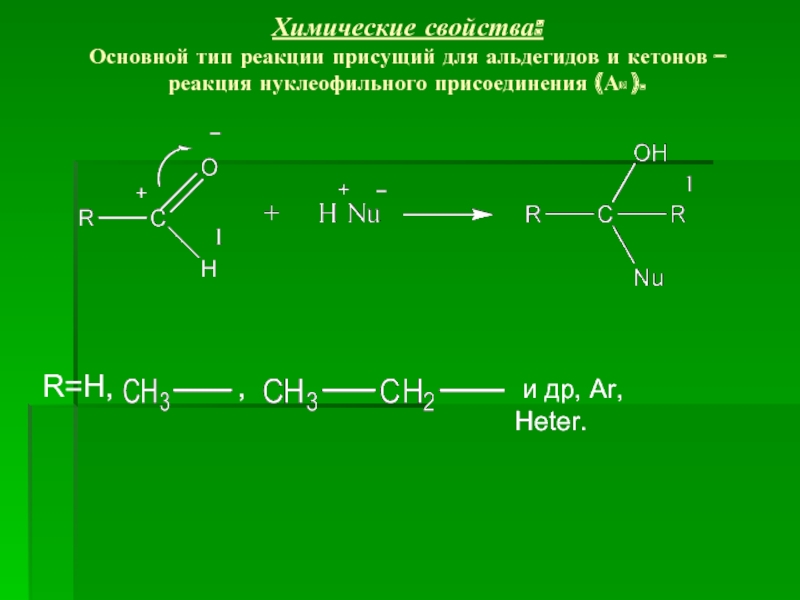
- 12. Химические свойства: Основной тип реакции присущий для
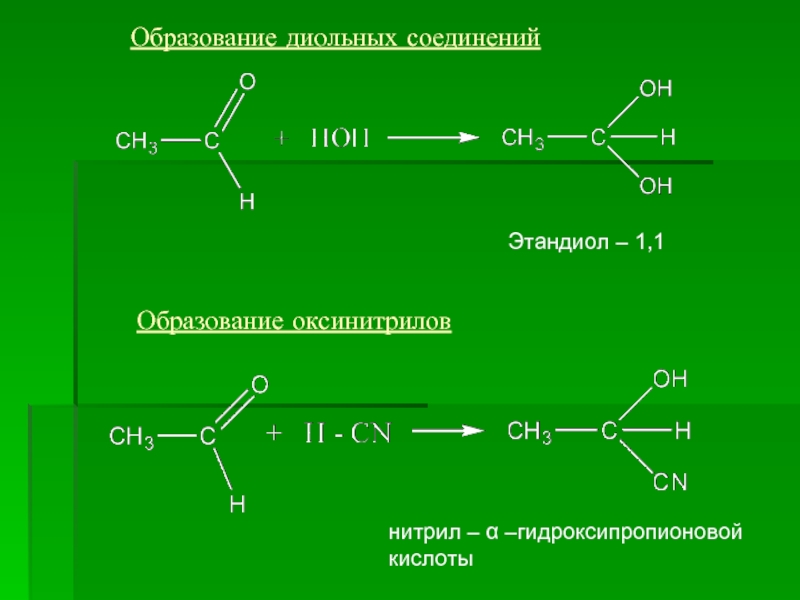
- 13. Образование диольных соединений Образование оксинитрилов Этандиол – 1,1 нитрил – α –гидроксипропионовой кислоты
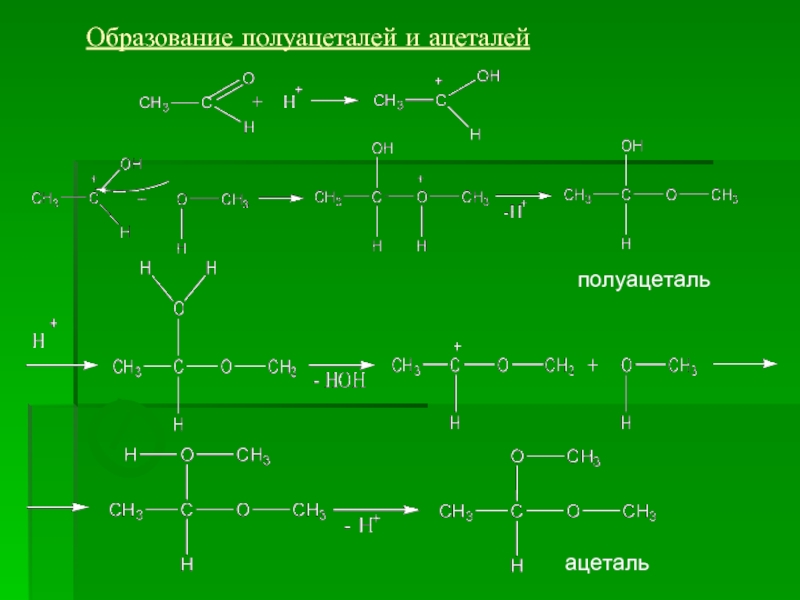
- 14. О Т Образование полуацеталей и ацеталей полуацеталь ацеталь
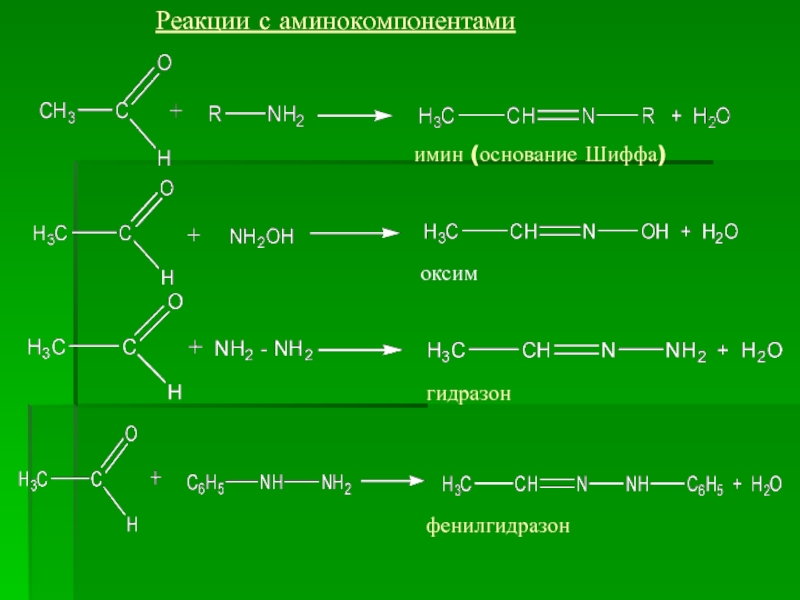
- 15. Реакции с аминокомпонентами имин (основание Шиффа) оксим гидразон фенилгидразон
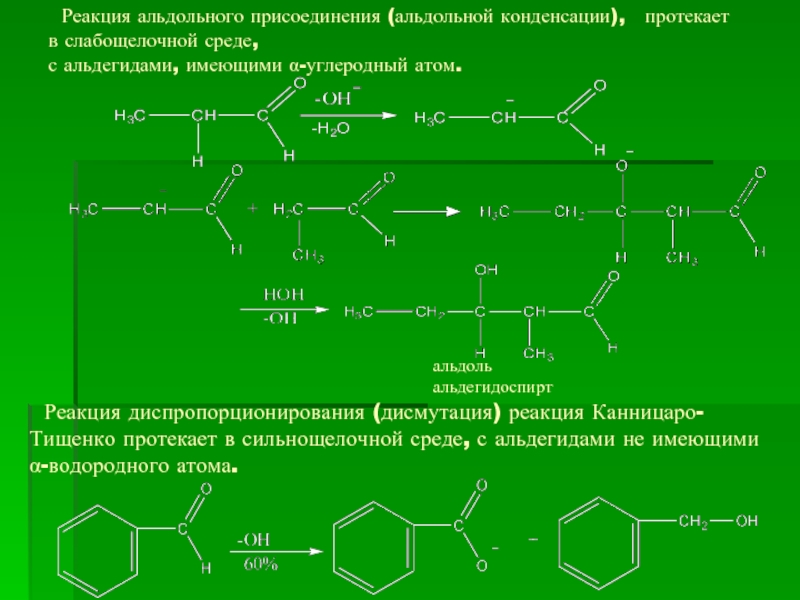
- 16. Реакция альдольного присоединения (альдольной конденсации),
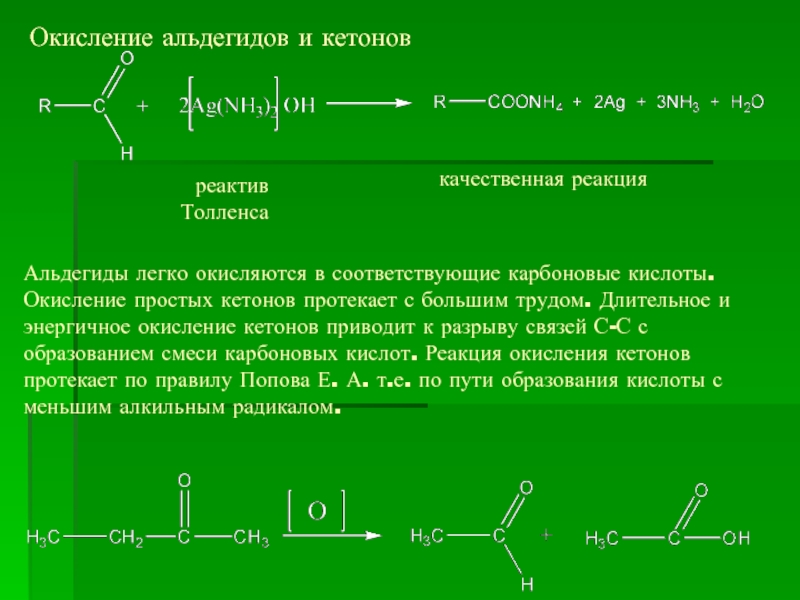
- 17. Окисление альдегидов и кетонов качественная реакция
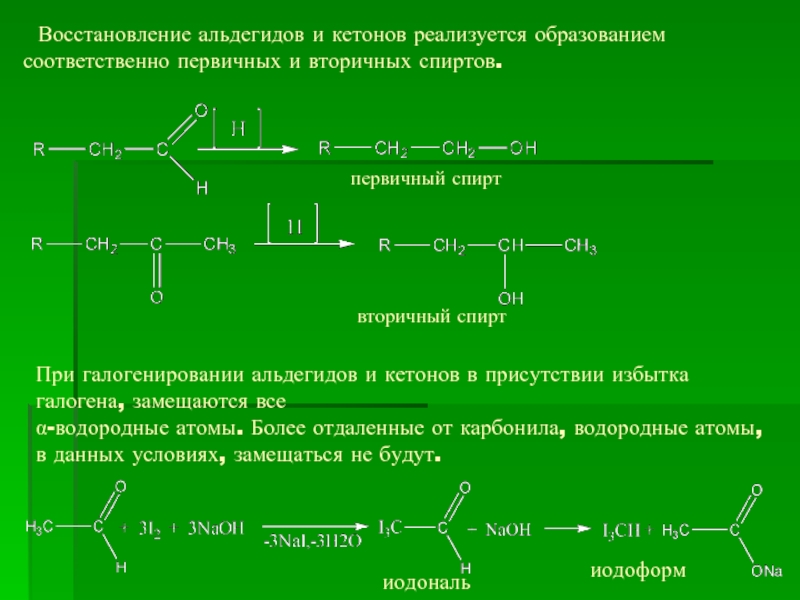
- 18. Восстановление альдегидов и кетонов реализуется образованием
- 19. Карбоновые кислоты – строение и химические свойства. Липиды. Фосфолипиды.
- 20. Одноосновные карбоновые кислоты – это
- 21. Классификация В зависимости от радикала с которым
- 22. Строение карбоксильной
- 23. Это может быть показано при помощи двух
- 24. Химические свойства монокарбоновых кислот
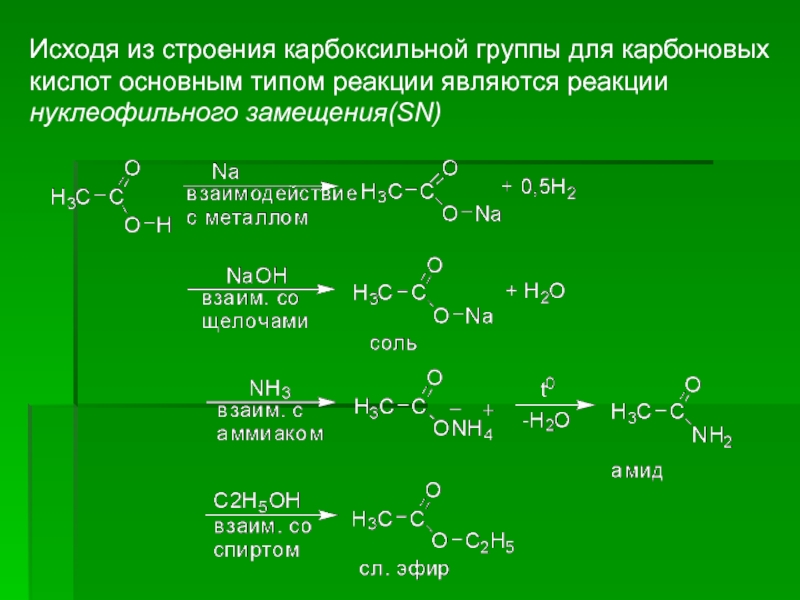
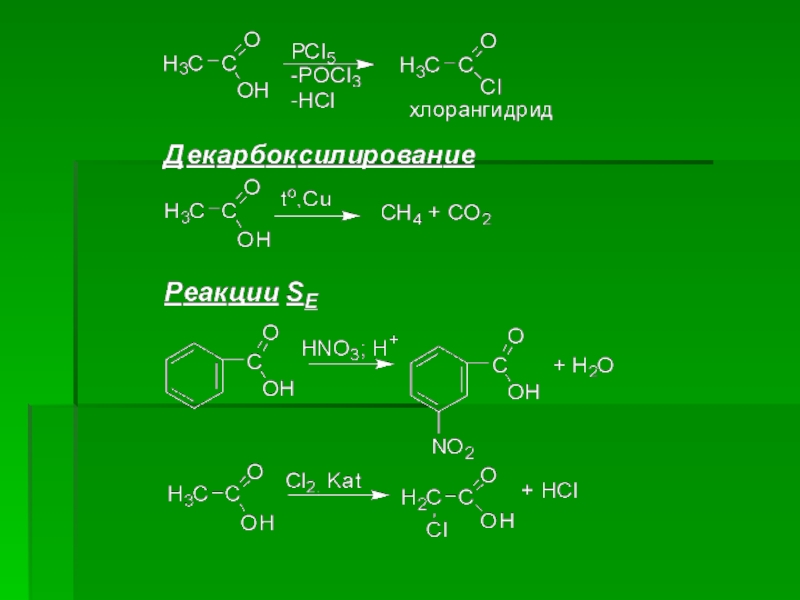
- 25. Исходя из строения карбоксильной группы для карбоновых
- 27. Липиды(жиры) – представляют собой смеси сложных эфиров,
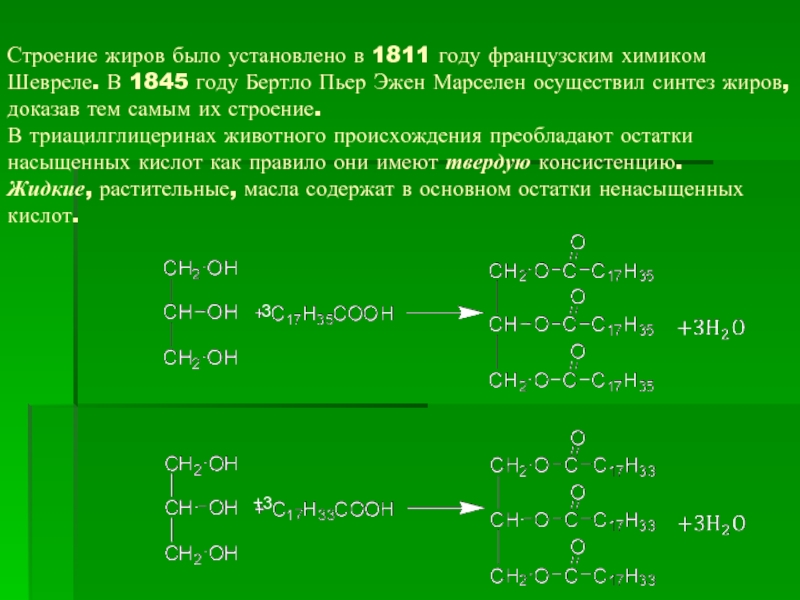
- 28. Строение жиров было установлено в 1811 году
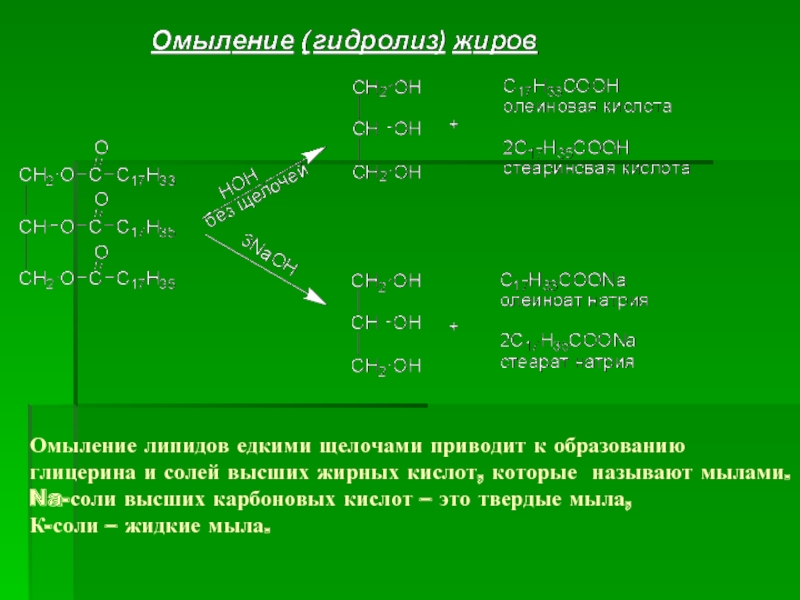
- 29. Омыление липидов едкими щелочами приводит к образованию
- 30. Гидрогенизация жиров – процесс присоединения водорода к
- 31. Для характеристики
- 32. Иодное число – служит показателем
- 33. Фосфолипиды – липиды, содержащие фосфорную кислоту.
- 34. Представителями фосфатидов являются кефалины
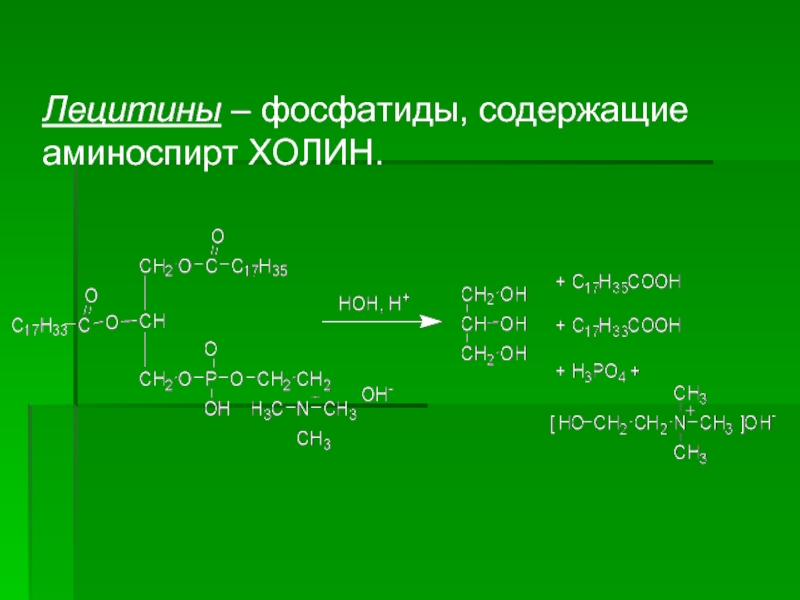
- 35. Лецитины – фосфатиды, содержащие аминоспирт ХОЛИН.
- 36. Благодарю
Слайд 1Карбонилсодержащие соединения. Строение и химические свойства карбоновых кислот. Липиды. Фосфолипиды.
Слайд 2 Альдегиды, кетоны, карбоновые кислоты, сложные эфиры, галогено ангидриды, амиды относятся к
Слайд 3Альдегидами – называются продукты замещения в углеводородах атома водорода альдегидной группой
Общая
Слайд 4По заместительной номенклатуре IUPAC названия альдегидов образуют от названия углеводорода с
- этаналь
- пропаналь
- 3 - метилбутаналь
1
2
3
1
2
3
4
- бензальдегид
Слайд 5Кетоны – углеводороды, содержащие карбонильную группу, связанную с двумя радикалами. В кетонах
1
Слайд 6 - пропанон – 2, ацетон
- бутанон – 2
- 2
Дифенилкетон
Бензофенон
Метилфенилкетон
Ацетофенон
Слайд 7
В зависимости от строения углеводородного радикала альдегиды и кетоны подразделяются
а кетоны и на смешанные.
Слайд 8
Строение оксо группы:
Тригональный атом углерода в карбонильной
Слайд 9
Величины эффективного + заряда на атоме углерода;
Его пространственной доступности;
Кислотно-основных свойств среды.
Величина эффективного положительного заряда на карбонильном атоме углерода увеличивается с ростом отрицательного индуктивного эффекта заместителя (-I) и уменьшается с увеличением +I и +М.
Слайд 10 Кислотно-основные свойства среды:
Кислотный катализ используют особенно в тех случаях, когда атакующий нуклеофил обладает низкой активностью.
Слайд 11 Сравнение реакционной способности: Более высокая
Слайд 12Химические свойства: Основной тип реакции присущий для альдегидов и кетонов – реакция
R=H,
,
и др, Ar, Heter.
Слайд 13Образование диольных соединений
Образование оксинитрилов
Этандиол – 1,1
нитрил – α –гидроксипропионовой кислоты
Слайд 16 Реакция альдольного присоединения (альдольной конденсации), протекает в слабощелочной среде,
с альдегидами, имеющими α-углеродный атом.
Реакция диспропорционирования (дисмутация) реакция Канницаро-Тищенко протекает в сильнощелочной среде, с альдегидами не имеющими α-водородного атома.
альдоль
альдегидоспирт
Слайд 17Окисление альдегидов и кетонов
качественная реакция
реактив
Толленса
Альдегиды легко окисляются в соответствующие карбоновые
Слайд 18 Восстановление альдегидов и кетонов реализуется образованием соответственно первичных и вторичных
первичный спирт
вторичный спирт
При галогенировании альдегидов и кетонов в присутствии избытка галогена, замещаются все
α-водородные атомы. Более отдаленные от карбонила, водородные атомы, в данных условиях, замещаться не будут.
иодоформ
иодональ
Слайд 20 Одноосновные карбоновые кислоты – это производные углеводородов, у которых
Название «карбоновые кислоты» произошло от латинского названия угольной кислоты – Acidum carbonicum.
Названия монокарбоновых кислот образуются от названия углеводородов, с тем же числом атомов углерода, прибавляя к ним окончание
–ОВАЯ КИСЛОТА.
Слайд 21Классификация В зависимости от радикала с которым связана карбоксильная группа различают: насыщенные,
Слайд 22Строение карбоксильной группы: Электронографическое
Слайд 23Это может быть показано при помощи двух крайних структур или одной
Слайд 24 Химические свойства монокарбоновых кислот определяются электрнным строением карбоксильной группы, в которой
Слайд 25Исходя из строения карбоксильной группы для карбоновых кислот основным типом реакции
Слайд 27Липиды(жиры) – представляют собой смеси сложных эфиров, образованных трехатомным спиртом глицерином
Слайд 28Строение жиров было установлено в 1811 году французским химиком Шевреле. В
+3
3