- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Изомерия комплексных соединений презентация
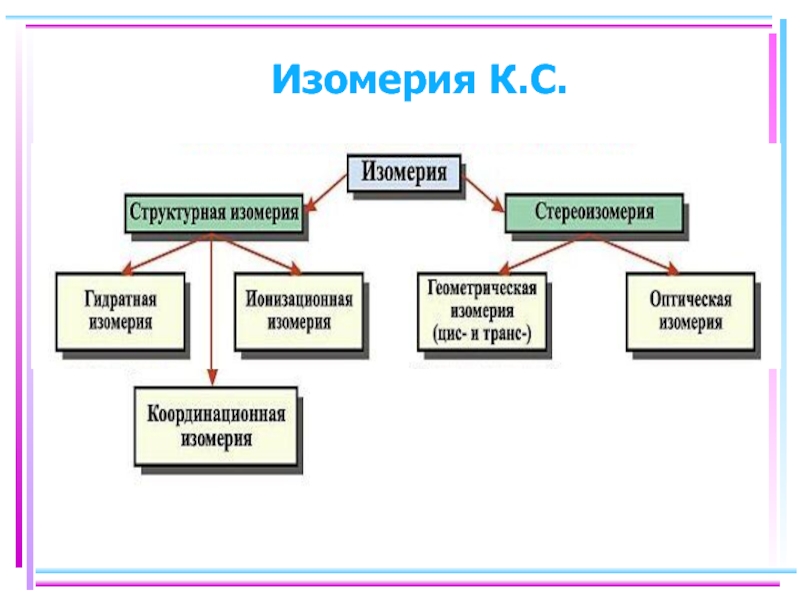
Содержание
- 1. Изомерия комплексных соединений
- 2. Изомерия комплексных соединений Изомерия – явление существования
- 3. Изомерия К.С.
- 4. Изомерия лигандов Связевая —NO2– и
- 5. Изомерия внутренней сферы: геометрическая Геометрическая изомерия вызвана
- 6. Геометрическая изомерия Плоскоквадратные комплексы при наличии двух
- 7. Геометрическая изомерия [ML′5L′′]: изомеров нет цис- и транс-изомеры дигидроксотетраамминкобальта(II)
- 8. Изомерия внутр. сферы: оптическая Оптическая (зеркальная)
- 9. Оптическая изомерия Оптические изомеры способны вращать плоскость
- 10. Ионизационная изомерия КС Лиганды во внутренней
- 11. Частный случай ионизационной изомерии – гидратная изомерия CrCl3.6H2O – три изомера
- 12. - обмен лигандами между комплексными анионами и катионом Координационная изомерия
- 13. Квантовомеханические теории строения комплексных соединений
- 14. Квантовомеханические теории строения комплексных соединений Для объяснения
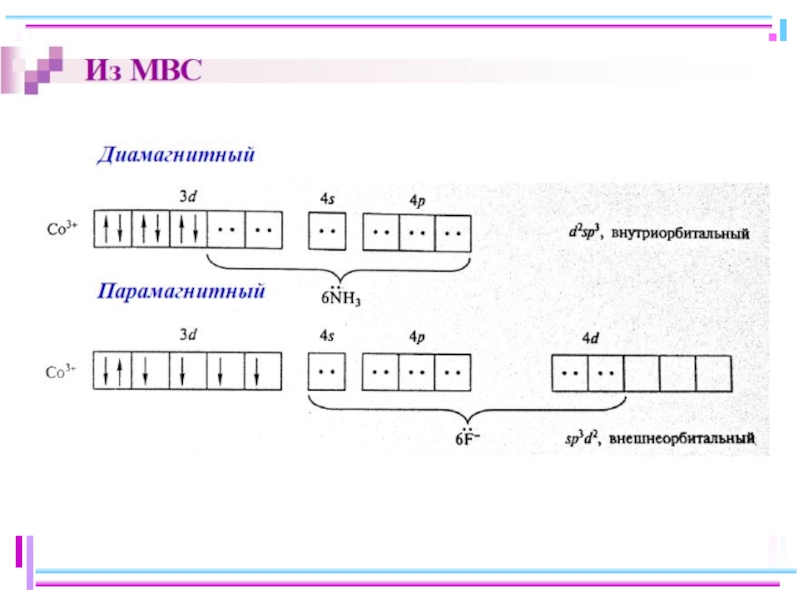
- 15. Метод валентных связей: связь – ковалентная, лиганд
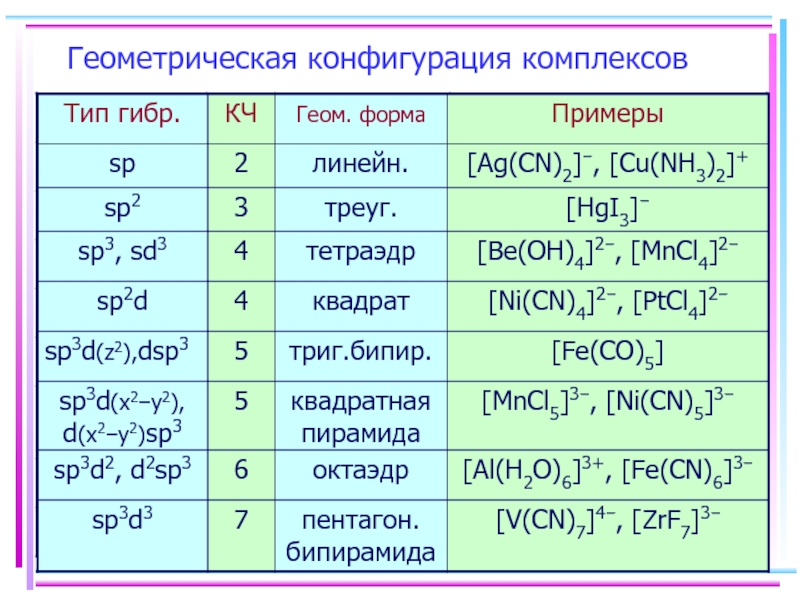
- 16. Геометрическая конфигурация комплексов
- 17. Zn0:4s23d104p0 Zn2+:4s03d104p0
- 18. Для атомов комплексообразователей: E(n−1)d ≈ Ens ≈
- 19. Ni+II [Ni(CN)4]2– уст. (низкоспин.), диамагн., внутриорбитальный
- 20. Fe+II [FeF6]4– парамагн., высокоспиновый внешнеорбитальный ,
- 21. [Fe(CN)6]3– Атом Fe0:
- 22. Пространственное строение [Fe(CN)6]3- □□□□□
- 24. Основные положения теории кристаллического поля (поля лигандов)
- 25. В случае [ML6]n±,0 : октаэдрическое поле лигандов
- 26. ТКП-октаэдрическое поле Сильное поле лигандов Δmax: переход
- 27. Сильное поле
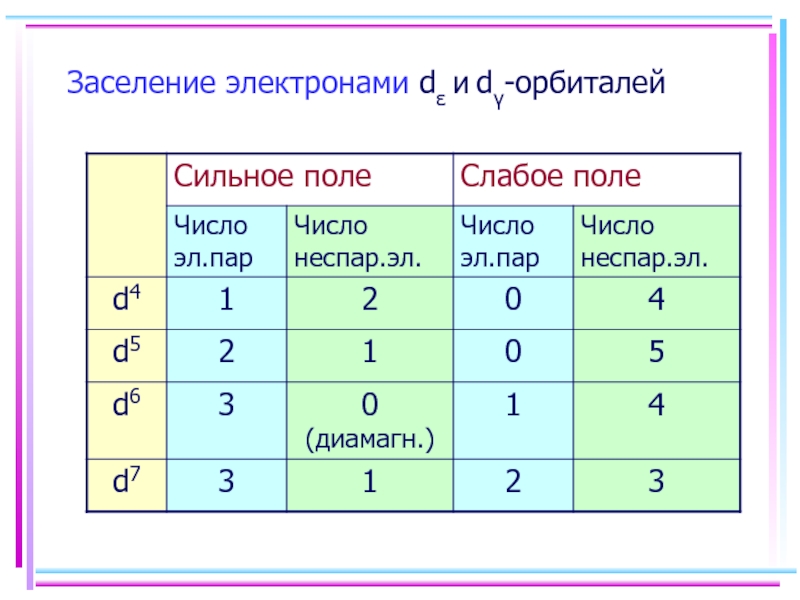
- 28. Заселение электронами dε и dγ-орбиталей
- 29. Лиганды сильного и слабого поля Спектрохимический ряд
- 30. Цветность комплексных соединений При облучении образца в-ва
- 31. Цветность комплексов Комплексы Sc(III), Cu(I), Zn(II), Cd(II)
- 32. Параметр расщепления Δ 1 см–1 соответствует ок.
Слайд 2Изомерия комплексных соединений
Изомерия – явление существования соединений (изомеров), одинаковых по составу
В случае комплексных соединений изомерия обусловлена:
различием в строении и координации лигандов
различием в строении внутренней координационной сферы
различным распределением частиц между внутренней и внешней сферой.
Слайд 4Изомерия лигандов
Связевая
—NO2– и —ONO–
нитро-
[Co(NH3)5NO2]2+ (желто-коричн.р-р)
[Co(NH3)5ONO]2+ (розов.р-р)
—NCS– и —SCN–
тиоцианато-N тиоцианато-S
[Cr(H2O)5(NCS)]2+
[Cr(H2O)5(SCN)]2+
Изомерия лигандов
Лиганды сложного строения (напр., аминокислоты) образуют изомеры, координация которых ведет к получению комплексов с разными свойствами.
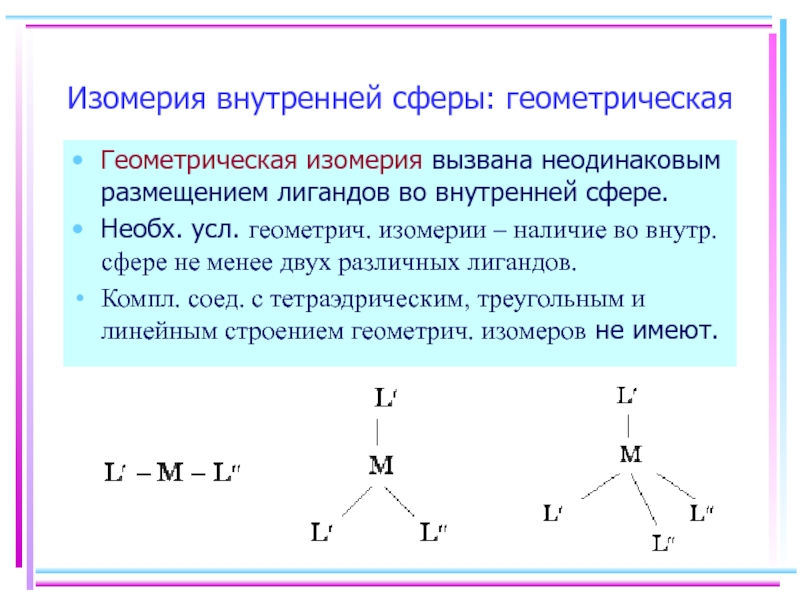
Слайд 5Изомерия внутренней сферы: геометрическая
Геометрическая изомерия вызвана неодинаковым размещением лигандов во внутренней
Необх. усл. геометрич. изомерии – наличие во внутр. сфере не менее двух различных лигандов.
Компл. соед. с тетраэдрическим, треугольным и линейным строением геометрич. изомеров не имеют.
Слайд 6Геометрическая изомерия
Плоскоквадратные комплексы при наличии двух разных лигандов L′ и L′′
Слайд 7Геометрическая изомерия
[ML′5L′′]: изомеров нет
цис- и транс-изомеры дигидроксотетраамминкобальта(II)
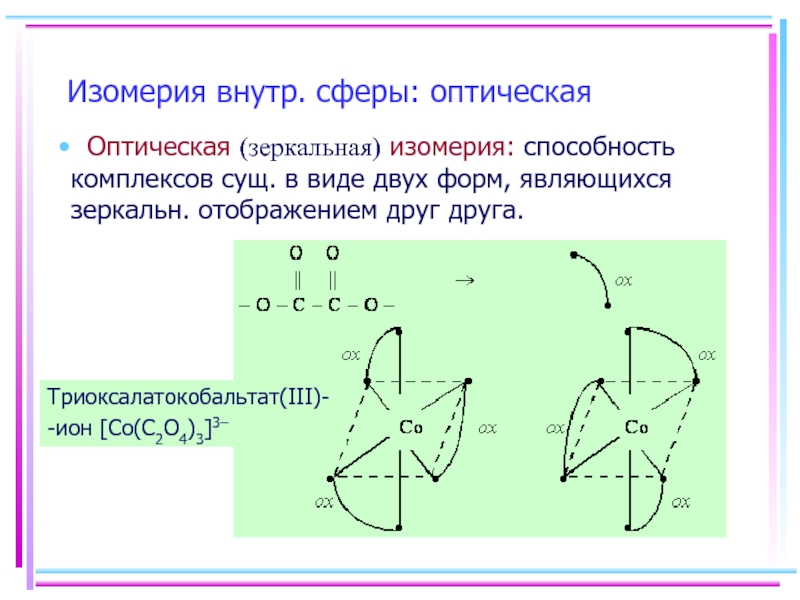
Слайд 8Изомерия внутр. сферы: оптическая
Оптическая (зеркальная) изомерия: способность комплексов сущ. в
Триоксалатокобальтат(III)-
-ион [Co(С2O4)3]3–
Слайд 9Оптическая изомерия
Оптические изомеры способны вращать плоскость поляризации светового луча (влево, L-изомер,
Световой луч (а) пропускают через поляризатор, и он становится плоско-поляризованным (б).
После пропускания через р-ры оптич. изомеров (в, г).
Угол вращения плоскости поляризации α (определяется анализатором).
Слайд 10Ионизационная изомерия КС
Лиганды во внутренней и внешней сфере меняются местами.
[Co(NH3)5СN]Cl – хлорид цианопентаамминкобальта (II)
[Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2
[Pt(NH3)4SO4](OH)2 и [Pt(NH3)4(OH)2]SO4
pH >> 7 pH ≈ 7
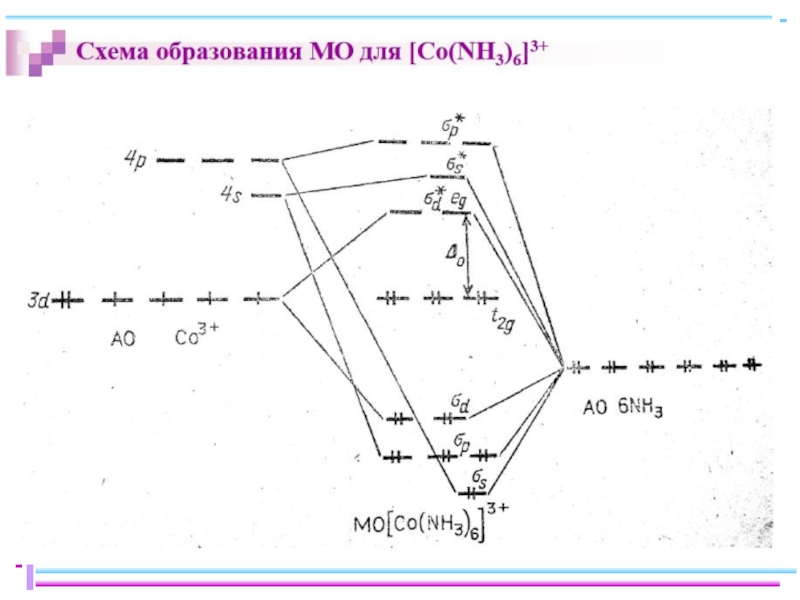
Слайд 14Квантовомеханические теории строения комплексных соединений
Для объяснения строения комплексных соединений наиболее широко
Так же – ММО.
В рамках метода валентных связей считается, что между комплексообразователем и лигандами существует чисто ковалентная связь, которая реализуется по донорно-акцепторному механизму.
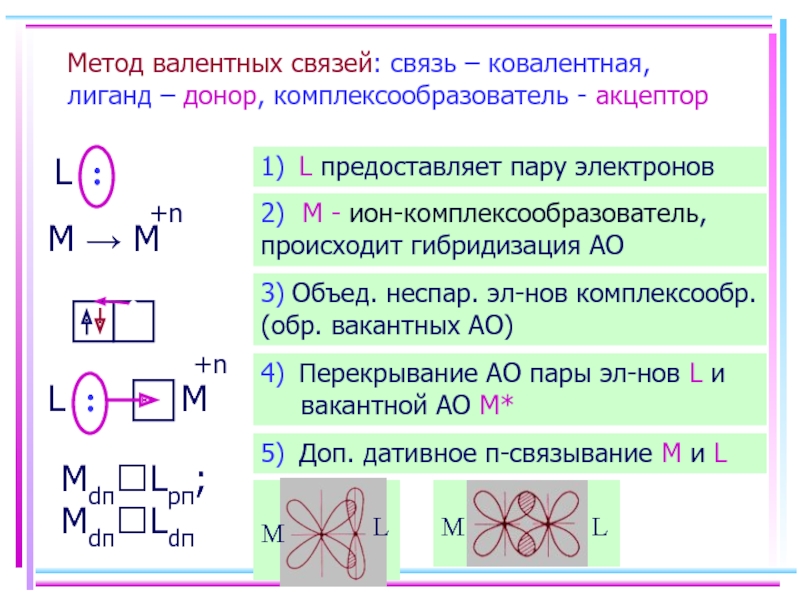
Слайд 15Метод валентных связей: связь – ковалентная, лиганд – донор, комплексообразователь -
L :
M → M
L :
Mdπ?Lpπ; Mdπ?Ldπ
1) L предоставляет пару электронов
2) M - ион-комплексообразователь, происходит гибридизация АО
3) Объед. неспар. эл-нов комплексообр. (обр. вакантных АО)
4) Перекрывание АО пары эл-нов L и вакантной АО M*
5) Доп. дативное π-связывание M и L
+n
+n
Слайд 18Для атомов комплексообразователей: E(n−1)d ≈ Ens ≈ Enp ≈ End
Пример:
Атом Ni0 парамагнитен
Ni0
Ni*
[Ni(CO)4] уст., диамагнитный, тетраэдрич.
Ni+II
[NiBr4]2– неуст., парамагн., тетраэдрич.
КЧ 4
КЧ 4
Слайд 19Ni+II
[Ni(CN)4]2– уст. (низкоспин.), диамагн., внутриорбитальный
КЧ 4
[Ni(CN)5]3– уст. (низкоспин.), , диамагн.,
КЧ
[Ni(H2O)6]2+, [Ni(NO2)6]4– : уст., парамагн., внешнеорбитальный
КЧ 6
Ni+II
Слайд 20Fe+II
[FeF6]4– парамагн., высокоспиновый внешнеорбитальный ,
КЧ 6
Fe+II
[Fe(CN)6]4– диамагн., низкоспиновый, внутриорбитальный
КЧ
Слайд 21[Fe(CN)6]3–
Атом Fe0:
□□□□□ □ □□□
□□□□□ □ □□□
↑
↑↓
↑
↑
↑
↑↓
3d
4S
4p
Fe0 – 3e → Fe3+: [Ar] 3d54S04p0
3d
4S
4p
↑↓
↑↓
↑
••
6 CN-
Слайд 22
Пространственное строение [Fe(CN)6]3-
□□□□□ □ □□□
3d
4S
4p
↑↓
↑↓
↑
•• ••
CN CN CN CN CN CN
sp3d2 - гибридизация
Октаэдр
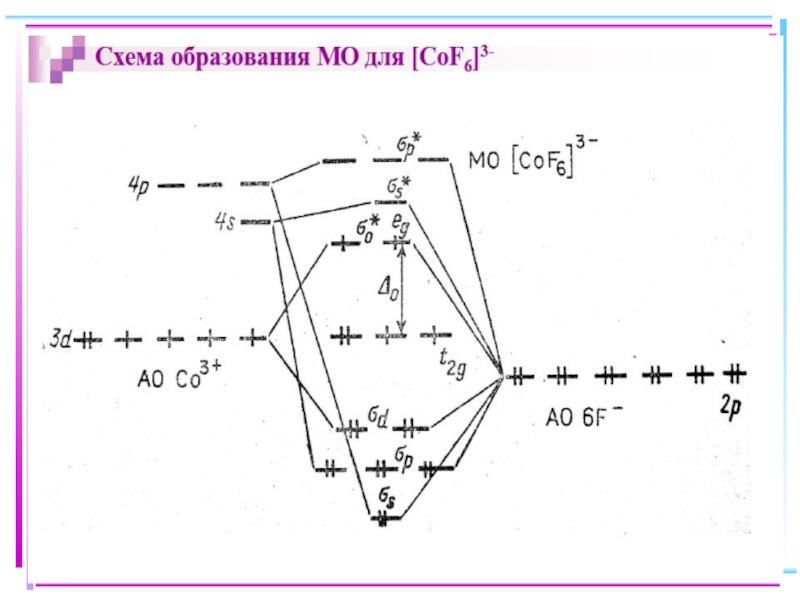
Слайд 24Основные положения теории кристаллического поля (поля лигандов)
Связь комплексообразователя (центр. атома) M
Лиганды L – точечные заряды в вершинах правильных полиэдров, т.е. на максимальном расстоянии друг от друга.
Взаимодействие L между собой не рассматр.
Детально рассматривается влияние электростатич. поля лигандов на M, а именно, на энергетич. подуровни (ЭПУ).
Слайд 25В случае [ML6]n±,0 : октаэдрическое поле лигандов
Поле слабо влияет (энергия падает)
Поле сильно влияет (энергия растет) в случае АО d(z2) и d(x2–y2), располож. вдоль осей координат (ближе всего к лигандам)
Eо
|Eγ–Eо| = 3/5 Δ ; |Eε–Eо| = 2/5 Δ
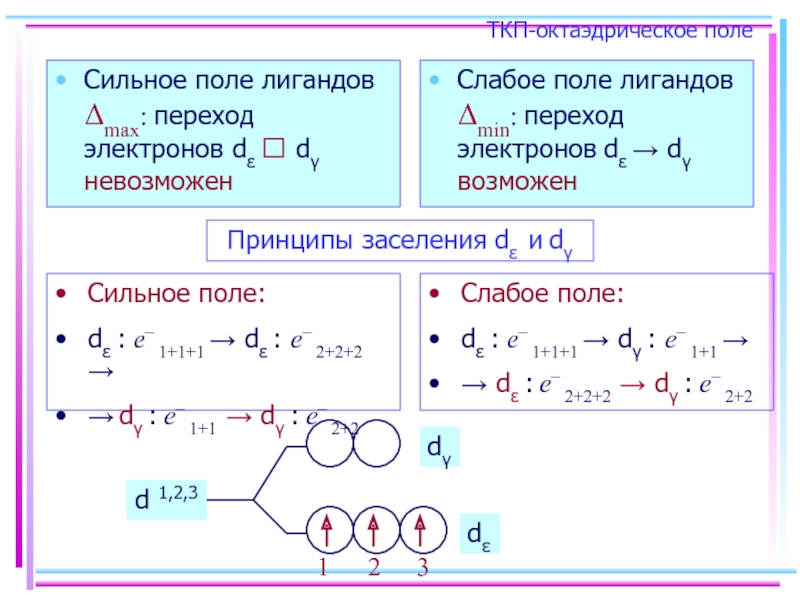
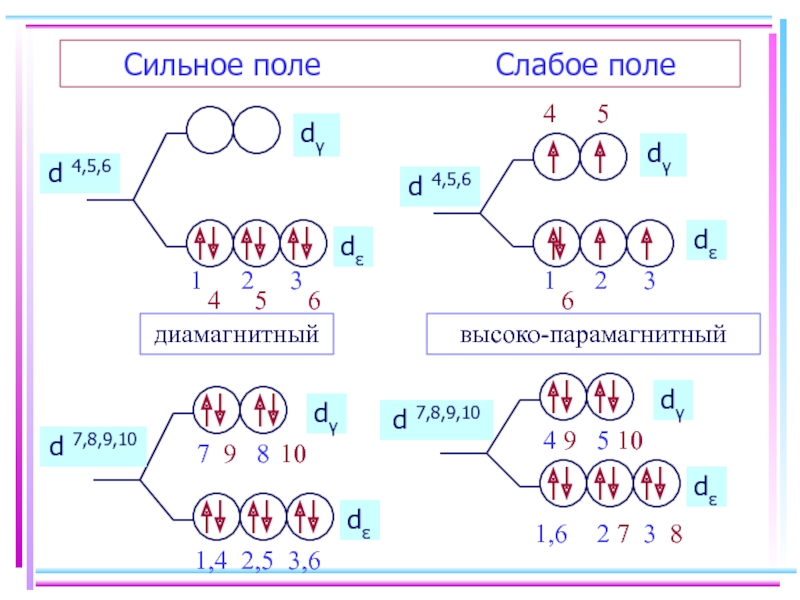
Слайд 26ТКП-октаэдрическое поле
Сильное поле лигандов Δmax: переход электронов dε ⭲ dγ невозможен
Слабое
Принципы заселения dε и dγ
Сильное поле:
dε : e– 1+1+1 → dε : e– 2+2+2 →
→ dγ : e– 1+1 → dγ : e– 2+2
Слабое поле:
dε : e– 1+1+1 → dγ : e– 1+1 →
→ dε : e– 2+2+2 → dγ : e– 2+2
d 1,2,3
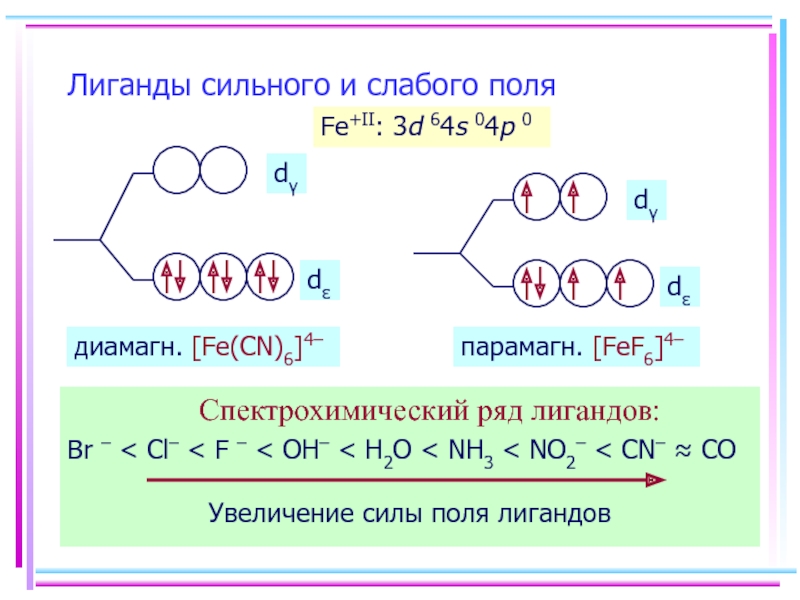
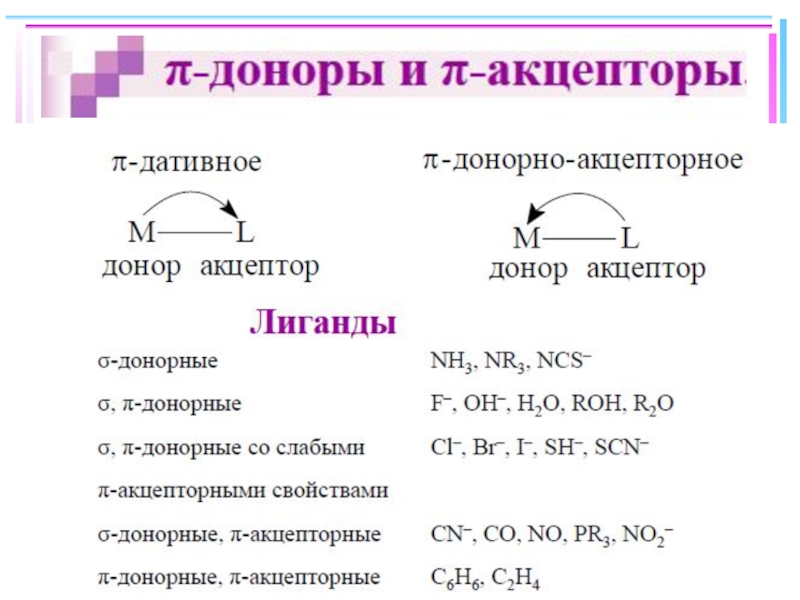
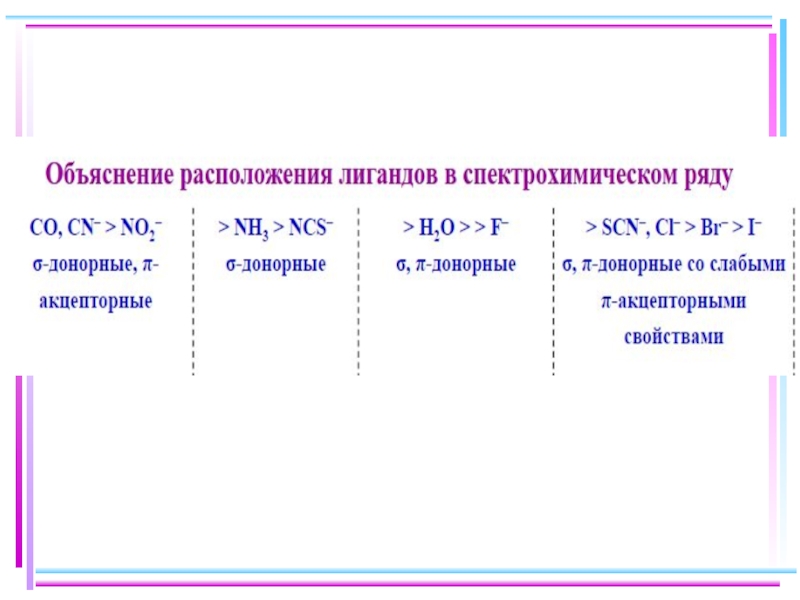
Слайд 29Лиганды сильного и слабого поля
Спектрохимический ряд лигандов:
Br – < Cl–
Fe+II: 3d 64s 04p 0
диамагн. [Fe(CN)6]4–
парамагн. [FeF6]4–
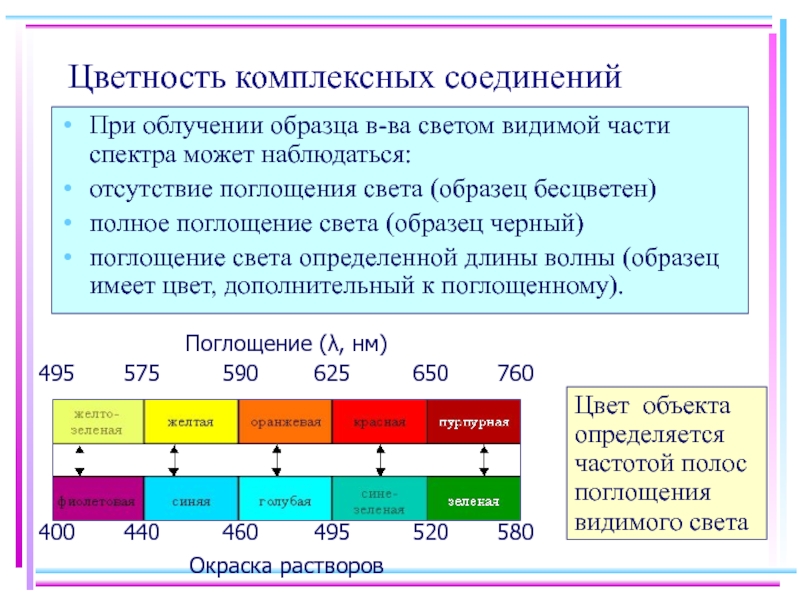
Слайд 30Цветность комплексных соединений
При облучении образца в-ва светом видимой части спектра может
отсутствие поглощения света (образец бесцветен)
полное поглощение света (образец черный)
поглощение света определенной длины волны (образец имеет цвет, дополнительный к поглощенному).
Цвет объекта определяется частотой полос поглощения видимого света
Слайд 31Цветность комплексов
Комплексы Sc(III), Cu(I), Zn(II), Cd(II) и др. не поглощают энергии
фиолет. [Ti(H2O)6]3+
бесцв. [Cd(H2O)6]2+
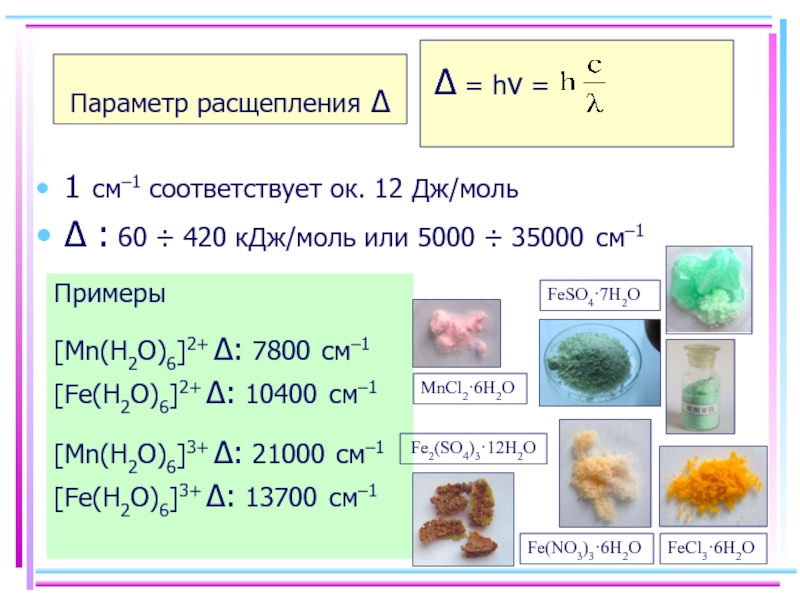
Слайд 32Параметр расщепления Δ
1 см–1 соответствует ок. 12 Дж/моль
Δ : 60 ÷
Примеры
[Mn(H2O)6]2+ Δ: 7800 см–1 [Fe(H2O)6]2+ Δ: 10400 см–1
[Mn(H2O)6]3+ Δ: 21000 см–1 [Fe(H2O)6]3+ Δ: 13700 см–1


![Изомерия лигандовСвязевая —NO2– и —ONO– нитро- нитрито-[Co(NH3)5NO2]2+ (желто-коричн.р-р)[Co(NH3)5ONO]2+ (розов.р-р)—NCS– и —SCN–тиоцианато-N](/img/tmb/3/284662/37a6fcf5d8aa309d1b1479c77d40fb46-800x.jpg)

![Геометрическая изомерия[ML′5L′′]: изомеров нетцис- и транс-изомеры дигидроксотетраамминкобальта(II)](/img/tmb/3/284662/f8bb80cab0368bddfa512dfdc3c6ac7f-800x.jpg)

![Ионизационная изомерия КС Лиганды во внутренней и внешней сфере меняются местами. [Co(NH3)5Cl]CN –цианид хлоропентаамминкобальта (II)](/img/tmb/3/284662/925fb62a0ddc2c794b28db0d9bdac812-800x.jpg)




![Zn0:4s23d104p0 Zn2+:4s03d104p03d4s4pZn2+:••••••••[ Zn (NH3)4]2+sp3](/img/tmb/3/284662/ce5f0ce2f484c797a4edce477272e59d-800x.jpg)
![Для атомов комплексообразователей: E(n−1)d ≈ Ens ≈ Enp ≈ End Пример: комплексы никеля. Ni0 [Ar]](/img/tmb/3/284662/a8b609d08710139e89519e1145b0c70f-800x.jpg)
![Ni+II[Ni(CN)4]2– уст. (низкоспин.), диамагн., внутриорбитальныйКЧ 4[Ni(CN)5]3– уст. (низкоспин.), , диамагн., КЧ 5[Ni(H2O)6]2+, [Ni(NO2)6]4– : уст.,](/img/tmb/3/284662/d5413be3c5b6888b075872264e9fe92f-800x.jpg)
![Fe+II[FeF6]4– парамагн., высокоспиновый внешнеорбитальный ,КЧ 6Fe+II[Fe(CN)6]4– диамагн., низкоспиновый, внутриорбитальныйКЧ 6](/img/tmb/3/284662/0a163c4d6b6757572bc64a89aea72041-800x.jpg)
![[Fe(CN)6]3–Атом Fe0: 3d64S2□□□□□ □ □□□□□□□□ □ □□□↑↑↓↑↑↑↑↓3d4S4p](/img/tmb/3/284662/f0687699cba79002450b73cba82cf43c-800x.jpg)
![Пространственное строение [Fe(CN)6]3- □□□□□ □ □□□3d4S4p↑↓↑↓↑ •• •• •• •• ••](/img/tmb/3/284662/388eb9ef2f53c82cc72c3b326006f416-800x.jpg)
![3d4s4pCr3+:••••••••[Cr(H2O)6 ]3+••••d2sp3Cr0: 3d54s1Cr3+ 3d34s0](/img/tmb/3/284662/33bb9aee379022ad1866a277d8e0c19a-800x.jpg)

![В случае [ML6]n±,0 : октаэдрическое поле лигандовПоле слабо влияет (энергия падает) в случае АО d(xy),](/img/tmb/3/284662/86828a68a114b9684c2dd6df1b5e4c79-800x.jpg)