- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ионные равновесия в растворах электролитов презентация
Содержание
- 1. Ионные равновесия в растворах электролитов
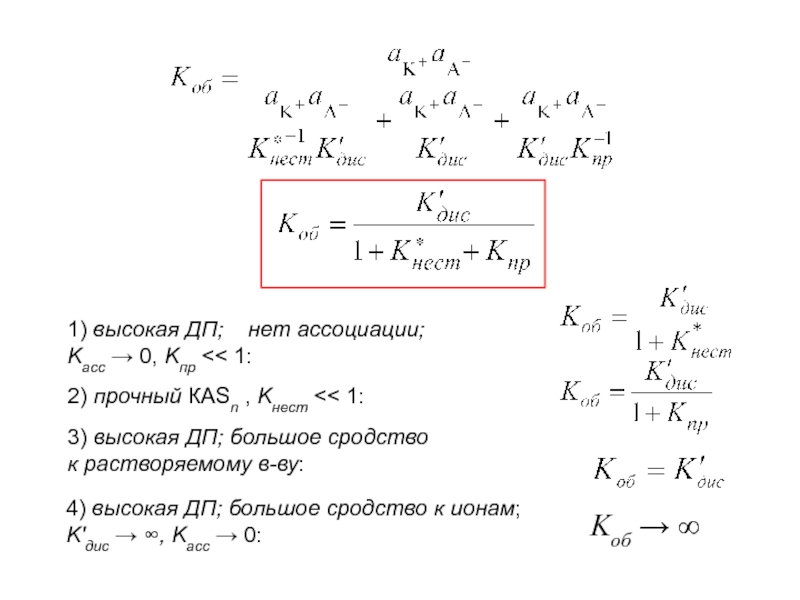
- 3. 1) высокая ДП; нет ассоциации; Kасс → 0, Kпр
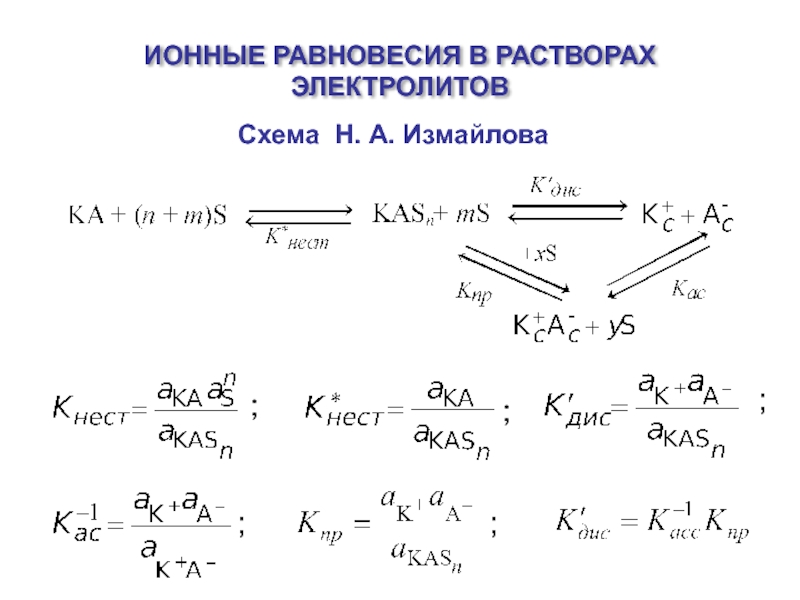
- 5. Уравнение Бренстеда – Измайлова:
- 6. Другие виды ионных равновесий Ступенчатая диссоциация электролитов
- 7. ДИССОЦИАЦИЯ СЛАБЫХ ЭЛЕКТРОЛИТОВ НА
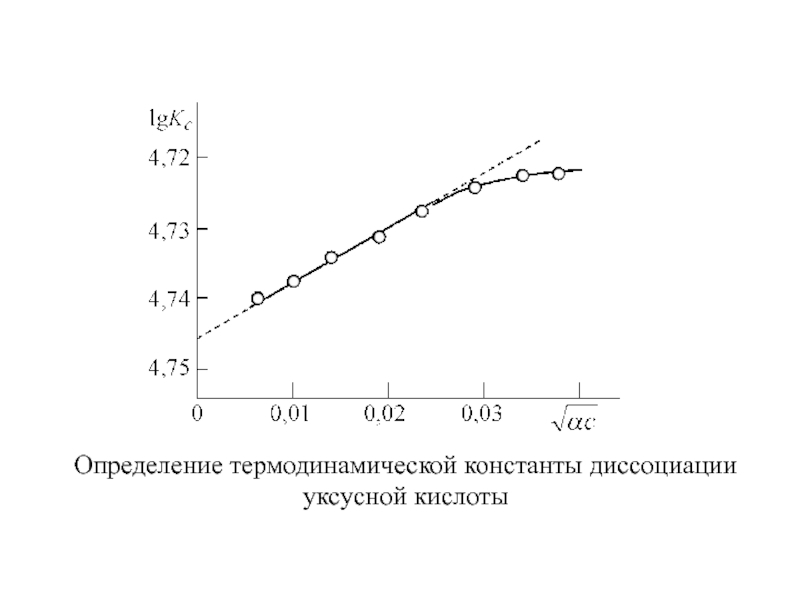
- 8. Определение термодинамической константы диссоциации уксусной кислоты
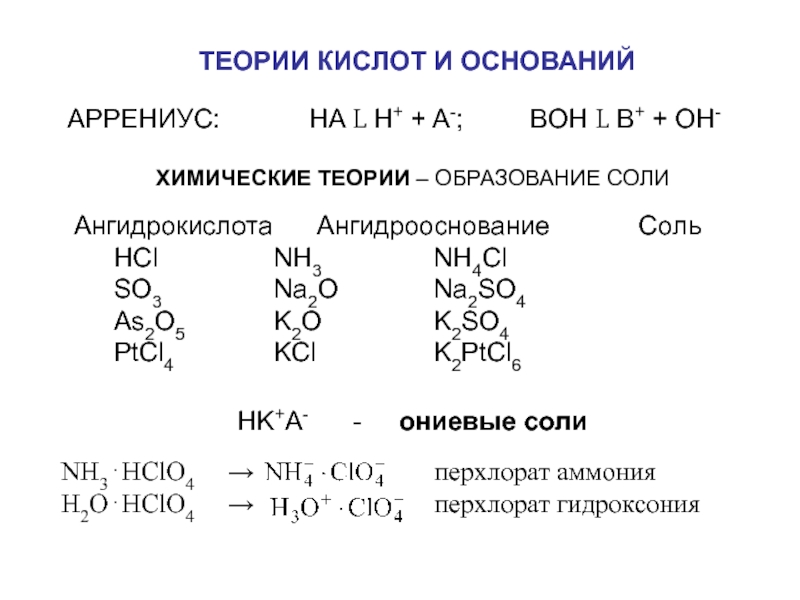
- 9. ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ АРРЕНИУС:
- 10. Амфотерность водородных кислот СН3СООН + Н2О
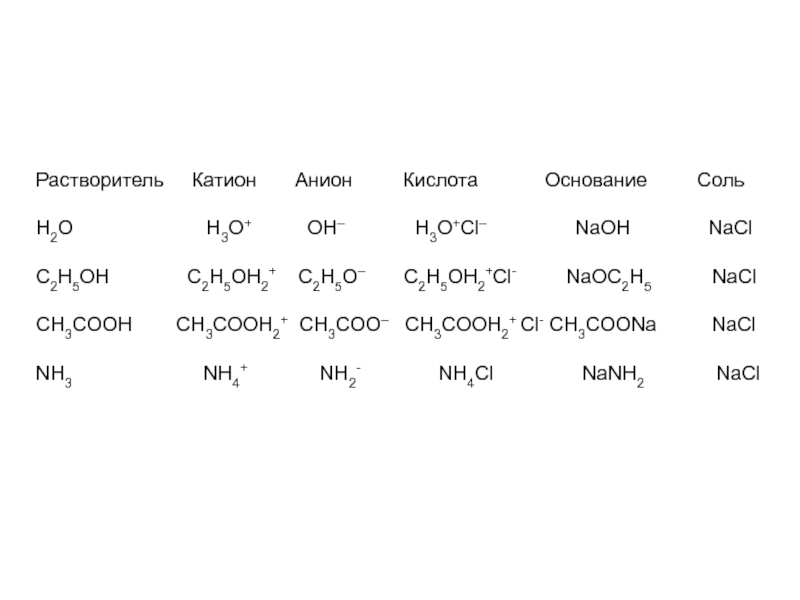
- 11. Растворитель Катион
- 12. ТЕОРИЯ ЛЬЮИСА КИСЛОТА – акцептор свободной пары
- 13. Протолитическая теория кислот и оснований Бренстеда
- 15. РАСТВОРИТЕЛИ Апротонные растворители не способны к автопротолизу.
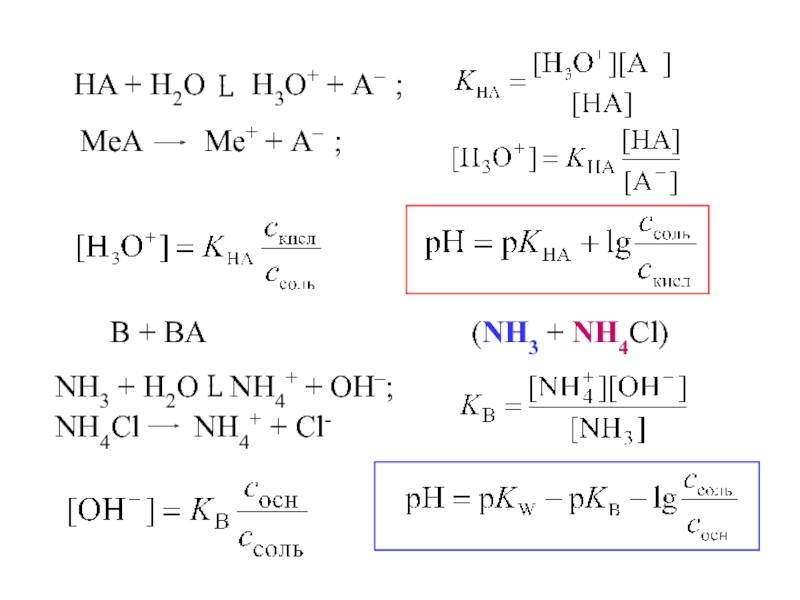
- 16. СИЛА КИСЛОТ И ОСНОВАНИЙ A L
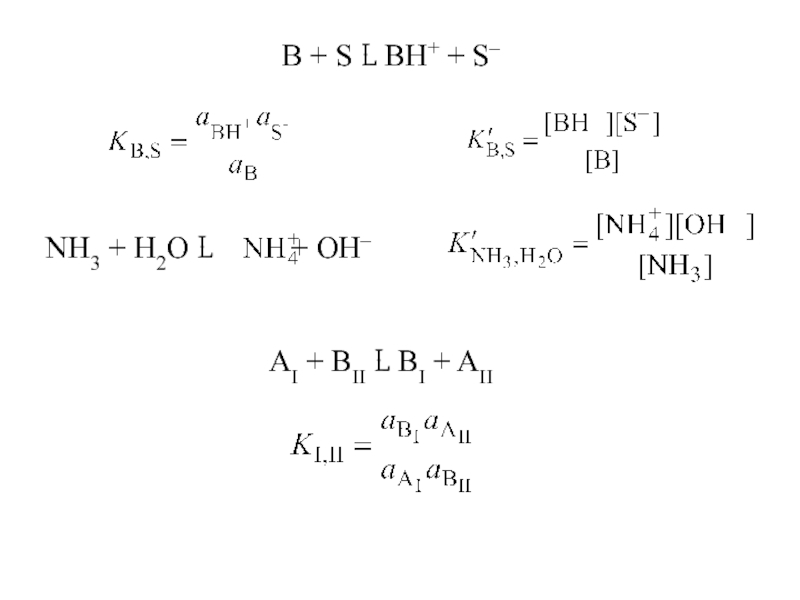
- 17. A + S L B + SH+
- 20. ДИССОЦИАЦИЯ ВОДЫ 2S L S+ +
- 21. Ионное произведение воды pKW при разных температурах
- 22. Водные растворы слабых кислот и оснований
- 23. если α
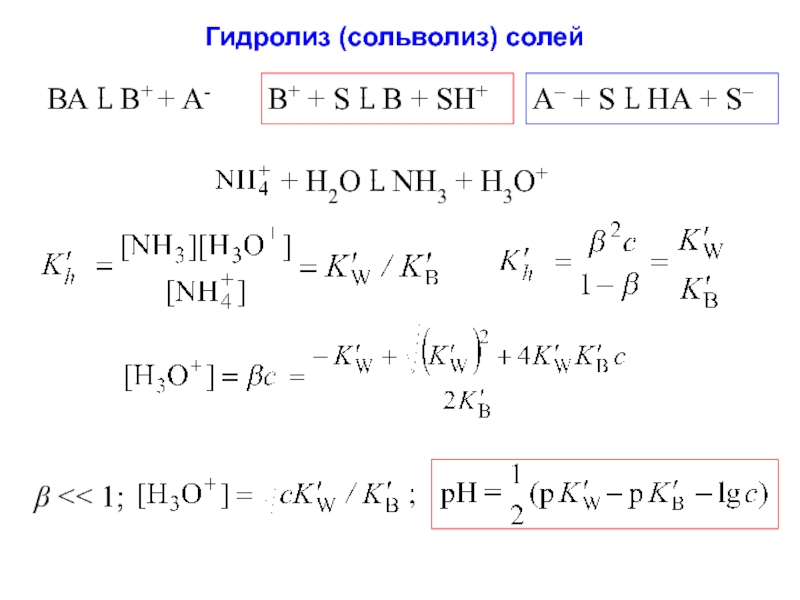
- 24. Гидролиз (сольволиз) солей ВА L B+
- 25. А– + Н2О L НА + ОН– β
- 26. βA – степень гидролиза аниона ;
- 27. БУФЕРНЫЕ РАСТВОРЫ БУФЕРНЫЙ РАСТВОР СОДЕРЖИТ СОПРЯЖЕННЫЕ
- 28. NH3 + H2O L NH4+ + OH–;
- 29. Буферное действие кислый р-р
- 30. рН = 4,756 + lg1
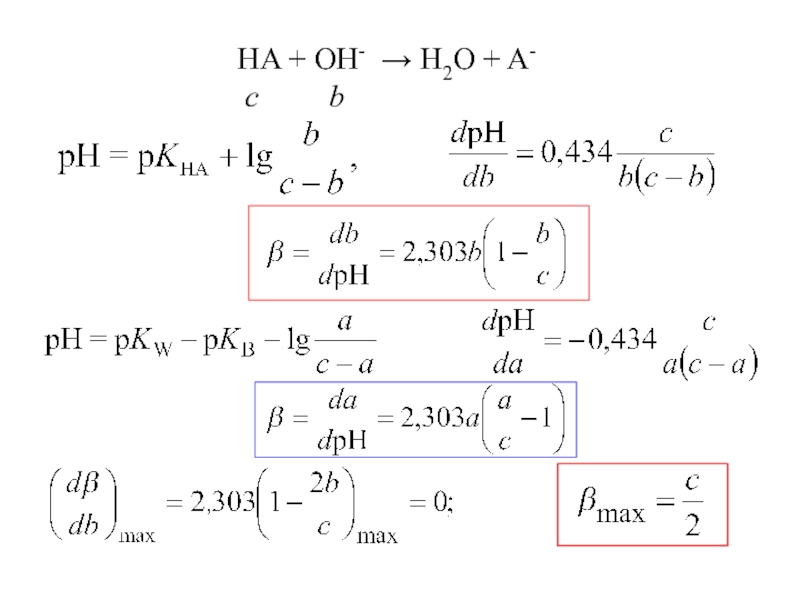
- 31. HA + OH- → H2O + A- c b
- 32. Зависимость рН от состава буферного раствора
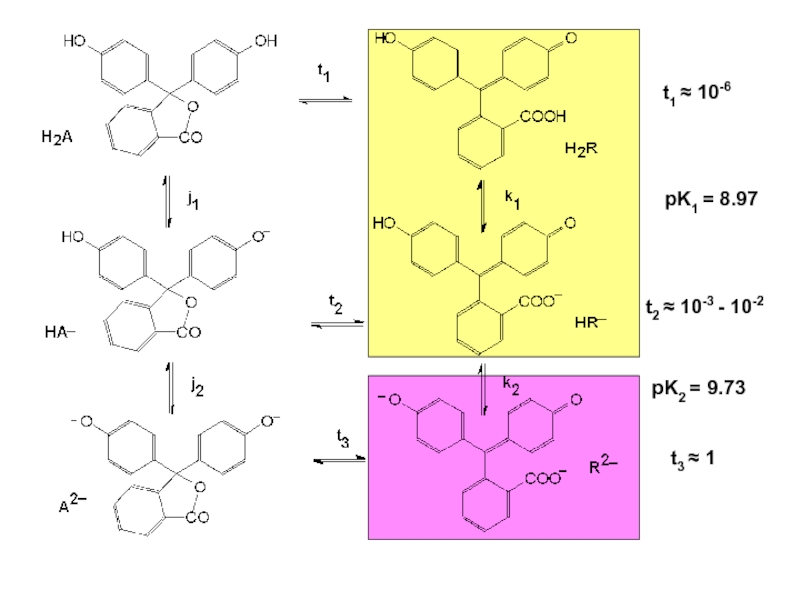
- 34. ИНДИКАТОРЫ
- 35. pH = pKHIn ± 1 интервал перехода,
- 36. 2,4-динитрофенол Бромфеноловый синий (анионы)
- 37. HInI + H2O L H3O+ + InI– HInII + H2O L H3O+ + InII–
- 39. pH 4 2 20 6 100
- 40. t1 ≈ 10-6 t2 ≈
- 41. Характеристики некоторых индикаторов _______________________________________________________________
- 42. Кислотно-основное титрование
- 43. Кривая титрования – зависимость рН от количества
- 44. HA + MeOH → MeA + H2O
- 45. Сильная кислота b = 0,
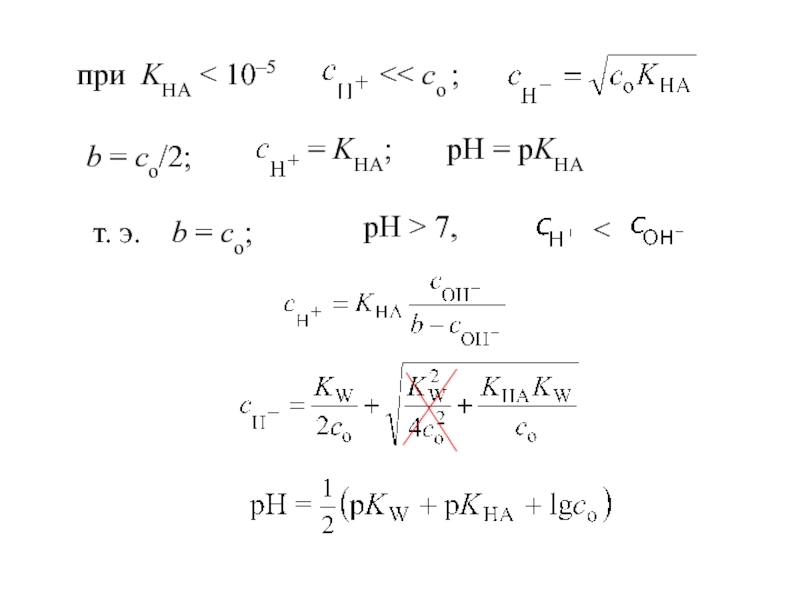
- 46. Слабая кислота
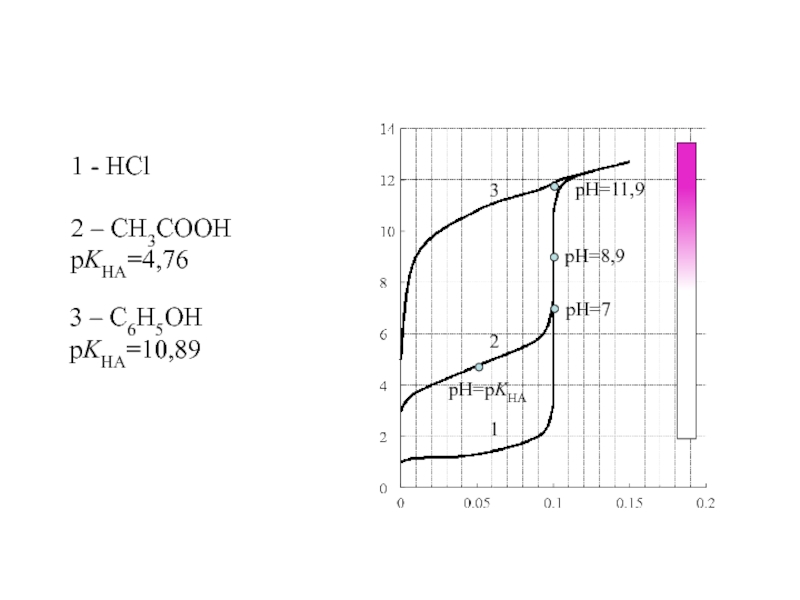
- 47. при KHA < 10–5 b
- 48. 1 2 3
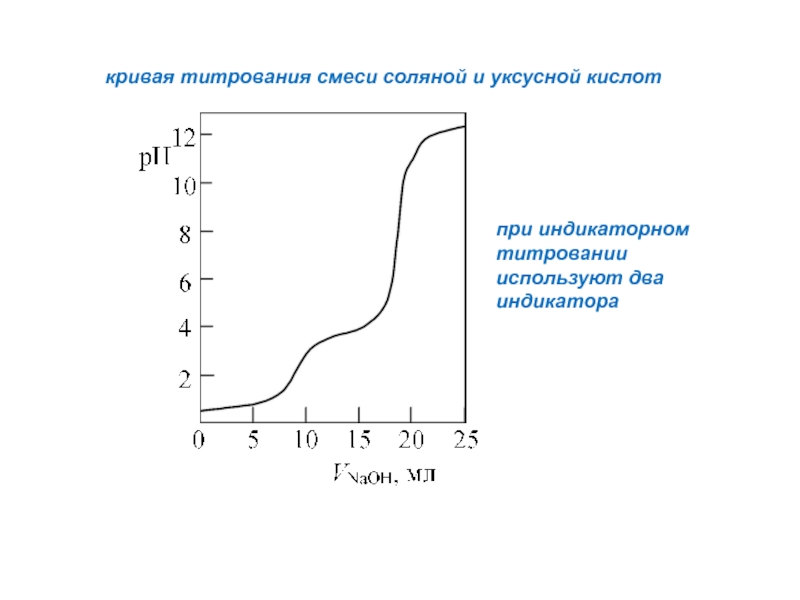
- 49. Титрование смеси двух кислот условие и
- 50. кривая титрования смеси соляной и
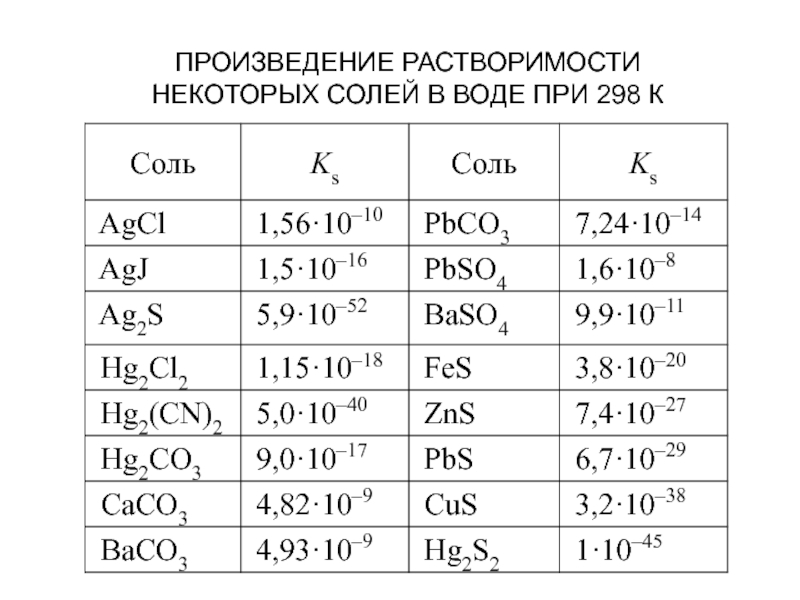
- 51. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ ApBq L pAz+ +qBz- (ПР, La)
- 52. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ НЕКОТОРЫХ СОЛЕЙ В ВОДЕ ПРИ 298 К
Слайд 3
1) высокая ДП; нет ассоциации;
Kасс → 0, Kпр
2) прочный КАSn , Kнест << 1:
3) высокая ДП; большое сродство
к растворяемому в-ву:
4) высокая ДП; большое сродство к ионам;
K′дис → ∞, Kасс → 0:
Kоб → ∞
Слайд 6Другие виды ионных равновесий
Ступенчатая диссоциация электролитов
Более сложные варианты ионной ассоциации
Образование ионных
Ионные равновесия с образованием очень слабых электролитов Образование малодиссоциирующих соединений Образование труднорастворимых соединений Образование комплексных соединений
Сочетание нескольких типов ионных равновесий
Специфический тип – кислотно-основные равновесия
Специфический тип – ионные равновесия в гетерогенных системах и на границах раздела фаз
Слайд 7ДИССОЦИАЦИЯ СЛАБЫХ ЭЛЕКТРОЛИТОВ
НА + Н2О L Н3О+ + А–
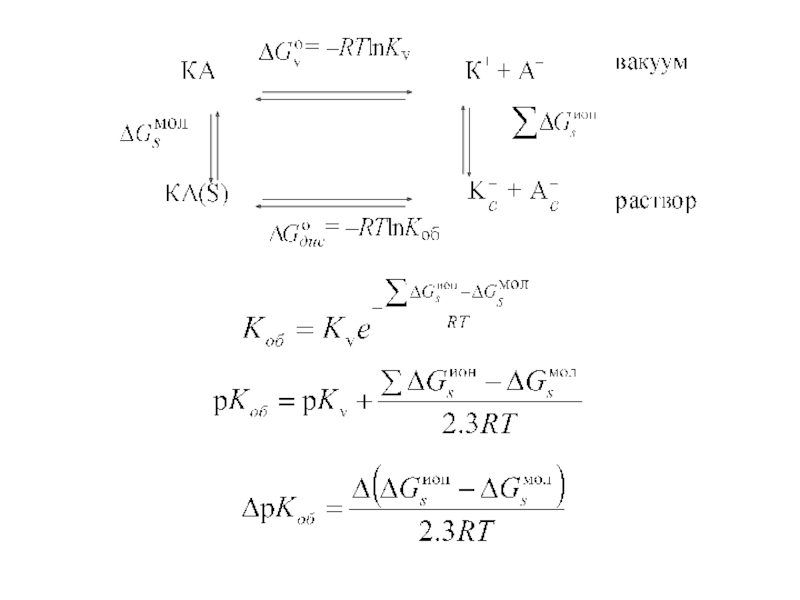
Термодинамическая и концентрационная константы диссоциации
Слайд 9ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ
АРРЕНИУС: HA L
ХИМИЧЕСКИЕ ТЕОРИИ – ОБРАЗОВАНИЕ СОЛИ
Ангидрокислота Ангидрооснование Соль
HCl NH3 NH4Cl
SO3 Na2O Na2SO4
As2O5 K2O K2SO4
PtCl4 KCl K2PtCl6
NH3⋅HClO4 → перхлорат аммония
H2O⋅HClO4 → перхлорат гидроксония
HK+A- - ониевые соли
Слайд 10Амфотерность водородных кислот
СН3СООН + Н2О → Н3О+⋅СН3СОО- ацетат гидроксония
СН3СООН
ТЕОРИИ СОЛЬВОСИСТЕМ
АВТОИОНИЗАЦИЯ
2H2O L H3O+ + OH- 2NH3 L NH4++ NH2-
кислота (в S) + основание (в S) → соль + растворитель S
Слайд 11Растворитель Катион Анион
Н2О Н3О+ ОН– Н3О+Сl– NaOH NaCl
C2H5OH C2H5OH2+ C2H5O– C2H5OH2+Cl- NaOC2H5 NaCl
CH3COOH CH3COOH2+ CH3COO– CH3COOH2+ Cl- CH3COONa NaCl
NH3 NH4+ NH2- NH4Cl NaNH2 NaCl
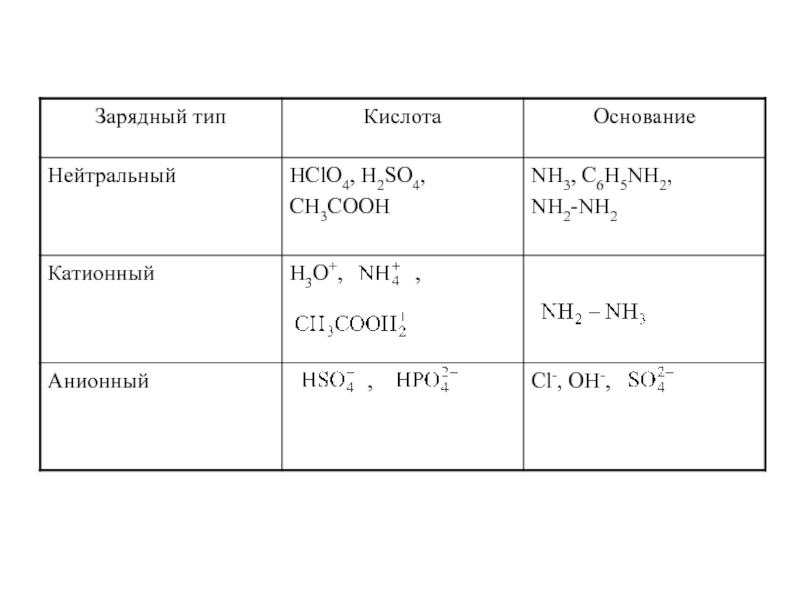
Слайд 12ТЕОРИЯ ЛЬЮИСА
КИСЛОТА – акцептор свободной пары электронов (L-кислота)
ОСНОВАНИЕ - донор свободной
O H O H
O : S + : O : → O : S : O :
O H O H
Br Br
Br : Al + :NC5H5 → Br : Al : NC5H5
Br Br
..
..
..
..
..
..
..
..
..
..
..
..
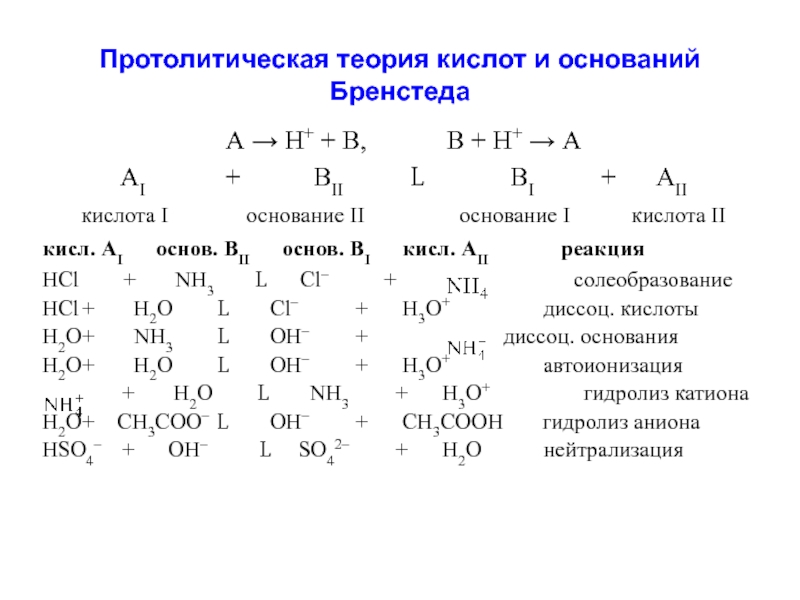
Слайд 13Протолитическая теория кислот и оснований Бренстеда
А → Н+
АI + ВII L BI + АII
кислота I основание II основание I кислота II
кисл. АI основ. ВII основ. ВI кисл. АII реакция
HCl + NH3 L Cl– + cолеобразование
HCl + H2O L Cl– + H3O+ диссоц. кислоты
H2O + NH3 L OH– + диссоц. основания
H2O + H2O L OH– + H3O+ автоионизация
+ H2O L NH3 + H3O+ гидролиз катиона
H2O + CH3COO– L OH– + CH3COOH гидролиз аниона
HSO4– + OH– L SO42– + H2O нейтрализация
Слайд 15РАСТВОРИТЕЛИ
Апротонные растворители не способны к автопротолизу. Они или не участвуют в
Протогенные, или кислые растворители способны отщеплять протон (уксусная, серная кислоты).
Протофильные, или основные растворители способны связывать протон (жидкий аммиак).
Амфотерные растворители проявляют как кислотные, так и основные свойства (вода, спирты).
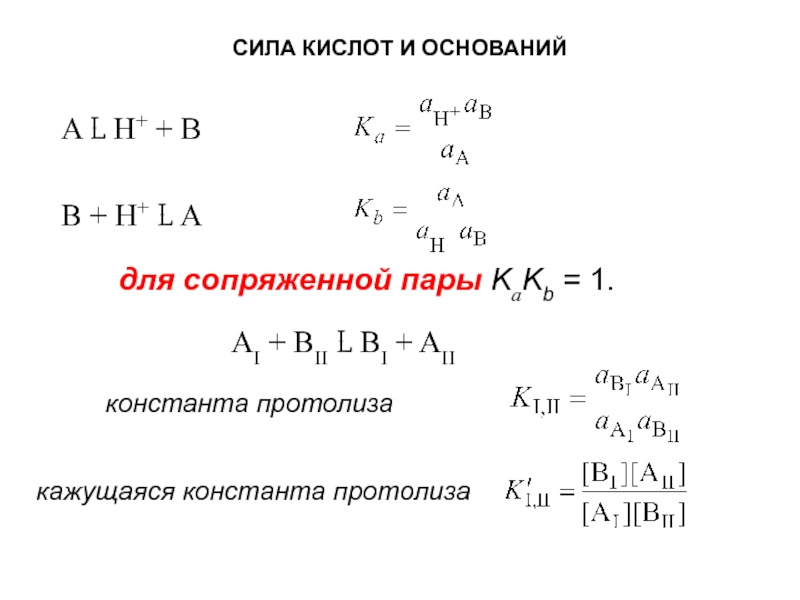
Слайд 16СИЛА КИСЛОТ И ОСНОВАНИЙ
A L H+ + В
В + Н+ L
для сопряженной пары KaKb = 1.
AI + BII L BI + AII
константа протолиза
кажущаяся константа протолиза
Слайд 17A + S L B + SH+
СН3СООН + Н2О L
условная константа протолиза
( константа диссоциации кислоты)
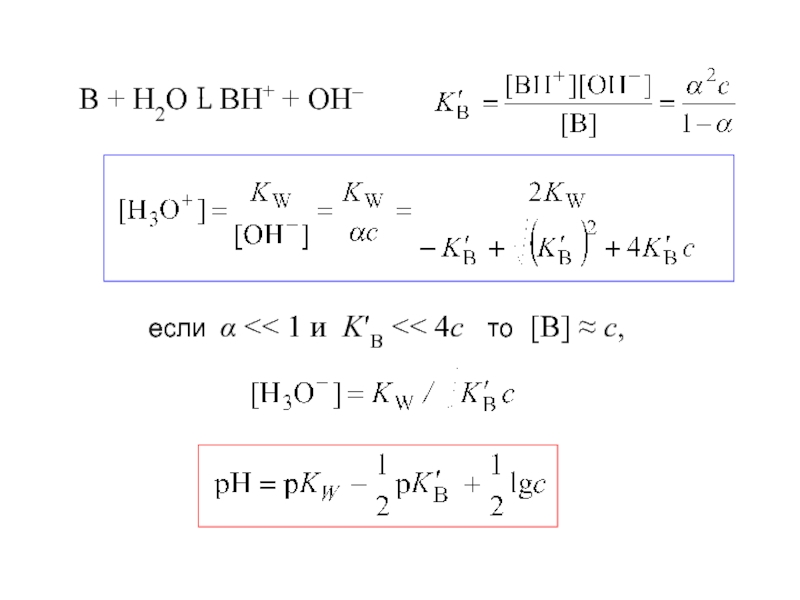
Слайд 20ДИССОЦИАЦИЯ ВОДЫ
2S L S+ + S–,
ионное произведение среды
рН = –
рOН = – lg [ОН–]
ионное произведение воды
рKW = – lg KW = pH + pOH
2Н2О L Н3О+ + ОН–
Слайд 21Ионное произведение воды pKW при разных температурах
___________________________________________________
T, K
______________________________________________________________________________________________
273,15 14,9435 303,15 13,8330
283,15 14,5346 313,15 13,5348
293,15 14,1669 323,15 13,2617
298,15 13,9965 333,15 13,0171
25 °C рKW = 13,997 ≈ 14; pH + pOH = 14
нейтральная среда [H3O+]=[OH−] pH = pOH = 7
кислая среда [H3O+]>[OH−] pH <7 pOH > 7
щелочная среда [H3O+]<[OH−] pH > 7 pOH < 7
Слайд 26
βA – степень гидролиза аниона ; βB – степень гидролиза катиона
[B] = βBc; [HA] = βAc; [A–] = (1 – βA )c; [BH+] = (1 – βB)c,
если (βA ≈ βB) n 1, то ≈ βAβB
Слайд 27БУФЕРНЫЕ РАСТВОРЫ
БУФЕРНЫЙ РАСТВОР
СОДЕРЖИТ СОПРЯЖЕННЫЕ КИСЛОТУ И ОСНОВАНИЕ
НА + МеА (СН3СООН + CH3COONa)
СН3СООН CH3COO-
Слайд 29
Буферное действие
кислый р-р H3O+ + A- =
OH- + HA = H2O + A-
щелочной р-р H3O+ + B = BH+ + H2O
OH- + BH+ = H2O + B
Пример
В 1 л раствора содержится 1 моль СН3СООН и 1 моль
СН3СООNa. В раствор добавлено 0,9 моль НСl.
Определить изменение рН.
Слайд 30 рН = 4,756 + lg1 – lg1 = 4,756
СН3СООNa + НСl = СН3СООН + NaСl
рН = 4,756 + lg0,1 – lg1,9 = 3,478 ΔpH = 1,278
Небуферный раствор:
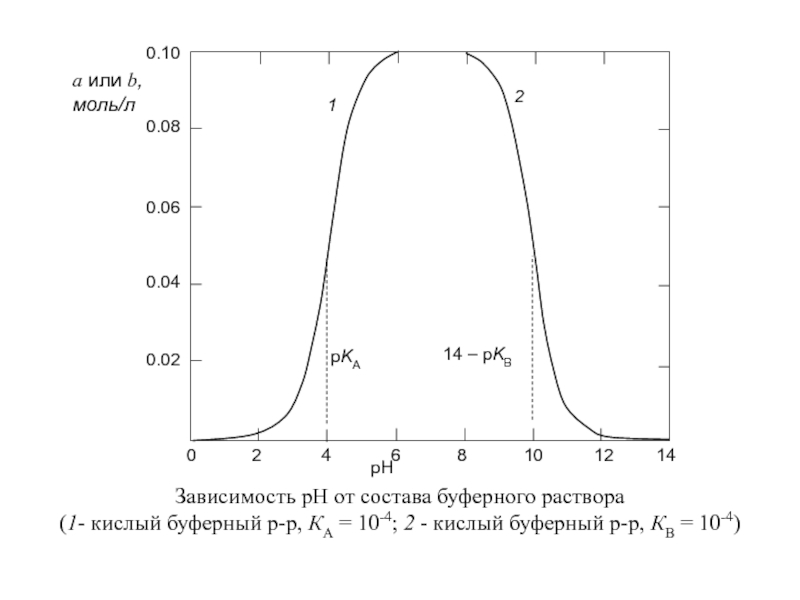
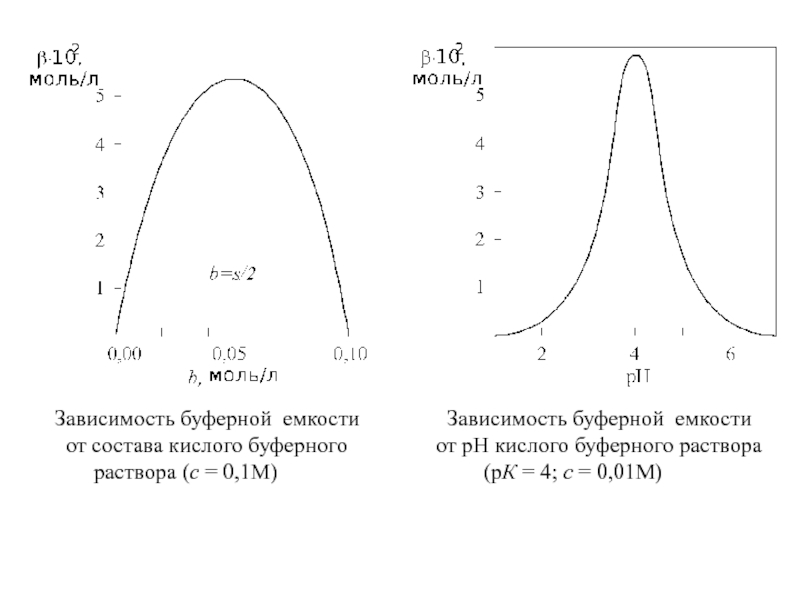
Слайд 32Зависимость рН от состава буферного раствора (1- кислый буферный р-р, КА
pH
Слайд 34ИНДИКАТОРЫ
Кислотно-основным индикатором называют вещество, для которого в некоторой доступной области спектра
[Гаммет Л.П. Основы физической органической химии. М.: Мир, 1972. 535 с.]
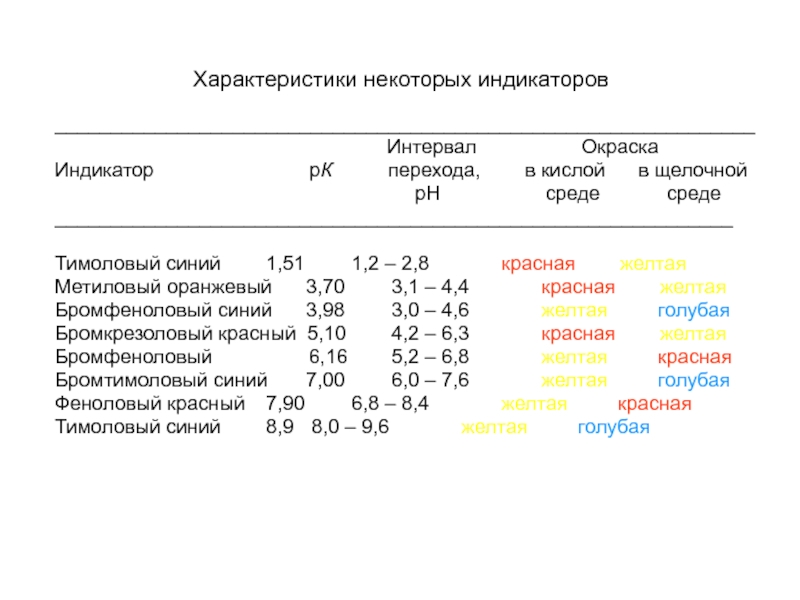
Слайд 41Характеристики некоторых индикаторов
_______________________________________________________________
Индикатор рК перехода, в кислой в щелочной
рН среде среде
_____________________________________________________________
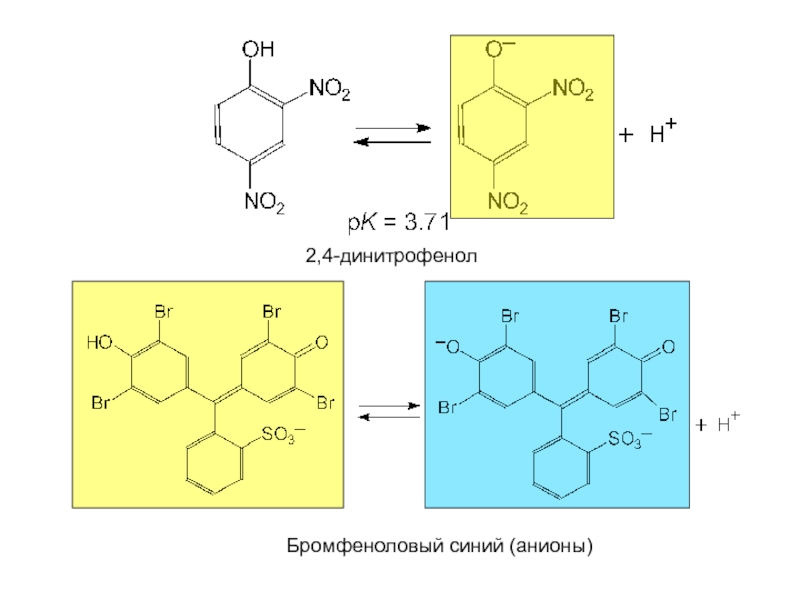
Тимоловый синий 1,51 1,2 – 2,8 красная желтая
Метиловый оранжевый 3,70 3,1 – 4,4 красная желтая
Бромфеноловый синий 3,98 3,0 – 4,6 желтая голубая
Бромкрезоловый красный 5,10 4,2 – 6,3 красная желтая
Бромфеноловый 6,16 5,2 – 6,8 желтая красная
Бромтимоловый синий 7,00 6,0 – 7,6 желтая голубая
Феноловый красный 7,90 6,8 – 8,4 желтая красная
Тимоловый синий 8,9 8,0 – 9,6 желтая голубая
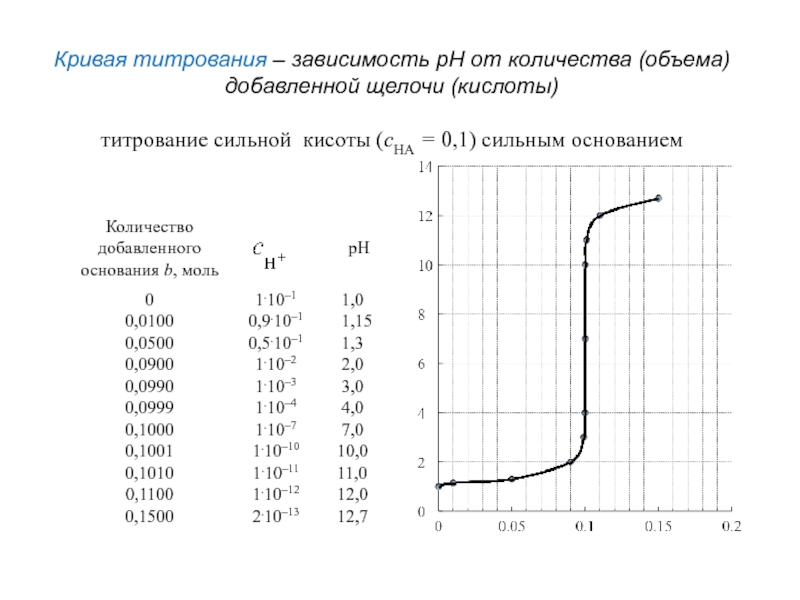
Слайд 43Кривая титрования – зависимость рН от количества (объема)
добавленной щелочи (кислоты)
титрование
Слайд 49Титрование смеси двух кислот
условие и точность совместного титрования двух кислот
при coI = coII =0,1 точность титрования 1% достигается, если KII/KI > 104
при coI = coII =0,1 и KII/KI = 103
точность титрования 10%
при KII/KI < 102 кислоты не раститровываются
при титровании в воде точности 0,1% можно достичь, если KHA l 10-6









![ДИССОЦИАЦИЯ ВОДЫ2S L S+ + S–, ионное произведение средырН = – lg [Н3О+] рOН =](/img/tmb/4/355335/4d5203679736ccefd47a402c930fb9f3-800x.jpg)



![βA – степень гидролиза аниона ; βB – степень гидролиза катиона [B] = βBc;](/img/tmb/4/355335/d76754036ab6d7aabc3fd1bf9e54f3e0-800x.jpg)





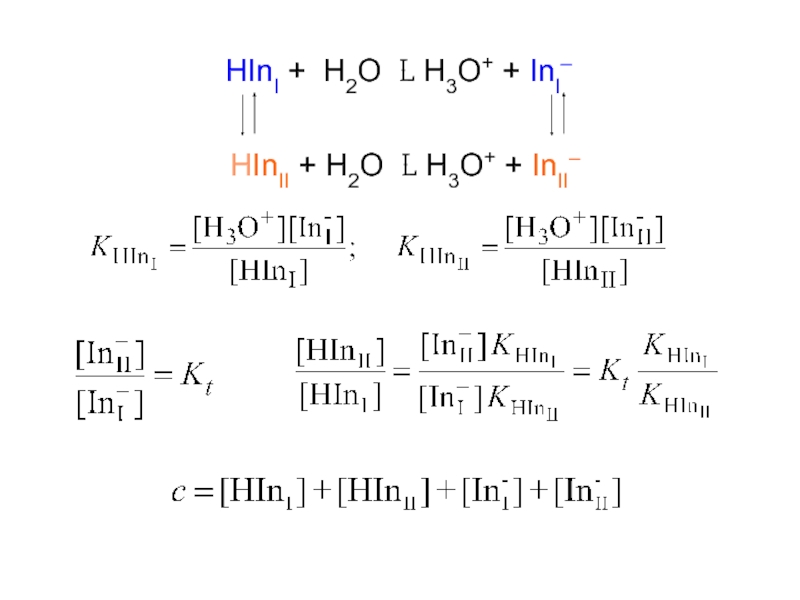
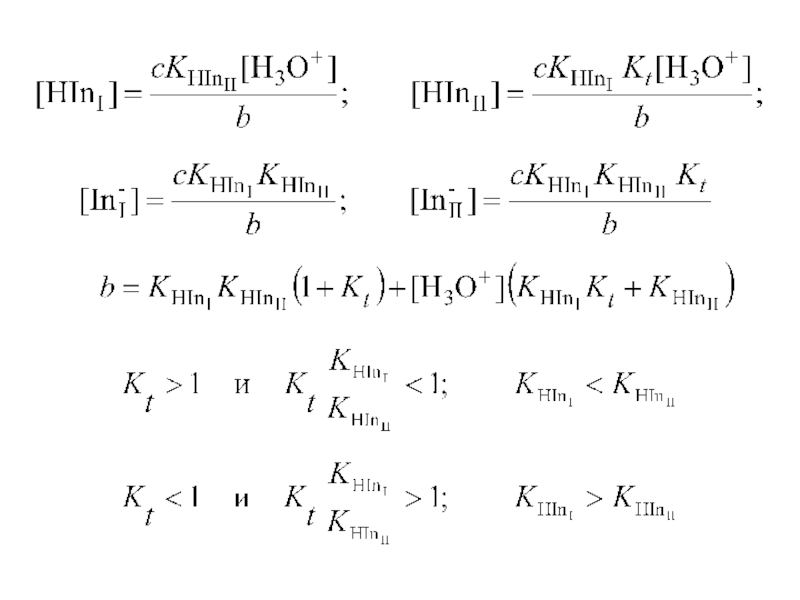
![pH42206100608040c,%012108[HInI][HInII]](/img/tmb/4/355335/83dccb08284f73d75ca8c036a96d6b63-800x.jpg)