- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Хімічна кінетика презентация
Содержание
- 1. Хімічна кінетика
- 2. План: 1. Предмет і значення хімічної кінетики.
- 3. КІНЕТИКА - це розділ хімії, який
- 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ - показує зміну концентрації
- 5. На швидкість гомогенних (однорідних) хімічних реакцій впливають:
- 6. Для гетерогенних реакцій – найбільше значення має
- 7. 2. Вплив концентрацій речовин на швидкість хімічної
- 8. У середині XIX ст. (1865 р. -
- 9. k1 і k2 - це константи швидкості
- 10. Вплив природи реагентів на швидкість хімічної
- 11. Вплив температури на швидкість хімічної реакції
- 12. Вплив тиску на швидкість хімічної реакції
- 13. Вплив розчинника на швидкість хімічної реакції
- 14. 3. Молекулярність і порядок реакції Мономолекулярна реакція
- 15. ПОРЯДОК РЕАКЦІЇ - число, що рівне сумі
- 17. Порядок реакції визначають: по графіку залежності
- 18. 4. Вплив каталізатора на швидкість хімічної реакції
- 19. У хімічну взаємодію вступають тільки молекули з
- 20. Якщо Еак < 20 кДж/моль -
- 22. 5. Теорія “активних комплексів” Каталізаторами називають
- 23. 6. Ферментативний каталіз ФЕРМЕ́НТИ або ензи́ми —
- 24. Функції ферментів Ферменти виступають в ролі каталізаторів
- 25. Особливості дії ферментів: 1) Ферменти - в
- 26. 4) Швидкість біохімічних реакцій залежать як від
- 27. Для дальшого протікання реакції: де Р -
- 28. Рівняння Міхаеліса-Ментен: k1 = [E]·[S] = k2·[ES]
- 29. Кm -знаходиться експериментально Де
- 30. Рівняння Міхаеліса - Ментена має два граничних
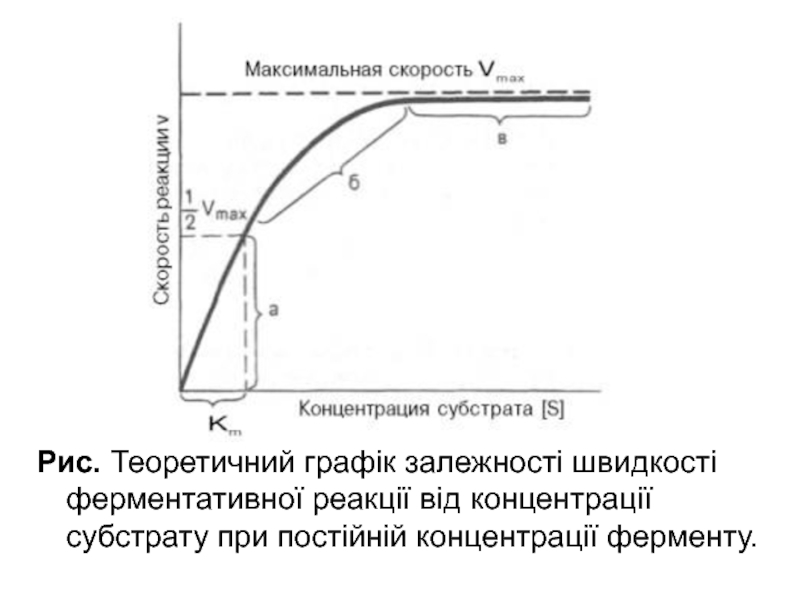
- 31. Рис. Теоретичний графік залежності швидкості ферментативної реакції від концентрації субстрату при постійній концентрації ферменту.
Слайд 2План:
1. Предмет і значення хімічної кінетики.
2. Вплив факторів на швидкість хімічної
3. Порядок реакції
4. Каталіз.
5. Теорія активних комплексів
6. Ферментативний каталіз
Слайд 3КІНЕТИКА - це розділ хімії,
який вивчає швидкість хімічних реакцій і
Слайд 4ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ - показує зміну концентрації реагуючих речовин (С) за
[моль/літр*сек]
Слайд 5На швидкість гомогенних (однорідних) хімічних реакцій впливають:
природа реагуючих речовин;
концентрація реагентів;
температура;
тиск;
природа розчинника;
наявність каталізатора.
Слайд 6Для гетерогенних реакцій – найбільше значення має площа поверхні контакту
ВІДЕО 1
Швидкість
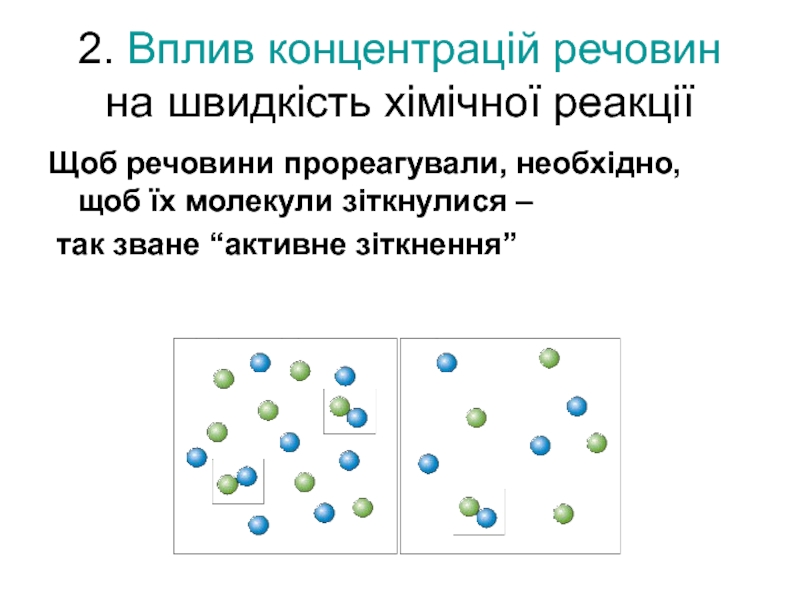
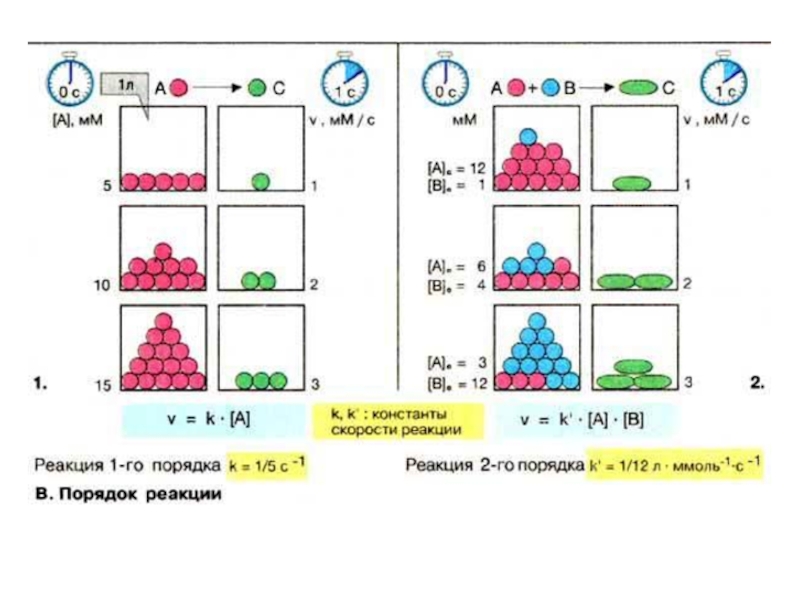
Слайд 72. Вплив концентрацій речовин на швидкість хімічної реакції
Щоб речовини прореагували,
так зване “активне зіткнення”
Слайд 8У середині XIX ст. (1865 р. - М. М. Бекетов, 1867
При постійній температурі
швидкість хімічної реакції прямопропорціональна діючим масам - молярним концентраціям реагуючих речовин, взятих в ступені відповідного стехіометричного коефіцієнту
aA + bB ⮀ cC +dD
υпр.=k1[A]a•[B]b
υзв.=k2[C]c• [D]d
Слайд 9k1 і k2 - це константи швидкості відповідно прямої і зворотної
Фізичний зміст констант відображає природу реагуючих речовин, а числове значення їх відповідає швидкості реакції, коли концентрація кожного із вихідних речовин рівна 1 моль/л.
υпр.=k1 υзв.=k2
Відео 2
Слайд 10Вплив природи реагентів
на швидкість хімічної реакції
Константа швидкості реакції залежить в
від природи реагуючих речовин
Під "природою реагуючих речовин" розуміють:
1. Для речовин молекулярної будови - тип хімічних зв'язків у молекулах реагентів, міцність зв'язків. Щоб молекула прореагувала, зв'язок в ній необхідно розірвати.
2. Для речовин немолекулярное будови (іонний або атомний кристал) - будова кристалічної решітки, її міцність.
3. Для речовин, у яких "молекула" складається з одного атома (наприклад, метали, благородні гази) - будова електронної оболонки атома, міцність зв'язування зовнішніх електронів.
Відео 3_4
Слайд 11Вплив температури на швидкість хімічної реакції
збільшення хаотичості руху молекул приводить до
Правило Вант-Гоффа
при підвищенні температури реакції на кожні 10°С швидкість реакції зростає в 2- 4 рази
Для біосистем використовують γ2, γ3, γ5
γ= 7-10 (оскільки температура=36,6-42°С)
відео 5?
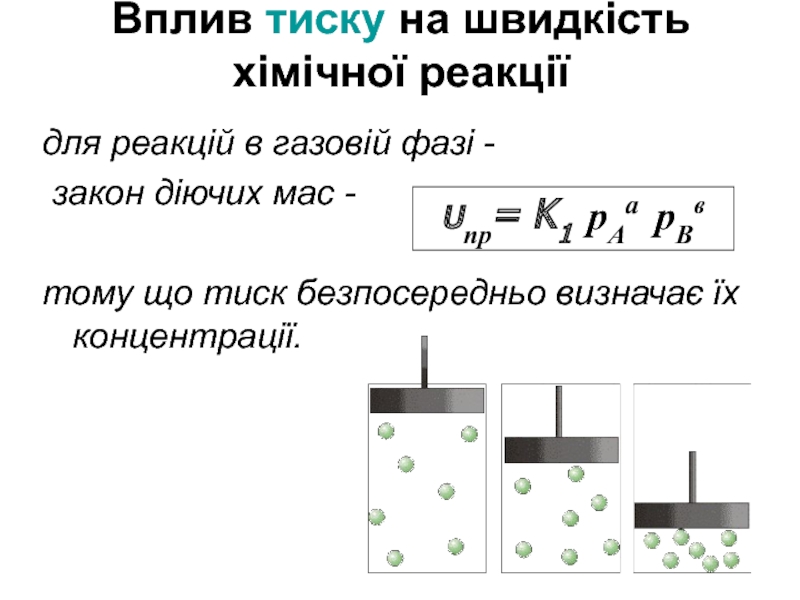
Слайд 12Вплив тиску на швидкість хімічної реакції
для реакцій в газовій фазі -
тому що тиск безпосередньо визначає їх концентрації.
υпр= K1 рАа рВв
Слайд 13Вплив розчинника на швидкість хімічної реакції
розчинник має значення тільки
для рідкофазних
Слайд 143. Молекулярність і порядок реакції
Мономолекулярна реакція - приймає участь тільки одна
Бімолекулярна реакція - приймає участь дві молекули
Тримолекулярна реакція – одночасна взаємодія трьох молекул
Ca(HCO3)2 → CaCO3 + H2O + CO2
J2 + H2 → 2HJ
Слайд 15ПОРЯДОК РЕАКЦІЇ - число, що рівне сумі показників, що відповідають стехіометричним
Нап, для реакції нульового порядку
швидкість реакції не залежить від концентрації реагента
В реакції першого порядку можуть приймати участь два компоненти, але швидкість реакції залежить тільки від одного з них – того, якого є менше.
aA + bB = cC + dD
де υпр.=k1[A]a*[B]b і υзв.=k2[C]c*[D]d
n1 = a + b і n2 = c + d
нульовий порядок реакції υ=k * c0
υ = k * c0
υ = k * c1
Слайд 17Порядок реакції визначають:
по графіку залежності концентрації реагенту від часу;
2) методом підстановки;
3)
Слайд 184. Вплив каталізатора на швидкість хімічної реакції
КАТАЛІЗАТОРИ –це речовини, які збільшують
ІНГІБІТОРИ - це речовини які сповільнюють реакцію.
Вони не беруть безпосередю участі у реакції і залишаються незмінними результаті реакції.
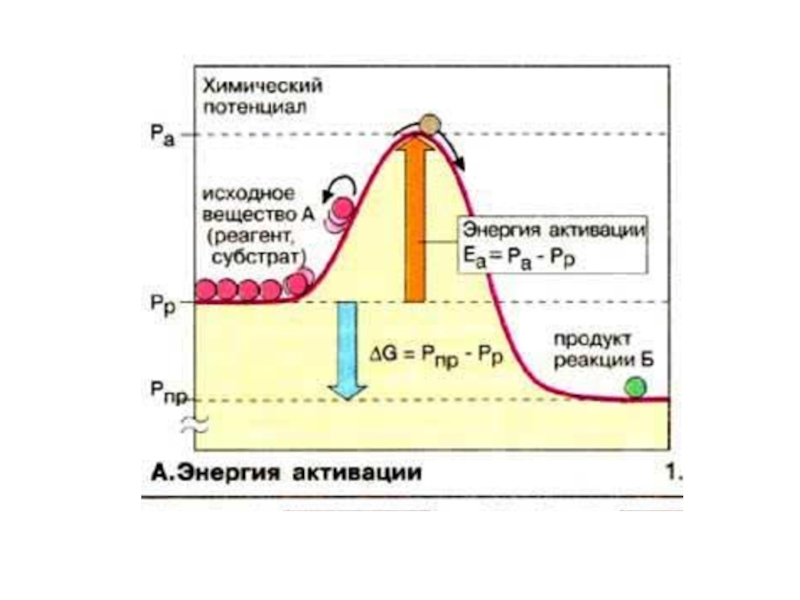
Слайд 19У хімічну взаємодію вступають тільки молекули з достатньо високим рівнем кінетичної
K - константа швидкості реакції моль/л*с
А - предекспоненціяльний множник, K, коли всі молекули активні.
Еа - енергія активації Дж/моль.
R - універсальна газова постійна 8,314 Дж/моль*К.
T - абсолютна температура.
е - основа натурального логарифму. *
K=Aе-Еа/RT
Слайд 20Якщо
Еак < 20 кДж/моль - реакція проходить при температурі до
Еак > 120 кДж/моль, то t > 250 ° C.
ЕНЕРГІЯ АКТИВАЦІЇ (Еа) – це мінімальна енергія, яку повинні мати молекули, щоб їх зіткнення призвело до елементрного акту взаємодії
Слайд 225. Теорія “активних комплексів”
Каталізаторами називають речовини, які допомагають знижувати енергію активації.
А+В→АВ
А+К→АК Е2
АК+В→АВ+К Е3
Е2+Е3<Е1
Де АК – активний комплекс
некаталітичні реакції Еа=45-30 ккал/моль
Каталітичні Е=30-16 ккал/моль
ферментативні реакції Е=12-8 ккал/моль
Слайд 236. Ферментативний каталіз
ФЕРМЕ́НТИ або ензи́ми — органічні каталізатори білкової або РНК природи.
Поділяються на:
прості (тільки білки);
ко-ферменти (крім білків можуть мати й інші компоненти, нап. Катіони d-елементів)
Ферменти — це високоефективні катализатори.
Слайд 24Функції ферментів
Ферменти виступають в ролі каталізаторів практично у всіх біохімічних реакціях,
— ними каталізується біля 4000 хімічно окремих біореакцій.
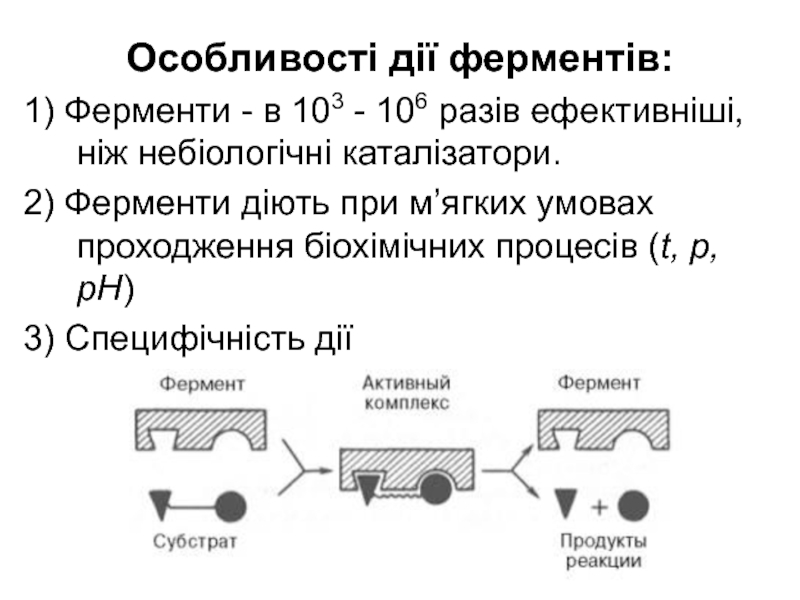
Слайд 25Особливості дії ферментів:
1) Ферменти - в 103 - 106 разів ефективніші,
2) Ферменти діють при м’ягких умовах проходження біохімічних процесів (t, p, pH)
3) Специфічність дії
Слайд 264) Швидкість біохімічних реакцій залежать як від концентрації реагуючих речовин (субстрата
k1
Е +S ⮀ ЕS
k2
Е – фермент (ензим)
S – субстрат
ЕS – фермент субстратний комплекс
Де KS - константа дисоціації
Слайд 27Для дальшого протікання реакції:
де Р - продукт реакції
k1 - константа швидкості
k2 - константа швидкості розпаду комплексу;
k3- константа швидкості переходу комплексу в продукт реакції і фермент.
k1 k3 km
Е +S ⮀ ЕS → ... → Е + Р
k2
Слайд 28Рівняння Міхаеліса-Ментен:
k1 = [E]·[S] = k2·[ES] = (k2 + k3) ·
Константу К3 називають числом обертів ферменту.
νmax = K3 · [E0]
де Кm - константа Міхаеліса
Слайд 30Рівняння Міхаеліса - Ментена має два граничних випадки :
коли [S]
коли [S] >> Km, то швидкість має нульовий порядок відносно [S]






















![Рівняння Міхаеліса-Ментен:k1 = [E]·[S] = k2·[ES] = (k2 + k3) · [ES]Константу К3 називають числом](/img/tmb/6/511918/001b30e1974b827dfe09c34e9d3dc2e1-800x.jpg)

![Рівняння Міхаеліса - Ментена має два граничних випадки : коли [S] > Km, то швидкість](/img/tmb/6/511918/887249d8ca98a5cfb327d555f943ecf3-800x.jpg)