- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Хлор презентация
Содержание
- 1. Хлор
- 2. Хлор в периодической системе Д. И. Менделеева
- 3. Нахождение Cl в природе
- 4. Нахождение Cl в природе
- 5. Получение хлора Впервые хлор
- 6. Получение хлора В лабораторных
- 7. Физические свойства
- 8. Физические свойства
- 9. Химические свойства Хлор
- 10. Взаимодействие хлора с
- 11. Взаимодействие хлора с
- 12. Применение хлора
- 13. Спасибо за внимание
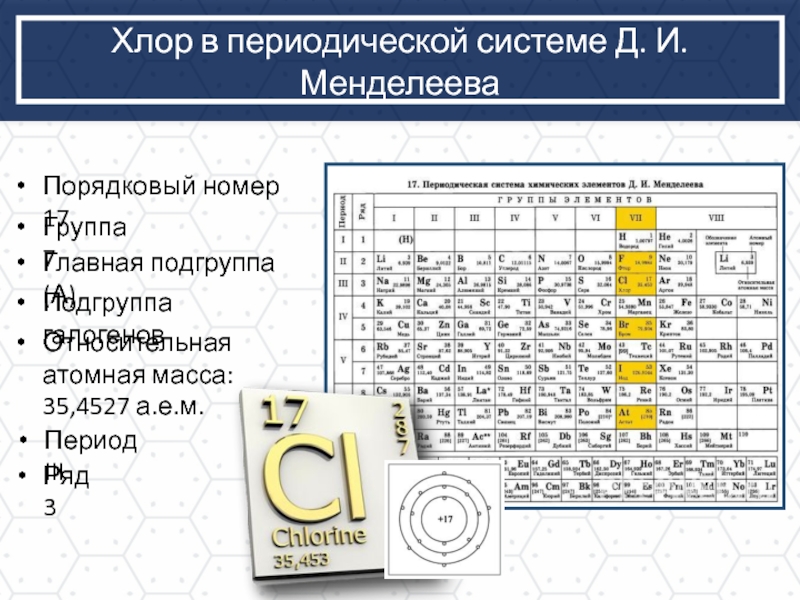
Слайд 2Хлор в периодической системе Д. И. Менделеева
Порядковый номер 17
Группа 7
Главная подгруппа
Подгруппа галогенов
Период III
Ряд 3
Относительная атомная масса: 35,4527 а.е.м.
Слайд 3
Нахождение Cl в природе
В природе хлор встречается только в виде соединений
Галит NaCl
(соль)
Сильвин KCl
Сильвинит
KCl · NaCl
Слайд 4
Нахождение Cl в природе
В земной коре хлор - самый распространённый галоген.
Содержание
Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
Содержание Cl в морской воде в среднем около 18,8 г/л
Слайд 5
Получение хлора
Впервые хлор получил шведский химик Карл Шееле в 1774 году
Для этого в промышленности используют постоянный электрический ток
Для получения хлора в свободном состоянии надо окислить его ионы
Слайд 6
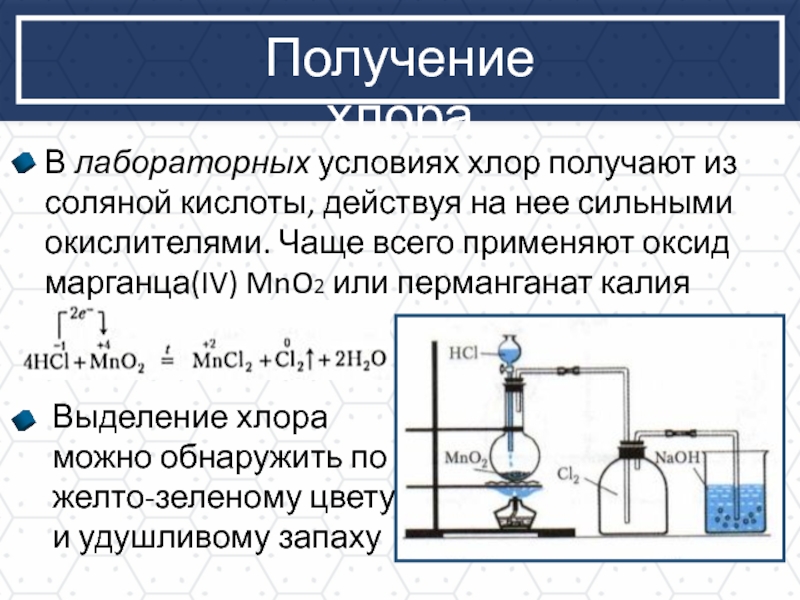
Получение хлора
В лабораторных условиях хлор получают из соляной кислоты, действуя на
Выделение хлора можно обнаружить по желто-зеленому цвету
и удушливому запаху
Слайд 7
Физические свойства
Хлор при обычных условиях – газ желто-зеленого цвета с резким
При атмосферном давлении хлор при -34°C переходит в жидкое состояние, а при -101°C затвердевает.
Слайд 8
Физические свойства
Хлор под давлением около 0,6 МПа уже при комнатной температуре
Хлор хорошо растворим во многих органических растворителях
Слайд 9
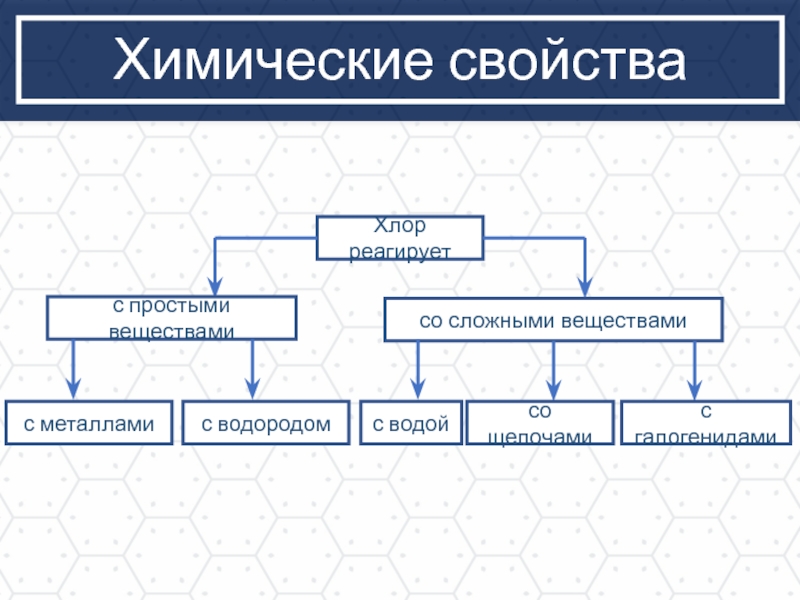
Химические свойства
Хлор реагирует
с простыми веществами
со сложными веществами
с металлами
с водородом
с водой
со щелочами
с
Слайд 10
Взаимодействие хлора с другими элементами
I. Взаимодействие хлора с простыми веществами
1.
(При повышенной температуре хлор реагирует также с медью, железом и некоторыми др. металлами
С некоторыми металлами хлор реагирует при обычной температуре, например с сурьмой
2. Хлор реагирует с водородом. Реакция хлора с водородом начинается при нагревании или освещении
Слайд 11
Взаимодействие хлора с другими элементами
II . Взаимодействие хлора со сложными
Хлор реагирует с водой. Можно наблюдать, как реагирует хлор с водой, если выставить на свет колбу, наполненную раствором хлора в воде – хлорной водой. Через некоторое время можно заметить выделение пузырьков газа – это кислород. Раствор постепенно утрачивает зеленоватый цвет, а синий лакмус в нем приобретает красный цвет. Происходит реакция, в которой образуются две кислоты
Хлор реагирует со щелочами
Хлор вытесняет из солей бром и йод