- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе презентация
Содержание
- 1. Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
- 5. Простые и комплексные соединения HgI2 + 2KI
- 6. Комплексные (координационные) соединения Комплексами называют сложные частицы,
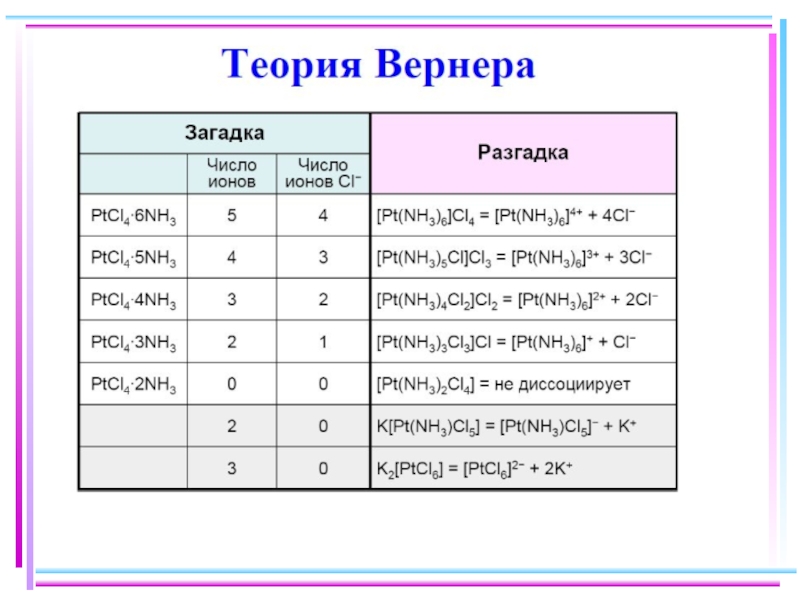
- 7. Координационная теория (1893 г. ) Внутренняя и
- 8. Внутренняя сфера [комплекс] Внешняя сфера (противоион)
- 9. Комплексообразователь, лиганды, КЧ и дентатность. Примеры [NH4]Cl
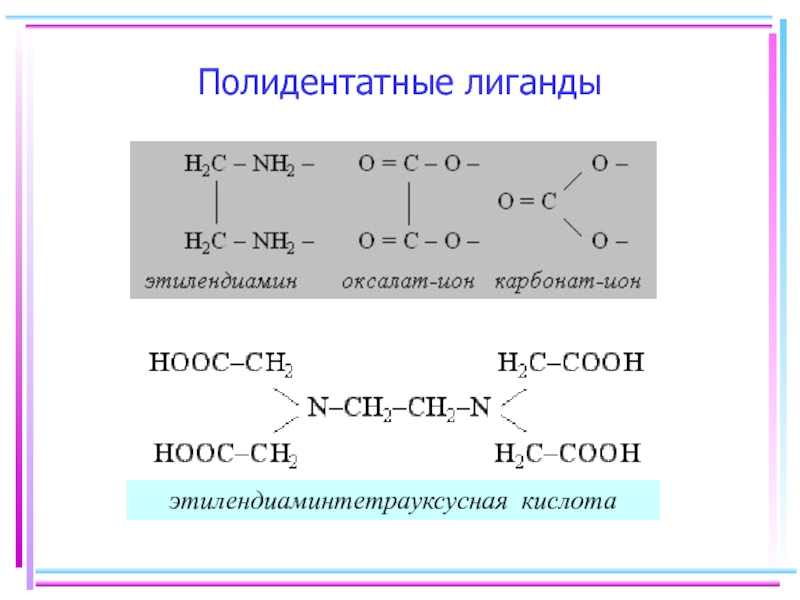
- 10. Полидентатные лиганды
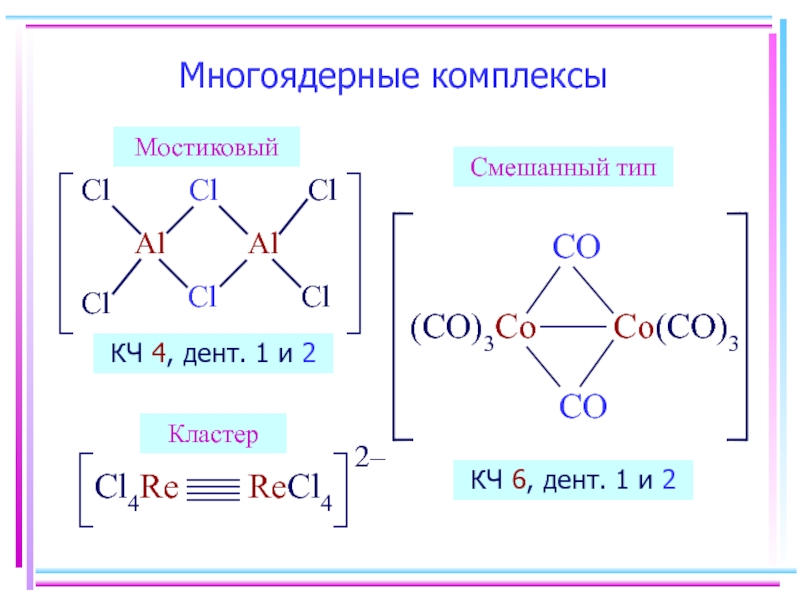
- 11. Многоядерные комплексы КЧ 4, дент. 1 и
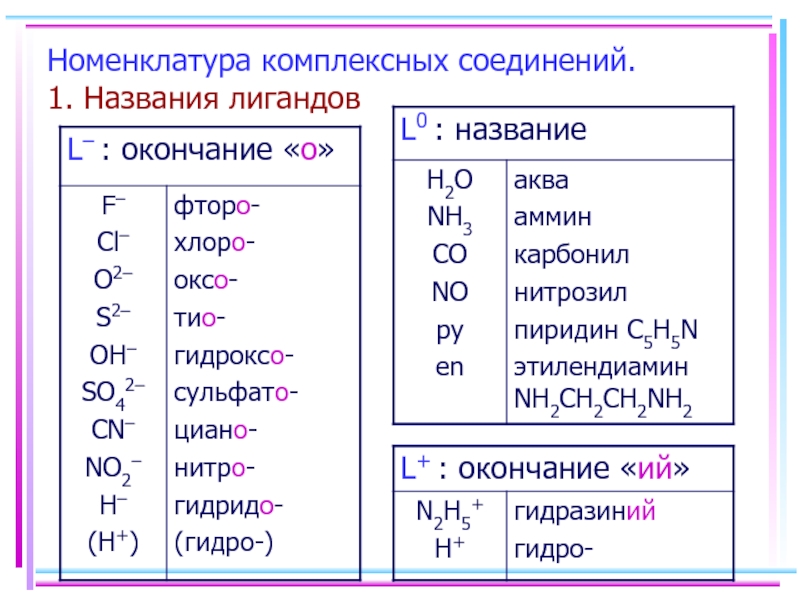
- 12. Номенклатура комплексных соединений. 1. Названия лигандов
- 13. 2. Формулы и названия компл. соединений.
- 14. 3. Названия комплексных соединений А) Комплексы
- 15. Названия комплексных соединений Б) Комплексный катион [MLn]+X–
- 16. Названия комплексных соединений В) Комплексный анион X+[MLn]–
- 17. Упражнения: Na3[AgI(SO3S)2] – бис(тиосульфато)аргентат(I) натрия [PtII(py)4]2[FeII(CN)6]
- 18. Изомерия комплексных соединений Изомерия – явление существования
- 19. Изомерия лигандов Связевая —NO2– и
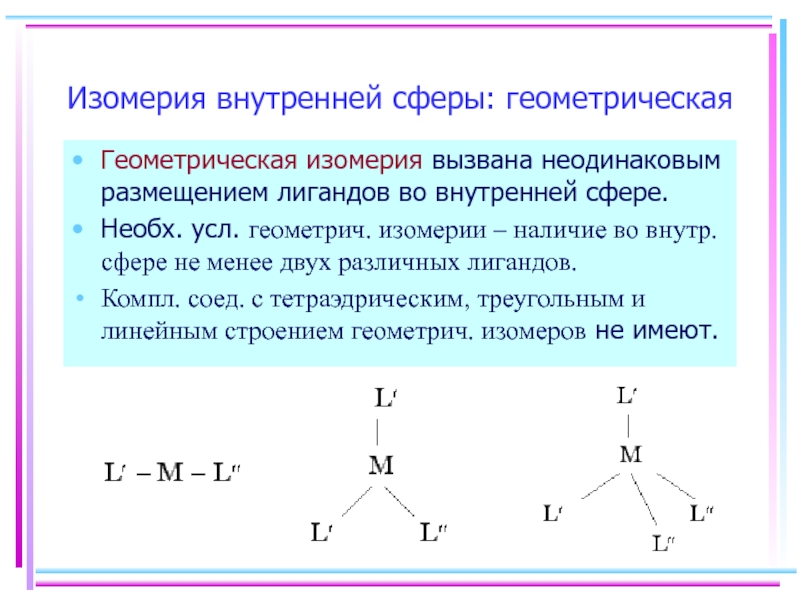
- 20. Изомерия внутренней сферы: геометрическая Геометрическая изомерия вызвана
- 21. Геометрическая изомерия Плоскоквадратные комплексы при наличии двух
- 22. Геометрическая изомерия [ML′5L′′]: изомеров нет цис- и транс-изомеры дигидроксотетраамминкобальта(II)
- 23. Изомерия внутр. сферы: оптическая Оптическая (зеркальная)
- 24. Оптическая изомерия Оптические изомеры способны вращать плоскость
- 25. Междусферная изомерия: 1) сольватная (гидратная); 2) ионная
- 26. Междусферная изомерия Ионные (ионизационные) изомеры [Pt(NH3)4Cl2]Br2
- 27. Комплексные соединения в растворах Неэлектролиты (слабые электролиты)
- 28. [MLn] + H2O ⮀ [MLn-1(H2O)] + L0
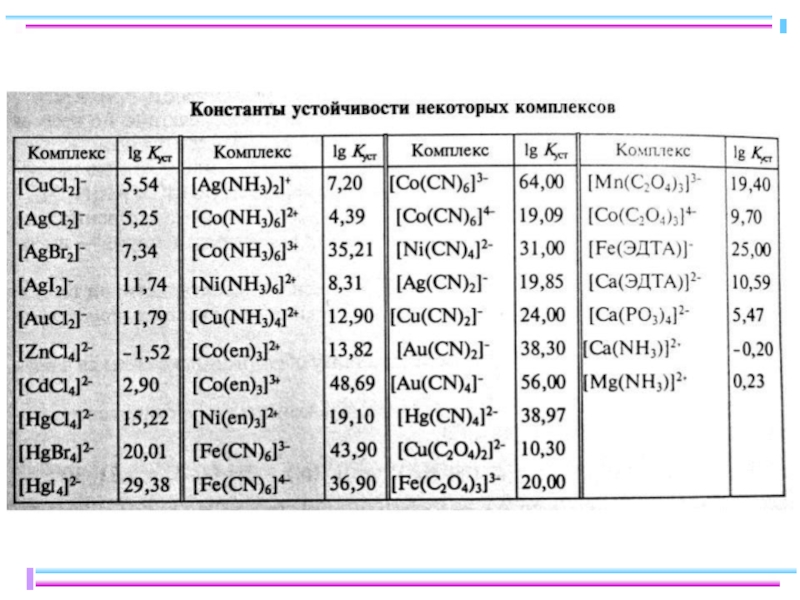
- 29. Чем больше значение Ki(обр), тем сильнее
- 30. Полные (суммарные) константы образования Характеристика устойчивости
- 31. Связь между полной и ступенчатой константами образования βn(обр) = K1(обр)·K2(обр)·K3(обр)·… ·Kn(обр)
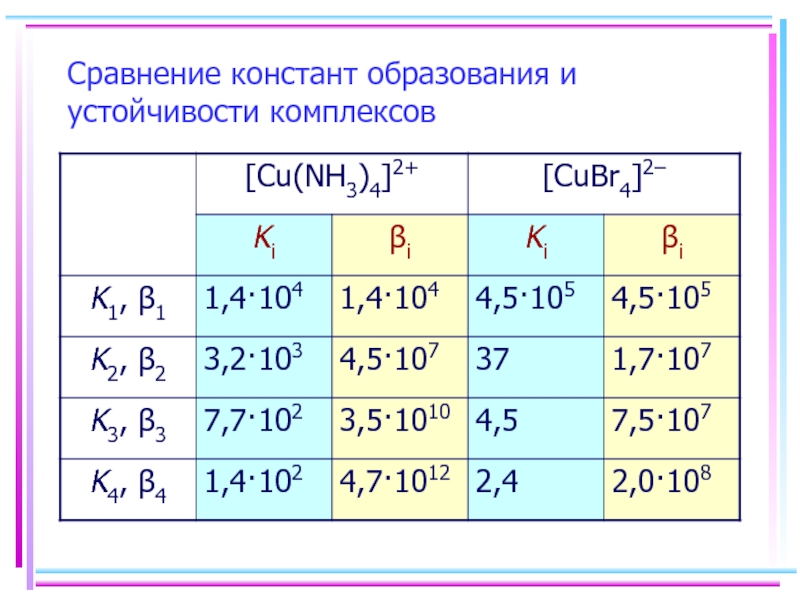
- 32. Сравнение констант образования и устойчивости комплексов
- 33. Сравнение устойчивости аммиачных комплексов Ступени комплексообразования [Cu(NH3)2]+
- 34. Хелат-эффект [Ni(NH3)6]2+ β6(обр)= 5,3
- 35. Квантовомеханические теории строения комплексных соединений Для объяснения
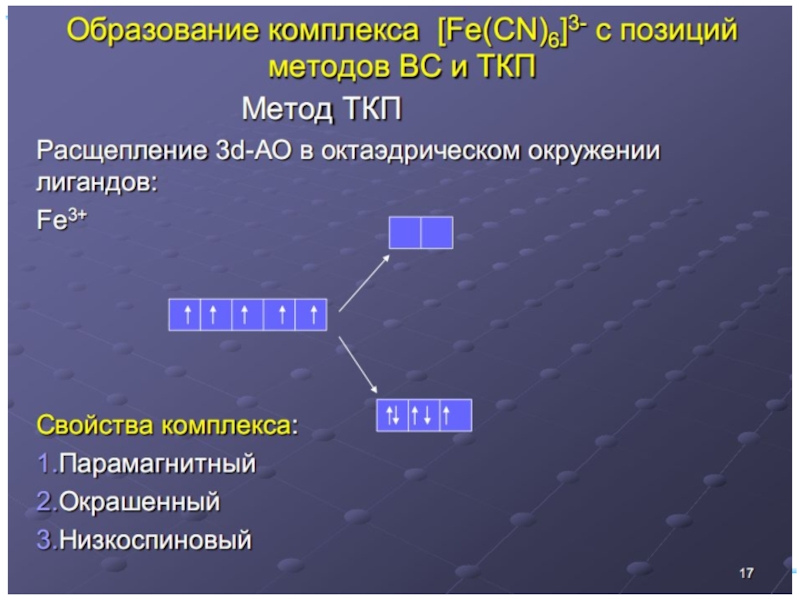
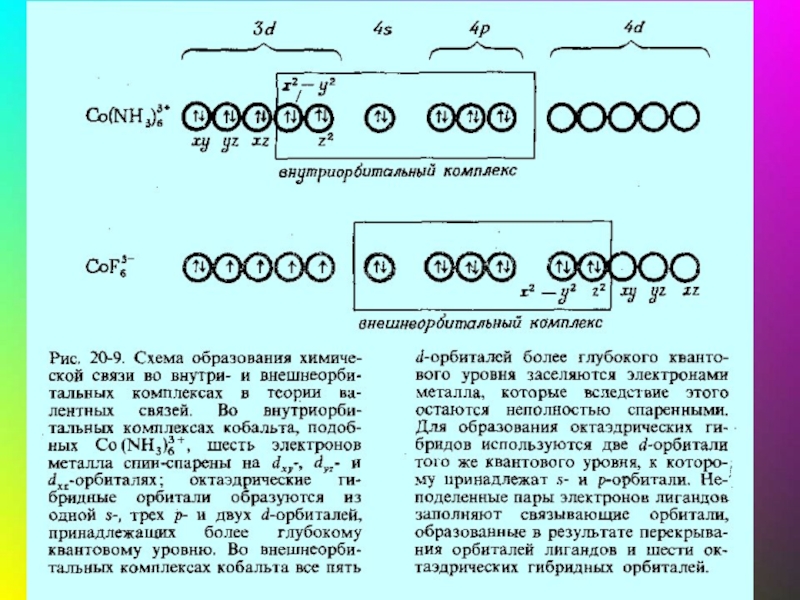
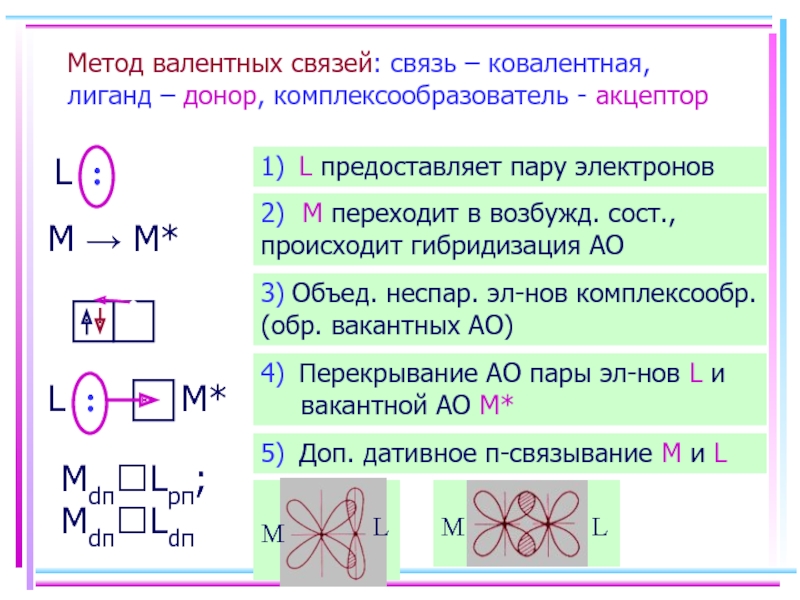
- 36. Метод валентных связей: связь – ковалентная, лиганд
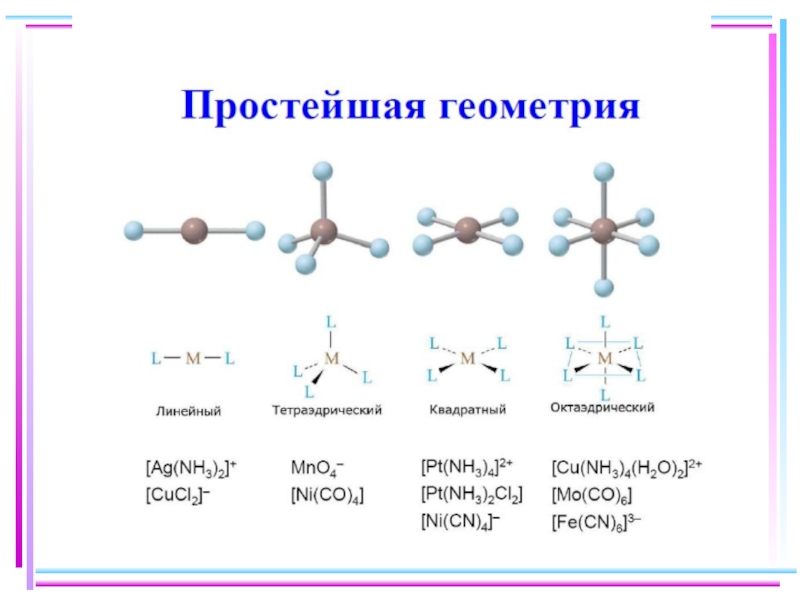
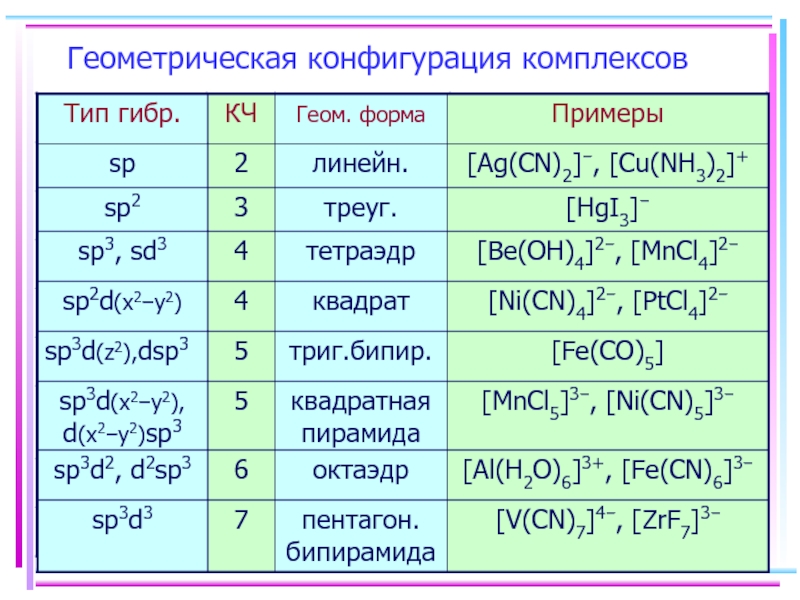
- 37. Геометрическая конфигурация комплексов
- 38. Для атомов комплексообразователей: E(n−1)d ≈ Ens ≈
- 39. Ni+II [Ni(CN)4]2– уст., диамагн., квадрат КЧ
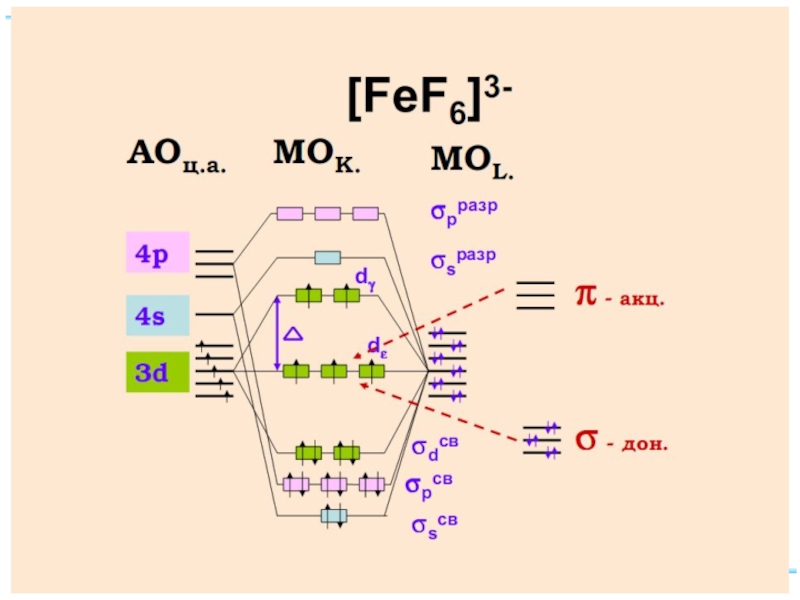
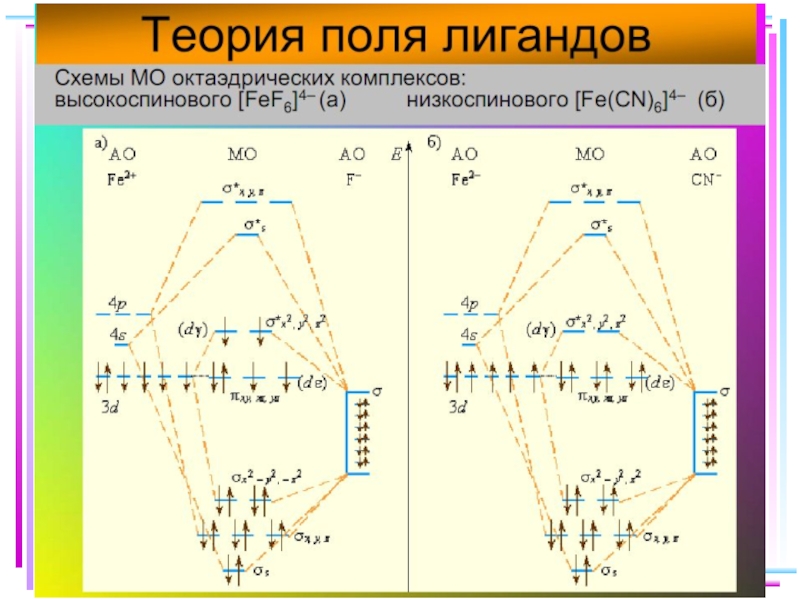
- 40. Fe+II [FeF6]4– уст., парамагн., октаэдр КЧ
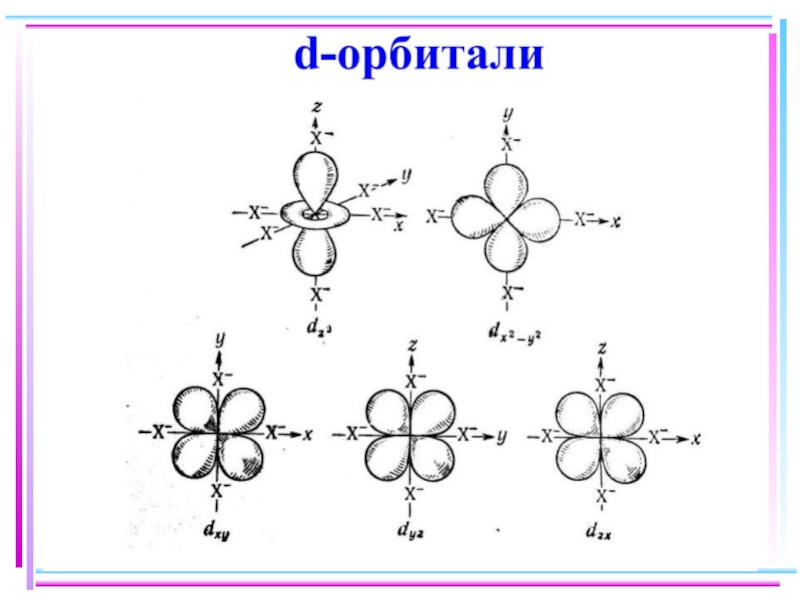
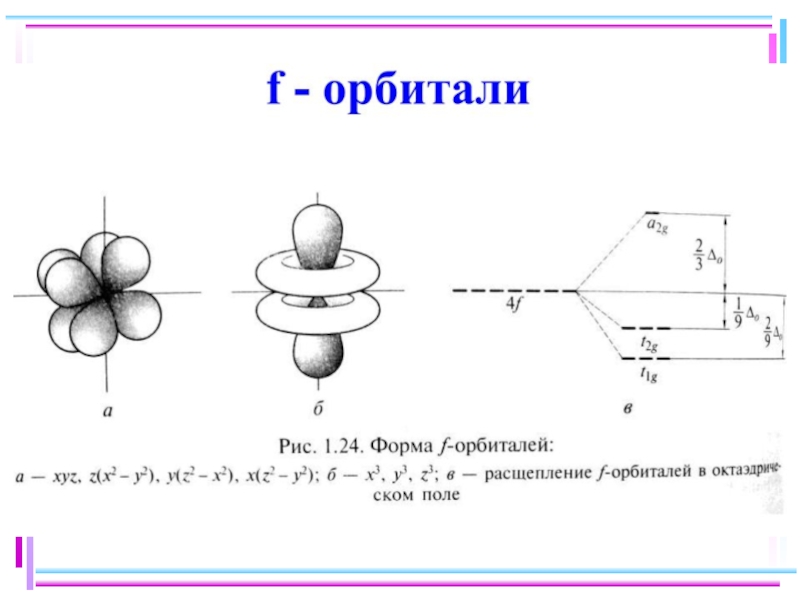
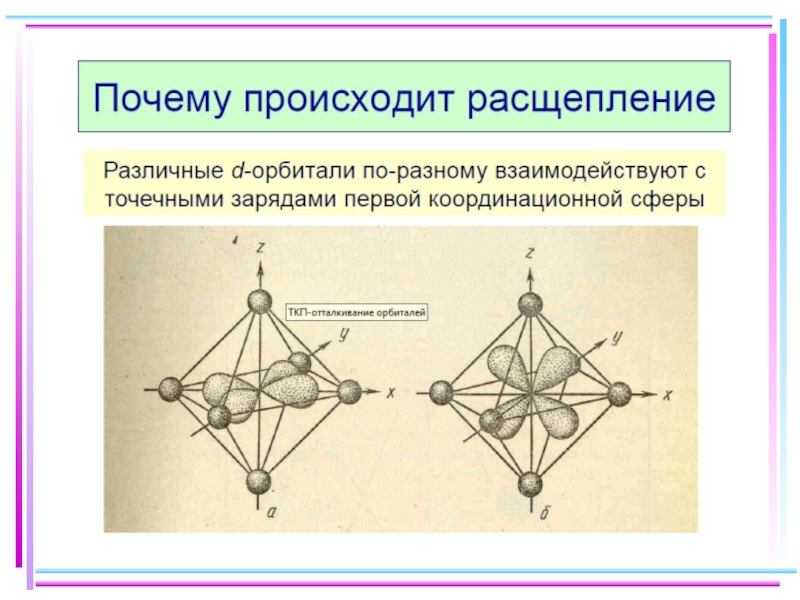
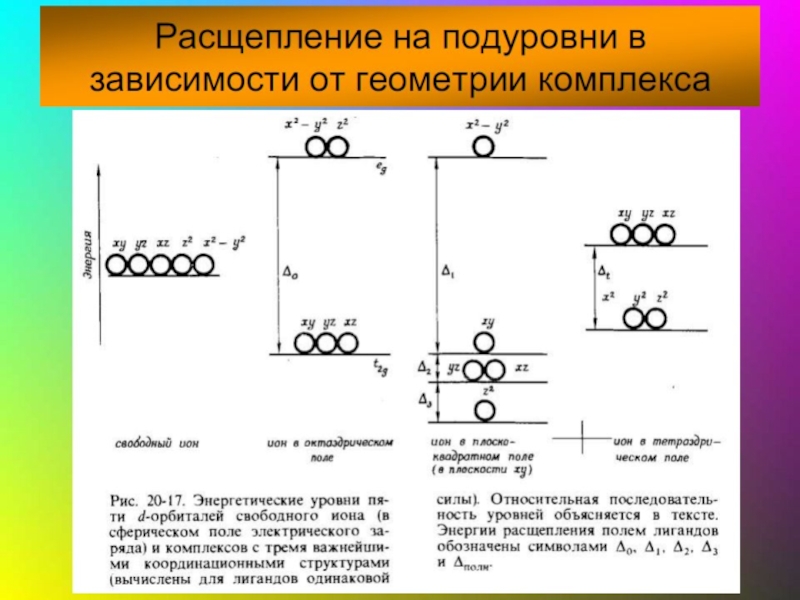
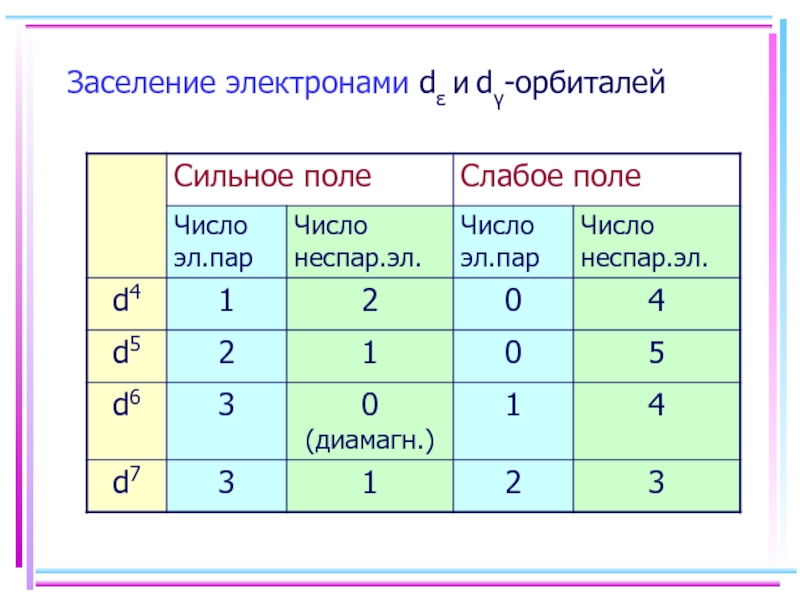
- 41. Основные положения теории кристаллического поля (поля лигандов)
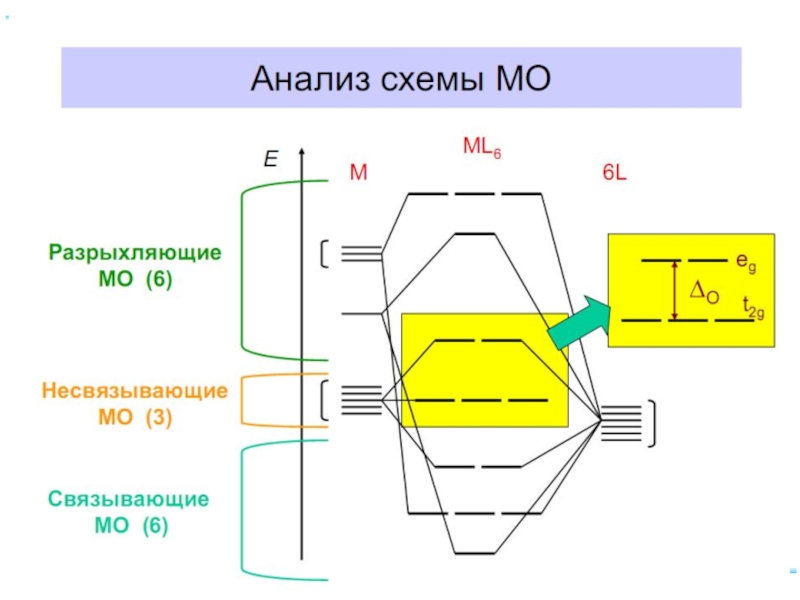
- 42. В случае [ML6]ν±,0 : октаэдрическое поле лигандов
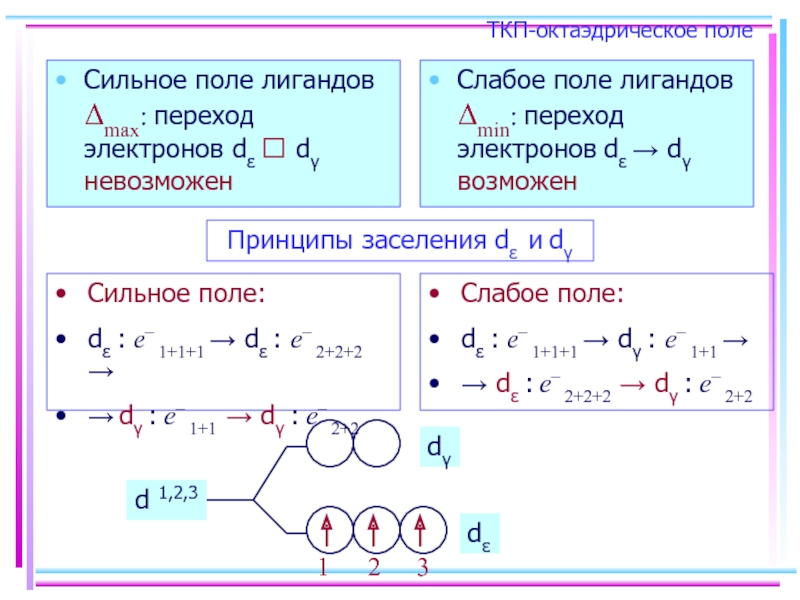
- 43. ТКП-октаэдрическое поле Сильное поле лигандов Δmax: переход
- 44. Параметр расщепления Δ и волновое число ν
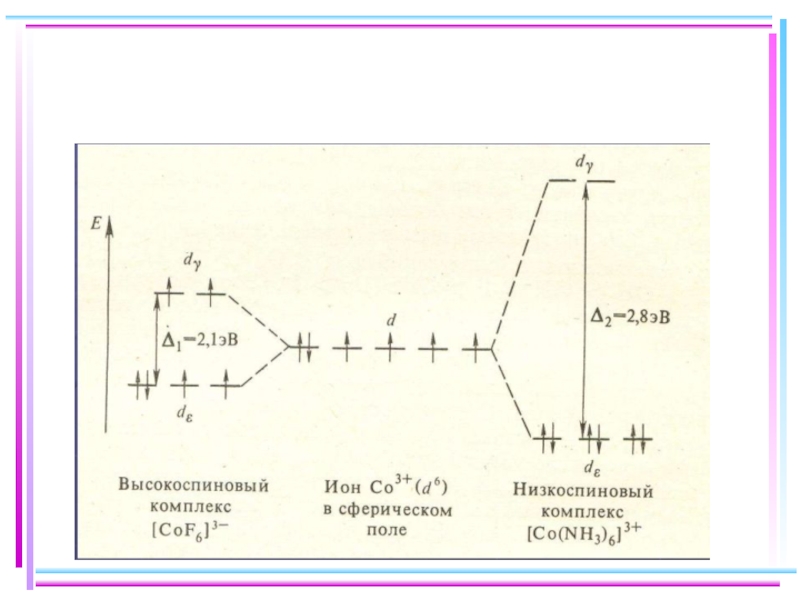
- 45. Сильное поле
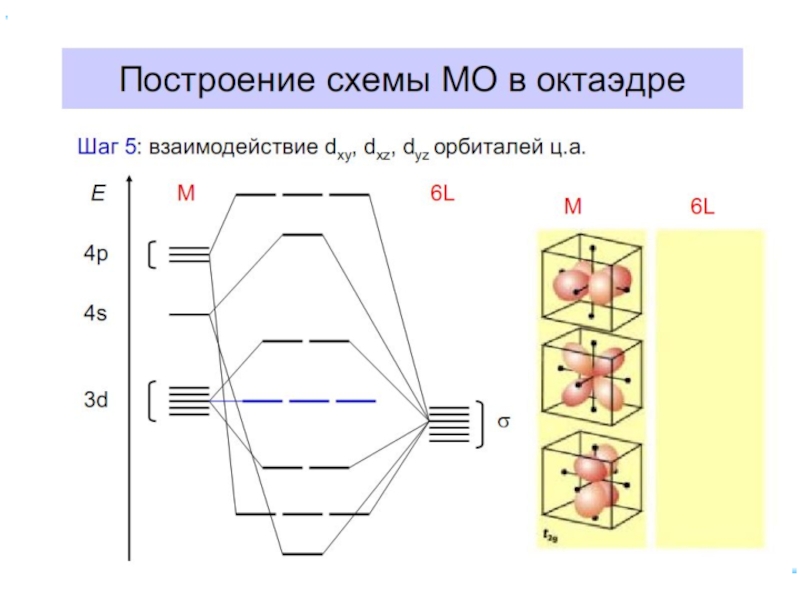
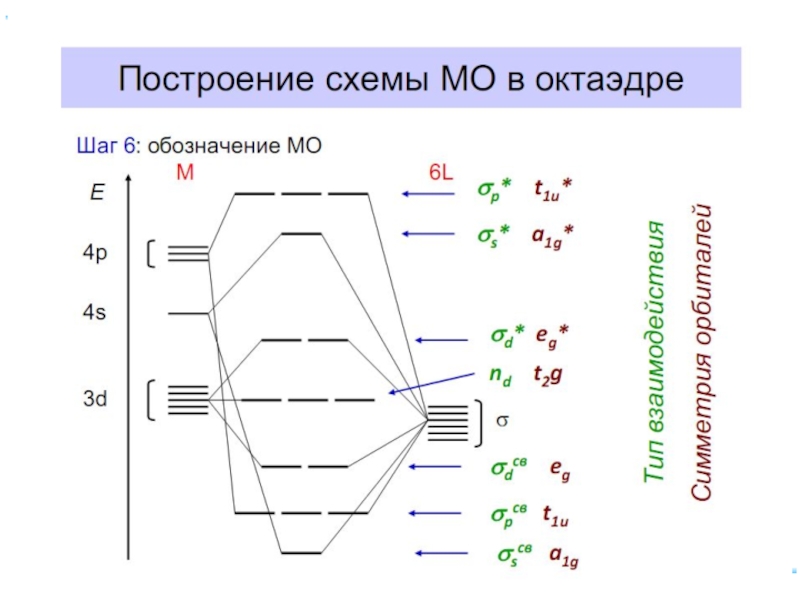
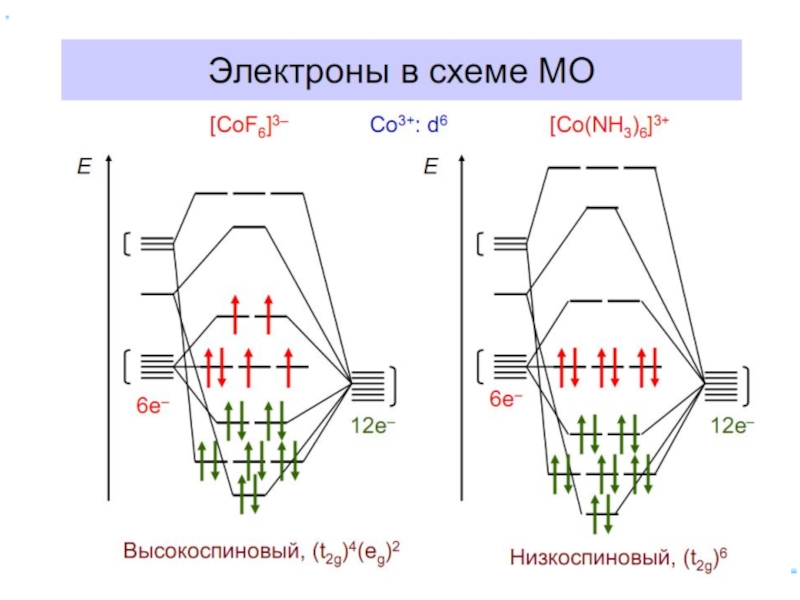
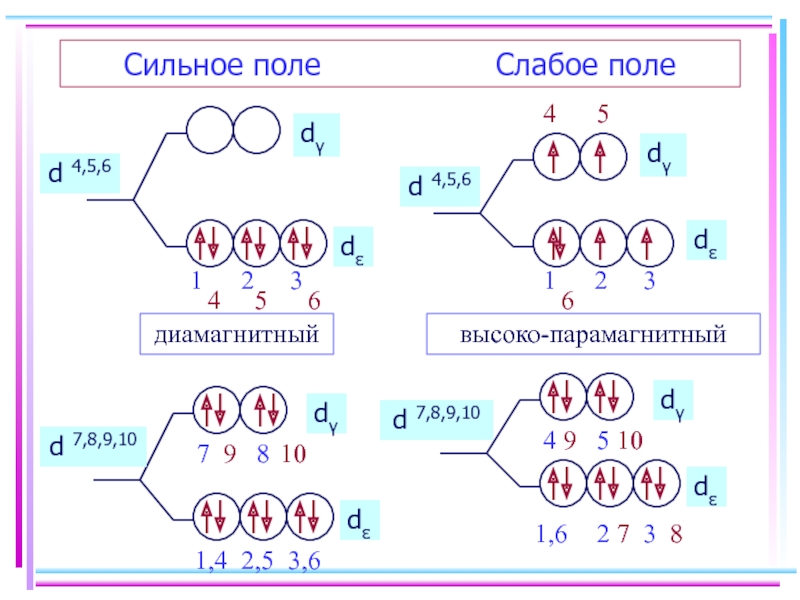
- 46. Заселение электронами dε и dγ-орбиталей
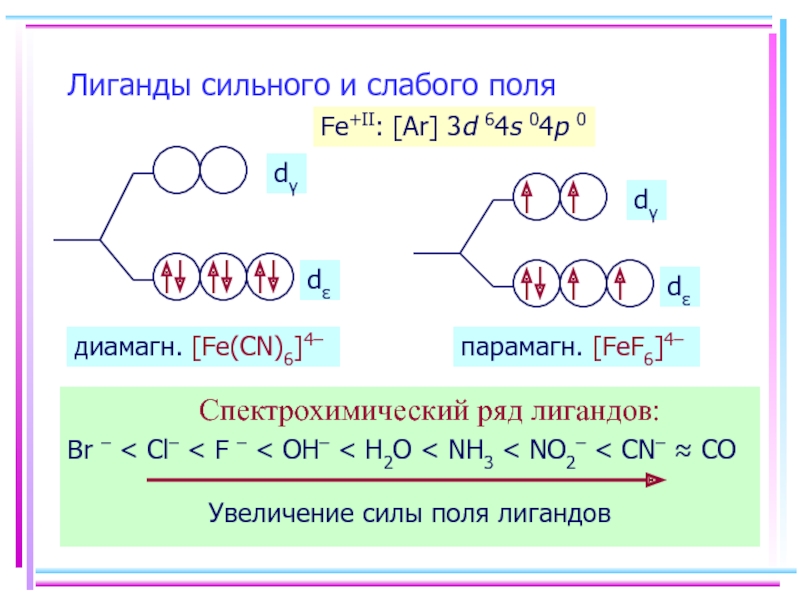
- 47. Лиганды сильного и слабого поля Спектрохимический ряд
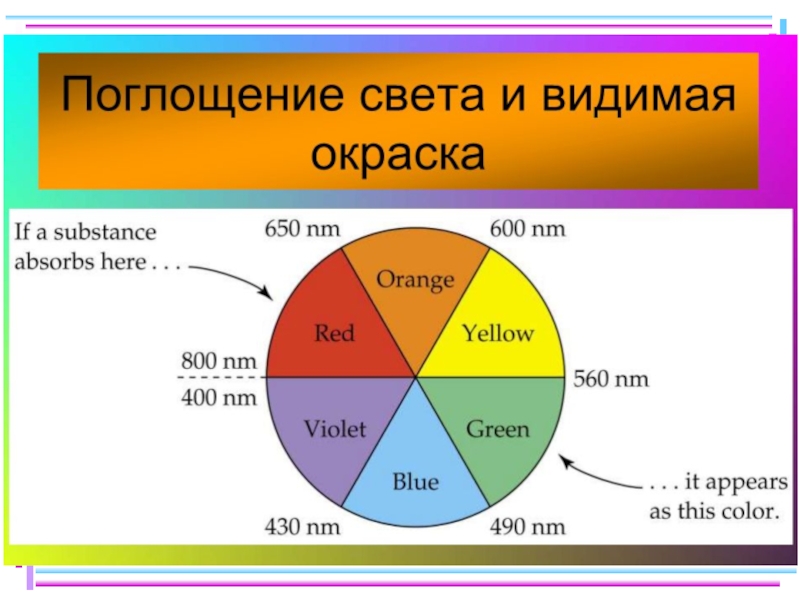
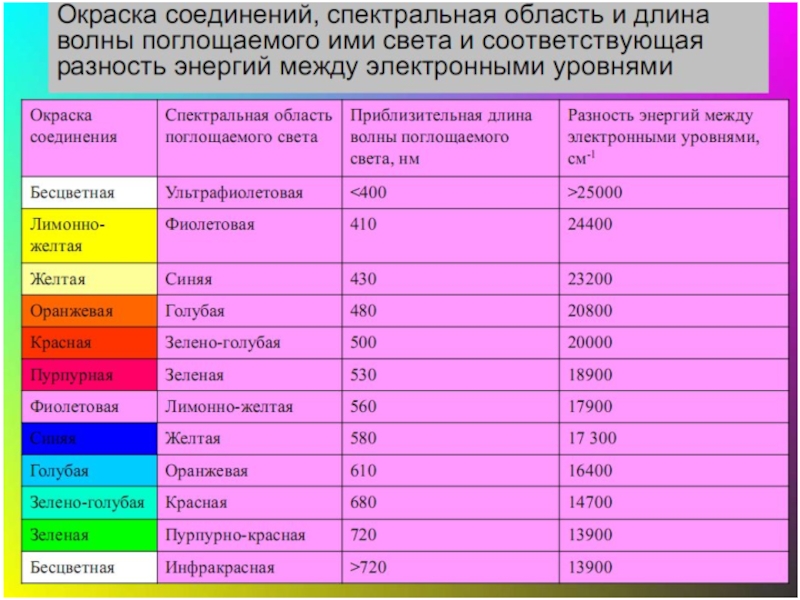
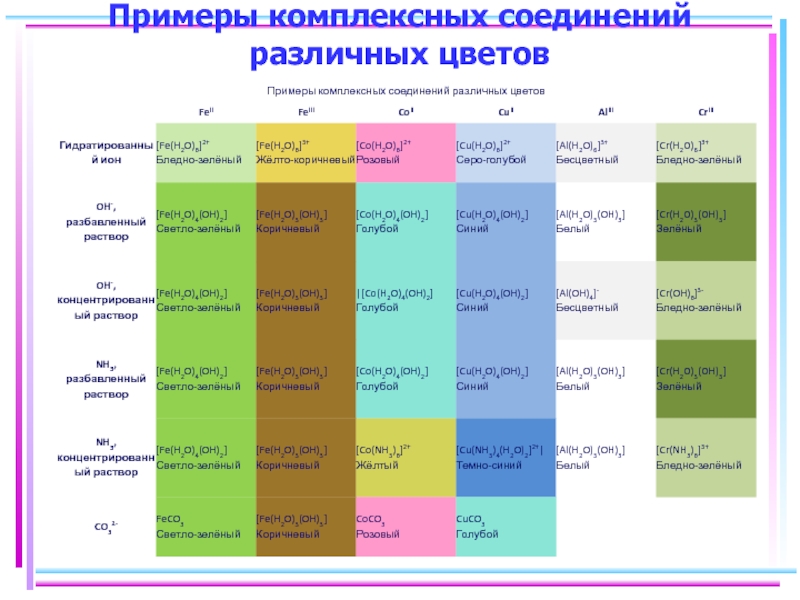
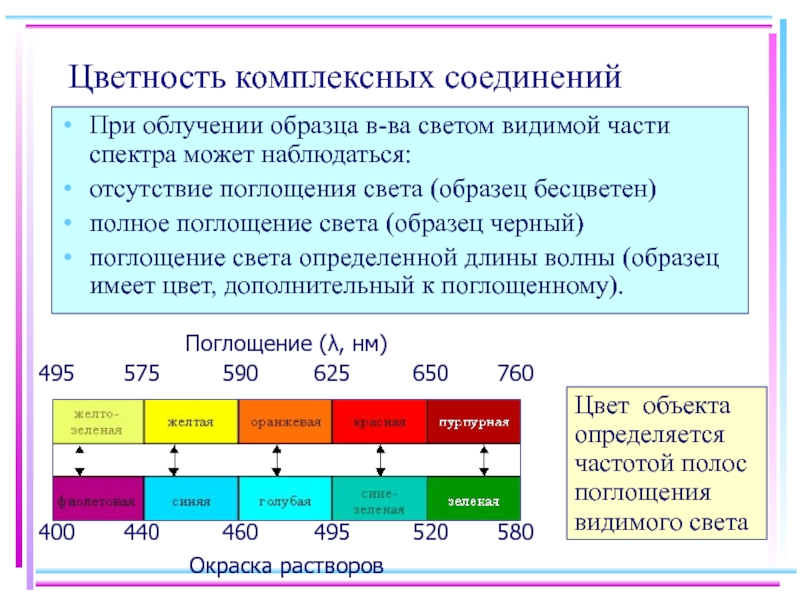
- 48. Цветность комплексных соединений При облучении образца в-ва
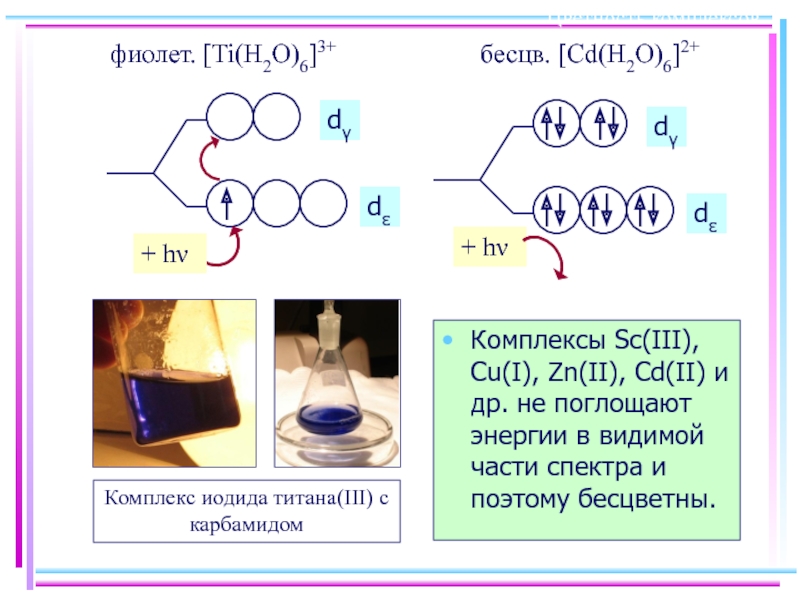
- 49. Цветность комплексов Комплексы Sc(III), Cu(I), Zn(II), Cd(II)
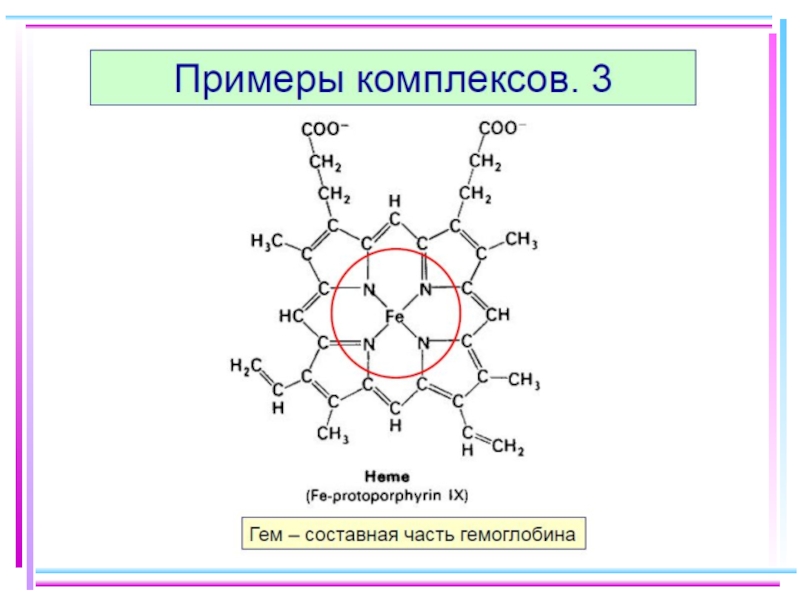
- 50. Типы комплексных соединений. 1. Аквакомплексы
- 51. Аквакомплексы Термич. разложение: CuSO4·5H2O ⭣ CuSO4·4H2O
- 52. Аквакомплексы [Fe(H2O)6]SO4·H2O («железный купорос»)
- 53. 2. Гидроксокомплексы Получение: Zn(OH)2 +
- 54. 3. Аммины (аммиакаты) Получение: AgCl(т) +
- 55. Получение: HgI2(т) + 2I–(изб.) = [HgI4]2–
- 56. 6. Анионгалогенаты M[ЭГ′mГ″n] (Э, Г′ и Г″
- 57. Получение: 4 NaH + B(OCH3)3 = Na[BH4]
- 58. Получение: Ni(т) + 4CO(г) =
- 59. Правило Сиджвика для определения состава комплексов
- 60. Правило Сиджвика (примеры) * 27Co0 [Ar]3d74s2 ||
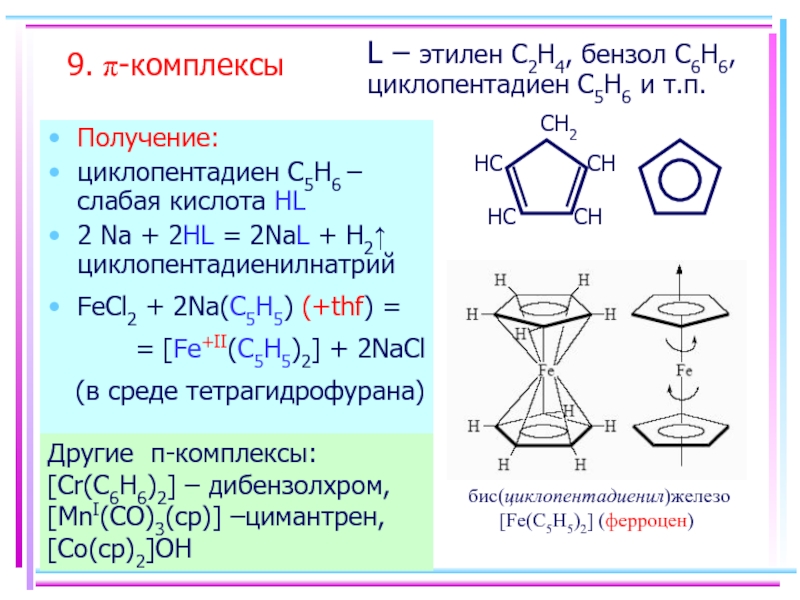
- 61. 9. π-комплексы Получение: циклопентадиен С5H6 – слабая
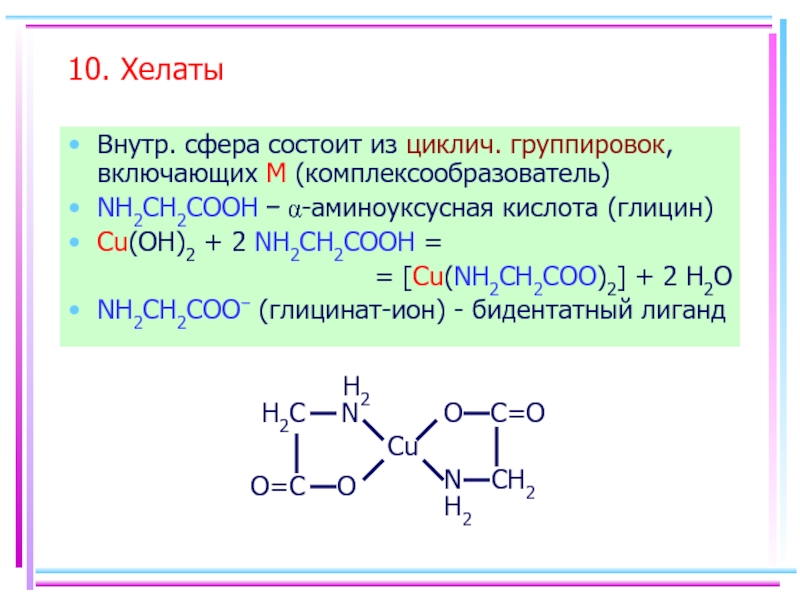
- 62. 10. Хелаты Внутр. сфера состоит из
- 63. Реакция Чугаева Ni2+ + 2 NH3·H2O
- 64. Методы синтеза комплексных соединений Реакция обмена лигандов
- 65. Методы синтеза комплексных соединений Д) ОВР +
- 66. Решение задач. 1. Растворение осадка при комплексообразовании
- 67. Решение задач. 2. Реакция обмена лигандов [Co(NH3)6]3+
- 68. Решение задач. 3. Разрушение комплекса [Cu(NH3)4]2+ +
- 69. Решение задач. 4. Направление реакции CuCN(т)
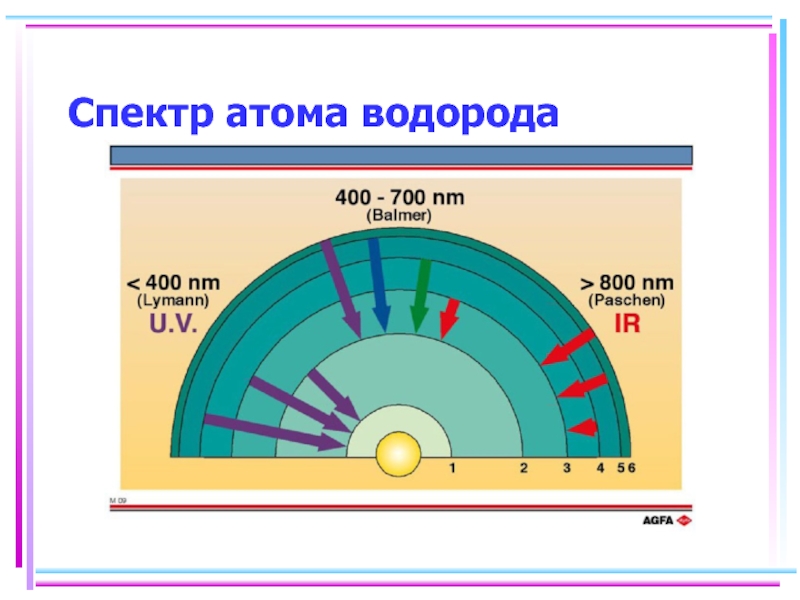
- 112. Спектр атома водорода
- 113. Спектр атома водорода
- 125. Примеры комплексных соединений различных цветов
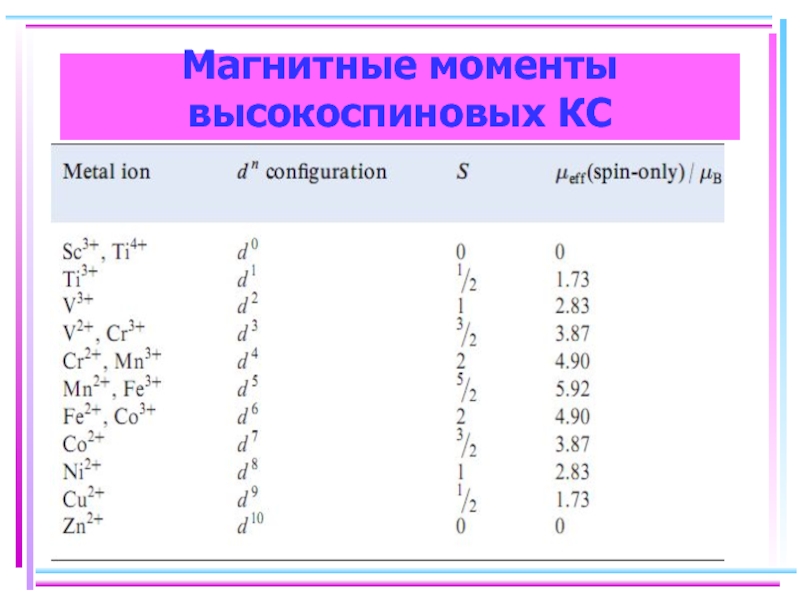
- 128. Магнитные моменты высокоспиновых КС
- 129. Содержание Введение Комплексные ионы
- 130. Глава 4. Изомерия комплексных соединений 4.1. Изомерия
- 131. Глава 7. Типы комплексных соединений
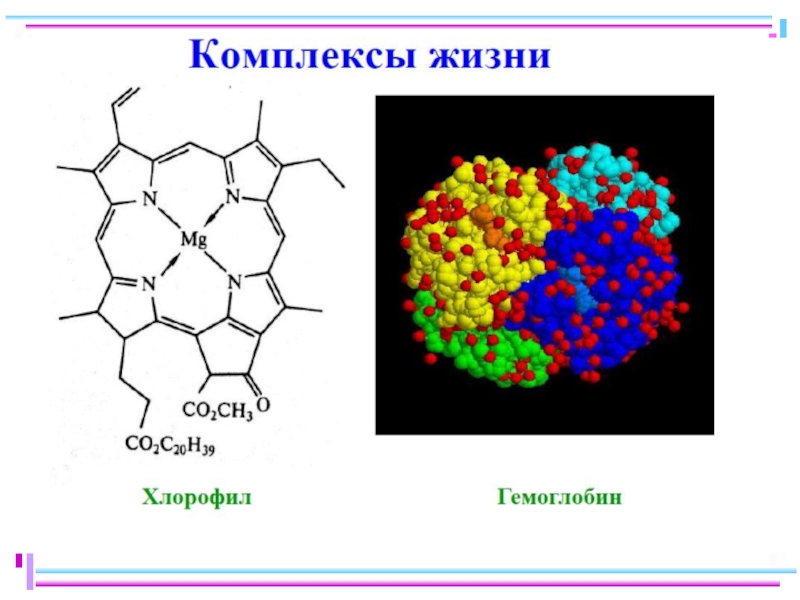
Слайд 1Химия элементов
Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
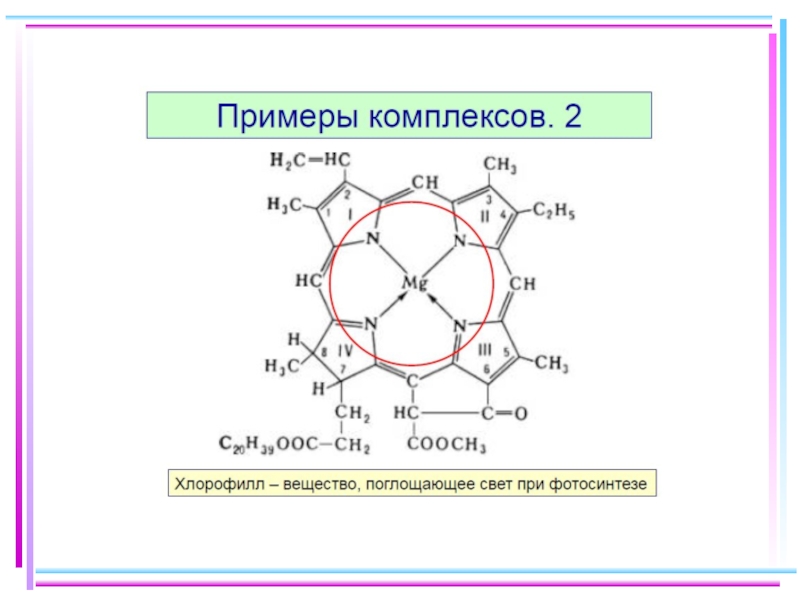
Слайд 5Простые и комплексные соединения
HgI2 + 2KI = K2[HgI4]
SO3(т) + K2O(т) =
HgI2(т) + 2K+(р) + 2I–(р)=
= 2K+(р) + [HgI4]2–(р)
K2O(т) + SO3(т) =
= 2K+(р) + SO42–(р)
Слайд 6Комплексные (координационные) соединения
Комплексами называют сложные частицы, образованные из реально существующих более
в узлах кристаллической решетки
в растворе
Слайд 7Координационная теория (1893 г. )
Внутренняя и внешняя сфера комплексного соединения [MLx]Yz
Комплексообразователь
Лиганды L±ν
Координационное число КЧ
Дентатность лигандов
Многоядерные комплексы (мостиковые, смешанные, кластеры)
Слайд 8Внутренняя сфера [комплекс]
Внешняя сфера (противоион)
[Ni(NH3)6]Cl2
K4[Fe(CN)6]
[Cr(CO)6]
[Ni(NH3)6]2[Fe(CN)6]
Примеры
Внеш.сферы
Слайд 9Комплексообразователь, лиганды, КЧ и дентатность. Примеры
[NH4]Cl – КЧ 4, дент.1
[Al(H2O)6]Cl3 –
K[I(I)2] – КЧ 2, дент.1
H2[SnCl6] – КЧ 6, дент.1
K2[Be(OH)4] – КЧ 4, дент.1
K[BiI4] – КЧ 4, дент.1
[Al(H2O)3(OH)3] – КЧ 6, дент.1
(NH4)2[Be(CO3)2] – КЧ 4, дент.2
[I—I—I]–
Слайд 132. Формулы и названия компл. соединений.
[M(L+)(L0)(L–)]±,0
Число лигандов – греч. числит.
1
2 – ди
3 – три
4 – тетра
5 – пента
6 – гекса
7 – гепта …
Число сложных лигандов: бис-, трис-, тетракис-, пентакис- …
[M(en)4] - тетракис(этилендиамин)…
[M(SO42-)2] бис(сульфато-)…
Название комплекса:
число лигандов каждого типа → название лигандов → название комплексообр. в нужной форме
Слайд 143. Названия комплексных соединений
А) Комплексы без внешней сферы
[MLn]
Примеры:
[Ni(CO)4] – тетракарбонилникель;
[Co2(CO)8] – октакарбонилдикобальт;
[Al2Cl6] – гексахлородиалюминий;
[Co+III(NH3)3Cl3] – трихлоротриамминкобальт(III)
[Co+II(H2O)4(NO2)2] – динитротетрааквакобальт(II)
Слайд 15Названия комплексных соединений
Б) Комплексный катион
[MLn]+X–
«анион катиона»: n →
Примеры:
[AgI(NH3)2]OH –
гидроксид диамминсеребра(I);
[CoIII(NH3)6](OH)2Cl –
хлорид-дигидроксид гексаамминкобальта(III);
[Cr2III(NH3)9(OH)2]Cl4 –
хлорид дигидроксононаамминдихрома(III)
Слайд 16Названия комплексных соединений
В) Комплексный анион
X+[MLn]–
«анион катиона»:
анион n
Ag – аргент-
Au – аур-
Cu – купр-
Fe – ферр-
Hg – меркур-
Mn – манган-
Ni – никкол-
Pb – плюмб-
Sb – стиб-
Sn – станн-
Примеры:
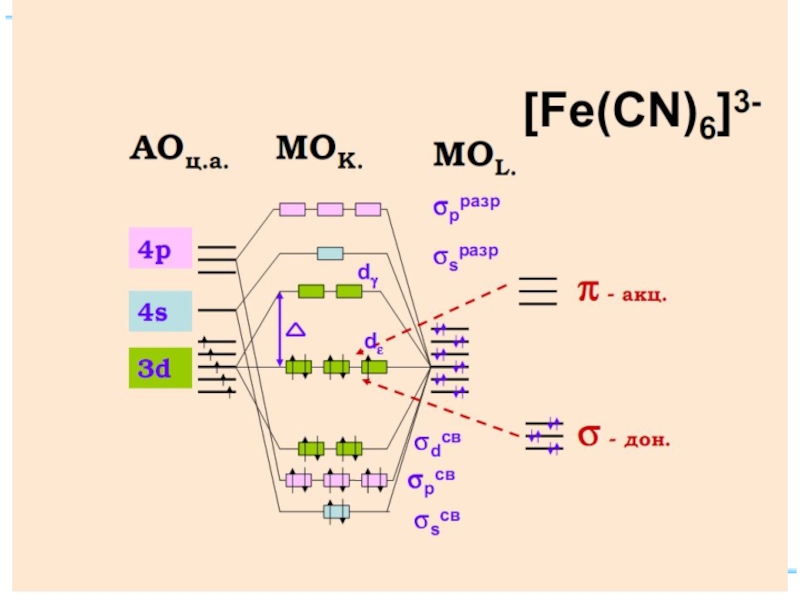
[Fe(CN)6]3– – гексацианоферрат(III)-ион
[Ag(CN)2]– – дицианоаргентат(I)-ион
K2[HgI4] – тетраиодомеркурат(II) калия
K2[PtCl6] – гексахлороплатинат(IV) калия
Слайд 17Упражнения:
Na3[AgI(SO3S)2] –
бис(тиосульфато)аргентат(I) натрия
[PtII(py)4]2[FeII(CN)6] –
гексацианоферрат(II) тетрапиридинплатины(II)
[K(H2O)6][Al(H2O)6](SO4)2 –
сульфат гексаакваалюминия-гексааквакалия
[(CO)5Mn-Mn(CO)5] –
бис(пентакарбонилмарганец)
[(H2O)4Al(OH)2Al(H2O)4](SO4)2 –
сульфат ди(μ-гидроксо)бис(тетраакваалюминия)
Слайд 18Изомерия комплексных соединений
Изомерия – явление существования соединений, одинаковых по составу и
В случае комплексных соединений изомерия обусловлена:
различием в строении и координации лигандов
различием в строении внутренней координационной сферы
различным распределением частиц между внутренней и внешней сферой.
Слайд 19Изомерия лигандов
Связевая
—NO2– и —ONO–
нитро-
[Co(NH3)5NO2]2+ (желто-коричн.р-р)
[Co(NH3)5ONO]2+ (розов.р-р)
—NCS– и —SCN–
тиоцианато-N тиоцианато-S
[Cr(H2O)5(NCS)]2+
[Cr(H2O)5(SCN)]2+
Изомерия лигандов
Лиганды сложного строения (напр., аминокислоты) образуют изомеры, координация которых ведет к получению комплексов с разными свойствами.
Слайд 20Изомерия внутренней сферы: геометрическая
Геометрическая изомерия вызвана неодинаковым размещением лигандов во внутренней
Необх. усл. геометрич. изомерии – наличие во внутр. сфере не менее двух различных лигандов.
Компл. соед. с тетраэдрическим, треугольным и линейным строением геометрич. изомеров не имеют.
Слайд 21Геометрическая изомерия
Плоскоквадратные комплексы при наличии двух разных лигандов L′ и L′′
Слайд 22Геометрическая изомерия
[ML′5L′′]: изомеров нет
цис- и транс-изомеры дигидроксотетраамминкобальта(II)
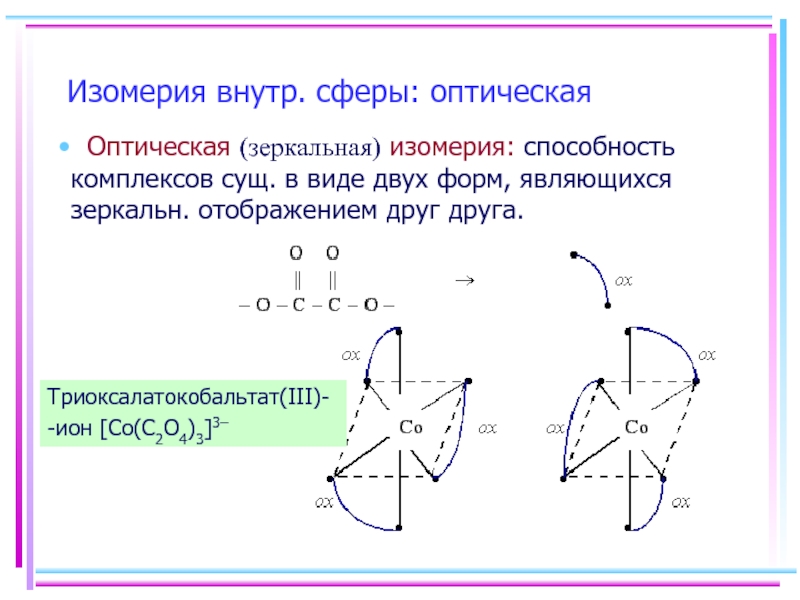
Слайд 23Изомерия внутр. сферы: оптическая
Оптическая (зеркальная) изомерия: способность комплексов сущ. в
Триоксалатокобальтат(III)-
-ион [Co(С2O4)3]3–
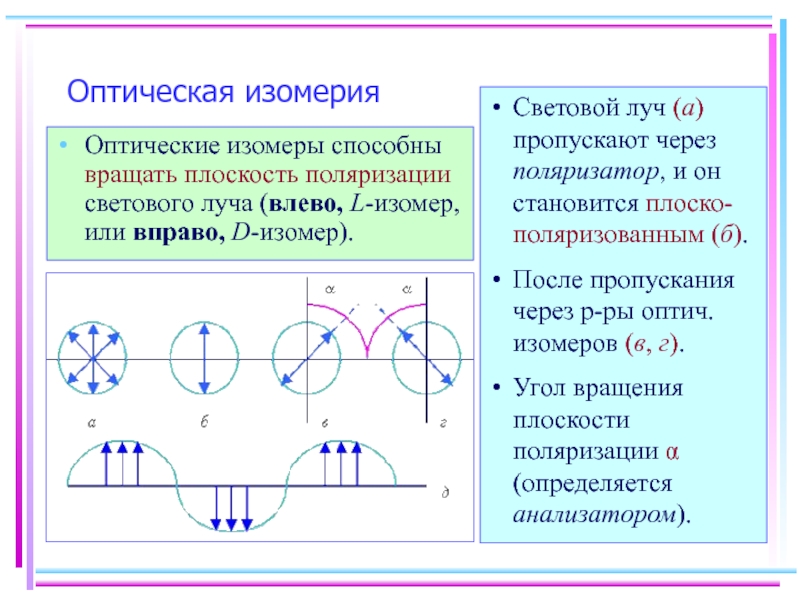
Слайд 24Оптическая изомерия
Оптические изомеры способны вращать плоскость поляризации светового луча (влево, L-изомер,
Световой луч (а) пропускают через поляризатор, и он становится плоско-поляризованным (б).
После пропускания через р-ры оптич. изомеров (в, г).
Угол вращения плоскости поляризации α (определяется анализатором).
Слайд 25Междусферная изомерия:
1) сольватная (гидратная); 2) ионная изомерия
[Co(en)2Cl2]Cl · H2O
[Co(H2O)(en)2Cl]Cl2
[Co(NH3)5I]SO4
[Co(NH3)5SO4]I
1 Cl–;
2 Cl– (2 AgCl↓)
SO42– (BaSO4↓)
I– (AgI↓)
Слайд 26Междусферная изомерия
Ионные (ионизационные) изомеры
[Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2
[Pt(NH3)4SO4](OH)2 и [Pt(NH3)4(OH)2]SO4
Координационные изомеры
[Cr(NH3)4(NCS)2][Cr(NH3)2(NCS)4]
[Cr(NH3)6][Cr(NCS)6]
Слайд 27Комплексные соединения в растворах
Неэлектролиты (слабые электролиты) [Pt(NH3)2Cl2] (ср. H2O2, CO(NH2)2 )
Сильные
[Pt(NH3)4]Cl2 = [Pt(NH3)4]2+ + 2Cl–
соль
[Zn(NH3)4](OH)2 = [Zn(NH3)4]2+ + 2OH–
с. осн. pH >> 7
H[BF4] + H2O = H3O+ + [BF4]–
с. к-та pH << 7
Акватация: [ … ] + H2O ⮀ [ … ] + L
Слайд 28[MLn] + H2O ⮀ [MLn-1(H2O)] + L0 (n = КЧ)
Ступенчатая диссоциация комплекса:
[MLn] ⮀ [ML(n−1)] + L
[MLn-1] ⮀ [ML(n−2)] + L
…
[ML2] ⮀ [ML] + L
[ML] ⮀ M + L
Суммарное уравнение диссоциации комплекса:
[MLn] ⮀ M + nL
Реакции обмена лигандов
Слайд 29
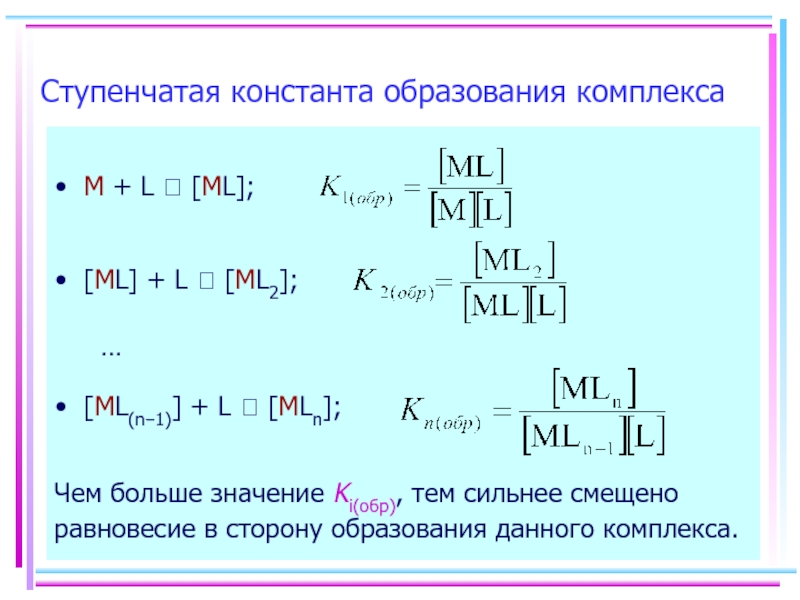
Чем больше значение Ki(обр), тем сильнее смещено равновесие в сторону образования
…
Ступенчатая константа образования комплекса
Слайд 30
Полные (суммарные) константы образования
Характеристика устойчивости комплексного соединения: чем больше значение βn(обр),
……
Слайд 31Связь между полной и ступенчатой константами образования
βn(обр) = K1(обр)·K2(обр)·K3(обр)·… ·Kn(обр)
Слайд 33Сравнение устойчивости аммиачных комплексов
Ступени комплексообразования
[Cu(NH3)2]+ K2(обр) = 5,0·104
[Cu(NH3)]+ K1(обр) = 1,4·106
Природа комплексообразователя
[Cu(NH3)2]+ β2(обр) = 7,0·1010
[Ag(NH3)2]+ β2(обр) = 1,1·107
Комплекс Cu(I) устойчивее, чем комплекс Ag(I)
Степень окисления комплексообразователя
[CoII(NH3)6]2+ β6(обр) = 1,3·105
[CoIII(NH3)6]3+ β6(обр) = 3,2·1032
Комплекс Co(III) устойчивее, чем комплекс Co(II)
Слайд 34Хелат-эффект
[Ni(NH3)6]2+ β6(обр)= 5,3 . 108
[Ni(en)3]2+ β3(обр)= 1,3 . 1019
[Ni(NH3)6]2+ + 3
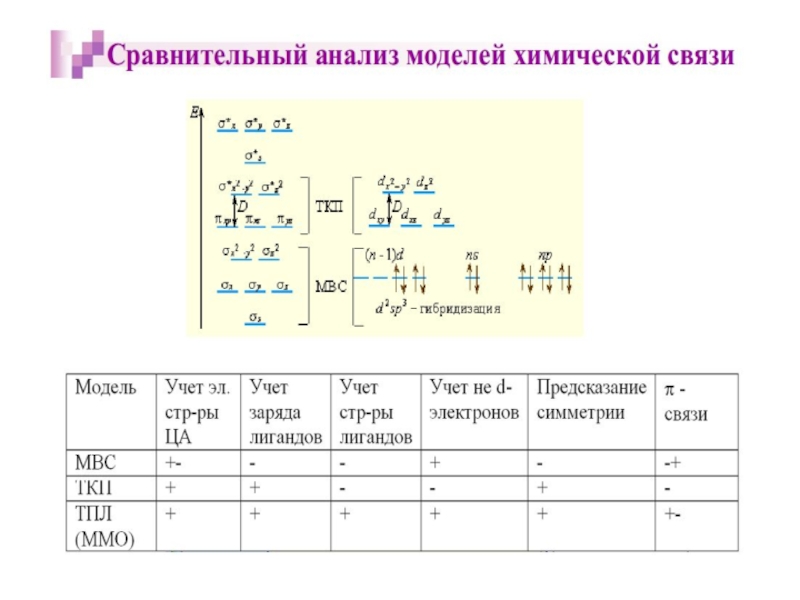
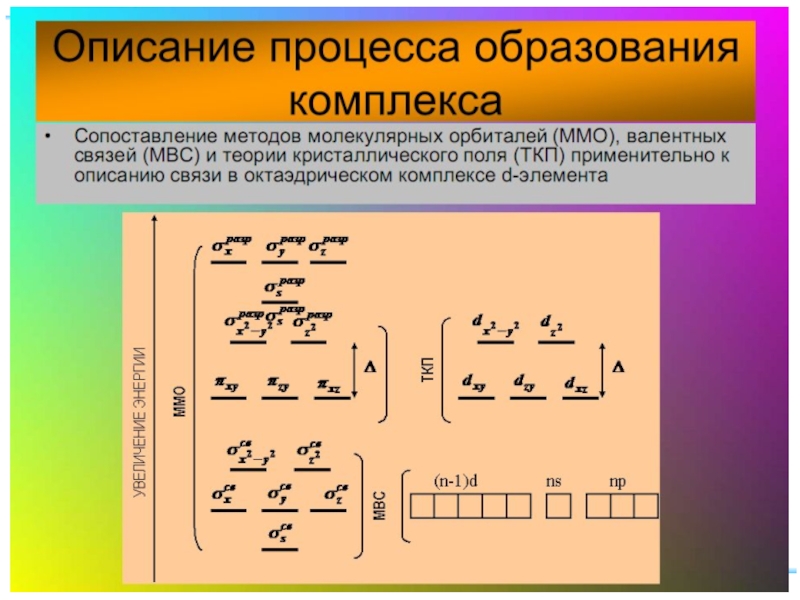
Слайд 35Квантовомеханические теории строения комплексных соединений
Для объяснения строения комплексных соединений наиболее широко
В рамках метода валентных связей считается, что между комплексообразователем и лигандами существует чисто ковалентная связь, которая реализуется по донорно-акцепторному механизму.
Слайд 36Метод валентных связей: связь – ковалентная, лиганд – донор, комплексообразователь -
L :
M → M*
L :
Mdπ?Lpπ; Mdπ?Ldπ
1) L предоставляет пару электронов
2) M переходит в возбужд. сост., происходит гибридизация АО
3) Объед. неспар. эл-нов комплексообр. (обр. вакантных АО)
4) Перекрывание АО пары эл-нов L и вакантной АО M*
5) Доп. дативное π-связывание M и L
Слайд 38Для атомов комплексообразователей: E(n−1)d ≈ Ens ≈ Enp ≈ End
Пример:
Атом Ni0 парамагнитен
Ni0
Ni*
[Ni(CO)4] уст., диамагнитный, тетраэдрич.
Ni+II
[NiBr4]2– неуст., парамагн., тетраэдрич.
КЧ 4
КЧ 4
Слайд 39Ni+II
[Ni(CN)4]2– уст., диамагн., квадрат
КЧ 4
[Ni(CN)5]3– уст., диамагн., квадратная пирамида
КЧ 5
[Ni(H2O)6]2+, [Ni(NO2)6]4–
КЧ 6
Ni+II
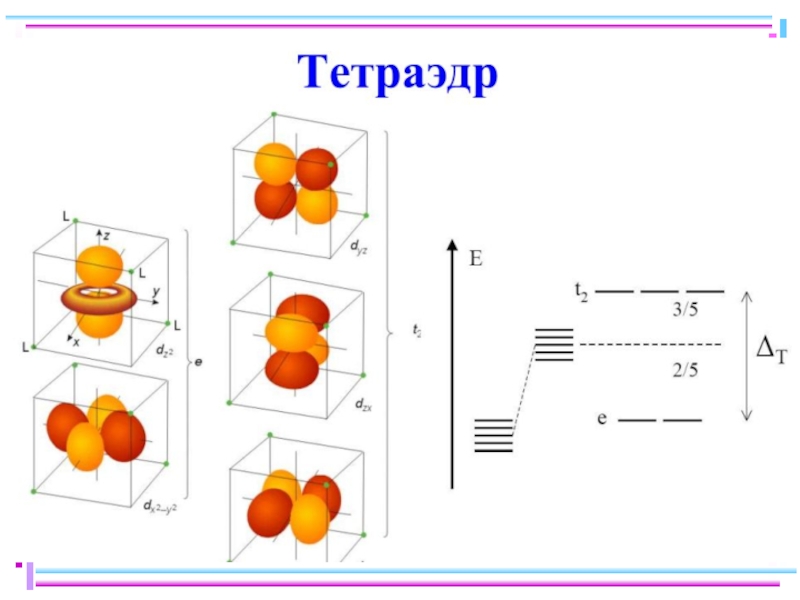
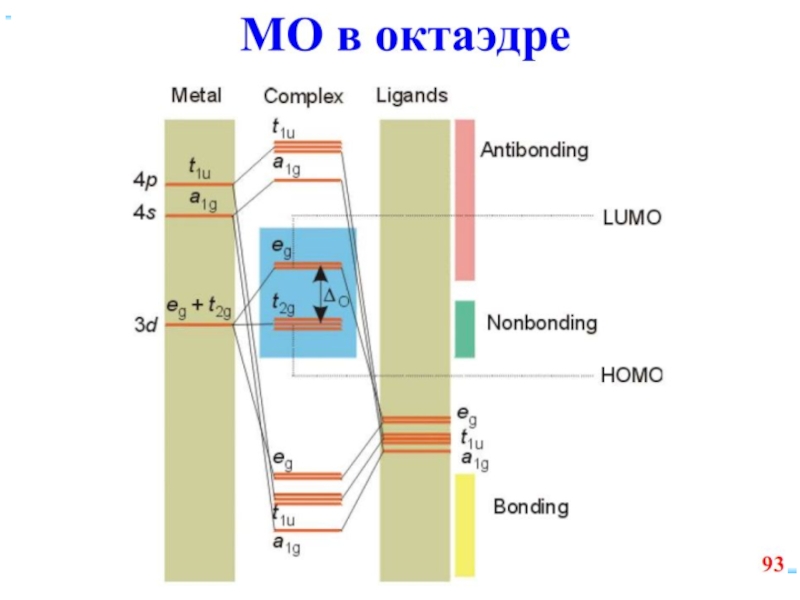
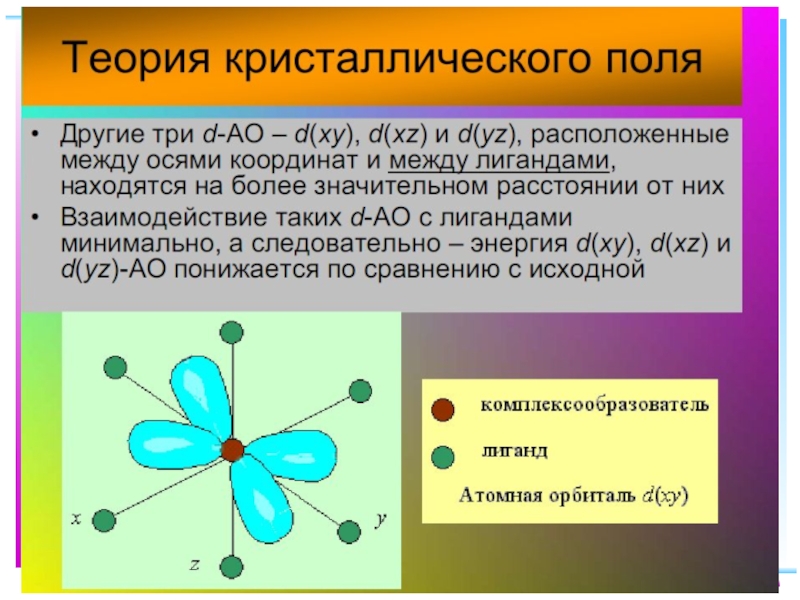
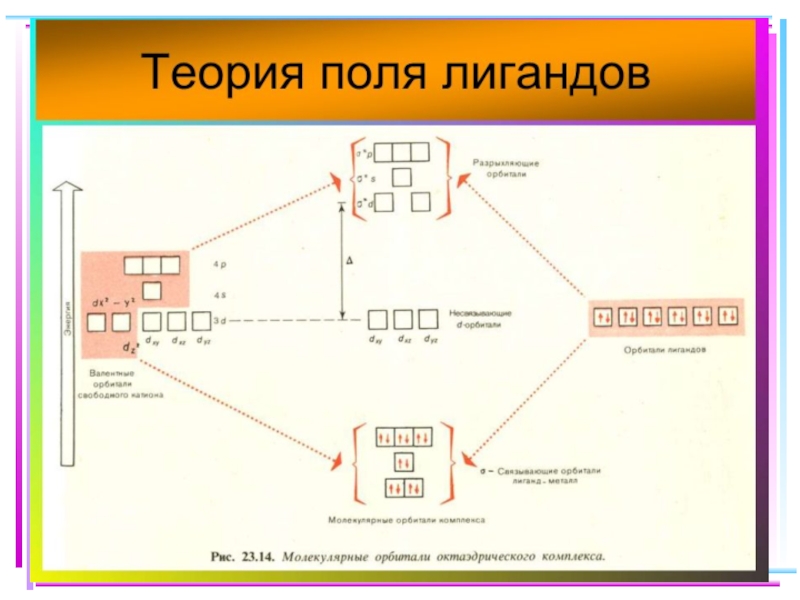
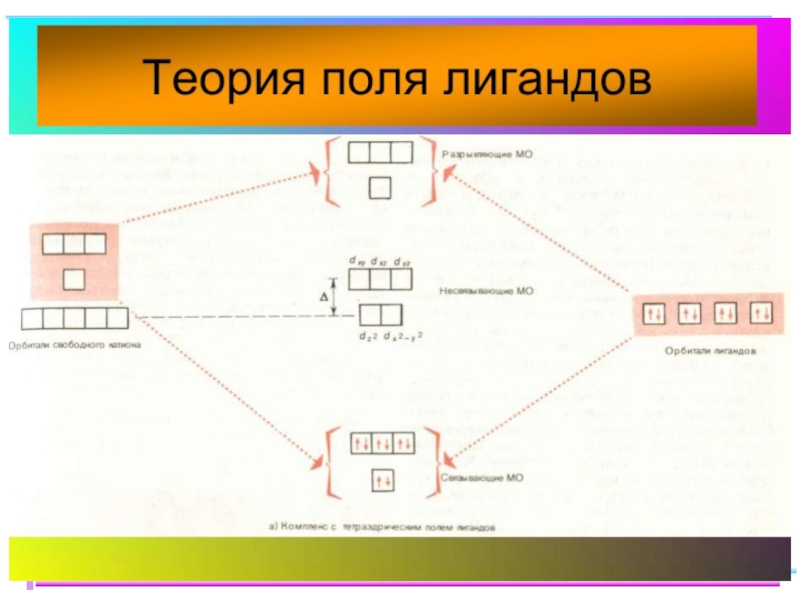
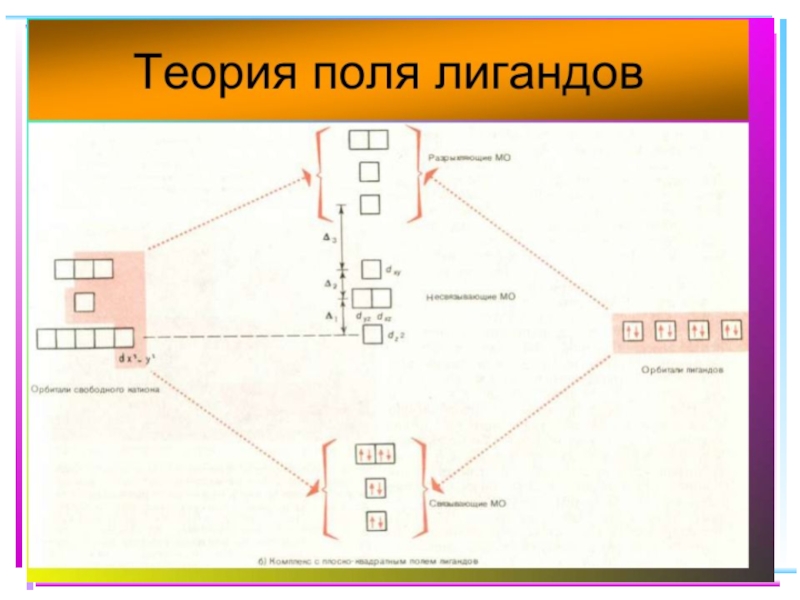
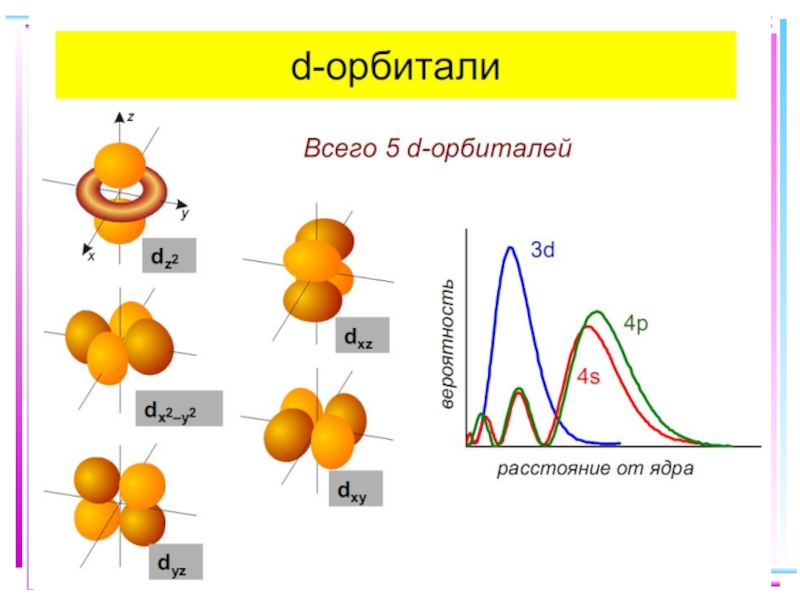
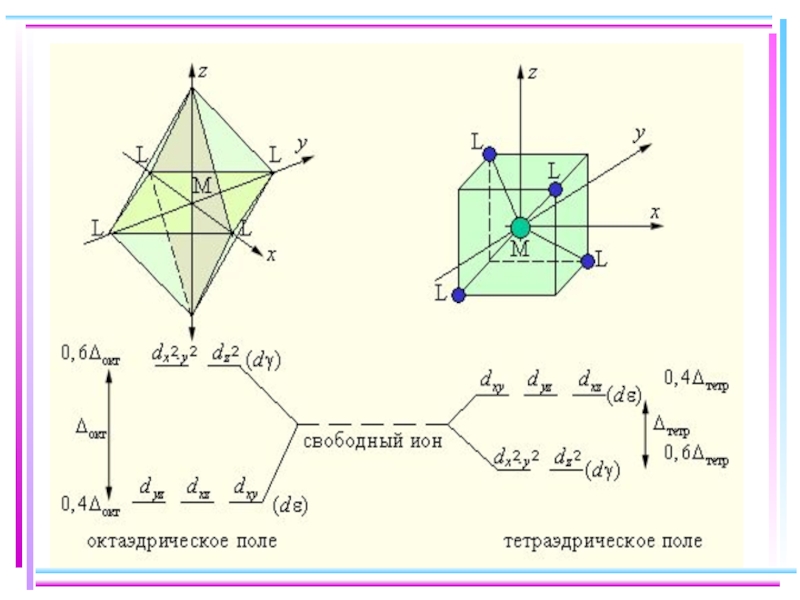
Слайд 41Основные положения теории кристаллического поля (поля лигандов)
Связь комплексообразователя (центр. атома) Mе
Лиганды L – точечные заряды в вершинах правильных полиэдров, т.е. на максимальном расстоянии друг от друга
Взаимодействие L между собой не рассматр.
Детально рассматривается влияние электростатич. поля лигандов на Mе, а именно, на энергетич. подуровни (ЭПУ) центрального атома
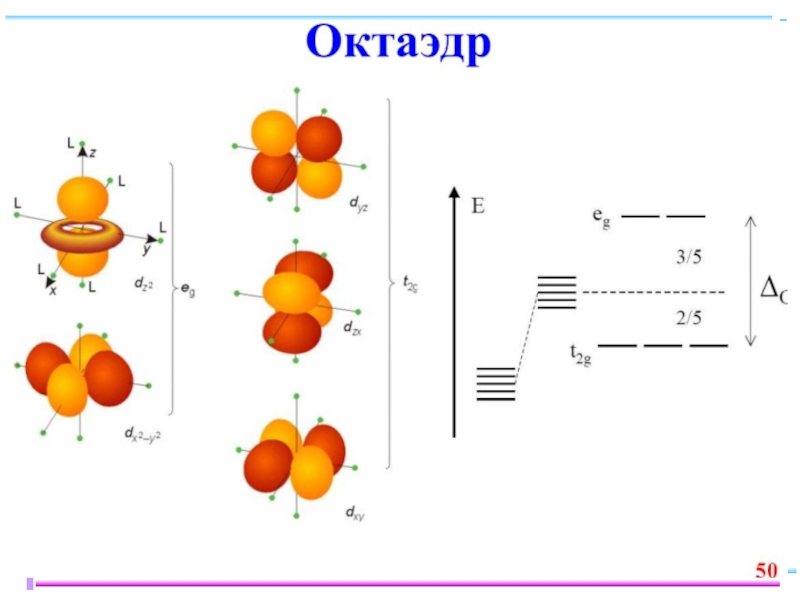
Слайд 42В случае [ML6]ν±,0 : октаэдрическое поле лигандов
Поле слабо влияет (энергия падает)
Поле сильно влияет (энергия растет) в случае АО d(z2) и d(x2–y2), располож. вдоль осей координат (ближе всего к лигандам)
Eо
|Eγ–Eо| = 3/5 Δ ; |Eε–Eо| = 2/5 Δ
Слайд 43ТКП-октаэдрическое поле
Сильное поле лигандов Δmax: переход электронов dε ⭲ dγ невозможен
Слабое
Принципы заселения dε и dγ
Сильное поле:
dε : e– 1+1+1 → dε : e– 2+2+2 →
→ dγ : e– 1+1 → dγ : e– 2+2
Слабое поле:
dε : e– 1+1+1 → dγ : e– 1+1 →
→ dε : e– 2+2+2 → dγ : e– 2+2
d 1,2,3
Слайд 44Параметр расщепления Δ и волновое число ν
1 см–1 соответствует ок. 12
Δ : 60 ÷ 420 кДж/моль или 5000 ÷ 35000 см–1
Примеры
[Mn(H2O)6]2+ Δ: 7800 см–1 [Fe(H2O)6]2+ Δ: 10400 см–1
[Mn(H2O)6]3+ Δ: 21000 см–1 [Fe(H2O)6]3+ Δ: 13700 см–1
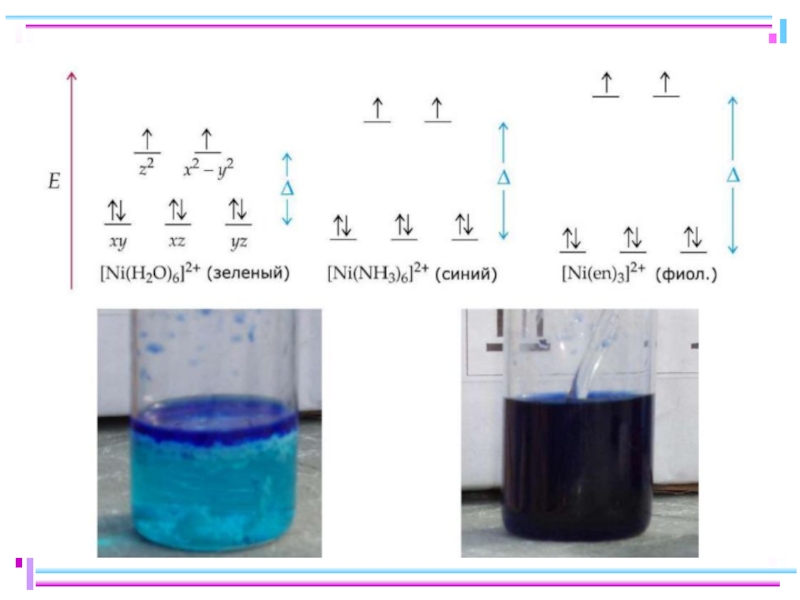
Слайд 47Лиганды сильного и слабого поля
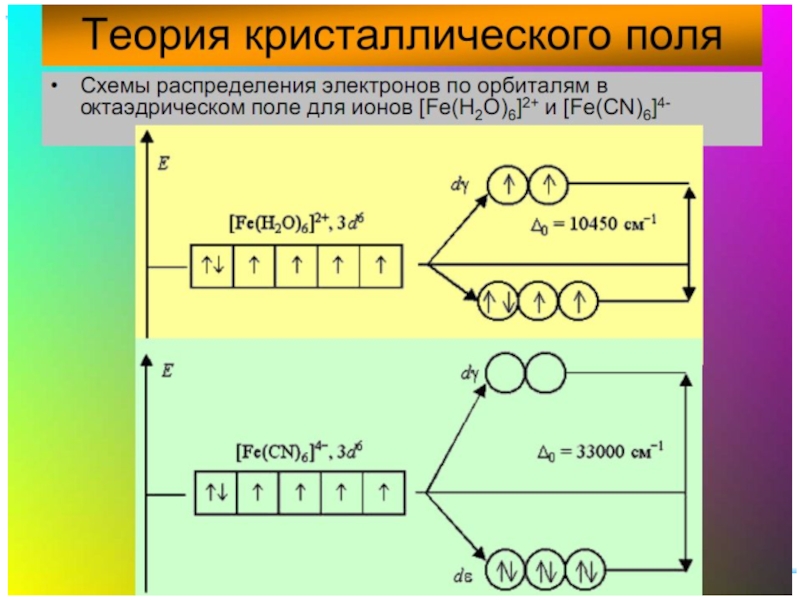
Спектрохимический ряд лигандов:
Br – < Cl–
Fe+II: [Ar] 3d 64s 04p 0
диамагн. [Fe(CN)6]4–
парамагн. [FeF6]4–
Слайд 48Цветность комплексных соединений
При облучении образца в-ва светом видимой части спектра может
отсутствие поглощения света (образец бесцветен)
полное поглощение света (образец черный)
поглощение света определенной длины волны (образец имеет цвет, дополнительный к поглощенному).
Цвет объекта определяется частотой полос поглощения видимого света
Слайд 49Цветность комплексов
Комплексы Sc(III), Cu(I), Zn(II), Cd(II) и др. не поглощают энергии
фиолет. [Ti(H2O)6]3+
бесцв. [Cd(H2O)6]2+
Слайд 50
Типы комплексных соединений.
1. Аквакомплексы
В водных растворах:
[Be(H2O)4]2+
[Al(H2O)6]3+
[Cr(H2O)6]3+ …
Кристаллогидраты:
[Be(H2O)4]SO4
[Al(H2O)6]Cl3
[K(H2O)6][Cr(H2O)6](SO4)2
[Cu(H2O)4]SO4·H2O
[Ni(H2O)6]SO4·H2O
: OH2
Слайд 51Аквакомплексы
Термич. разложение:
CuSO4·5H2O
⭣
CuSO4·4H2O + H2O(г)
⭣
CuSO4 + 4H2O(г)
[Cu(H2O)4]SO4·H2O («медный купорос»)
Слайд 532. Гидроксокомплексы
Получение:
Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >> 7
Разрушение:
⭣ + CH3COOH; CO2; NH4+ (сл.к-ты, pH ≈ 7)
Zn(OH)2(т)
⭣ + H3O+ (сильн.к-ты, pH < 7)
[Zn(H2O)4]2+
Образование гидроксокомплексов характерно для амфотерных элементов.
: OH–
Слайд 543. Аммины (аммиакаты)
Получение:
AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– + 2H2O
Разрушение:
[Ag(NH3)2]+
[Ag(NH3)2]+ + I– ⭢ AgI(т) + …
[Ag(NH3)2]+ + t° ⭢ NH3(г) + …
: NH3
Слайд 55Получение:
HgI2(т) + 2I–(изб.) = [HgI4]2–
[Fe(H2O)6]3+ + 6NCS−=[Fe(NCS)6]3− + 6H2O
Разрушение:
[HgI4]2–
[Fe(NCS)6]3− + 4F− = [FeF4]− + 6NCS−
4. Ацидокомплексы
: Х–
Слайд 566. Анионгалогенаты M[ЭГ′mГ″n] (Э, Г′ и Г″ – галогены)
Получение:
KI +
Разрушение:
K[I(I)2] + t° = KI + I2(г)
Cs[I(Br)(Cl)] + t° = CsCl + IBr(г)
7. Катионгалогены [ЭГ′mГ″n]Z (Э, Г′ и Г″ – галогены)
Получение:
ICl3 + SbCl5 = [ICl2][SbCl6]; BrF3 + AsF5 = [BrF2][AsF6]
Свойства:
Ag[BrF4](s) + [BrF2][SbF6](s) = Ag[SbF6](s) + 2BrF3(ж) в среде BrF3(ж)
Слайд 57Получение:
4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при 250 °C)
4 LiH + AlCl3 = Li[AlH4] + 3LiCl
3 Li[BH4] + AlCl3 = Al[BH4]3 + 3LiCl
Разрушение:
Na[AlH4] + 4 H2O = NaOH + Al(OH)3 + 4 H2↑ (ОВР)
2 Na[BH4] + H2SO4 = Na2SO4 + B2H6↑ + 2 H2↑ (ОВР)
5. Гидридокомплексы
: H–
Слайд 58Получение:
Ni(т) + 4CO(г) = [Ni(CO)4](ж) (ниже 50 °С)
тетракарбонилникель(0)
Разрушение:
[Ni(CO)4] + H2SO4(разб.) = NiSO4 + 4 CO↑ + H2↑
8. Карбонилы
: CO
Состав карбонильных комплексов: [Cr(CO)6], [Mn2(CO)10], [Fe(CO)5], [Co2(CO)8] и др.
Слайд 59Правило Сиджвика для определения состава комплексов
Устойчивым является комплекс, в котором
26Fe0 [Ar]3d64s2 || 36Kr
18 – 8 = 10e –
или 36 – 26 = 10e –
x = 10/2 = 5 эл.пар (5 молекул CO)
[Fe(CO)5] пентакарбонилжелезо
Слайд 60Правило Сиджвика (примеры)
* 27Co0 [Ar]3d74s2 || 36Kr
* 18 – 9 =
* х = 9/2 = 4,5 (?)
* радикал [·Co(CO)4]
* тетракарбонилкобальт
(неуст.)
* димер [Co2(CO)8] (уст.) октакарбонилдикобальт
23V0 [Ar]3d34s2 || 36Kr
18–5 = 13e –;
х = 13/2 = 6,5 (?)
радикал [·V(CO)6] (неуст.)
или компл.соединение состава K[:V–I(CO)6] гексакарбонилванадат(-I) калия (уст.)
Слайд 619. π-комплексы
Получение:
циклопентадиен С5H6 – слабая кислота HL
2 Na + 2HL =
FeCl2 + 2Na(C5H5) (+thf) =
= [Fe+II(C5H5)2] + 2NaCl
(в среде тетрагидрофурана)
Другие π-комплексы: [Cr(C6H6)2] – дибензолхром, [MnI(CO)3(cp)] –цимантрен, [Co(cp)2]OH
L – этилен C2H4, бензол C6H6, циклопентадиен С5H6 и т.п.
Слайд 6210. Хелаты
Внутр. сфера состоит из циклич. группировок, включающих M (комплексообразователь)
NH2CH2COOH
Cu(OH)2 + 2 NH2CH2COOH =
= [Cu(NH2CH2COO)2] + 2 H2O
NH2CH2COO− (глицинат-ион) - бидентатный лиганд
Слайд 63Реакция Чугаева
Ni2+ + 2 NH3·H2O + 2H2L =
= [Ni(HL)2](т)
бис(диметилглиоксимато)никель(II)
Слайд 64Методы синтеза комплексных соединений
Реакция обмена лигандов
А) в водном растворе (βобр, принцип
[Сu(H2O)4]2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 8H2O
β(обр. прод.) > β(обр. исх.реаг.)
Б) в неводном растворителе:
[Al(H2O)6]3+ + NH3·H2O ≠
[Al(H2O)6]3+(s) + 6NH3(ж) = [Al(NH3)6]3+(s) + 6H2O(s)
В) без растворителя:
[Ni(H2O)6]Cl2(т) + 6NH3(г) = [Ni(NH3)6]Cl2(т) +6H2O(г)
Г) внутримол. обмен лигандов в тв. фазе:
2[Co(H2O)6]Cl2(т) + t° = Co[CoCl4](т) + 12H2O
розовый синий
Слайд 65Методы синтеза комплексных соединений
Д) ОВР + реакции обмена лигандов
[СoII(H2O)6]2+ → [СoIIIL6]3+
Ок.: H2O2, KNO2 … L – NH3, NO2– …
Примеры:
2CoIICl2 + 12NH3 + H2O2 = 2[CoIII(NH3)6](OH)Cl2
CoIICl2 + 7KNO2 + 2CH3COOH =
= K3[CoIII(NO2)6]↓ + NO↑ + 2KCl + 2CH3COOK + H2O
+ Вс
[NiII(CN)4]2– → [Ni0(CN)4]4–
Слайд 66Решение задач. 1. Растворение осадка при комплексообразовании
AgBr(т) ⮀ Ag+ + Br
Ag+ + 2 SO3S2– ⮀ [Ag(SO3S)2]3– ; βобр = 4·1013
AgBr(т) + 2 SO3S2– ⮀ [Ag(SO3S)2]3– + Br –;
Kc = ?
Kc = ПРAgBr × βобр = 7,7·10–13 × 4·1013 = 30,8 >> 1
Наблюдается растворение осадка (смещение равновесия вправо →)
= ПРAgBr × βобр
Слайд 67Решение задач. 2. Реакция обмена лигандов
[Co(NH3)6]3+ + 6 CN– ⮀ [Co(CN)6]3–
Kc = ?
Co3+ + 6 NH3 ⮀ [Co(NH3)6]3+ ; βобр(1) = 1,6·1035
Co3+ + 6 CN– ⮀ [Co(CN)6]3– ; βобр(2) = 1,0·1064
Kc = βобр(2) / βобр(1) = (1,0·1064)/(1,6·1035) = 6,2·1029 >> 1
Наблюдается смещение равновесия вправо →
βобр(2)
βобр(1)
Слайд 68Решение задач. 3. Разрушение комплекса
[Cu(NH3)4]2+ + 4 H3O+ ⮀ [Cu(H2O)4]2+ +
Kc = ?
Cu2+ + 4 NH3 ⮀ [Cu(NH3)4]2+ ; βобр = 7,9·1012
NH4+ + 2H2O ⮀ NH3·H2O + H3O+ ; Kк = 5,75·10–10
Kc = 1 / (7,9·1012·5,754·10–40 ) = 1,16·1020 >> 1
Наблюдается разрушение аммиачного комплекса в кислотной среде (смещение равновесия вправо →)
1
βобр Kк 4
Слайд 69Решение задач. 4. Направление реакции
CuCN(т) + H2O + HCN ⮀
Kc = ?
Cu+ + 2CN– ⮀ [Cu(CN)2]– ; βобр = 1,0·1024
HCN + H2O ⮀ CN– + H3O+ ; Kк = = 4,93·10–10
CuCN(т) ⮀ Cu+ + CN– ; ПРCuCN = 3,2·10–20
Kc = 1,0·1024 · 4,93·10–10 · 3,2·10–20 = 1,6·10–6 << 1
Растворение осадка не наблюдается (равновесие смещено влево ←)
= βобр·Kк·ПРCuCN
Слайд 129
Содержание
Введение
Комплексные ионы
Комплексные соединения
Реакции комплексообразования
Координационные соединения
Глава 1. Основные понятия
1.1. Комплексообразователь
1.2. Лиганды
1.3. Дентатность
1.4. Координационное число
1.5. Внутренняя и внешняя сфера
1.6. Многоядерные комплексы
Глава 2. Номенклатура комплексных соединений
2.1. Названия лигандов
2.2. Порядок перечисления лигандов
2.3. Нейтральные комплексы
2.4. Комплексные катионы
2.5. Комплексные анионы
2.6. Мостиковые группы и многоядерные комплексы
2.7. Геометрические изомеры
Глава 3. Строение комплексных соединений
3.1. Координационное число 2
3.2. Координационное число 3
3.3. Координационное число 4
3.4. Координационное число 5
3.5. Координационное число 6 и выше
Слайд 130Глава 4. Изомерия комплексных соединений
4.1. Изомерия лигандов
4.2. Геометрическая изомерия
4.3.
4.4. Сольватная (гидратная) изомерия
4.5. Ионная изомерия
Вопросы к 4 главе
Глава 5. Устойчивость комплексных соединений в растворе
5.1. Комплексные соединения без внешней сферы
5.2. Отщепление ионов внешней сферы
5.3. Обратимая диссоциация комплексов
5.4. Ступенчатая и полная константы образования
5.5. Прочность комплексов
5.6. Константы нестойкости
5.7. Примеры образования и разрушения комплексов
Вопросы к 5 главе
Глава 6. Квантовомеханические теории строения комплексов
6.1. Теория валентных связей
6.2. Гибридизация орбиталей и структура комплексов
6.3. Теория кристаллического поля
6.4. Цветность
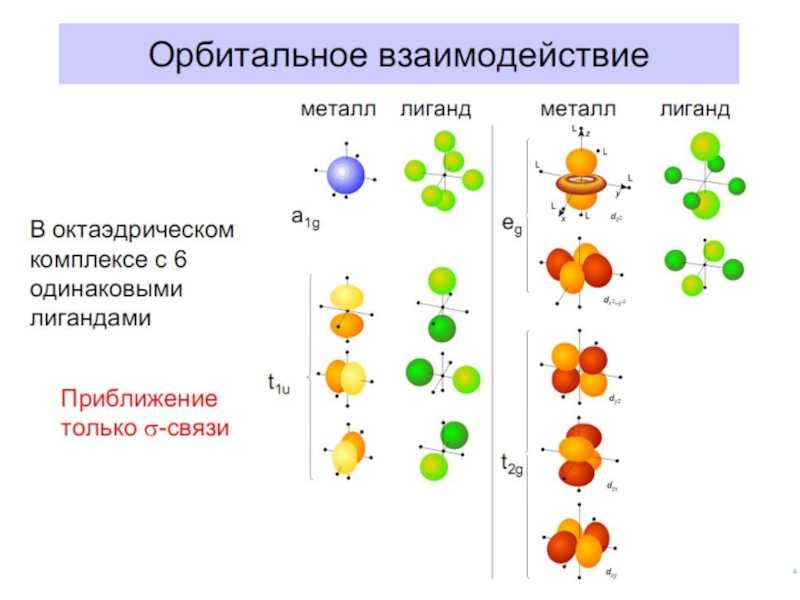
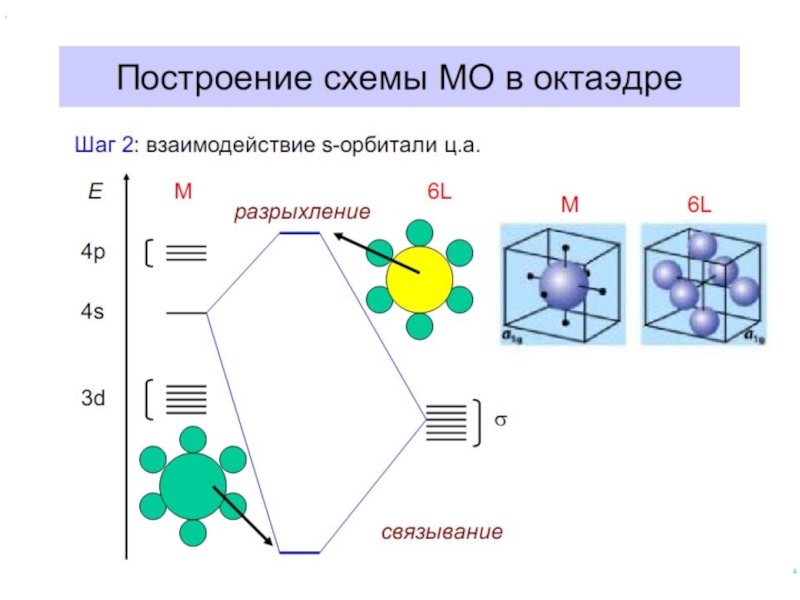
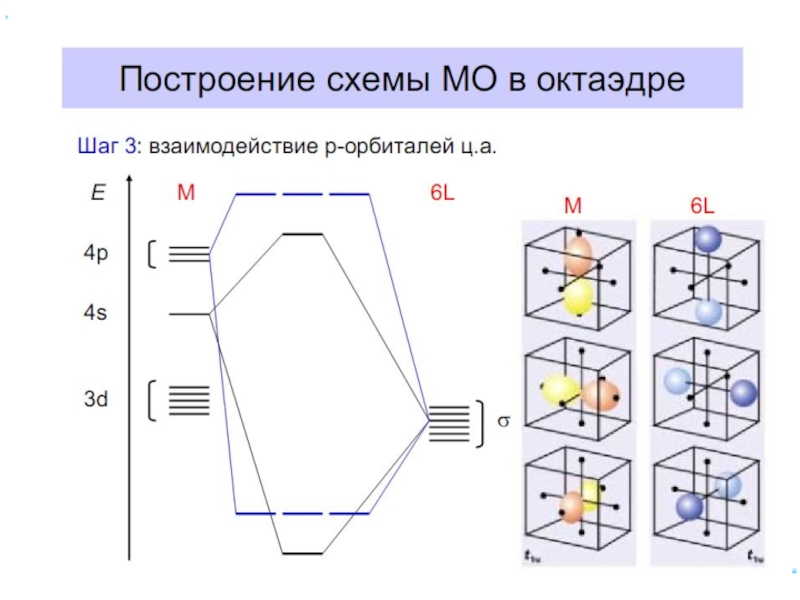
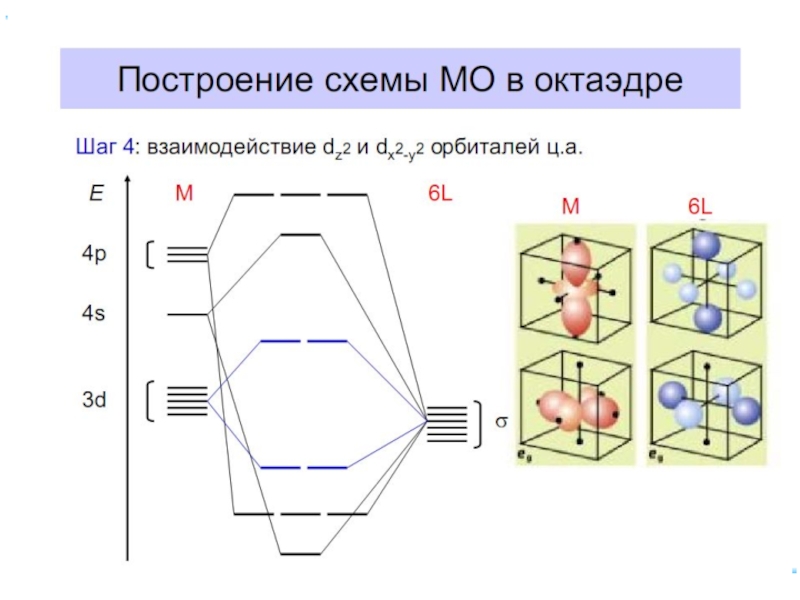
6.5. ММО для комплексных соединений
Слайд 131
Глава 7. Типы комплексных соединений
7.1. Аквакомплексы
7.2. Гидроксокомплексы
7.3. Аммиакаты
7.4.
7.5. Анионгалогенаты
7.6. Катионгалогены
7.7. Гидридные комплексы
7.8. Карбонильные комплексы
7.9. p-комплексы
7.10. Хелаты
7.11. Многоядерные комплексы
Глава 8. Элементы Периодической системы Д.И. Менделеева: способность к образованию комплексов
8.1. Элементы s-секции
8.2. Элементы p-секции
8.3. Элементы d-секции
8.4. Лантаноиды и актиноиды


![Простые и комплексные соединенияHgI2 + 2KI = K2[HgI4]SO3(т) + K2O(т) = = K2SO4(т)HgI2(т) + 2K+(р)](/img/tmb/4/383236/a4f3816d7a19b9ee9caed219e0dc8bd8-800x.jpg)

![Координационная теория (1893 г. )Внутренняя и внешняя сфера комплексного соединения [MLx]YzКомплексообразователь M±νЛиганды L±νКоординационное число КЧДентатность](/img/tmb/4/383236/becfc22c40b9b200e0a92426e1adce64-800x.jpg)
![Внутренняя сфера [комплекс] Внешняя сфера (противоион) [Ni(NH3)6]Cl2 K4[Fe(CN)6][Cr(CO)6][Ni(NH3)6]2[Fe(CN)6]ПримерыВнеш.сферы нет](/img/tmb/4/383236/9715c4fff02237c39dc18a18423cef4b-800x.jpg)
![Комплексообразователь, лиганды, КЧ и дентатность. Примеры[NH4]Cl – КЧ 4, дент.1[Al(H2O)6]Cl3 – КЧ 6, дент.1K[I(I)2] –](/img/tmb/4/383236/2ad1b721ed6751d3a78a411e204a5f70-800x.jpg)
![2. Формулы и названия компл. соединений. [M(L+)(L0)(L–)]±,0Число лигандов – греч. числит.1 – (моно)2 – ди3](/img/tmb/4/383236/17b4adc14c8fe6a00acf15bfa2a01e5d-800x.jpg)
![3. Названия комплексных соединений А) Комплексы без внешней сферы[MLn] n → L → M](/img/tmb/4/383236/2c992c5a08823fcfd4571acbe4f6579e-800x.jpg)
![Названия комплексных соединенийБ) Комплексный катион[MLn]+X– «анион катиона»: n → L → M(ст.ок.)Примеры: [AgI(NH3)2]OH –](/img/tmb/4/383236/10ad25792df3111ae2f8c5a3da65df5e-800x.jpg)
![Названия комплексных соединенийВ) Комплексный анионX+[MLn]– «анион катиона»: анион n → L → M(ст.ок.)-«ат»Ag –](/img/tmb/4/383236/cb8e75142533d30ed368a1a07c9d58ed-800x.jpg)
![Упражнения:Na3[AgI(SO3S)2] – бис(тиосульфато)аргентат(I) натрия[PtII(py)4]2[FeII(CN)6] – гексацианоферрат(II) тетрапиридинплатины(II)[K(H2O)6][Al(H2O)6](SO4)2 – сульфат гексаакваалюминия-гексааквакалия[(CO)5Mn-Mn(CO)5] – бис(пентакарбонилмарганец)[(H2O)4Al(OH)2Al(H2O)4](SO4)2 – сульфат ди(μ-гидроксо)бис(тетраакваалюминия)](/img/tmb/4/383236/84782c9aaf97192b57898c92a8e14bea-800x.jpg)

![Изомерия лигандовСвязевая —NO2– и —ONO– нитро- нитрито-[Co(NH3)5NO2]2+ (желто-коричн.р-р)[Co(NH3)5ONO]2+ (розов.р-р)—NCS– и —SCN–тиоцианато-N](/img/tmb/4/383236/7c3fca35f593687c341ade2f7b50d8e5-800x.jpg)

![Геометрическая изомерия[ML′5L′′]: изомеров нетцис- и транс-изомеры дигидроксотетраамминкобальта(II)](/img/tmb/4/383236/8219054344fa77d98c384cbc545de8ca-800x.jpg)
![Междусферная изомерия: 1) сольватная (гидратная); 2) ионная изомерия [Co(en)2Cl2]Cl · H2O[Co(H2O)(en)2Cl]Cl2[Co(NH3)5I]SO4[Co(NH3)5SO4]I1 Cl–; H2O (AgCl↓)2 Cl–](/img/tmb/4/383236/e39ed721e081be2b0a6d137bfb6723f1-800x.jpg)
![Междусферная изомерияИонные (ионизационные) изомеры [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2[Pt(NH3)4SO4](OH)2 и [Pt(NH3)4(OH)2]SO4 pH >> 7](/img/tmb/4/383236/9e3c8efbe50399831abfc96d01a84984-800x.jpg)
![Комплексные соединения в растворахНеэлектролиты (слабые электролиты) [Pt(NH3)2Cl2] (ср. H2O2, CO(NH2)2 )Сильные электролиты[Pt(NH3)4]Cl2 = [Pt(NH3)4]2+ +](/img/tmb/4/383236/409c7c87916dc24a0a1ab6dbdd91c08a-800x.jpg)
![[MLn] + H2O ⮀ [MLn-1(H2O)] + L0 (n = КЧ)](/img/tmb/4/383236/05b784a37ff63078b9c770a0d8e0f392-800x.jpg)


![Сравнение устойчивости аммиачных комплексовСтупени комплексообразования[Cu(NH3)2]+ K2(обр) = 5,0·104 [Cu(NH3)]+ K1(обр) = 1,4·106 Природа комплексообразователя[Cu(NH3)2]+ β2(обр) = 7,0·1010](/img/tmb/4/383236/da85453c52bbdd3e0487fef7eac23206-800x.jpg)
![Хелат-эффект[Ni(NH3)6]2+ β6(обр)= 5,3 . 108[Ni(en)3]2+ β3(обр)= 1,3 . 1019[Ni(NH3)6]2+ + 3 en + 6H2O =](/img/tmb/4/383236/0679c89fdd9cb2e61d44e4b5f1ddb6f3-800x.jpg)

![Для атомов комплексообразователей: E(n−1)d ≈ Ens ≈ Enp ≈ End Пример: комплексы никеля. Ni0 [Ar]](/img/tmb/4/383236/6df95af3c8a3910f94728d3ffd6f10fd-800x.jpg)
![Ni+II[Ni(CN)4]2– уст., диамагн., квадратКЧ 4[Ni(CN)5]3– уст., диамагн., квадратная пирамидаКЧ 5[Ni(H2O)6]2+, [Ni(NO2)6]4– : уст., парамагн., октаэдрКЧ 6Ni+II](/img/tmb/4/383236/c15dbd6b21af55df136c5dfa2c184c45-800x.jpg)
![Fe+II[FeF6]4– уст., парамагн., октаэдрКЧ 6Fe+II[Fe(CN)6]4– уст., диамагн., октаэдрКЧ 6](/img/tmb/4/383236/fc2903bbd96bde546b203a824d39e53c-800x.jpg)

![В случае [ML6]ν±,0 : октаэдрическое поле лигандовПоле слабо влияет (энергия падает) в случае АО d(xy),](/img/tmb/4/383236/71c659845060deae6e542926b3e493c8-800x.jpg)

![Типы комплексных соединений. 1. АквакомплексыВ водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+ [Cr(H2O)6]3+ … Кристаллогидраты: [Be(H2O)4]SO4 [Al(H2O)6]Cl3[K(H2O)6][Cr(H2O)6](SO4)2[Cu(H2O)4]SO4·H2O[Ni(H2O)6]SO4·H2O : OH2](/img/tmb/4/383236/c23b7c3faa3db02099479c49d342968e-800x.jpg)
![АквакомплексыТермич. разложение:CuSO4·5H2O⭣ CuSO4·4H2O + H2O(г)⭣CuSO4 + 4H2O(г)[Cu(H2O)4]SO4·H2O («медный купорос»)](/img/tmb/4/383236/bfd2c65a059db0e627328a9d36bb35dd-800x.jpg)
![Аквакомплексы[Fe(H2O)6]SO4·H2O («железный купорос»)](/img/tmb/4/383236/bed539a974118fcda437ad58dce69af8-800x.jpg)
![2. ГидроксокомплексыПолучение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >> 7Разрушение: [Zn(OH)4]2– (+H3O+) ⭣ +](/img/tmb/4/383236/a46300d74528ef7cd429a29d52e2e6ec-800x.jpg)
![3. Аммины (аммиакаты)Получение: AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– + 2H2OРазрушение:[Ag(NH3)2]+ + H3O+ ⭢ NH4+](/img/tmb/4/383236/d0cf2372936f8b4c908295dc008cd498-800x.jpg)
![Получение: HgI2(т) + 2I–(изб.) = [HgI4]2– [Fe(H2O)6]3+ + 6NCS−=[Fe(NCS)6]3− + 6H2OРазрушение:[HgI4]2– + S2– = HgS(т)](/img/tmb/4/383236/cb4abededbdf7a0ce417baea3261264c-800x.jpg)
![6. Анионгалогенаты M[ЭГ′mГ″n] (Э, Г′ и Г″ – галогены)Получение: KI + I2 = K[I(I)2];](/img/tmb/4/383236/d91780763707651a15dfd8b28368c44c-800x.jpg)
![Получение:4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при 250 °C) 4 LiH + AlCl3](/img/tmb/4/383236/ef9997ccdfb8d92f0e21c0178710d704-800x.jpg)
 (ниже 50 °С)тетракарбонилникель(0) Разрушение: [Ni(CO)4](ж) + t° = Ni(т)](/img/tmb/4/383236/27591659a0e3323fd468abb905b49b8d-800x.jpg)

![Правило Сиджвика (примеры)* 27Co0 [Ar]3d74s2 || 36Kr* 18 – 9 = 9e –; * х](/img/tmb/4/383236/311d2e11218adbf1c2535368583af50c-800x.jpg)
 + 2NH4+ + 2H2Oбис(диметилглиоксимато)никель(II)](/img/tmb/4/383236/556a0a8f863a5532354b58783f46d652-800x.jpg)
![Методы синтеза комплексных соединенийРеакция обмена лигандовА) в водном растворе (βобр, принцип Ле Шателье):[Сu(H2O)4]2+ + 4NH3·H2O](/img/tmb/4/383236/0bd5b5a124cf98292fc13fefdf23b65c-800x.jpg)


![Решение задач. 2. Реакция обмена лигандов[Co(NH3)6]3+ + 6 CN– ⮀ [Co(CN)6]3– + 6 NH3 ;](/img/tmb/4/383236/4316714e4a178a43fd58902070b8e92e-800x.jpg)
![Решение задач. 3. Разрушение комплекса[Cu(NH3)4]2+ + 4 H3O+ ⮀ [Cu(H2O)4]2+ + 4 NH4+ ; Kc](/img/tmb/4/383236/ea939af9d86ea85b18b8139cee5d2bd1-800x.jpg)
![Решение задач. 4. Направление реакции CuCN(т) + H2O + HCN ⮀ [Cu(CN)2]– + H3O+ Kc](/img/tmb/4/383236/2c19a495520db5e4c35e1bf04dfad15d-800x.jpg)