ХИМИЯ
АМИНОКИСЛОТ, ПЕПТИДОВ
И БЕЛКОВ
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химия аминокислот, пептидов и белков презентация
Содержание
- 1. Химия аминокислот, пептидов и белков
- 2. План лекции Аминокислоты. Определение, строение, виды классификаций.
- 3. Аминокислоты - это органические вещества, содержащие карбоксильную
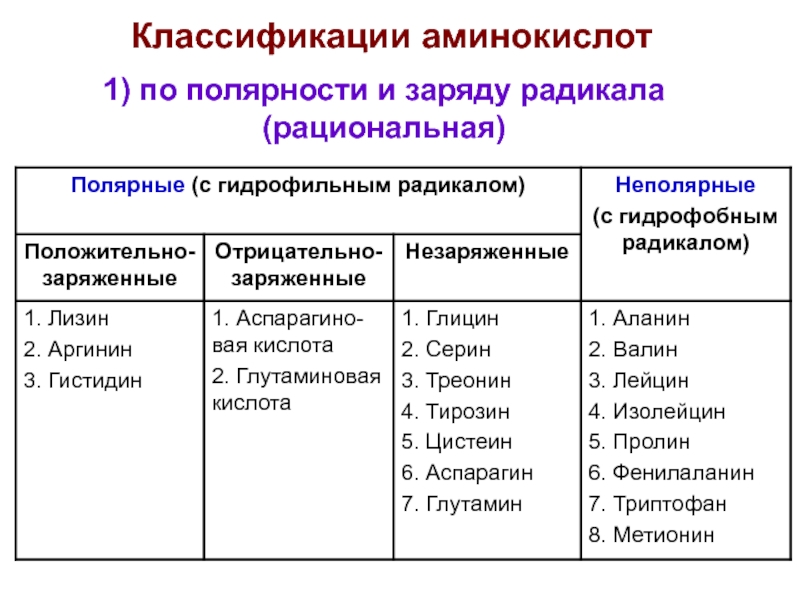
- 4. 1) по полярности и заряду радикала (рациональная) Классификации аминокислот
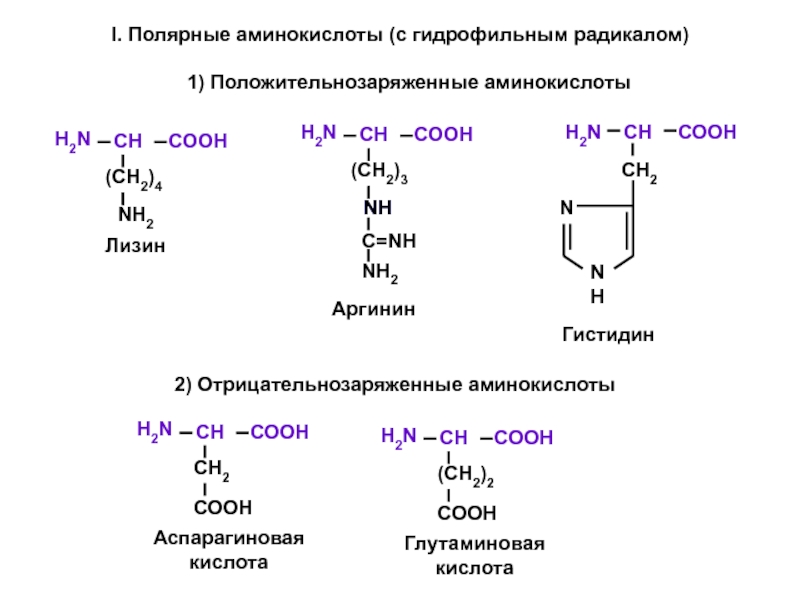
- 5. 2) Отрицательнозаряженные аминокислоты 1) Положительнозаряженные аминокислоты I. Полярные аминокислоты (с гидрофильным радикалом)
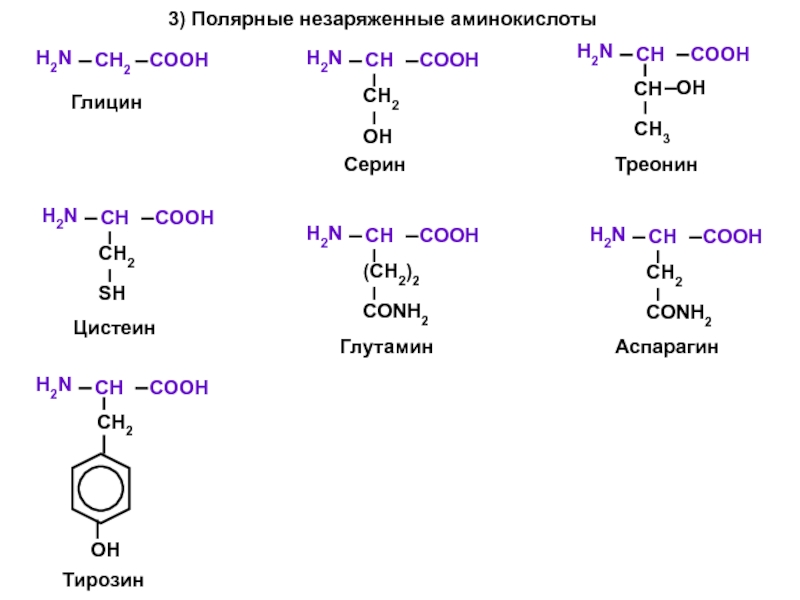
- 6. 3) Полярные незаряженные аминокислоты
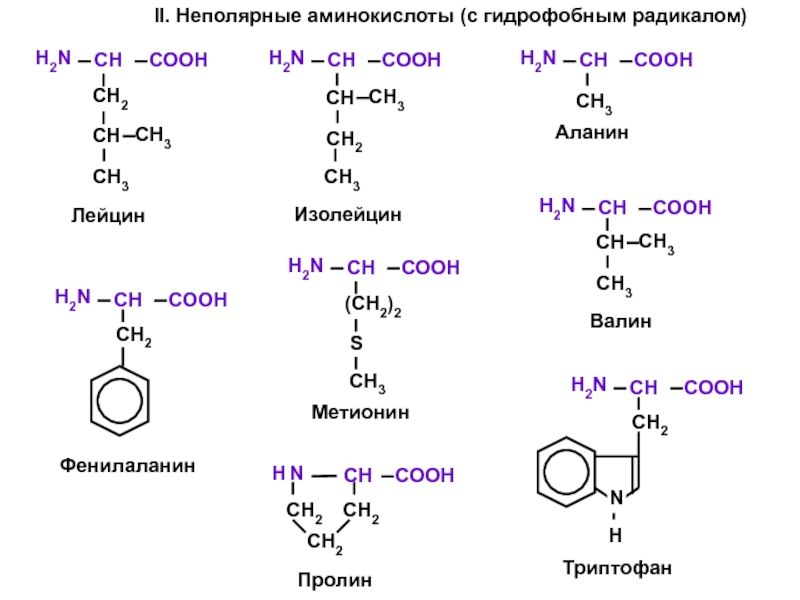
- 7. II. Неполярные аминокислоты (с гидрофобным радикалом)
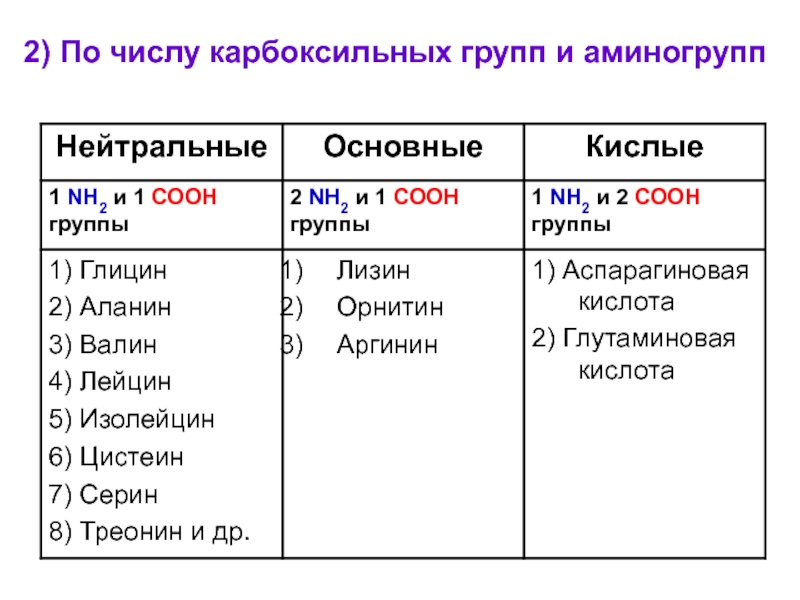
- 8. 2) По числу карбоксильных групп и аминогрупп
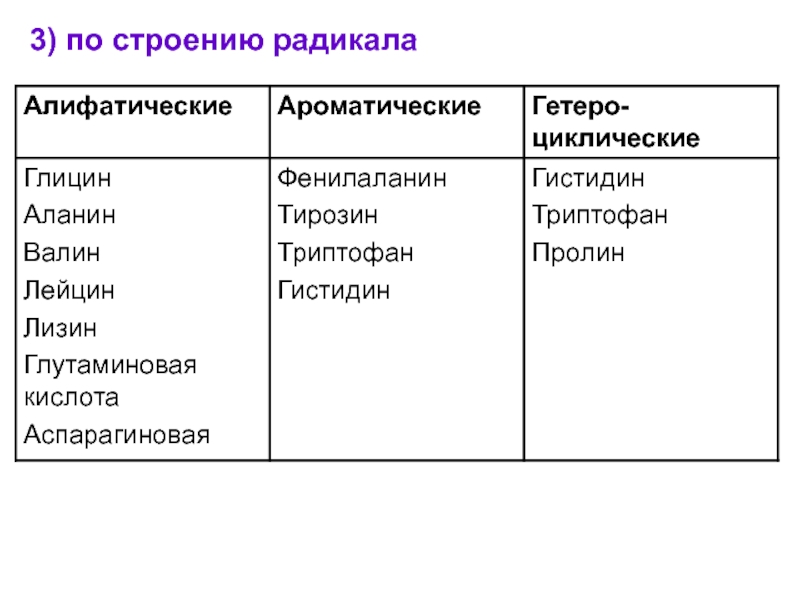
- 9. 3) по строению радикала
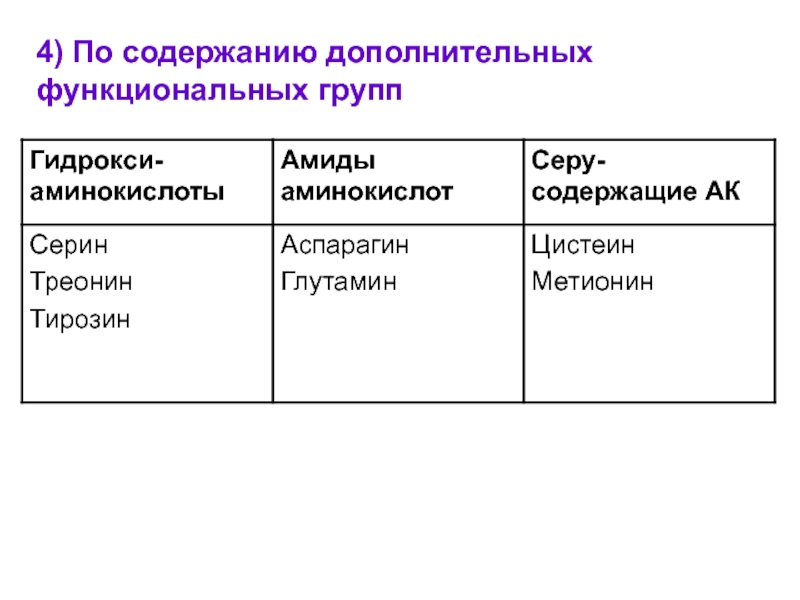
- 10. 4) По содержанию дополнительных функциональных групп
- 11. 5) Биологическая классификация
- 12. Свойства аминокислот
- 13. 1) Амфотерность аминокислот Основные свойства аминокислоты обусловлены
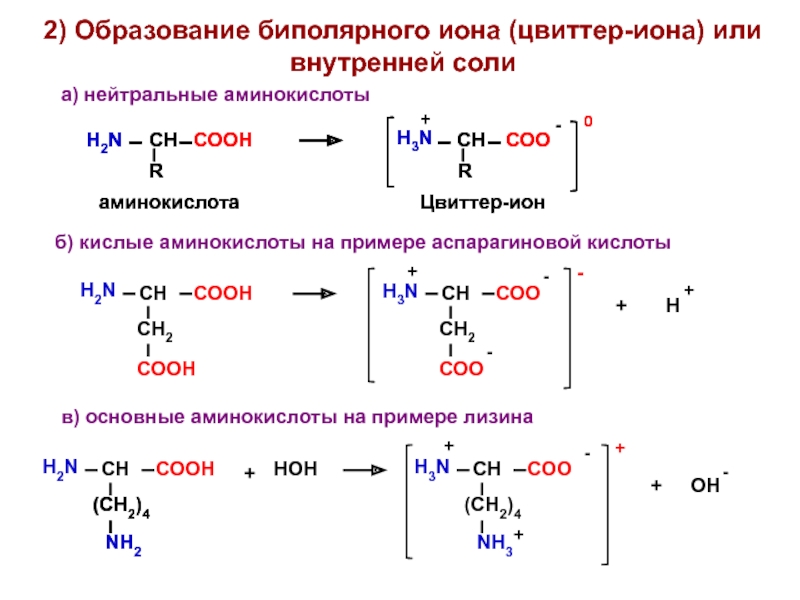
- 14. 2) Образование биполярного иона (цвиттер-иона) или внутренней
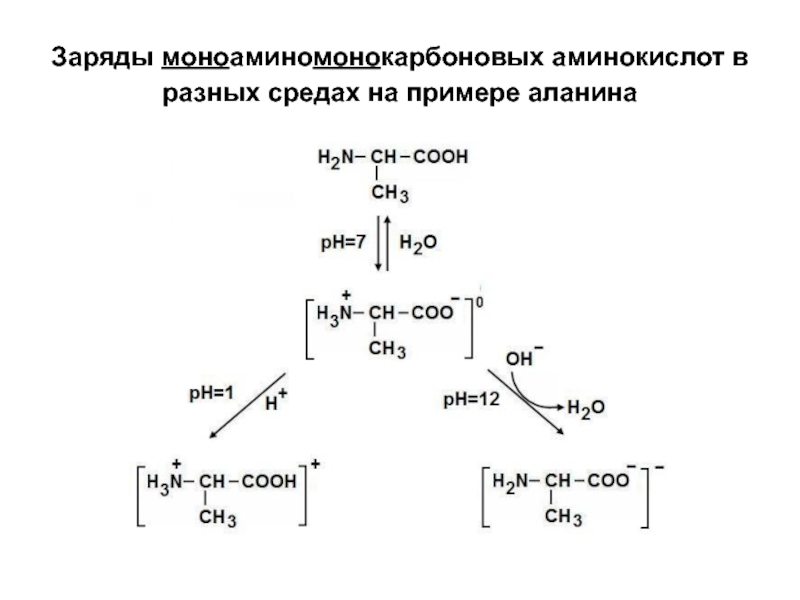
- 15. Заряды моноаминомонокарбоновых аминокислот в разных средах на примере аланина
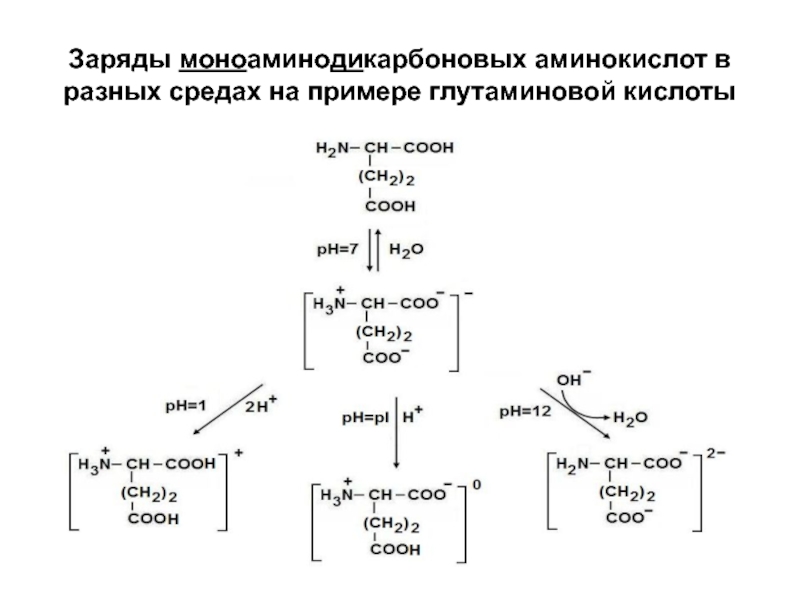
- 16. Заряды моноаминодикарбоновых аминокислот в разных средах на примере глутаминовой кислоты
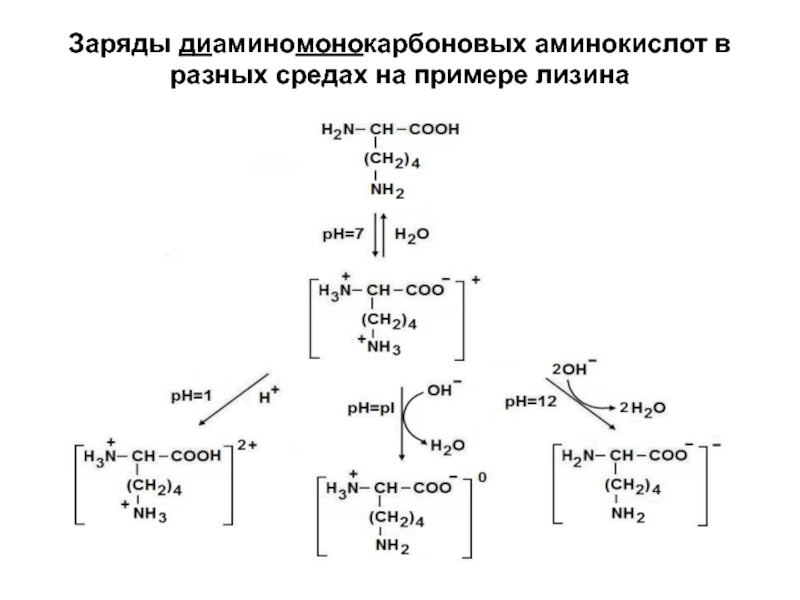
- 17. Заряды диаминомонокарбоновых аминокислот в разных средах на примере лизина
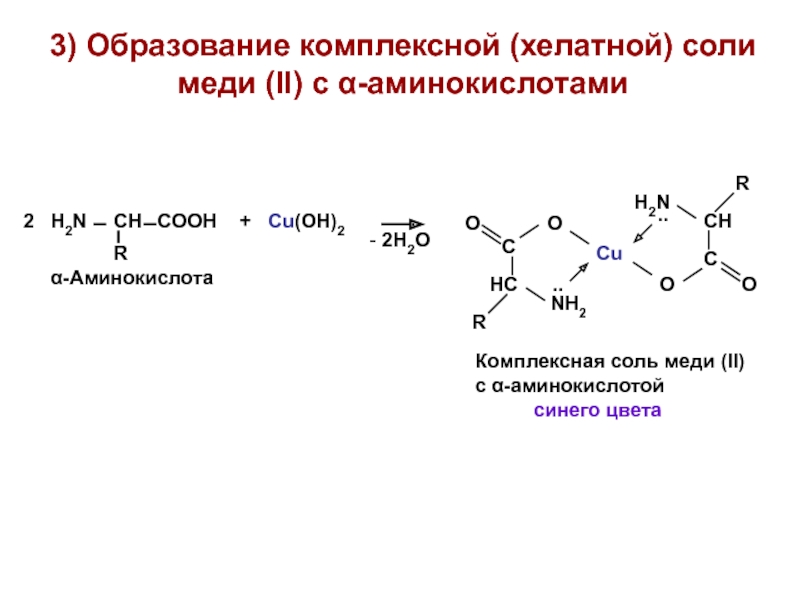
- 18. 3) Образование комплексной (хелатной) соли меди (II) с α-аминокислотами синего цвета
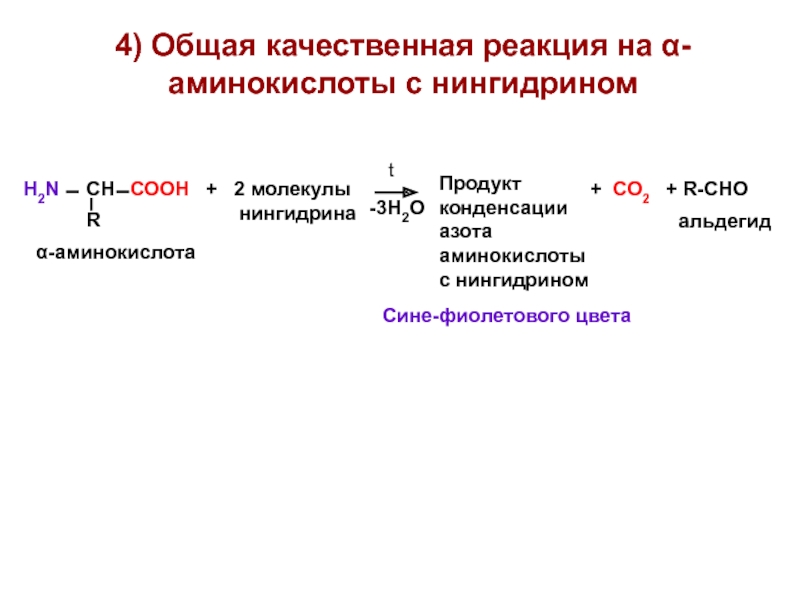
- 19. 4) Общая качественная реакция на α-аминокислоты с нингидрином
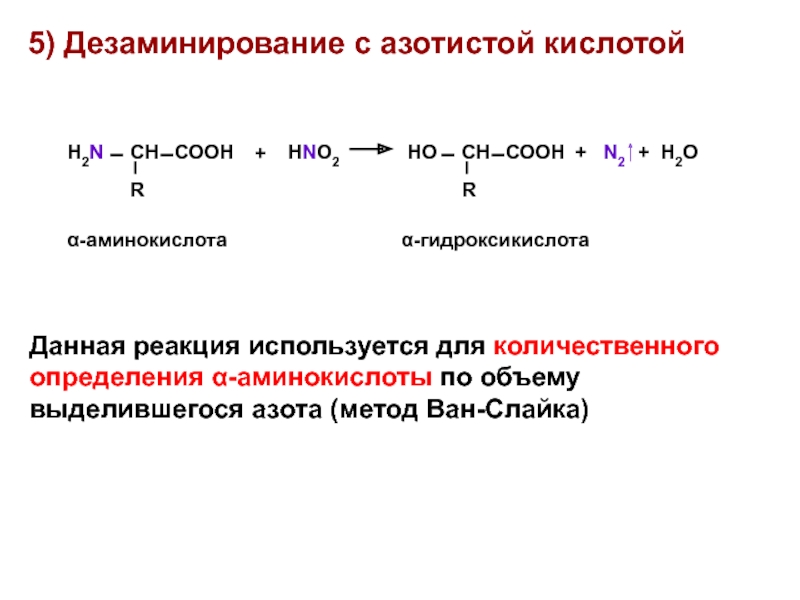
- 20. 5) Дезаминирование с азотистой кислотой Данная реакция
- 21. Общие пути превращения аминокислот в организме животных
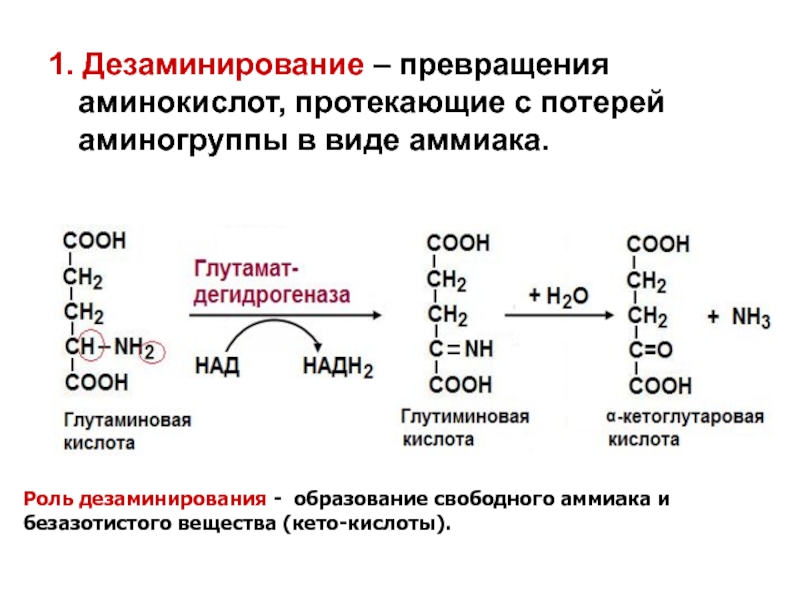
- 22. 1. Дезаминирование – превращения аминокислот, протекающие с
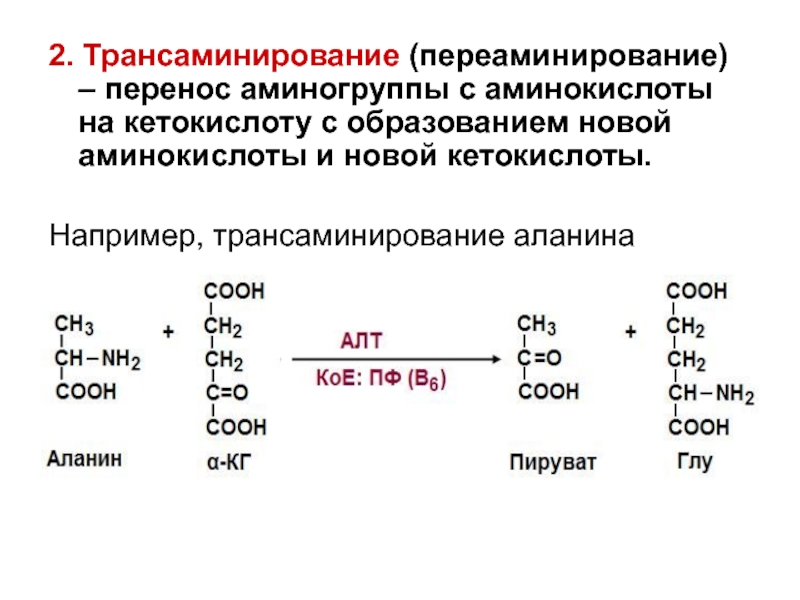
- 23. 2. Трансаминирование (переаминирование) – перенос аминогруппы с
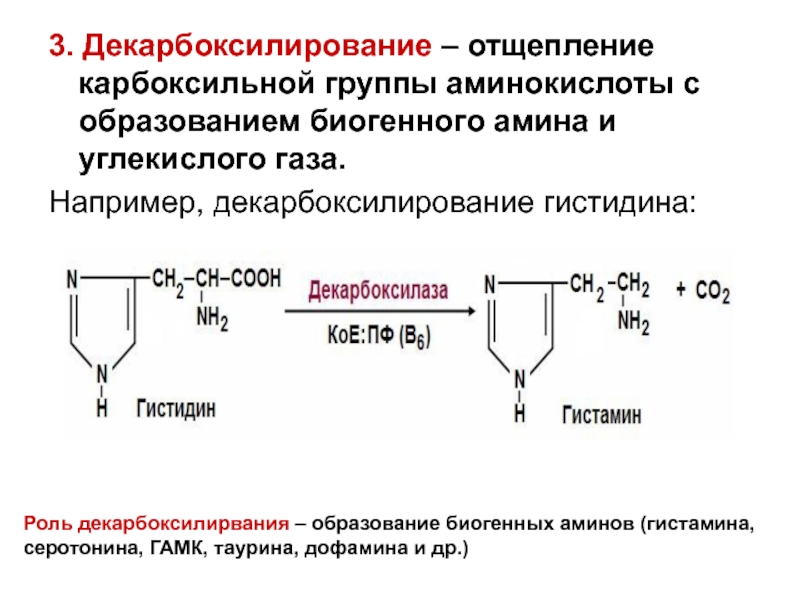
- 24. 3. Декарбоксилирование – отщепление карбоксильной группы аминокислоты
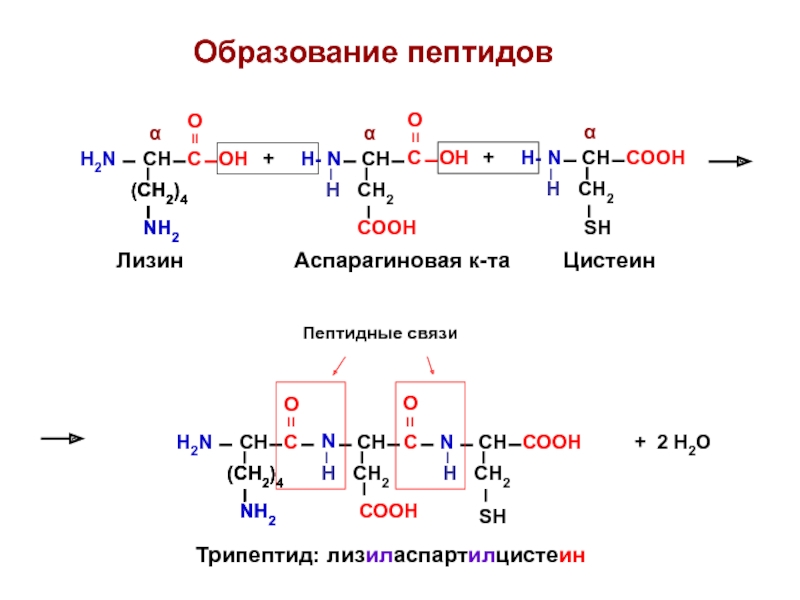
- 25. Пептиды - это органические вещества, содержащие
- 26. Образование пептидов H2N СН + 2
- 27. Белки – высокомолекулярные азотсодержащие биополимеры (полипептиды), построенные
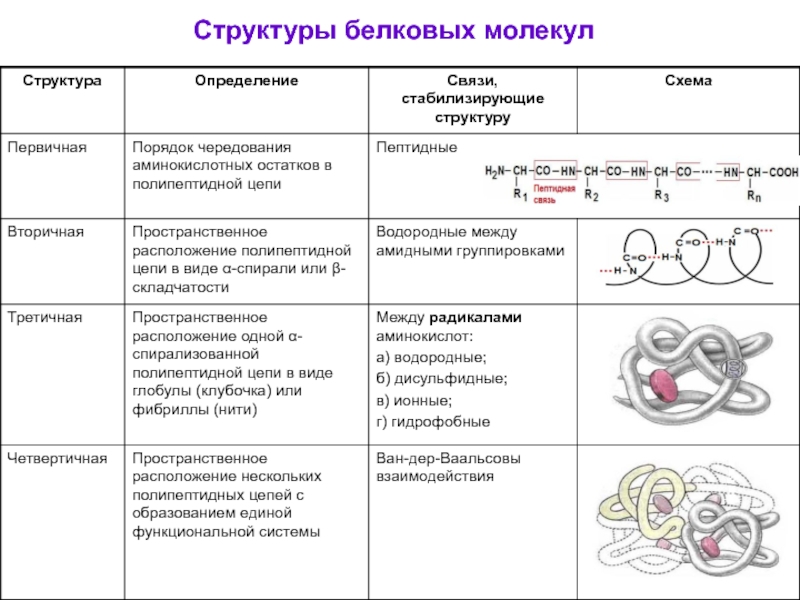
- 28. Строение белковых молекул Первичная структура белка
- 29. Секвенирование – определение первичной структуры белка путем
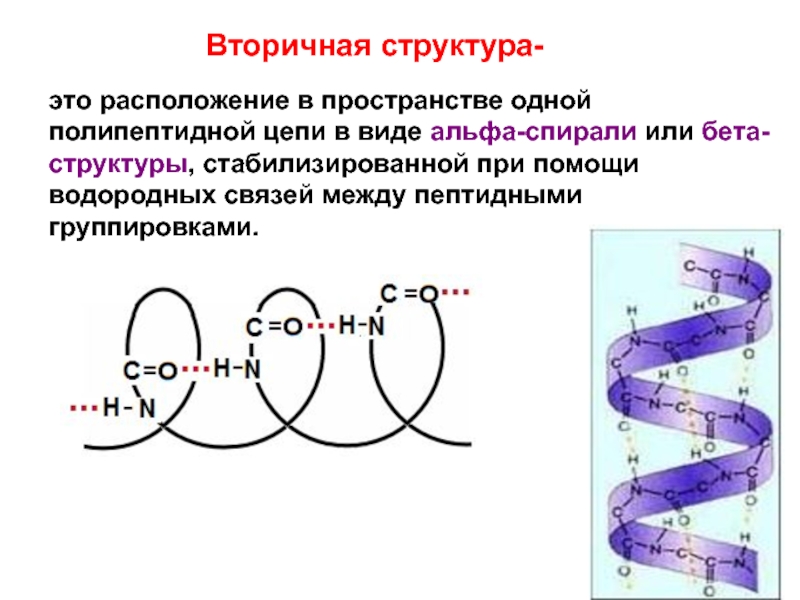
- 30. Вторичная структура- это расположение в пространстве одной
- 31. Третичная структура - это расположение в пространстве
- 32. Четвертичная структура- Это расположение в пространстве нескольких
- 33. Структуры белковых молекул
- 34. Физико-химические свойства белков Наличие высокой молекулярной
- 35. 3) Изоэлектрическая точка (рI) – значение рН
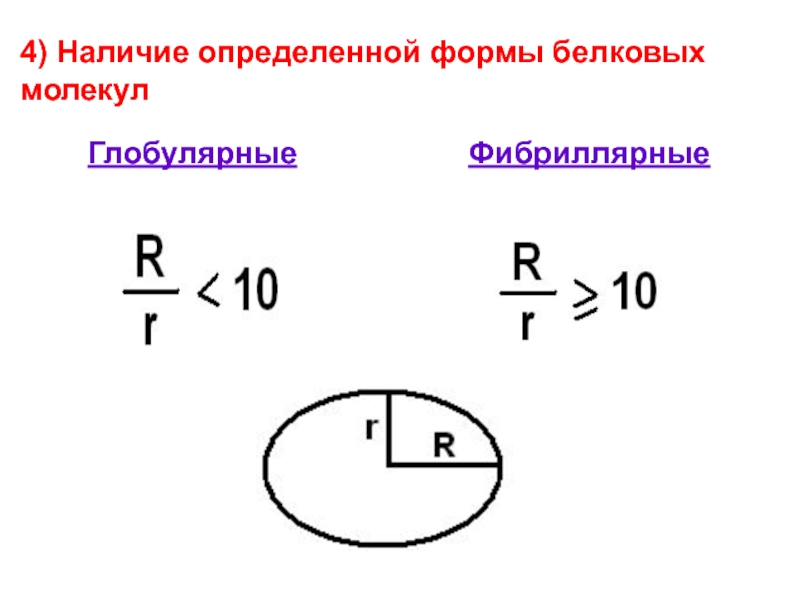
- 36. Глобулярные Фибриллярные 4) Наличие определенной формы белковых молекул
- 37. 5) Растворимость в воде
- 38. 6) осаждаемость Необратимое осаждение (денатурация)
- 39. Классификация белков Простые - при гидролизе дают
- 40. Функции белков Структурная (коллаген, эластин, кератин)
Слайд 1Лекция для студентов 1 курса лечебного, педиатрического и стоматологического факультетов
Составитель: Трофимова
Слайд 2План лекции
Аминокислоты. Определение, строение, виды классификаций.
Свойства аминокислот: амфотерность, образование цвиттер-иона, образование
Пептиды, полипептиды, образование пептидов. Биологически важные пептиды.
Белки: определение, структуры, связи, участвующие в стабилизации структуры молекулы белка, формы белковых молекул.
Свойства белков: амфотерность, растворимость, факторы, стабилизирующие белки в растворе, изоэлектрическое состояние, изоэлектрическая точка.
Классификация и роль белков
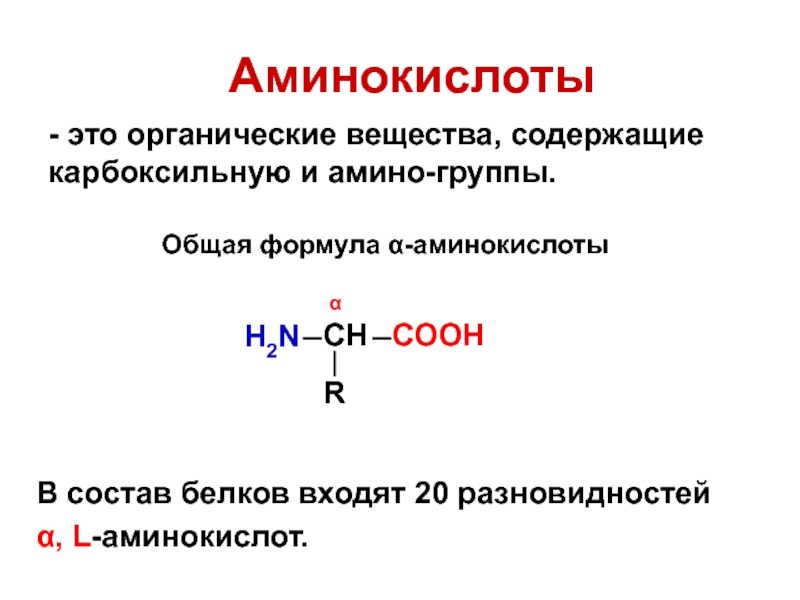
Слайд 3Аминокислоты
- это органические вещества, содержащие карбоксильную и амино-группы.
В состав белков входят
α, L-аминокислот.
Общая формула α-аминокислоты
Слайд 52) Отрицательнозаряженные аминокислоты
1) Положительнозаряженные аминокислоты
I. Полярные аминокислоты (с гидрофильным радикалом)
Слайд 131) Амфотерность аминокислот
Основные свойства аминокислоты обусловлены наличием амино-группы:
- способность аминокислоты проявлять
Кислотные свойства аминокислоты обусловлены наличием карбоксильной группы:
Слайд 142) Образование биполярного иона (цвиттер-иона) или внутренней соли
а) нейтральные аминокислоты
-
+
НОН
б)
в) основные аминокислоты на примере лизина
Слайд 205) Дезаминирование с азотистой кислотой
Данная реакция используется для количественного определения α-аминокислоты
Слайд 21Общие пути превращения аминокислот в организме животных и человека
1. Дезаминирование
2. Трансаминирование
3.
Слайд 221. Дезаминирование – превращения аминокислот, протекающие с потерей аминогруппы в виде
Роль дезаминирования - образование свободного аммиака и безазотистого вещества (кето-кислоты).
Слайд 232. Трансаминирование (переаминирование) – перенос аминогруппы с аминокислоты на кетокислоту с
Например, трансаминирование аланина
Слайд 243. Декарбоксилирование – отщепление карбоксильной группы аминокислоты с образованием биогенного амина
Например, декарбоксилирование гистидина:
Роль декарбоксилирвания – образование биогенных аминов (гистамина, серотонина, ГАМК, таурина, дофамина и др.)
Слайд 25 Пептиды - это органические вещества, содержащие в своем составе от
Полипептиды - это органические вещества, содержащие в своем составе более 10 АК остатка.
Белки – полипептиды, содержащие более 50 АК остатков.
Пептиды
Слайд 26Образование пептидов
H2N
СН
+ 2 Н2О
(СН2)4
NН2
(СН2)4
NН2
α
С
=
О
ОН
H- N
СН
+
_
Н
СН2
СООН
α
С
=
О
ОН
СООН
H- N
СН
+
_
Н
СН2
α
SH
Лизин
Аспарагиновая к-та
Цистеин
Слайд 27Белки
– высокомолекулярные азотсодержащие биополимеры (полипептиды), построенные из α-аминокислот, соединенных друг с
Углерод – 52%
Кислород – 22%
Азот – 16%
Сера – 1%
Элементарный состав белков
Слайд 28Строение белковых молекул
Первичная структура белка
уникальна и детерминирована генетически
определяет дальнейшую структурную организацию
Первичная структура – линейное последовательное расположение аминокислотных остатков, связанных между собой пептидными связями.
Слайд 29Секвенирование – определение первичной структуры белка путем последовательного отщепления α-аминокислот с
Секвенирование проводят в автоматическом приборе секвенаторе.
Слайд 30Вторичная структура-
это расположение в пространстве одной полипептидной цепи в виде альфа-спирали
Слайд 31Третичная структура -
это расположение в пространстве одной полипептидной цепи, стабилизированной связями
водородными,
дисульфидными,
ионными,
Ван-дер-Ваальсовыми силами,
гидрофобными взаимодействиями.
Слайд 32Четвертичная структура-
Это расположение в пространстве нескольких полипептидных цепей, соединенных между собой
Каждая отдельная цепь называется протомером (субъединицей).
Белок, состоящий из протомеров, называется олигомерным белком (н-р: гемоглобин).
Слайд 34Физико-химические свойства белков
Наличие высокой молекулярной массы (>5000 Да)
Амфотерность -
Слайд 353) Изоэлектрическая точка (рI) – значение рН раствора, при котором суммарный
рI белка зависит от соотношения свободных амино- и карбоксильных групп в молекуле белка:
Если число –NH2 > -COOH, то рI > 7
Если число –NH2 < -COOH, то рI < 7
В изоэлектрическом состоянии белок выпадает в осадок!
Слайд 375) Растворимость в воде
Факторы, стабилизирующие белки в растворе:
а) заряд молекулы
б) гидратная оболочка
Растворимость придают гидрофильные
группы в составе радикалов аминокислот:
-СООН
-NН2
-ОН
-SН
Глобулярные белки (альбумины, глобулины) обычно растворимые,
Фибриллярные (коллаген, эластин) – не растворимые
Слайд 386) осаждаемость
Необратимое осаждение (денатурация)
Денатурация – любое негидролитическое нарушение уникальной
При денатурации нарушаются все структуры, кроме первичной.
Денатурирующие факторы: высокая температура, кислоты, щелочи, соли тяжелых металлов, алкалоиды, разные виды излучения.
Обратимое осаждение
белок лишается гидратной оболочки, но не теряет способности растворяться вновь в воде после удаления осаждающего фактора.
Высаливание – обратимое осаждение белка солями щелочных и щелочно-земельных металлов и (NH4)2SO4
Слайд 39Классификация белков
Простые - при гидролизе дают только аминокислоты
Альбумины и глобулины (белки
Протамины и гистоны (ядерные белки)
Проламины и глютелины (растительные белки)
Протеиноиды (фибриллярные белки соединительной ткани: коллаген, эластин)
Сложные - при гидролизе дают аминокислоты и небелковый компонент – простетическую группу
Нуклеопротеины
Хромопротеины
Гликопротеины
Металлопротеины
Фосфопротеины
Липопротеины
Слайд 40Функции белков
Структурная (коллаген, эластин, кератин)
Сократительная (актин, миозин и др.)
Транспортная (альбумины,
Защитная (иммуноглобулины)
Питательная (казеин, овоальбумин)
Гормональная или регуляторная (инсулин)
Каталитическая или ферментативная (пепсин, амилаза, липаза и др.)
Энергетическая (1 г белка дает 4,1 ккал)