- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Коррозия металлов презентация
Содержание
- 1. Коррозия металлов
- 2. Коррозия - это самопроизвольный процесс разрушения металлов
- 3. Коррозия протекает с уменьшением энергии Гиббса: Меn+
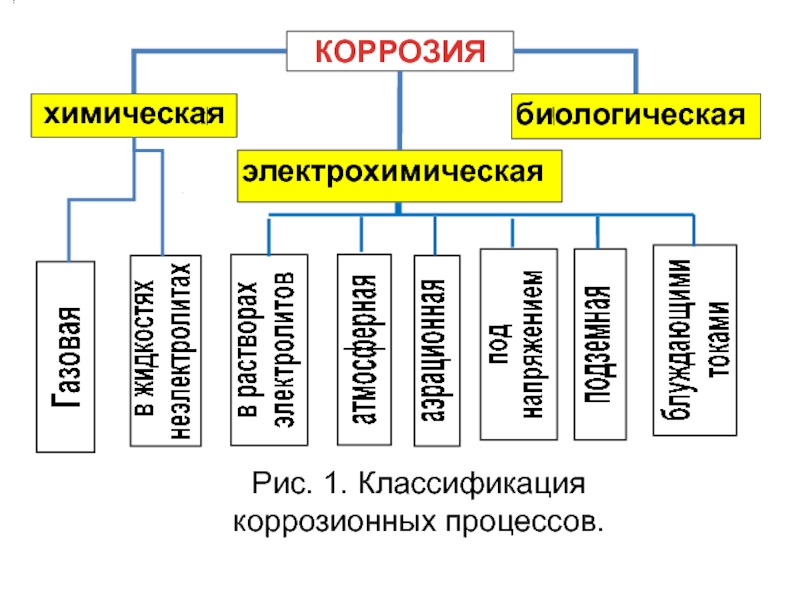
- 4. КОРРОЗИЯ химическая электрохимическая биологическая Рис. 1. Классификация коррозионных процессов.
- 5. -
- 7. ХИМИЧЕСКАЯ КОРРОЗИЯ Химическая коррозия - это самопроизвольное
- 8. Продуктами коррозии могут быть оксиды, хлориды, сульфиды,
- 9. Различают жаростойкость и жаропрочность металлов. ЖАРОСТОЙКОСТЬ
- 10. КОРРОЗИЯ В ЖИДКОСТЯХ - НЕЭЛЕКТРОЛИТАХ. К
- 11. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ Эл.хим.коррозия возникает при соприкосновении металла
- 12. В общем случае причиной образования короткозамкнутых микрогальванических
- 13. На аноде происходит окисление и растворение металла
- 14. ВОДОРОДНАЯ ДЕПОЛЯРИЗАЦИЯ сопровождается восстановлением на катодных участках
- 15. при водородной деполяризации электрохимической коррозии могут подвергаться
- 16. МЕХАНИЗМЫ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ При электрохимической коррозии металлов
- 17. К[Cu]: 2Н+ + 2e- → Н2
- 18. 2. КОНТАКТ С ПРОДУКТОМ КОРРОЗИИ. Fe(OH)2
- 19. или Fe0 - 2e- → Fe2+,
- 20. 4. КОРРОЗИЯ ПОД МЕХ. НАПРЯЖЕНИЕМ. Статические
- 21. растяжение сжатие 4. Коррозия
- 22. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ легирование металлов
- 23. Катодное покрытие - это покрытие более активного
- 24. Анодное покрытие - это покрытие менее
- 25. Протекторная защита состоит в том, что к
- 26. Защита внешним током или катодная защита -
- 27. КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ Коррозионные процессы чрезвычайно многообразны
Слайд 2Коррозия - это самопроизвольный процесс разрушения металлов и сплавов в результате
Слайд 3Коррозия протекает с уменьшением энергии Гиббса:
Меn+ + nе- → Мео (ΔG
Мео - ne- → Меn+ (ΔG < 0) коррозия
Основной причиной разрушения металлов и сплавов является их термодинамическая неустойчивость.
Слайд 4
КОРРОЗИЯ
химическая
электрохимическая
биологическая
Рис. 1. Классификация коррозионных процессов.
Слайд 5
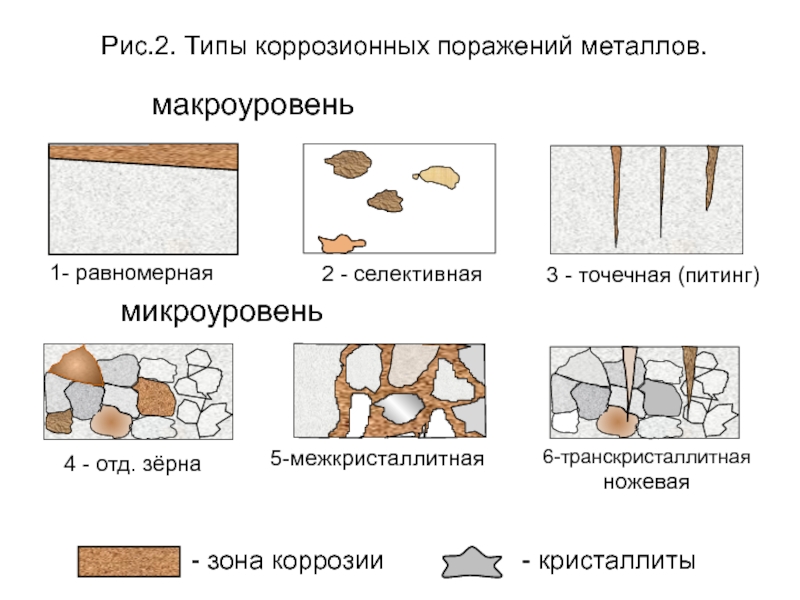
- зона коррозии
- кристаллиты
1- равномерная
2 - селективная
3 - точечная (питинг)
5-межкристаллитная
6-транскристаллитная
ножевая
4
Рис.2. Типы коррозионных поражений металлов.
макроуровень
микроуровень
Слайд 7ХИМИЧЕСКАЯ КОРРОЗИЯ
Химическая коррозия - это самопроизвольное разрушение металлов под действием окислителей-неэлектролитов,
Соответственно различают газовую коррозию и коррозию в жидких неэлектролитах.
Газовая коррозия – это разрушение металла при контакте с сухими газами при высоких температурах. Она имеет место при работе двигателей внутреннего сгорания, при химической обработке металлов, горячей прокатке, ковке, в энергетических установках и др. При газовой коррозии происходит химическое взаимодействие металла с активными средами (CO2; H2S; O2; SO2; галогенами).
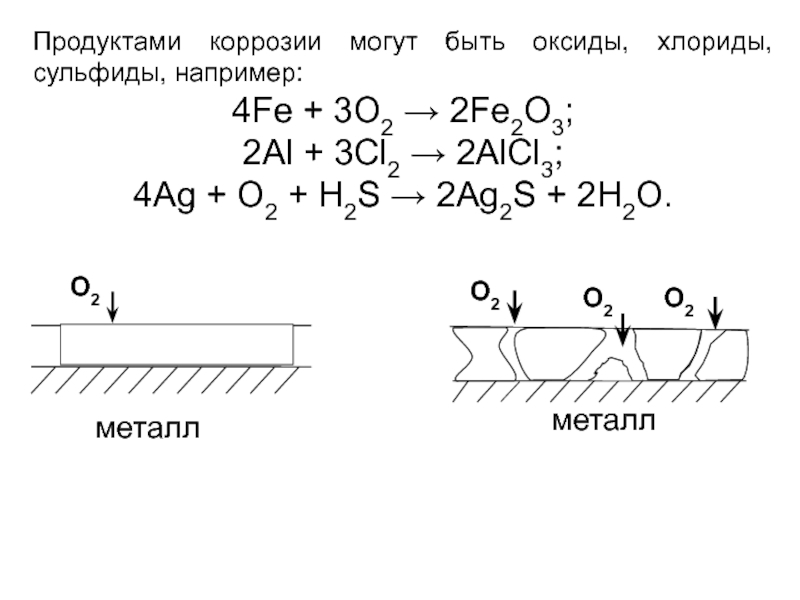
Слайд 8Продуктами коррозии могут быть оксиды, хлориды, сульфиды, например:
4Fe + 3O2 →
2Al + 3Cl2 → 2AlCl3;
4Ag + O2 + H2S → 2Ag2S + 2H2O.
O2
O2
O2
O2
металл
металл
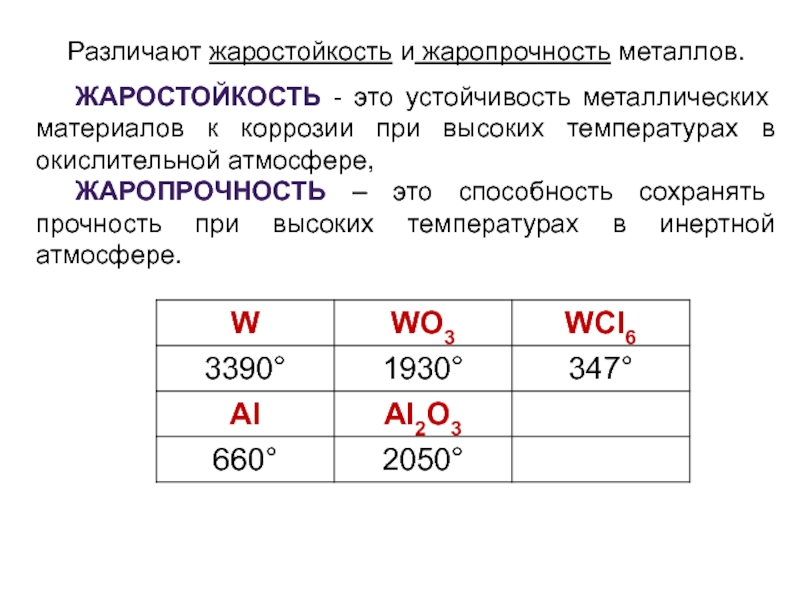
Слайд 9Различают жаростойкость и жаропрочность металлов.
ЖАРОСТОЙКОСТЬ - это устойчивость металлических материалов
ЖАРОПРОЧНОСТЬ – это способность сохранять прочность при высоких температурах в инертной атмосфере.
Слайд 10КОРРОЗИЯ В ЖИДКОСТЯХ - НЕЭЛЕКТРОЛИТАХ.
К неэлектролитам (непроводящим электрический ток) относятся
а) 2R - Cl + Me → MeCl2 + R - R
S + Me → MeS + R1 – R2
R2
б) R1
где R - органический радикал.
Слайд 11ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Эл.хим.коррозия возникает при соприкосновении металла с электропроводящей средой (водой, водными
Слайд 12В общем случае причиной образования короткозамкнутых микрогальванических элементов может служить не
Слайд 13На аноде происходит окисление и растворение металла по схеме:
(−)А: Me0
На катоде протекает один из двух процессов восстановления, получивших название ВОДОРОДНОЙ И КИСЛОРОДНОЙ ДЕПОЛЯРИЗАЦИИ.
Слайд 14ВОДОРОДНАЯ ДЕПОЛЯРИЗАЦИЯ сопровождается восстановлением на катодных участках водорода.
в кислой среде:
(+)К:
в нейтральной или щелочной среде:
(+)К: Н2О + 2е- = Н20 + 2ОН−;
ϕ(Н2О/Н20)=−0,059рН.
протекает в случаях, ограниченного доступа кислорода. Имеет место под толстым слоём воды или в кислых растворах, в которых растворимость кислорода очень низка.
Слайд 15при водородной деполяризации электрохимической коррозии могут подвергаться металлы с электродным потенциалом
КИСЛОРОДНАЯ ДЕПОЛЯРИЗАЦИЯ обусловлена восстановлением атмосферного кислорода, растворённого в коррозионной среде, и протекает по схеме:
(+)К: О2 + 2Н2О + 4e- = 4OH−;
ϕ (О2/Н2О) = +1,23 − 0,059рН
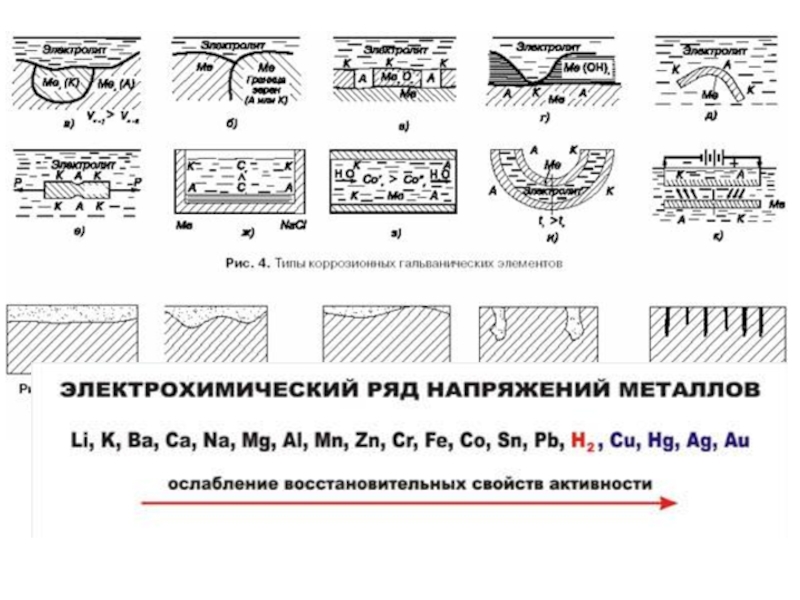
Слайд 16МЕХАНИЗМЫ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
При электрохимической коррозии металлов выделяют четыре механизма, вызывающих образование
1) контакта двух разных металлов;
2) контакта металла с продуктом коррозии;
3) разной концентрации окислителя на поверхности металла;
4) изменения электродного потенциала металла под действием механических напряжений.
Как особый случай рассматривается коррозия под действием блуждающих токов.
Слайд 17
К[Cu]: 2Н+ + 2e- → Н2
А: Fe0- 2e-→Fe2+
4Fe(OH)2 + 2H2O
Fe2+ + 2H2O →Fe(OH)2
Fe(ОН)3 → FeOOH + Н2О.
ϕ0 Fe/Fe2+= − 0,44B,
ϕ0 Сu/Cu2+= +0,34B
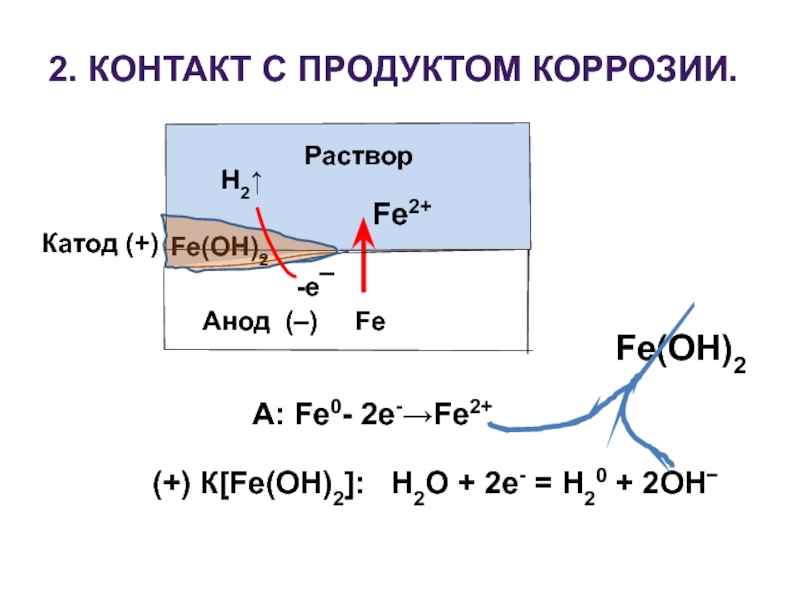
Слайд 182. КОНТАКТ С ПРОДУКТОМ КОРРОЗИИ.
Fe(OH)2
Раствор
Анод (–) Fe
Катод
-e¯
Fe(OH)2
H2↑
А: Fe0- 2e-→Fe2+
(+) К[Fe(OH)2]: Н2О + 2е- = Н20 + 2ОН−
Fe2+
Fe(OH)2
Слайд 19или Fe0 - 2e- → Fe2+, Fe2+ +2OH- →
4Fe(OH)2 + O2 +2H2O → 4Fe(OH)3.
[O2]I > [O2]II
ϕ (О2/Н2О) = +1,23 + 0,03lg[O2] − 0,059рН
на катоде (+)К:
О2 + 2Н2О + 4е- → 4ОН-
на аноде (−)А:
Fe0 - 3e- → Fe3+,
Fe3+ +3OH- → Fe(OH)3,
3) РАЗНАЯ КОНЦ-ЦИЯ ОК-ЛЯ НА ПОВ-СТИ МЕТАЛЛА
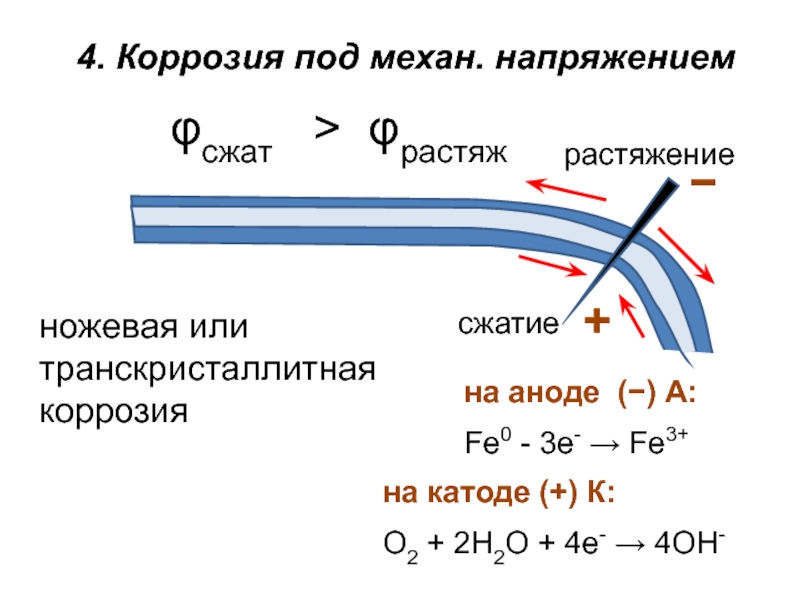
Слайд 204. КОРРОЗИЯ ПОД МЕХ. НАПРЯЖЕНИЕМ.
Статические напряжения могут понижать термодинамическую устойчивость
Слайд 21
растяжение
сжатие
4. Коррозия под механ. напряжением
ножевая или транскристаллитная коррозия
φсжат > φрастяж
на
Fe0 - 3e- → Fe3+
на катоде (+) К:
О2 + 2Н2О + 4е- → 4ОН-
−
+
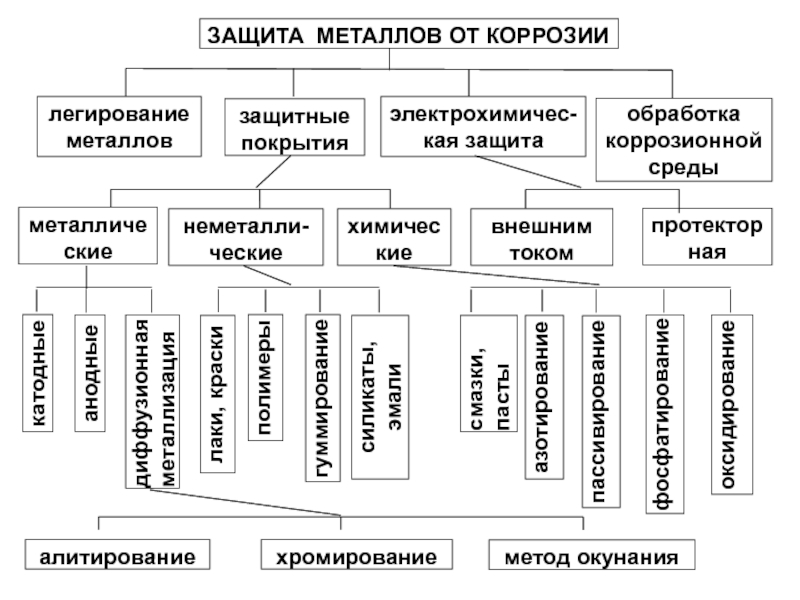
Слайд 22ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
легирование металлов
защитные покрытия
электрохимичес-кая защита
обработка коррозионной среды
металлические
неметалли-ческие
химические
внешним током
протекторная
катодные
анодные
диффузионная металлизация
оксидирование
лаки,
полимеры
гуммирование
силикаты,
эмали
смазки, пасты
азотирование
пассивирование
фосфатирование
алитирование
хромирование
метод окунания
Слайд 23 Катодное покрытие - это покрытие более активного металла менее активным. Пример:
К[Sn]: 2H+ + 2 e- → H20 (pH< 7); H2O + O2 + 4 e- → 4 OH- (pH = 7)
Принцип защиты основан на том, что менее активный металл более стоек к коррозии, и пока он сохраняет целостность, основной металл защищён от коррозионно-активной среды. В местах нарушения покрытия защищаемый металл будет подвергаться коррозии.
А[Fe]: Fe0 - 2 e- → Fe2+
Fe2+ + 2 OH- → Fe(OH)2
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Слайд 24
Анодное покрытие - это покрытие менее активного металла более активным, например,
При нарушении целостности покрытия в образовавшемся гальваническом элементе металл покрытия (цинк) становится анодом и разрушается:
Н2
е−
Fe
Zn2+
Zn
H2O
A
K
Схема коррозии.
(+)К [Fe]: 2H+ + 2e- → H20
(при рН< 7) или
О2 + 2Н2О + 4е- → 4ОН-
(при рН = 7 ).
(−)А[Zn]: Zn0 – 2e- → Zn2+;
Zn2+ + 2OH- → Zn(OH)2.
Таким образом, анодное покрытие будет защищать основной металл и при нарушении его целостности.
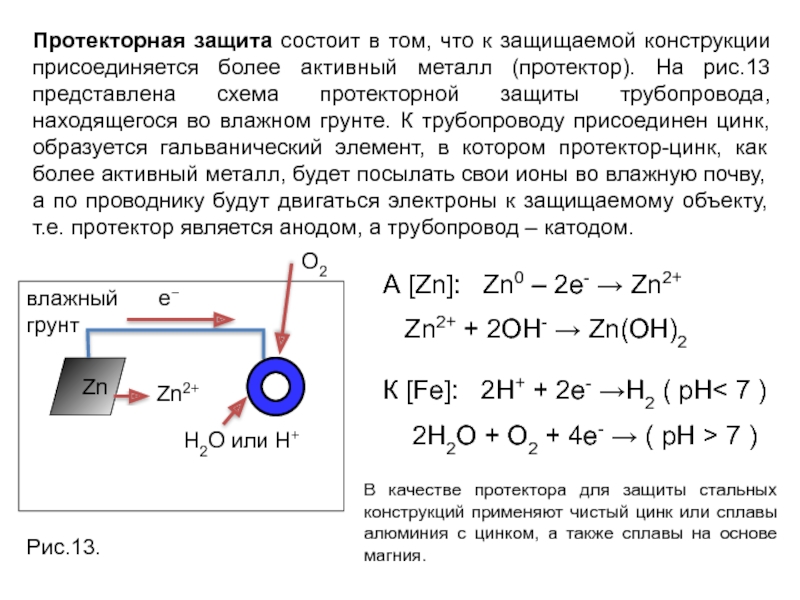
Слайд 25Протекторная защита состоит в том, что к защищаемой конструкции присоединяется более
В качестве протектора для защиты стальных конструкций применяют чистый цинк или сплавы алюминия с цинком, а также сплавы на основе магния.
А [Zn]: Zn0 – 2e- → Zn2+
Zn2+ + 2OH- → Zn(OH)2
К [Fe]: 2Н+ + 2е- →Н2 ( рН< 7 )
2H2O + O2 + 4e- → ( pH > 7 )
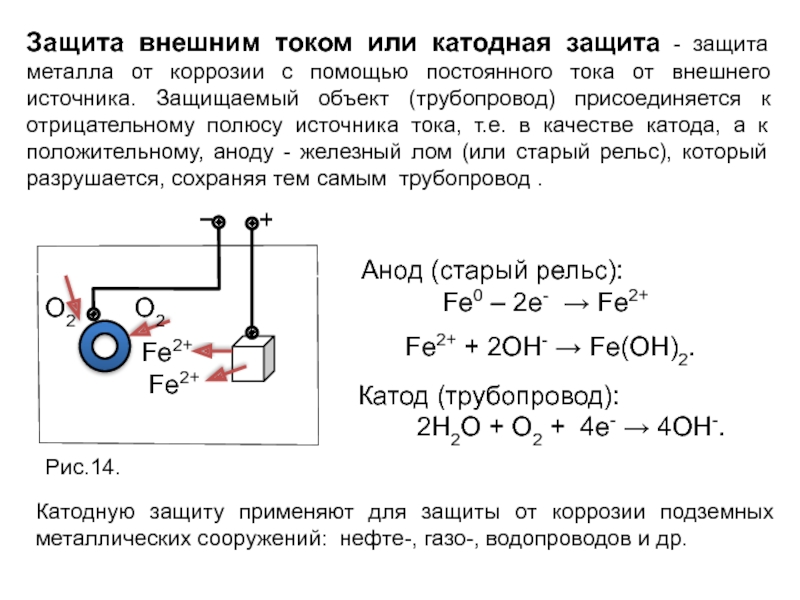
Слайд 26Защита внешним током или катодная защита - защита металла от коррозии
Катодную защиту применяют для защиты от коррозии подземных металлических сооружений: нефте-, газо-, водопроводов и др.
Анод (старый рельс):
Fe0 – 2e- → Fe2+
Fe2+ + 2OH- → Fe(OH)2.
Катод (трубопровод):
2H2O + O2 + 4e- → 4OH-.
Слайд 27КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
Коррозионные процессы чрезвычайно многообразны и их классификация проводится по
По механизму процесса:
ХИМИЧЕСКАЯ, ЭЛЕКТРОХИМИЧЕСКАЯ И БИОЛОГИЧЕСКАЯ (рис.1).
По условиям протекания (рис.1):
- газовая; - в жидкостях-неэлектролитах;
- в водных р-рах электролитов (солевая, кислотная, щелочная и т.п.); - атмосферная; - аэрационная; - подземная; - под действием блуждающих токов;
- под механическим напряжением.
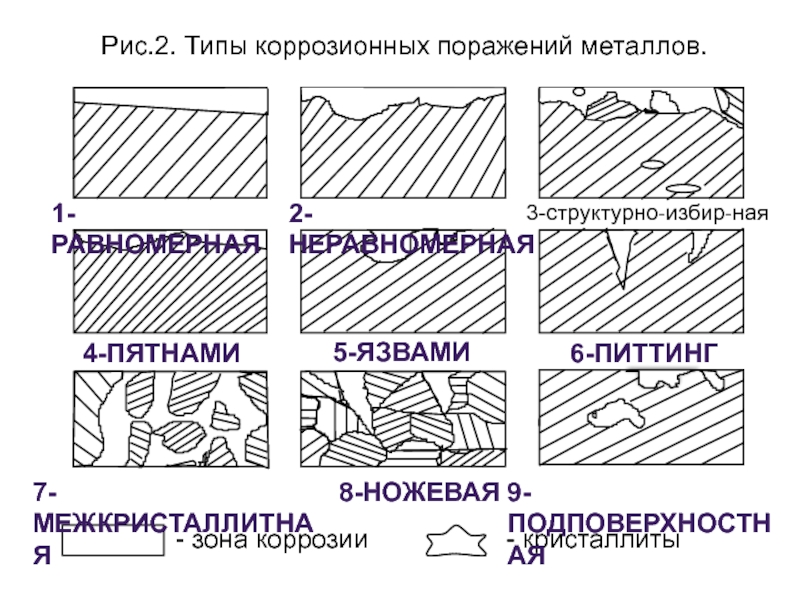
По характеру коррозионных поражений (рис.2):
1) равномерная; 2) неравномерная; 3) структурно-избирательная; 4) пятнами; 5) язвами; 6) питтинг или точками; 7) межкристаллитная;8) транскристаллитная или ножевая; 9) подповерхностная.











![К[Cu]: 2Н+ + 2e- → Н2А: Fe0- 2e-→Fe2+ 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3Fe2+](/img/tmb/5/481867/e40775fdbf5aa6adb5c97ef47e10d208-800x.jpg)
![или Fe0 - 2e- → Fe2+, Fe2+ +2OH- → Fe(OH)2,4Fe(OH)2 + O2 +2H2O → 4Fe(OH)3.[O2]I](/img/tmb/5/481867/d25214e32e6cef3c677ebdc8ed2abd7e-800x.jpg)