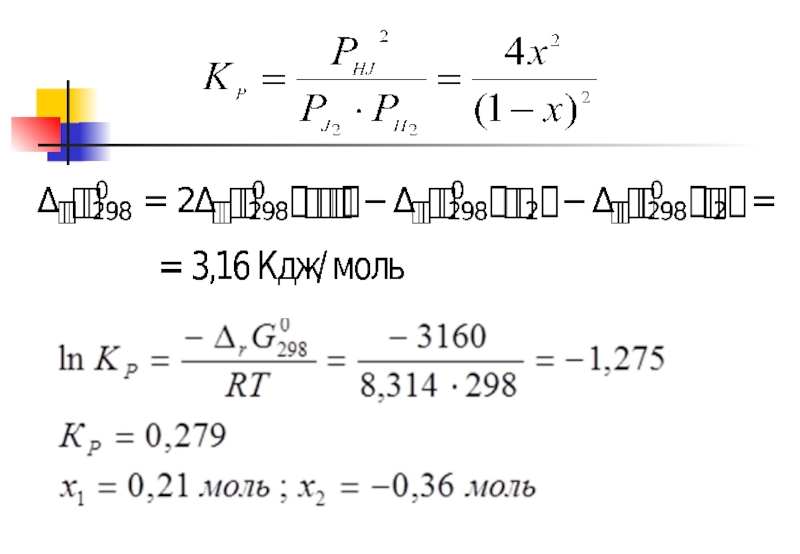- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическое равновесие. Термодинамика химического равновесия презентация
Содержание
- 1. Химическое равновесие. Термодинамика химического равновесия
- 2. Химическое равновесие - состояние системы, при котором
- 3. В момент равенства скоростей прямой
- 8. Уравнение изотермы химической реакции
- 11. Зависимость константы равновесия от температуры. Уравнения изобары
- 13. Интегрирование уравнения изобары (изохоры)
- 14. Интегрирование уравнения изобары
- 16. Уравнения изобары и изохоры как количественная интерпретация
- 17. РАСЧЕТ СОСТАВА РАВНОВЕСНОЙ РЕАКЦИОННОЙ СМЕСИ И РАВНОВЕСНОГО ВЫХОДА ПРОДУКТА
- 18. Расчет состава равновесной смеси для гомогенной
- 20. Расчет состава равновесной смеси для гомогенной реакции,
- 22. Расчет состава равновесной смеси для гетерогенной реакции. C(тв) + CO2 = 2CO
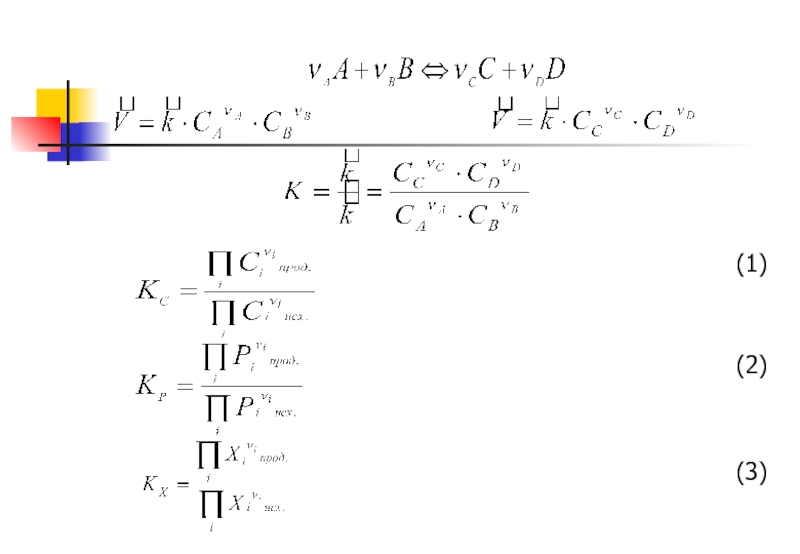
Слайд 2Химическое равновесие - состояние системы, при котором прямая и обратная реакции
Термодинамически равновесный процесс предполагает бесконечно медленное изменение всех свойств системы и не оставляет изменений в окружающей среде.
При химическом равновесии прямая и обратная реакции протекают с определенными конечными скоростями и сопровождаются изменениями как внутри системы, так и в окружающей среде.
Слайд 3
В момент равенства скоростей прямой и обратной реакций суммарная скорость процесса
Самопроизвольный процесс сопровождается убылью свободной энергии, поэтому условием химического равновесия является её минимум:
Слайд 11Зависимость константы равновесия от температуры. Уравнения изобары и изохоры химической реакции.