- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химические явления. Уравнения химических реакций презентация
Содержание
- 1. Химические явления. Уравнения химических реакций
- 2. Химические явления Химические явления (Химические реакции) –
- 3. Признаки химических реакций Выпадение осадка Осадок –
- 4. Скелет человека – внутренний скелет или
- 5. Условия протекания химических реакций
- 6. Закон постоянства состава Закон постоянства состава (Ж.
- 7. Опыт Ломоносова
- 8. Выводы, которые сделал Ломоносов 1. Так как
- 9. Химическое уравнение. Уравнение химической реакции Химическим уравнением
- 10. Уравнения реакций vs схемы реакций
- 11. Условные обозначения Стрелочки вверх и
- 12. Правила расстановки коэффициентов Самое главное правило! Количество
Слайд 2Химические явления
Химические явления (Химические реакции) – это явления, происходящие с веществами,
Картинка, иллюстрирующая возникновение резонного вопроса
Резонный вопрос
Как же понять, что из одного вещества получилось совершенно другое?
Наводящий вопрос для ответа на резонный вопрос
Что позволяет сказать нам, что стекло – это стекло, а не деревяшка?
Ответ на резонный вопрос
Так как каждое вещество обладает набором характерных только ему свойств, то при превращении одного вещества в другое мы будем иметь возможность пронаблюдать изменение этих свойств
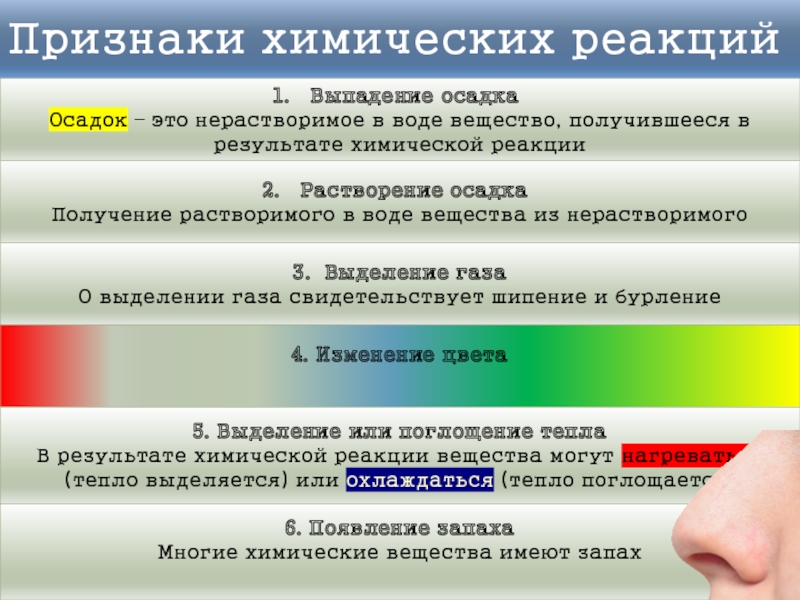
Слайд 3Признаки химических реакций
Выпадение осадка
Осадок – это нерастворимое в воде вещество, получившееся
Растворение осадка
Получение растворимого в воде вещества из нерастворимого
3. Выделение газа
О выделении газа свидетельствует шипение и бурление
4. Изменение цвета
5. Выделение или поглощение тепла
В результате химической реакции вещества могут нагреваться (тепло выделяется) или охлаждаться (тепло поглощается)
6. Появление запаха
Многие химические вещества имеют запах
Слайд 4Скелет человека –
внутренний скелет
или эндоскелет
Классификация реакций по тепловому эффекту
Тепловой эффект
Химические реакции
(по тепловому эффекту)
Экзотермические
(экзо- наружу)
Реакции протекающие с выделением теплоты
Эндотермические
(эндо- внутрь)
Реакции протекающие с поглощением теплоты
Экзоскелет «монолитовца»
Слайд 6Закон постоянства состава
Закон постоянства состава (Ж. Л. Пруст, 1801—1808гг.) — любое
Упрощенная формулировка – каждое вещество имеет характерный только для него качественный и количественный набор химических элементов
Жозеф Луи Пруст
Слайд 8Выводы, которые сделал Ломоносов
1. Так как носителями массы в химическом веществе
2. Значит, новые вещества в результате реакции образовались за счет того, что атомы перегруппировались, и образовали новые молекулы
Закон сохранения массы
Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько присовокупиться к другому. Так, ежели где убудет несколько материи, то умножится в другом месте
Ломоносов М. В. (с)
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции
Современная формулировка
Слайд 9Химическое уравнение.
Уравнение химической реакции
Химическим уравнением называют условную запись химической реакции с
Например, попробуем записать с помощью уравнения химической реакции, что хлорид железа (III) взаимодействует с гидроксидом натрия, при этом образуется нерастворимый в воде гидроксид железа (III) и хлорид натрия
Левая часть уравнения
Исходные вещества
Правая часть уравнения
Продукты реакции
Стрелочка
Слайд 10Уравнения реакций vs схемы реакций
Уравнение реакции (работает закон сохранения массы)
Схема реакции
Fe = Fe
3Cl = 3Cl
3Na = 3Na
3H = 3H
3O = 3O
Fe = Fe
3Cl ≠ Cl
Na = Na
H ≠ 3H
O ≠ 3O
Слайд 11Условные обозначения
Стрелочки вверх и вниз ставятся только в правой части уравнения
То, что написано над стрелочкой – условия протекания химической реакции
Слайд 12Правила расстановки коэффициентов
Самое главное правило! Количество атомов одного элемента слева и
Анализ: слева – 2 водорода, справа -2 водорода
Но, слева – 2 кислорода, а справа – 1 кислород
2H=2H
2O≠O
Чтобы уравнять кислороды, необходимо поставить
Коэффициент 2 к воде, тогда:
2H≠4H
2O=2O
Теперь, чтобы уравнять водороды, необходимо поставить коэффициент 2 к водороду
Важно! Нельзя ставить коэффициент в середине формулы, только перед формулой!