- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая термодинамика презентация
Содержание
- 1. Химическая термодинамика
- 2. Экзотермические реакции К экзотермическим реакциям относят: Реакции
- 3. Эндотермические реакции К эндотермическим реакциям относят:
- 4. Скорость химической реакции определяется количеством вещества, прореагировавшего
- 5. Факторы,влияющие на скорость химической реакции
- 6. «Скорость химической реакции пропорциональна произведению концентраций
- 7. Правило Я.Х. Вант-Гоффа «Повышение температуры на
- 8. Этот фактор характерен
- 9. Катализатор-это вещество, которое
- 10. H2SO4 + Zn = ZnSO4 + H2↑
- 11. Химические реакции По направлению все химические реакции
- 12. Химические реакции Обратимые реакции составляют более многочисленную
- 13. Химическое равновесие Концентрация реагирующих веществ с течением
- 14. Химическое равновесие В состоянии химического равновесия количественное
- 15. Смещение химического равновесия 1. Изменение температуры. Правило.
- 16. Смещение химического равновесия 2. Изменение давление (оказывает
- 17. Смещение химического равновесия 3. Изменение концентрации. Правило.
- 18. Закрепление материала: В какую сторону сместится
- 19. Домашняя работа § 16, определить в какую
Слайд 2Экзотермические реакции
К экзотермическим реакциям относят:
Реакции горения, сопровождающиеся выделением света и тепла:
2Mg
CH4 + O2 = CO2 + 2H2O + Q
Реакции соединения, которые практически всегда протекают с выделением тепла:
H2 + Cl2 = 2HCl + Q
2Ag + Br2 = 2AgBr + Q
Исключение – реакция азота с кислородом – сопровождается поглощением тепла, эндотермическая реакция:
N2 + O2 = 2NO - Q
Слайд 3Эндотермические реакции
К эндотермическим реакциям относят:
Реакции разложения, которые практически всегда протекают с
CaCO3 = CaO + O2 – Q
2H2O = 2H2 + O2 – Q
Слайд 4Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в
Что такое скорость химической реакции?
Слайд 6
«Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях,
N2 + 3H2 ↔ 2NH3
Vр-ии = k∙C (N2)∙ C (H2)3
S + O2 = SO2
Vр-ии = k∙C (O2)
Смотреть опыт
Концентрация
Слайд 7
Правило Я.Х. Вант-Гоффа
«Повышение температуры на каждые 10 ∙С приводит к увеличению
Vt2 = Vt1∙ γt2-t1/10
Смотреть опыт
Температура
Слайд 8
Этот фактор характерен только для гетерогенных реакций.
Чем больше площадь соприкосновения реагирующих
H2SO4 + Zn = ZnSO4 + H2↑
Смотреть опыт
Площадь соприкосновения реагирующих веществ
Слайд 9
Катализатор-это вещество, которое ускоряет химическую реакцию, но само при этом не
2H2O2 = 2H2O + O 2↑
Смотреть опыт
Катализатор
Слайд 10
H2SO4 + Zn = ZnSO4 + H2↑
2CH3COOH + Zn = (CH3COO)2 + H2↑
Смотреть опыт
Природа реагирующих веществ
Слайд 11Химические реакции
По направлению все химические реакции можно разделить на 2 группы:
Необратимыми
С + O2 → СO2
Обратимыми называют химические реакции, которые протекают одновременно в двух противоположных направлениях – прямом и обратном
СO2 + Н2О → Н2СО3
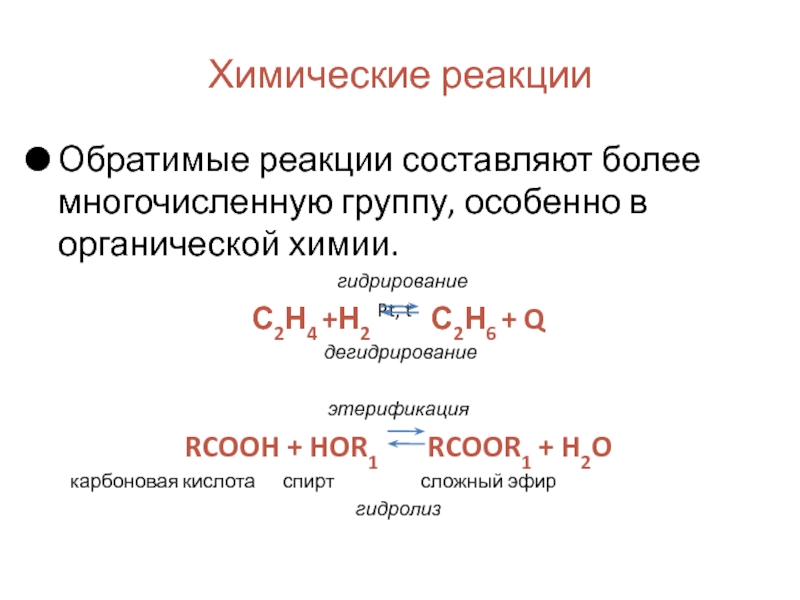
Слайд 12Химические реакции
Обратимые реакции составляют более многочисленную группу, особенно в органической химии.
С2Н4 +Н2 Pt, t С2Н6 + Q
дегидрирование
этерификация
RCOOH + HOR1 RCOOR1 + H2O
карбоновая кислота спирт сложный эфир
гидролиз
Слайд 13Химическое равновесие
Концентрация реагирующих веществ с течением времени уменьшается, а концентрация продуктов
Состояние химического обратимого процесса, при котором скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием.
Слайд 14Химическое равновесие
В состоянии химического равновесия количественное соотношение между реагирующими веществами и
Многочисленные исследования показали, что смещение химического равновесия подчиняется правилу, названному принципом Ле-Шателье:
При изменении внешних условий химическое равновесие смещается в сторону той реакции (прямой или обратной), которое ослабляет это внешнее воздействие.
Слайд 15Смещение химического равновесия
1. Изменение температуры.
Правило. При увеличении температуры равновесие сместится в
2SO3 2SO2 + O2 – Q
+ t
- t
Слайд 16Смещение химического равновесия
2. Изменение давление (оказывает влияние только на те системы.
Правило. При увеличении давления равновесие смещается в сторону уменьшения объема газообразных веществ и наоборот.
2Н2 + О2 2Н2О + Q
3 V 0 V
+ P
- P
Слайд 17Смещение химического равновесия
3. Изменение концентрации.
Правило. При увеличении концентрации вещества равновесие смещается
SO2 + Н2О → Н2SО3 + Q
+ SO2
- Н2SО3
Катализаторы в равной степени ускоряют как прямую, так и обратную реакции и поэтому не смещают равновесие, но ускоряют наступление равновесия.
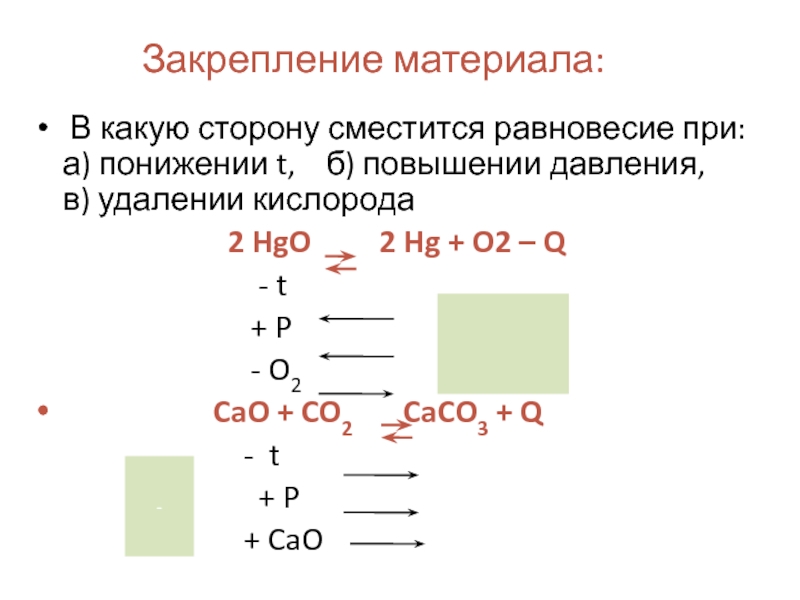
Слайд 18Закрепление материала:
В какую сторону сместится равновесие при:
2 HgO 2 Hg + O2 – Q
- t
+ P
- O2
CaO + CO2 CaCO3 + Q
- t
+ P
+ CaO
-
Слайд 19Домашняя работа
§ 16, определить в какую сторону сместится равновесие:
а) С2Н4
+ t - t
+ P + P
+ Н2 - NH3
б) 3Fe + 4H2O(г) Fe3O4 + Н2 – Q г) поставить знаки «+»
- t или «-»
- P 2 SO2 +O2 2SO3 +Q
- Н2 t
P
O2