- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
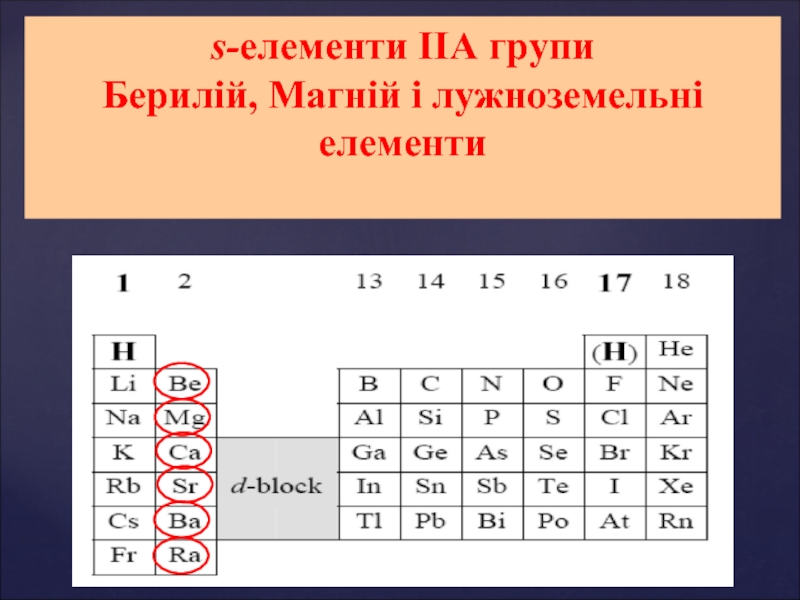
s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи презентация
Содержание
- 1. s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи
- 2. Властивості елементів ІІА групи s-елементи ІІА групи Берилій, Магній і лужноземельні елементи
- 3. Зовнішній вигляд металів ІІА групи Be
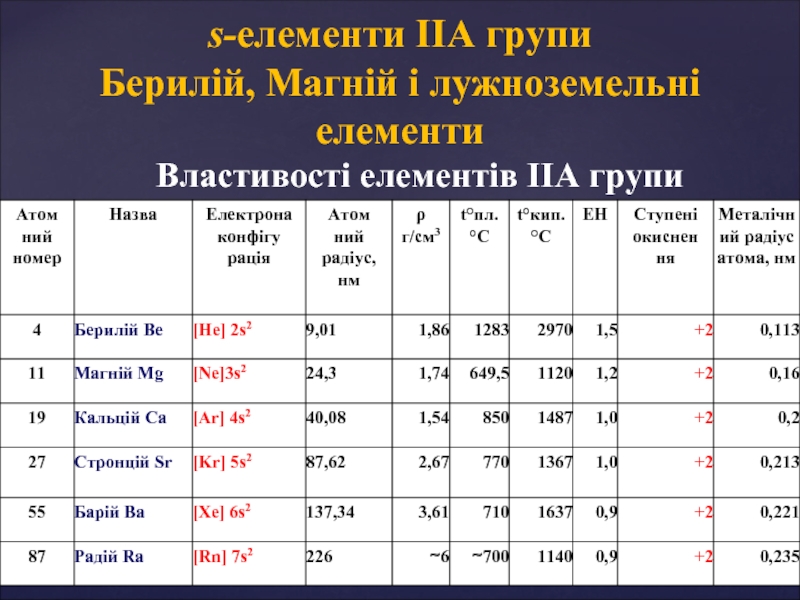
- 4. s-елементи ІІА групи. Фізичні властивості Метали ІІА
- 5. Способи отримання металів: Берилій отримують
- 6. Хімічні властивості металів Метали головної підгрупи
- 7. Хімічні властивості металів 3. З неметалами
- 8. s-елементи ІІА групи Хімічні властивості металів 5.
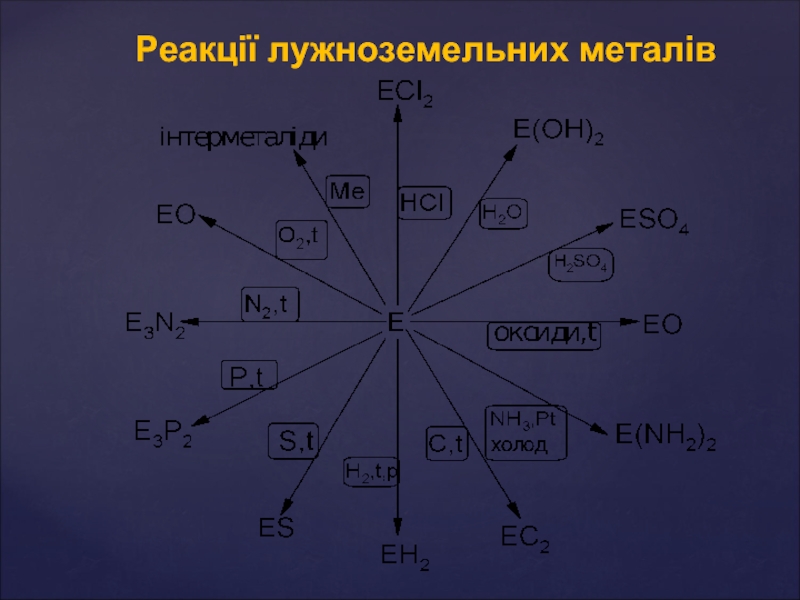
- 9. Реакції лужноземельних металів
- 10. Оксиди металів ІІА групи Отримання: 1) Окислення
- 11. Гідроксиди металів ІІА групи R(OH)2
- 12. Гідроксиди металів ІІА групи R(OH)2
- 13. Характерні реакції іонів Mg2+ : Натрій або
- 14. Характерні реакції іонів Sr2+
- 15. Характерні реакції іонів Ca2+ Амоній оксалат (фармакопейна
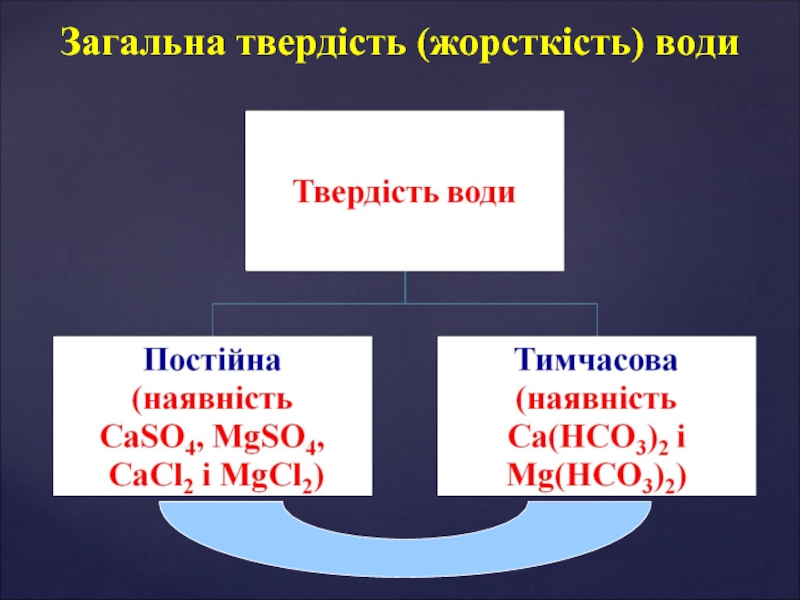
- 16. Загальна твердість (жорсткість) води
- 17. Розрахунок твердості води Твердість води відображає вміст
- 18. Способи усунення твердості води Тимчасову твердість води
- 19. р-Елементи ІІІА групи Бор і Алюміній
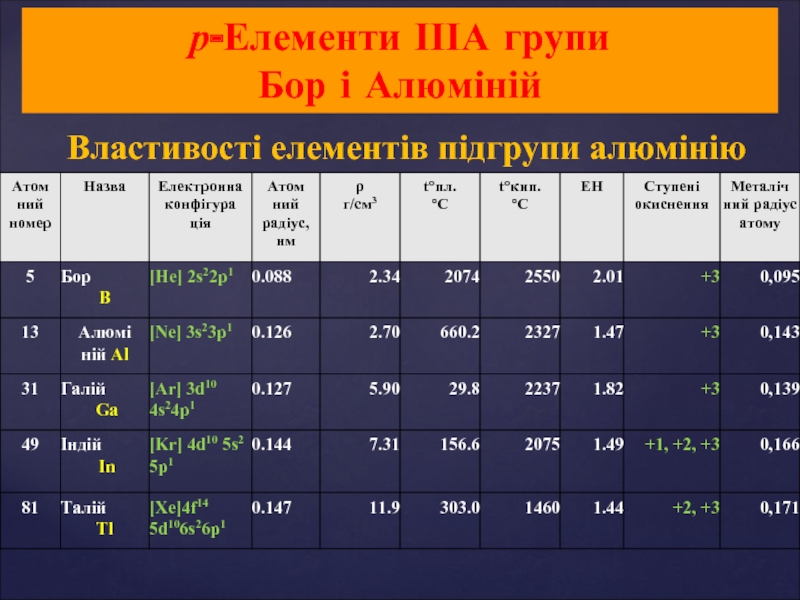
- 20. Властивості елементів підгрупи алюмінію р-Елементи ІІІА групи Бор і Алюміній
- 21. б г Бор: а – б –
- 22. Фізичні властивості 1. Із збільшенням атомної маси
- 23. При утворенні хімічних сполук у атома бору
- 24. БОР В залежності від умов
- 25. Бор хімічно інертний З киснем він реагує
- 26. Гідриди бору – борани мають склад, подібний
- 27. ОКСИГЕНОВМІСНІ СПОЛУКИ БОРУ До числа найважливіших
- 28. Ортоборна кислота являє собою типовий слабкий
- 29. Тетраборна кислота у вільному стані невідома Н2В4О7
- 30. Бор з галогенідами утворює всі чотири тригалогеніди.
- 31. р-Елементи ІІІА групи Алюміній Алюміній металічний Ga In
- 32. АЛЮМІНІЙ Природні сполуки Алюміній – найпоширеніший елемент,
- 33. Добування металічного алюмінію електрохімічним методом Технологічна
- 34. Фізичні властивості алюмінію Сріблясто-білий метал, дуже легкий,
- 35. Оксид алюмінію (ІІІ) має кілька кристалічних модифікацій.
- 36. Гідроксид алюмінію (ІІІ) добувають взаємодією розчинних солей
- 37. При нагріванні відповідних гідратів відбувається гідроліз: [Al(H2O)6]Cl3
- 38. Дякую за увагу!
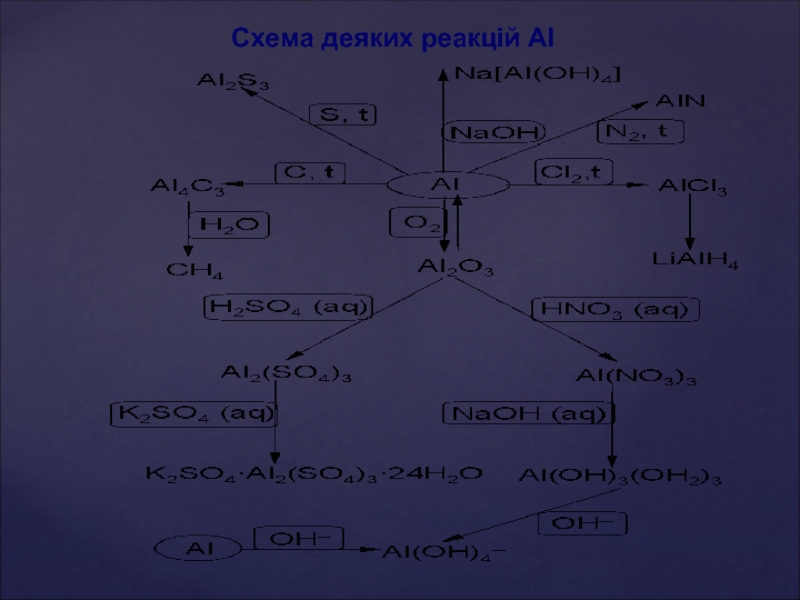
- 39. Схема деяких реакцій Al
Слайд 4s-елементи ІІА групи. Фізичні властивості
Метали ІІА групи (в порівнянні з лужними
Знаходження в природі
Be 3BeO • Al2O3 • 6SiO2 – берил
Mg MgCO3 – магнезит
CaCO3 • MgCO3 – доломіт
Ca CaCO3 – кальцит (вапняк, мармур і ін.)
Ca3(PO4)2 – апатит
CaSO4 • 2H2O – гіпс
CaF2 – плавиковий шпат (флюорит)
Sr SrSO4 – целестин
Ba BaSO4 – барит
BaCO3 – вітерит
Слайд 5
Способи отримання металів:
Берилій отримують відновленням фториду:
BeF2 + Mg (t°)→ Be +
Барій отримують відновленням оксиду:
3BaO + 2Al (t°)→ 3Ba + Al2O3
Решта металів отримує електролізом розплавів хлоридів:
CaCl2 → Ca + Cl2
катод: Ca2+ + 2e → Ca0
анод: 2Cl- – 2e → Cl02
s-елементи ІІА групи
Слайд 6
Хімічні властивості металів
Метали головної підгрупи II групи - сильні відновники. Активність
1. Реакція з водою:
У звичайних умовах поверхня Be і Mg покриті інертною оксидною плівкою, тому вони стійкі по відношенню до води. На відміну від них Ca, Sr і Ba розчиняються у воді з утворенням гідроксидів, які є сильними основами:
Mg + 2H2O (t°)→ Mg(OH)2 + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
2. Реакція з киснем: Всі метали утворюють оксиди RO, барій-пероксид – BaO2:
2Mg + O2 → 2MgO
Ba + O2 → BaO2
s-елементи ІІА групи
Слайд 7
Хімічні властивості металів
3. З неметалами утворюються бінарні сполуки (при нагрів.):
Be +
Ba + S → BаS (сульфіди)
3Mg + N2 → Mg3N2 (нітриди)
Ca + H2 → CaH2 (гідриди)
Ca + 2C → CaC2 (карбіди)
3Ba + 2P → Ba3P2 (фосфіди)
Берилій і магній порівняно поволі реагують з неметалами
4. Всі метали розчиняються в кислотах - неокисниках:
Ca + 2HCl → CaCl2 + H2
Mg + H2SO4(розв.)→ MgSO4 + H2
Берилій також розчиняється у водних розчинах лугів (амфотерні властивості):
Be + 2NaOH + 2H2O → Na2[Be(OH)4]+ H2
s-елементи ІІА групи
Слайд 8s-елементи ІІА групи
Хімічні властивості металів
5. Якісна реакція на катіони лужноземельних металів
Ca2+ - темно-оранжевий
Sr2+- темно-червоний
Ba2+ - ясно-зелений
Слайд 10Оксиди металів ІІА групи
Отримання:
1) Окислення металів (окрім Ba, який утворює пероксид)
2)
CaCO3 (t°)→ CаO + CO2
2Mg(NO3)2 (t°)→ 2MgO + 4NO2 + O2
Хімічні властивості
Типові основні оксиди. Реагують з водою (окрім BеO), кислотними оксидами і кислотами:
(палена магнезія) MgO + H2O → Mg(OH)2
(негашене вапно) 3CaO + P2O5 → Ca3(PO4)2
BeO + 2HNO3 → Be(NO3)2 + H2O
BeO - амфотерний оксид, розчиняється в лугах:
BeO + 2NaOH + H2O → Na2[Be(OH)4]
s-елементи ІІА групи
Слайд 11Гідроксиди металів ІІА групи R(OH)2
Отримання:
Реакції лужноземельних металів або їх оксидів
Ba + 2H2O → Ba(OH)2 + H2
CаO+ H2O → Ca(OH)2 (гашене вапно)
Хімічні властивості
Гідроксиди R(OH)2 - білі кристалічні речовини, у воді розчинні гірше, ніж гідроксиди лужних металів: Be(OH)2 – нерозчинний у воді, розчиняється в лугах. Основність R(OH)2 збільшується із збільшенням атомного номера:
Be(OH)2 – амфотерний гідроксид, Mg(OH)2 – слабка основа, решта гідроксидів - сильні основи (луги)
s-елементи ІІА групи
Слайд 12Гідроксиди металів ІІА групи R(OH)2
Хімічні властивості
1 ) Реакції з кислотними оксидами:
Ca(OH)2 + SO2 → CaSO3↓ + H2O
Ba(OH)2 + CO2 → BaCO3 ↓ + H2O
2) Реакції з кислотами:
Mg(OH)2 + 2CH3COOH → (CH3COO)2Mg + 2H2O
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
3) Реакції обміну з солями:
Ba(OH)2 + K2SO4 → BaSO4↓ + 2KOH
4) Реакція гідроксиду берилію з лугами:
Be(OH)2 + 2NaOH → Na2[Be(OH)4]
s-елементи ІІА групи
Слайд 13Характерні реакції іонів Mg2+ :
Натрій або амоній гідрогенфосфат (фармакопейна реакція) ,
Сіль амонію додають для того, щоб не випав осад Mg(OH)2. Реакції заважають іони Ba2+, Ca2+ та інших важких металів.
Характерні реакції іонів Ва2+ :
Калій хромат або біхромат утворюють з іонами Ва2+ жовтий кристалічний осад Барій хромату, нерозчинний в ацетатній кислоті, але розчинний у мінеральних кислотах: Ва2+ + CrО42– = ВаCrО4↓
Амоній карбонат осаджує з нейтральних або лужних розчинів солей Барію білий аморфний осад BaCO3, який під час нагрівання переходить у кристалічний: Ba2+ + CO32– = BaCО3↓
Барій карбонат розчиняється в ацетатній та мінеральних (крім H2SO4) кислотах.
Сульфатна кислота (розведена) і розчинні сульфати (фармакопейна реакція за ДФУ ) осаджують з розчинів солей Барію білий дрібнокристалічний осад BaSO4: Ba2+ + SO42– = BaSO4↓
s-елементи ІІА групи
Слайд 14Характерні реакції іонів Sr2+
Мікрокристалоскопічна реакція. Іони Sr2+
Sr2+ + Cu2+ + 6NO2– + 2K+ → K2Sr[Cu(NO2)6]↓
Сульфатна кислота і розчинні сульфати утворюють білий осад SrSO4 практично нерозчинний в кислотах: Sr2+ + SO42– = SrSO4↓
Виявленню іонів Sr2+ заважають іони Ba2+ та Ca2+, тому що вони осаджуються у вигляді сульфатів.
s-елементи ІІА групи
Слайд 15Характерні реакції іонів Ca2+
Амоній оксалат (фармакопейна реакція) утворює з іонами Ca2+
Ca2+ + C2O42– = CaC2O4↓
Осад CaC2O4 розчиняється у мінеральних кислотах, але не розчиняється в ацетатній кислоті.
Мікрокристалоскопічна реакція. Сульфатна кислота, взаємодіючи з розчинними солями Кальцію, утворює характерні білі кристали гіпсу CaSO4 ⋅ 2H2O у формі голок. Можна виявити іони Ca2+ за наявності іонів Ba2+ і Sr2+.
Калій гексаціаноферат (ІІ) (фармакопейна реакція) осаджує іони Кальцію в присутності NH3 і NH4Cl з концентрованих розчинів або в присутності етанолу у вигляді білого осаду Кальцій-амоній гексаціаноферату (ІІ):
Ca2+ + 2NH4+ + [Fe(CN)6]4- → Ca(NH4)2[Fe(CN)6]↓
s-елементи ІІА групи
Слайд 17Розрахунок твердості води
Твердість води відображає вміст йонів Мg2+ та Ca2+
[T] =
- 1 ммоль⋅екв кальцієвої твердості дорівнює вмісту 20,04 мг Ca2+ в 1 л води
- 1 ммоль⋅екв магнієвої твердості дорівнює вмісту 12,15 мг Mg2+ в 1 л води
Тзаг = ТCa2+ + TMg2+ = Ттимч + Тпост
m – маса речовини, мг;
МЕ – молярна маса еквівалента речовини;
V – об’єм розчину, л
Т = 4 ммоль·екв/л – вода м’ягка
Т > 12 ммоль·екв/л – вода тверда
Слайд 18Способи усунення твердості води
Тимчасову твердість води усувають кип’ятінням:
Ca(HCO3)2 = СаСО3↓ +
Mg(HCO3)2 = MgCO3↓ + Н2О + СО2↑
Під час нагрівання йони Са2+ і Mg2+ виводяться з розчину у вигляді нерозчинних карбонатів.
Постійну твердість води, зумовлену сульфатами та хлоридами Кальцію і Магнію, неможливо усунути кип’ятінням, оскільки ці солі не розкладаються. Її усувають введенням у воду деяких реагентів — натрій карбонату (кальцинована сода), кальцій гідроксиду (вапняна вода), натрій ортофосфату. Одночасно усувається як тимчасова, так і постійна, тобто загальна твердість води. Наприклад: метод осадження
Ca(HCO3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О
MgSO4 + Na2СО3 = MgCO3↓ + Na2SO4
Ca(HCO3)2 + Na2СО3 = СаСО3↓ + 2NaHCO3
3CaSO4 + 2Na3РО4 = Са3(РО4)2↓ + 3Na2SO4
Існує іонообмінний метод
Слайд 21б
г
Бор: а – б – кристалічний бор; в – аморфний бор;
Зовнішній вигляд бору :
2 модифікації
в
а
Слайд 22Фізичні властивості
1. Із збільшенням атомної маси посилюється металічний характер елементів (В
2. Бор значно відрізняється за властивостями від інших елементів (високі т.пл., т.кип., твердість; інертність).
Решта елементів – легкоплавкі метали, In і Tl - дуже м'які
БОР
Неметал, проте властивості бору відрізняються від його важких аналогів. Хімічні і фізичні властивості бору і його складних сполук, в склад яких він входить, зближують його не з алюмінієм, а з силіцієм (діагональна подібність). Правило діагоналі – спостерігається подібність у властивостях простих і складних сполук бору, який має менший розмір атома і менший ступінь окиснення (+3), і силіцію, який має більші розміри, але і більший ступінь окиснення (+4).
Електронна оболонка бору має таку будову: 1s22s22p1
Бор схильний утворювати ковалентні зв’язки.
Не збуджений стан :
р-Елементи ІІІА групи
Слайд 23При утворенні хімічних сполук у атома бору проходять такі зміни –
БОР
Поширення в природі
Бура (борат натрію) — кристали, температура плавлення бури — tпл = 60,8°С. В природі — мінерал класу боратів, хімічний осад бороносних соляних озер. Кристали бури — прозорі, без кольору, мають жирний блиск, розчинні у воді.
Борна кислота -
Слайд 24БОР
В залежності від умов синтезу одержують аморфний або кристалічний бор.
Аморфний бор отримують за реакціями:
B2O3 + 3Mg → 3MgO + 2B
Na2B4O7 + 12Na → 4B + 7Na2O
Кристалічний бор отримують піролізом ВJ3, термолізом або відновленням BBr3 воднем на танталовій нитці при 1300-15000С, а також кристалізацією розплаву аморфного бору (наприклад, із розплаву Al)
Добування:
Слайд 25Бор хімічно інертний
З киснем він реагує при температурі вищій за 7000С
4В + 3О2 → 2В2О3
2. При ще вищій температурі бор реагує з азотом, хлором:
2B + N2 → 2BN
2B + 3Cl2 → 2BCl3
3. З металами взаємодіє з утворенням боридів.
4. Розбавлені кислоти на бор не діють. Нітратна кислота окиснює бор до ортоборної кислоти:
5.Сплавлення бору з лугами в присутності окисника приводить до одержання боратів:
В + NаОН + Н2 О2 = NаВО2 + Н2О
БОР Хімічні властивості
Слайд 26Гідриди бору – борани мають склад, подібний із складом вуглеводнів. Так,
Борани отримують дією кислот і води на бориди деяких металів:
Mg3B2 + 6HCl → B2H6 + 3MgCl2
Борани – безколірні гази і летючі рідини, рідше тверді речовини.
На повітрі суміш боранів самозапалюється з утворенням Н2О і В2О3, а при їх взаємодії з водою утворюється борна кислота і молекулярний водень:
В2Н6 + 6Н2О → 2Н3ВО3 + 3Н2↑
БОР Хімічні властивості
Слайд 27
ОКСИГЕНОВМІСНІ СПОЛУКИ БОРУ
До числа найважливіших кисневмісних сполук бору відноситься ортоборна кислота
Н3ВО3 ↔ НВО2 + Н2О
4НВО2 ↔ Н2В4О7 + Н2О
Н2В4О7 ↔ 2В2О3 + Н2О
Процес дегідратації Н3ВО3 оборотний
БОР Хімічні властивості
Структурна формула борної кислоти
Кристалічна борна кислота
3% розчин борної кислоти (антибактеріальний засіб)
Слайд 28
Ортоборна кислота являє собою типовий слабкий електроліт. Кислотні властивості виражені слабко.
В(ОН)3 + Н2О ↔ В(ОН)4– + Н+
Борна кислота веде себе як трьохосновна в присутності сульфатної кислоти з етанолом і утворює борно-етиловий ефір:
B(OH)3 + 3C2H5OH = B(OC2H5)3↑ + 3H2O
Борно-етиловий ефір – летка сполука і забарвлює полум’я в характерне зелене забарвлення
Кислота борна
Хімічні властивості
Слайд 29Тетраборна кислота у вільному стані невідома Н2В4О7
Її солі
Борати утворюються при нейтралізації борної кислоти:
Тетраборати розчинні у воді, тому гідролізуються :
Тетраборати взаємодіють з сульфатною кислотою:
Тетраборат натрію (бура)
Хімічні властивості
Слайд 30Бор з галогенідами утворює всі чотири тригалогеніди. При звичайних умовах це
Галогеніди бору при гідролізі утворюють дві кислоти:
BCl3 + 3H2O ↔ B(OH)3 + 3HCl
2BF3 + 3H2O → B(OH)3 + HBF4 + 2HF
Фтороборна кислота сильніша за плавикову (HF) та існує тільки у розчині. При спробі виділити HBF4 з розчину вона розпадається на HF і BF3. Проте солі тетрафтороборної кислоти – тетрафтороборати – стійкі
Галогеніди бору
Хімічні властивості
Слайд 32АЛЮМІНІЙ
Природні сполуки
Алюміній – найпоширеніший елемент, третє місце після кисню та кремнію.
Велика кількість алюмінію входить до складу різновидностей глини (вторинний мінерал). Основою глини є каолініт Al2O3∙2SiO2∙2H2O.
Слайд 33Добування металічного алюмінію електрохімічним методом
Технологічна стадія підготовки сировини:
1)очищення бокситу Al2O3∙zH2O
2) очищений розчин алюмінату натрію розбавляють водою для гідролізу: Na[Al(OH)4] + H2O → NaOH + Al(OH)3↓ і піддають “викручуванню”;
3) фільтрація кристалічного гідроксиду Al(OH)3∙aq і термічна обробка при температурі 1100-12000С → Al2O3;
4) електроліз Al2O3 (проводять при температурі 900-9500С; склад електроліту: 85-90% Na3AlF6, 10-15% Al2O3, сила струму 130000 А, напруга 4-5В) з метою одержання металічного алюмінію.
АЛЮМІНІЙ
Слайд 34Фізичні властивості алюмінію
Сріблясто-білий метал, дуже легкий, легкоплавкий (т.пл=6580С). Алюміній в чистому
Хімічні властивості алюмінію
На поверхні алюмінію є оксидна плівка:4Al + 3O2 → 2Al2O3
Взаємодіє з :
Алюміній, взаємодіючи з водою, витісняє водень:
2Al + 6H2O → 2Al(OH)3 + 3H2↑ (після зняття плівки)
Проявляє амфотерні властивості:
Не взаємодіє з конц. нітратною та сірчаною кислотами, тільки – при нагріванні
АЛЮМІНІЙ
Слайд 35 Оксид алюмінію (ІІІ) має кілька кристалічних модифікацій. Найважливіша модифікація α- Al2O3
Al2O3 належить до класичних амфотерних оксидів і дає два види сполук:
солі, в яких Al (ІІІ) виконує роль катіона
2) алюмінати, де Al (ІІІ) виконує роль аніоноутворювача
Амфотерні властивості
ОКСИД АЛЮМІНІЮ
Слайд 36Гідроксид алюмінію (ІІІ) добувають взаємодією розчинних солей Al(III) з аміаком:
Al2(SO4)3
Гідроксид Al(OH)3 розчиняється в кислотах і лугах, що свідчить про його амфотерність.
Розчинення в кислотах є наслідком процесу нейтралізації: 2Al(OH)3+3H2SO4→Al2(SO4)3+ 6H2O
Розчинення в лугах є наслідком процесу комплексоутворення:
Al(OH)3 + KOH → K[Al(OH)4]
Al(OH)3 + 3KOH → K3[Al(OH)6]
Алюмінати типу МеАlO2 утворюються при спіканні гідратованого в розчині Al(OH)3 з лугами або содою:
2Al(OH)3 + Na2CO3 → 2NaAlO2 + CO2 + 3H2O
ГІДРОКСИД АЛЮМІНІЮ
Слайд 37При нагріванні відповідних гідратів відбувається гідроліз:
[Al(H2O)6]Cl3 → Al(OH)3 + 3HCl +
з поступовим перетворенням Al(ОН)3 в Al2О3.
Солі Al (ІІІ), утворені слабкими кислотами, піддаються гідролізу, й існувати в гідратованому стані не можуть. Із водних розчинів, які містять, наприклад, AlCl3 i Na2S сульфід алюмінію добути не можливо. Дійсно, AlCl3 i Na2S, сумісно перебуваючи у водному розчині, “доводять” гідроліз один одного до кінця, і сульфід Al2S3 не утворюється:
2AlCl3 + 3Na2S + 6H2O → 2Al(OH)3 + 3H2S + 6NaCl
СОЛІ АЛЮМІНІЮ












![Розрахунок твердості водиТвердість води відображає вміст йонів Мg2+ та Ca2+[T] = ммоль·екв/л- 1 ммоль⋅екв кальцієвої](/img/tmb/1/99395/f7844da76c429eab85fb378736dc0a4f-800x.jpg)

















![При нагріванні відповідних гідратів відбувається гідроліз:[Al(H2O)6]Cl3 → Al(OH)3 + 3HCl + 3H2Oз поступовим перетворенням Al(ОН)3](/img/tmb/1/99395/2c982c10cc5d1ab19deafcdc23cc71f3-800x.jpg)