Химическая термодинамика -
термодинамика химических процессов.
Описывает статистически значимые процессы (большое число частиц или случаев)
энергетические эффекты, сопровождающие физические и химические процессы
возможность, направления и предел самопроизвольного протекания процессов.

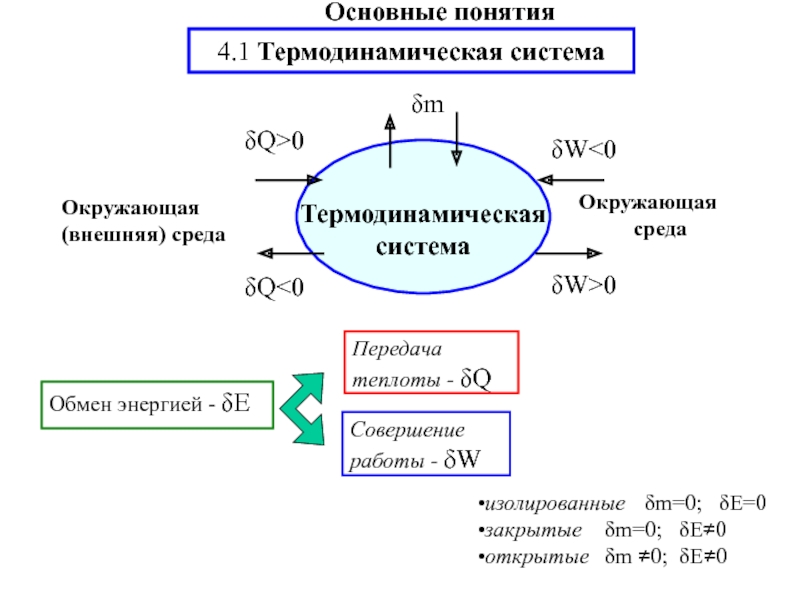
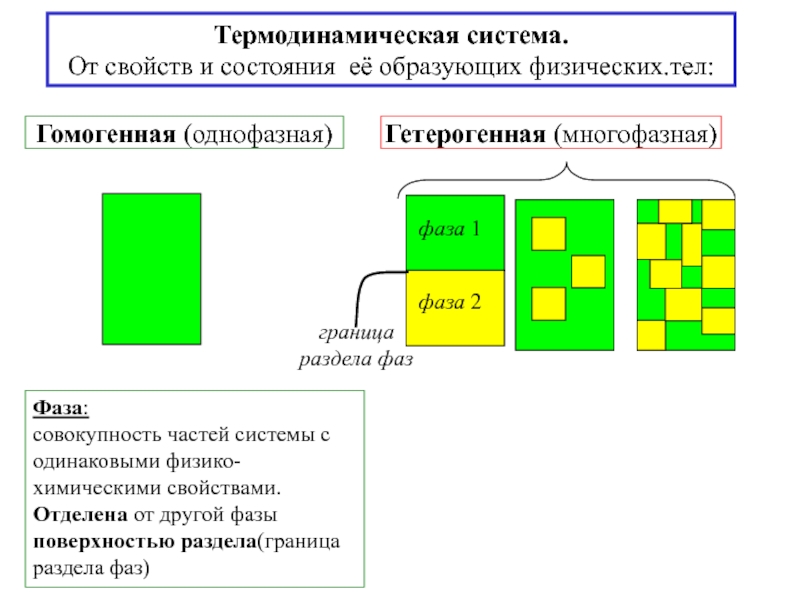

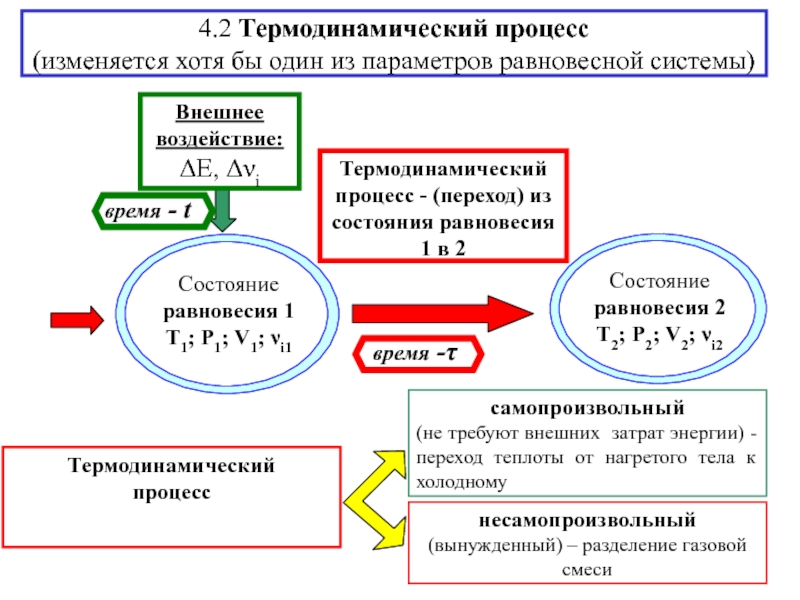
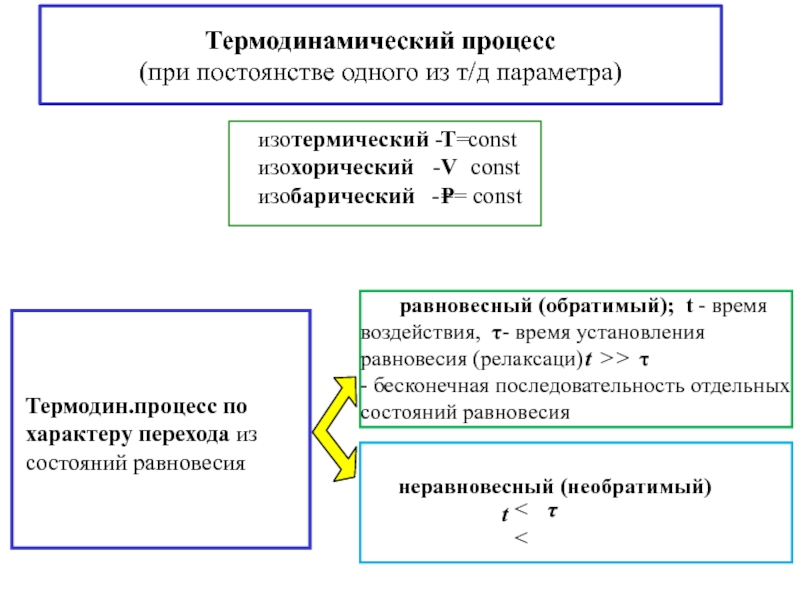
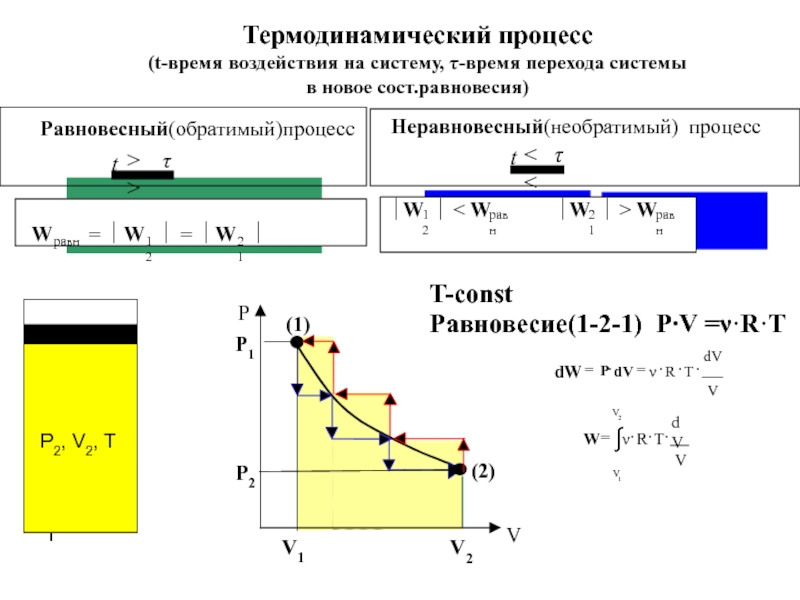
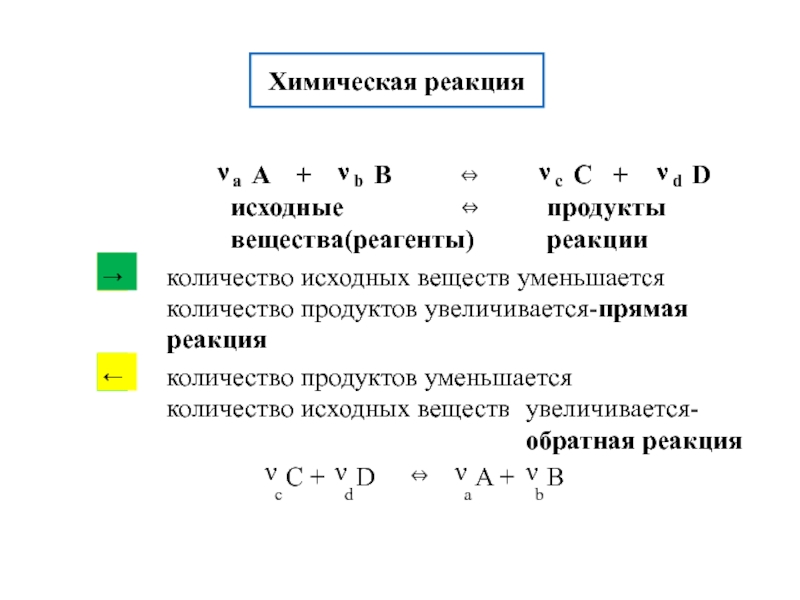
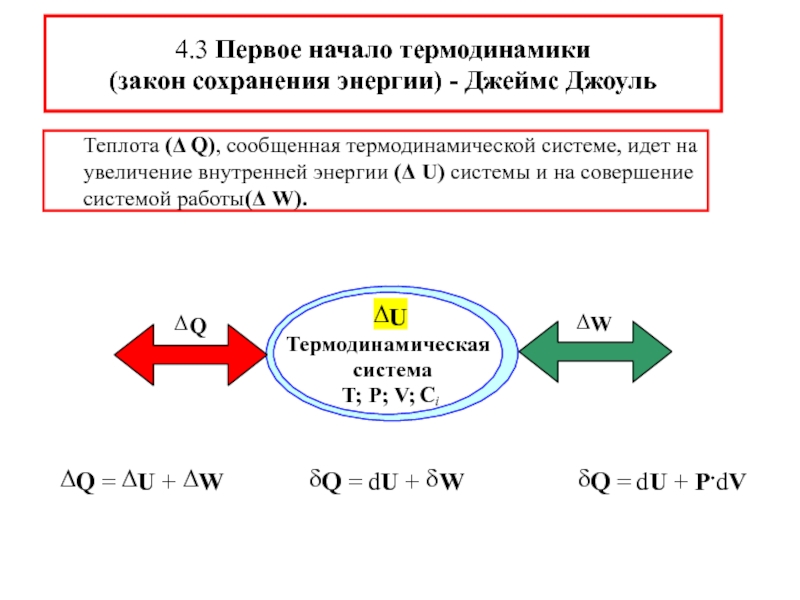
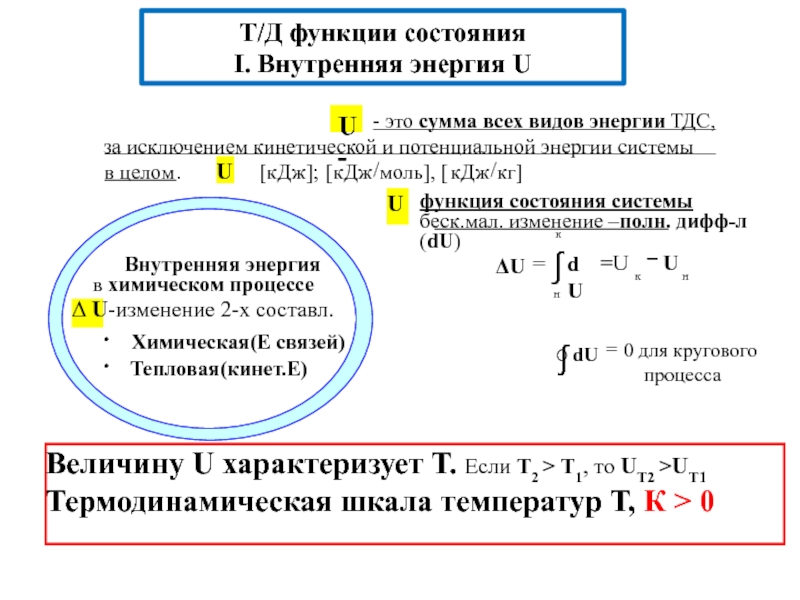
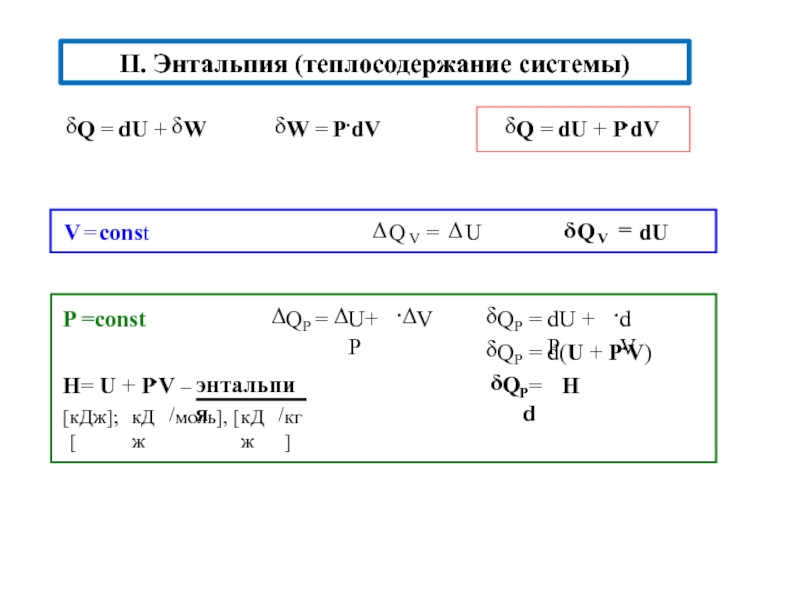


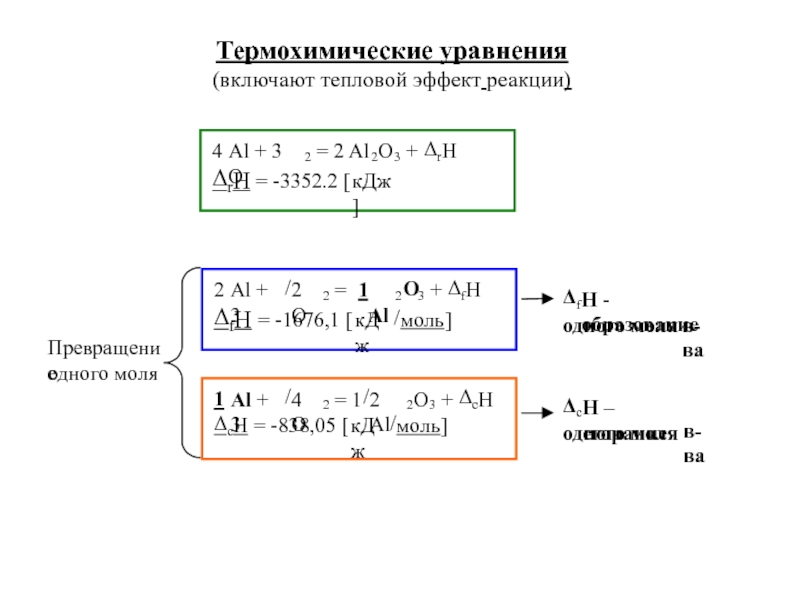



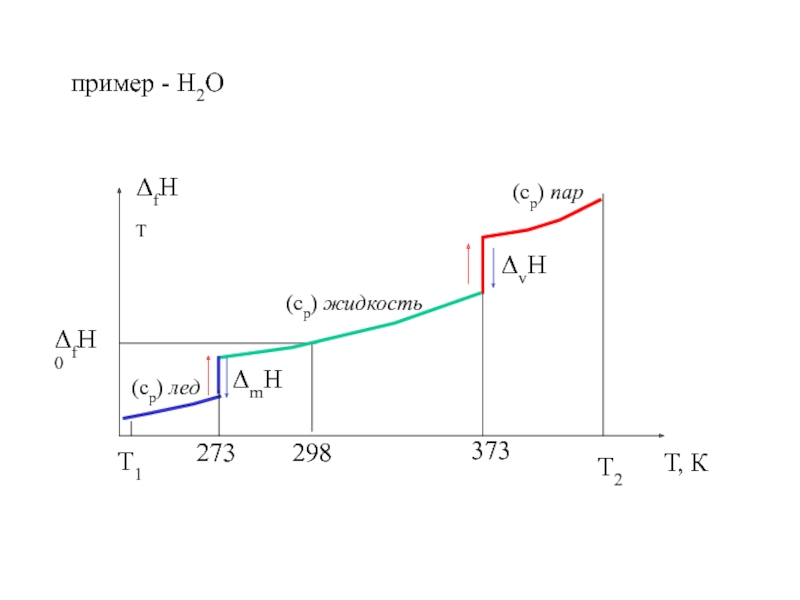




![S [Дж/К] стандартная - S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии](/img/tmb/5/436081/d10a5b529170f3226334486f8a29aec2-800x.jpg)











