- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов презентация
Содержание
- 1. Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов
- 2. План
- 3. 1. Типы химических связей
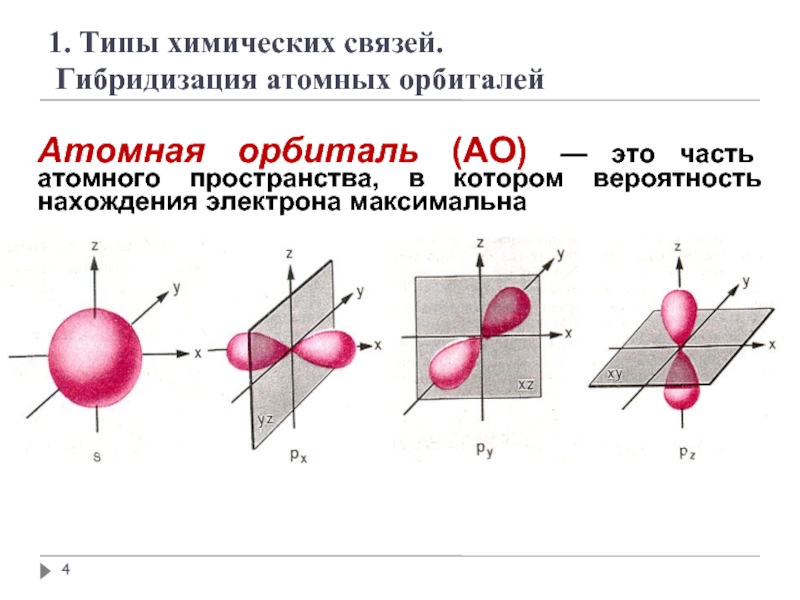
- 4. Атомная орбиталь (АО) — это часть атомного
- 5. Правило Хунда (Гунда): Орбитали данного
- 6. Электронное строение атома углерода С основное состояние
- 7. . Гибридизация − перестройка близких по
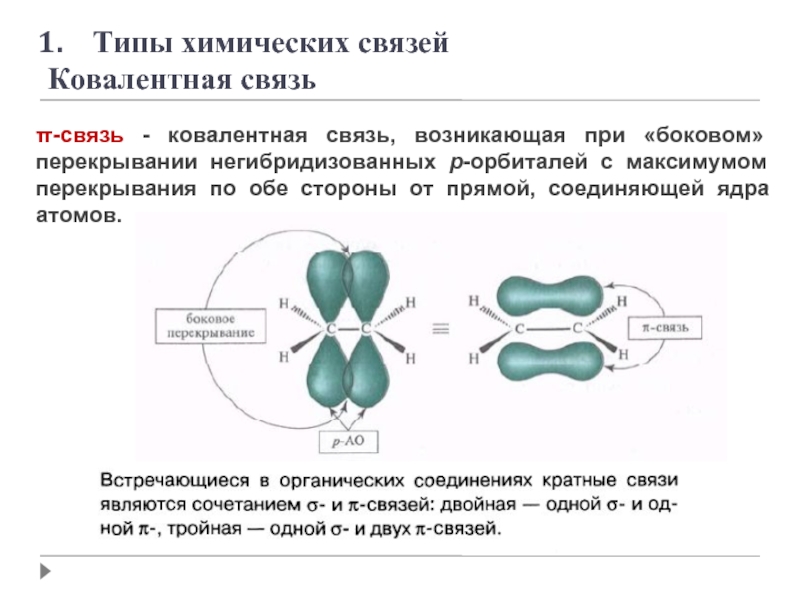
- 11. π-связь - ковалентная связь, возникающая при «боковом»
- 12. Типы химических связей Ковалентная связь. Характеристики
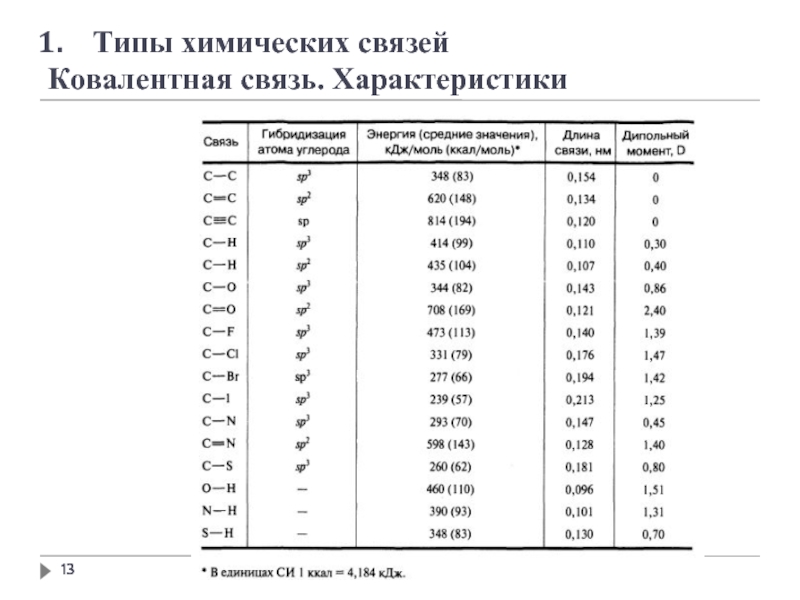
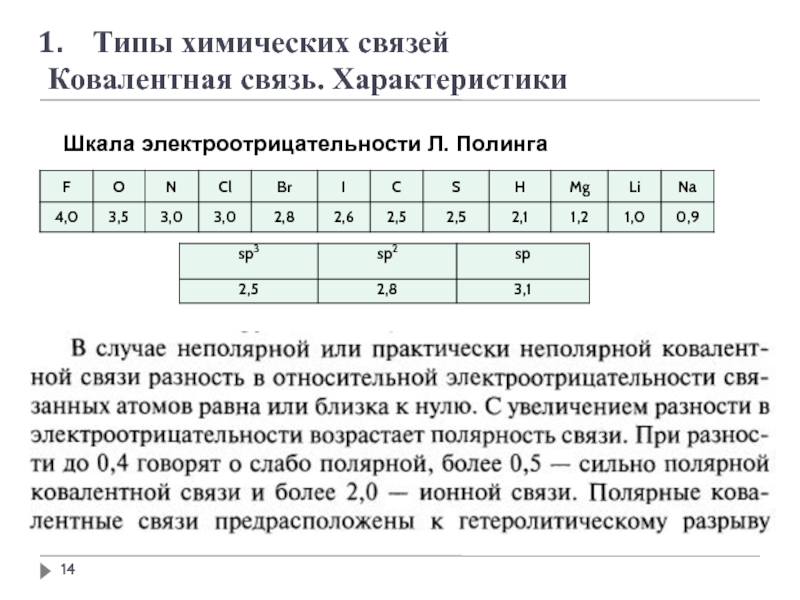
- 13. Типы химических связей Ковалентная связь. Характеристики
- 15. Типы химических связей Ковалентная связь. Характеристики
- 16. Типы химических связей Ковалентная связь. Характеристики
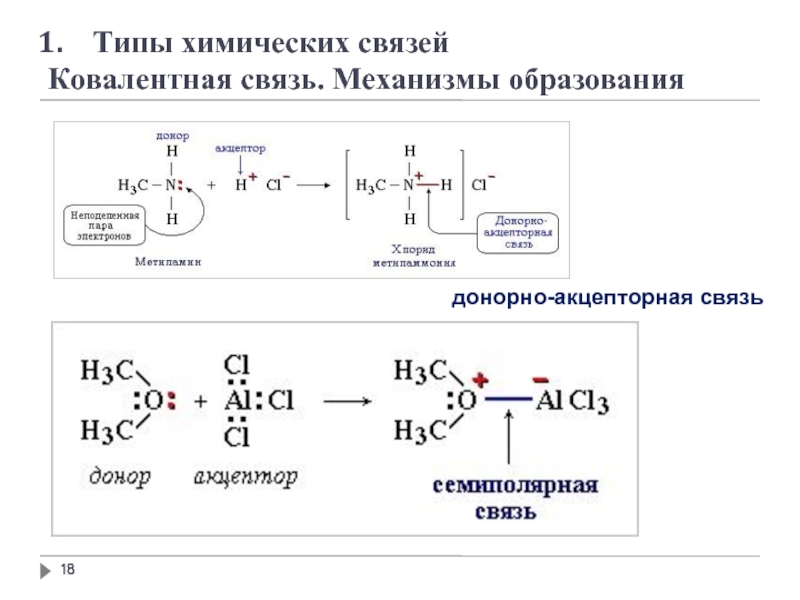
- 21. 1. Типы химических связей
- 22. 1. Типы химических связей
- 23. 2. Сопряжение. Сопряженные системы. Ароматичность
- 24. 2. Сопряжение. Сопряженные системы. Ароматичность
- 27. 4. Классификация реакций и реагентов
- 28. 4. Классификация реакций и реагентов
- 29. Приложение 1.
Слайд 1ХИМИЧЕСКАЯ СВЯЗЬ.
ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛЕ.
КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ
СТРУКТУРА И ФУНКЦИИ
Слайд 2План
1. Типы химических связей
2. Сопряжение. Сопряженные системы. Ароматичность
3. Взаимное влияние атомов
4. Классификация реакций и реагентов
Слайд 4Атомная орбиталь (АО) — это часть атомного пространства, в котором вероятность
1. Типы химических связей.
Гибридизация атомных орбиталей
Слайд 5Правило Хунда (Гунда): Орбитали данного подуровня заполняются сначала по
Правило Паули: на орбитали могут располагаться не более двух электронов с противоположными спинами
Принцип устойчивости: АО заполняются электронами в порядке повышения их энергетических уровней:
1s < 2s < 3s < 3p < 4s < 3d < 4p < 5s
Заполнение АО электронами
1. Типы химических связей.
Гибридизация атомных орбиталей
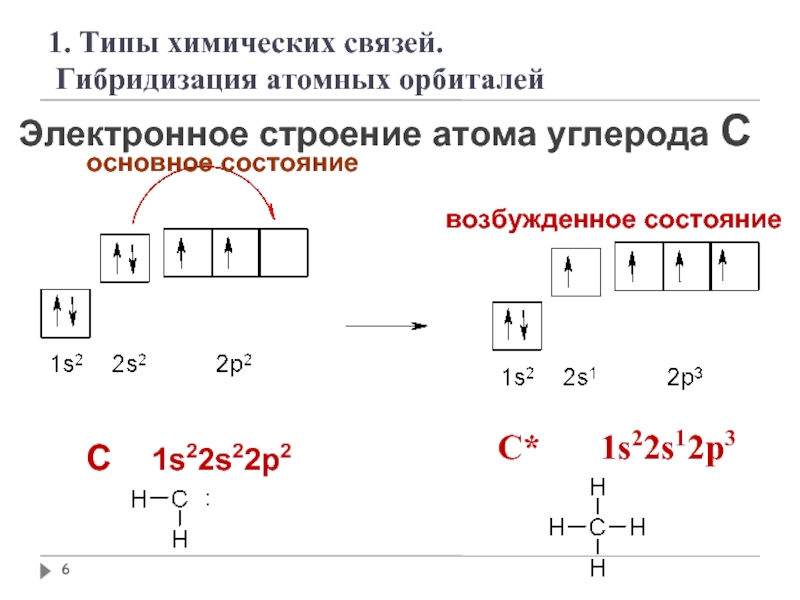
Слайд 6Электронное строение атома углерода С
основное состояние
возбужденное состояние
C 1s22s22p2
C*
1. Типы химических связей.
Гибридизация атомных орбиталей
Слайд 7.
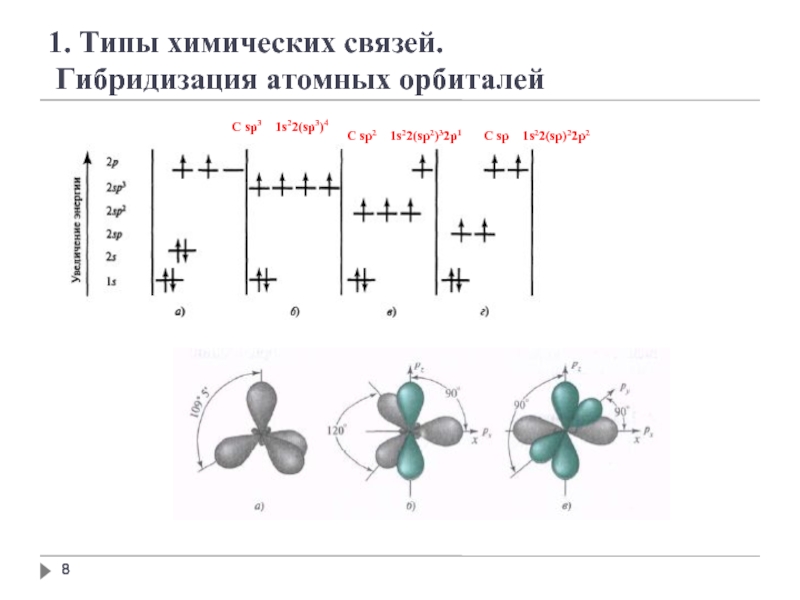
Гибридизация − перестройка близких по энергии орбиталей, в ходе которой
Гибридные орбитали обеспечивают более полной перекрывание при образовании связей.
1. Типы химических связей.
Гибридизация атомных орбиталей
Слайд 8
C sp3 1s22(sp3)4
C sp2 1s22(sp2)32p1
C
1. Типы химических связей.
Гибридизация атомных орбиталей
Слайд 9
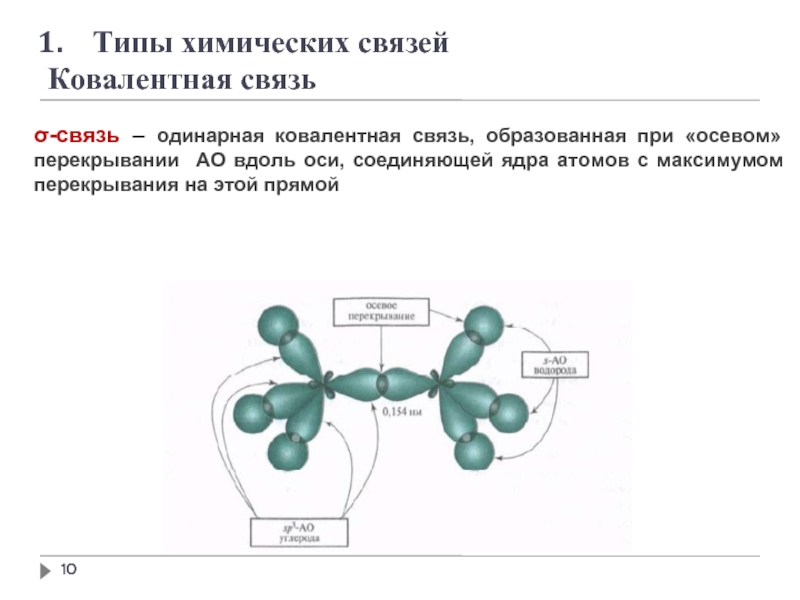
образуется путём обобществления пары электронов двух связываемых атомов.
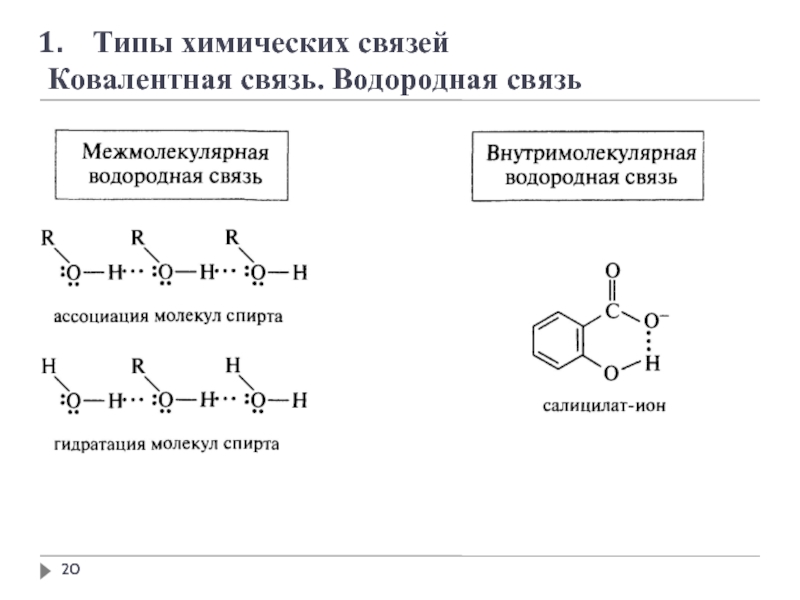
1. Типы химических связей
Ковалентная связь
Слайд 10
Типы химических связей
Ковалентная связь
σ-связь – одинарная ковалентная связь, образованная при
Слайд 11π-связь - ковалентная связь, возникающая при «боковом» перекрывании негибридизованных p-орбиталей с
Типы химических связей
Ковалентная связь