- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь. Валентность элементов в ковалентных соединениях. Степень окисления элементов презентация
Содержание
- 1. Химическая связь. Валентность элементов в ковалентных соединениях. Степень окисления элементов
- 2. ЛЕКЦИЯ №4 Тема: Химическая связь
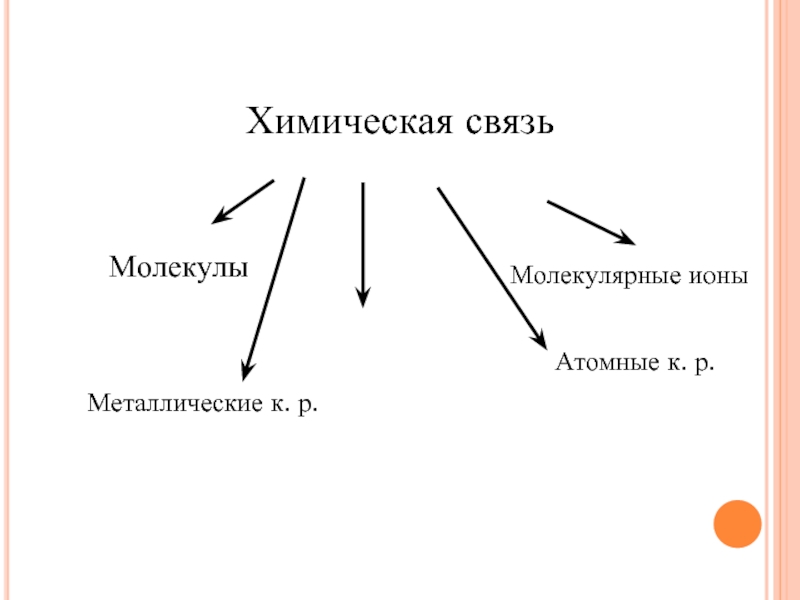
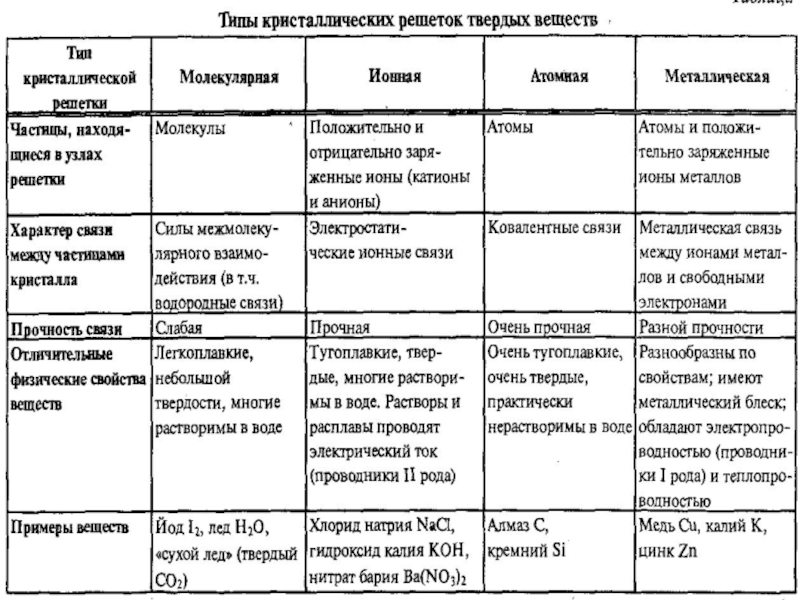
- 3. Химическая связь Молекулы Молекулярные ионы Ионные к. р. Атомные к. р. Металлические к. р.
- 4. ПОНЯТИЕ ВАЛЕНТНЫХ ЭЛЕКТРОНОВ
- 5. ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ Ковалентная Ионная Металлическая Водородная
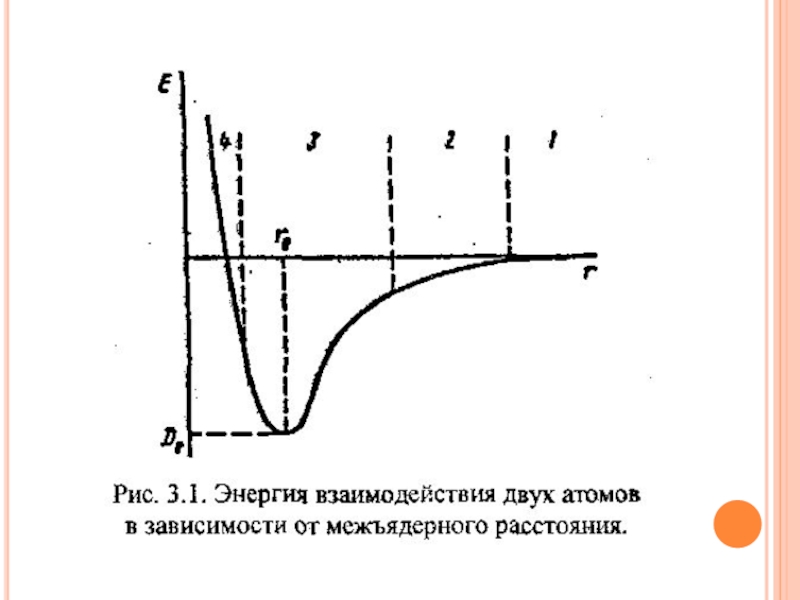
- 6. КОВАЛЕНТНАЯ СВЯЗЬ (ОБМЕННЫЙ МЕХАНИЗМ)
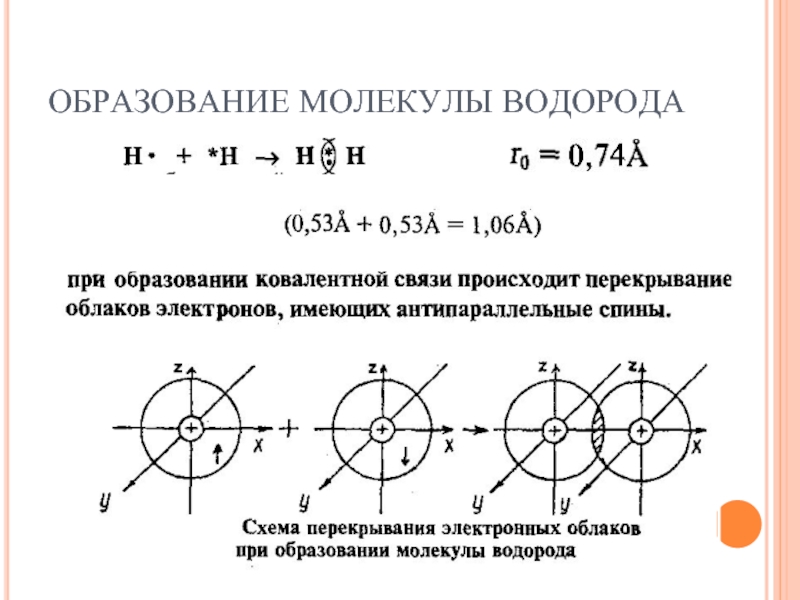
- 7. ОБРАЗОВАНИЕ МОЛЕКУЛЫ ВОДОРОДА
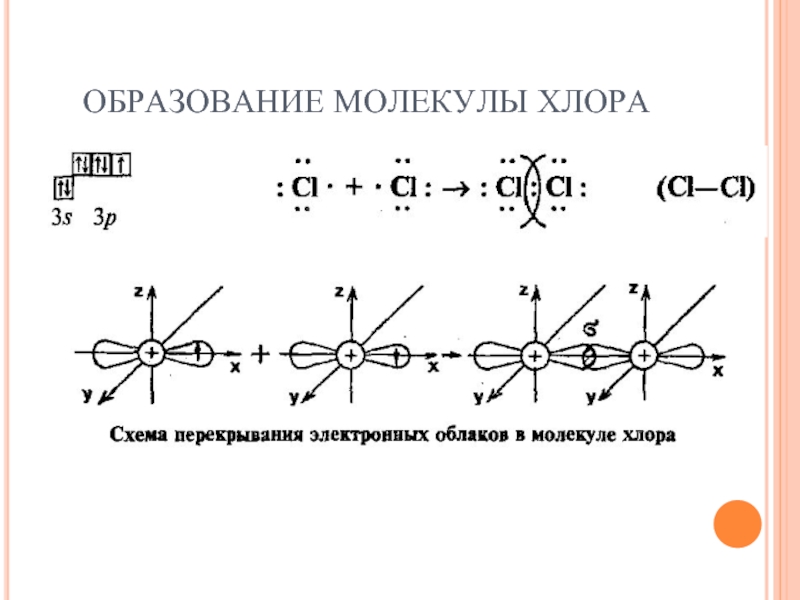
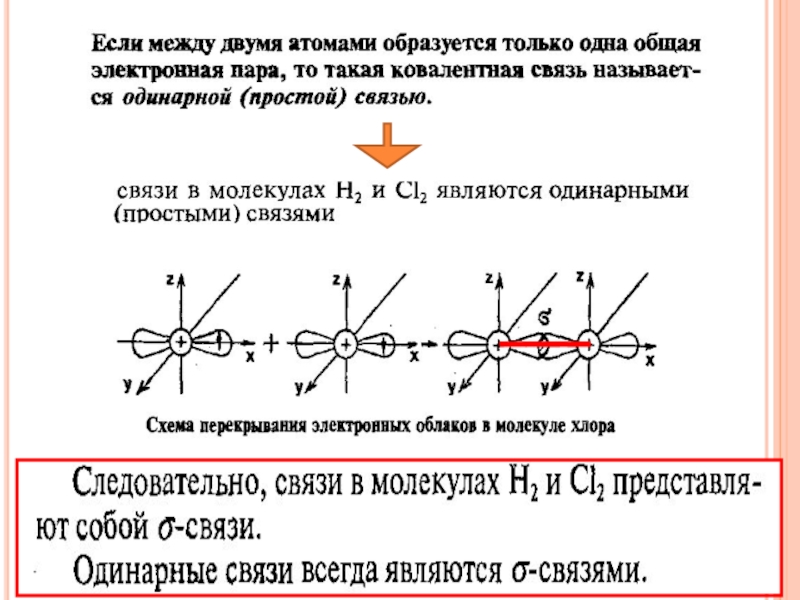
- 8. ОБРАЗОВАНИЕ МОЛЕКУЛЫ ХЛОРА
- 12. Двойная связь – связь между двумя
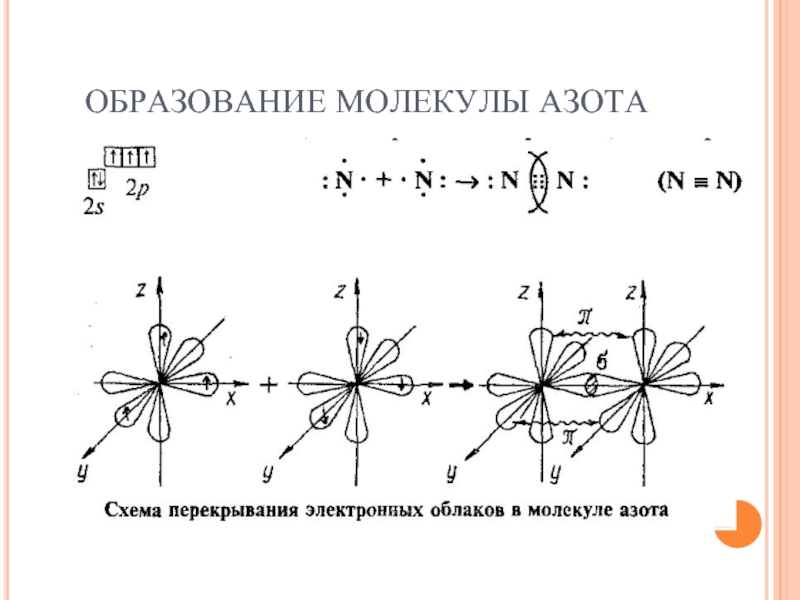
- 13. ОБРАЗОВАНИЕ МОЛЕКУЛЫ АЗОТА
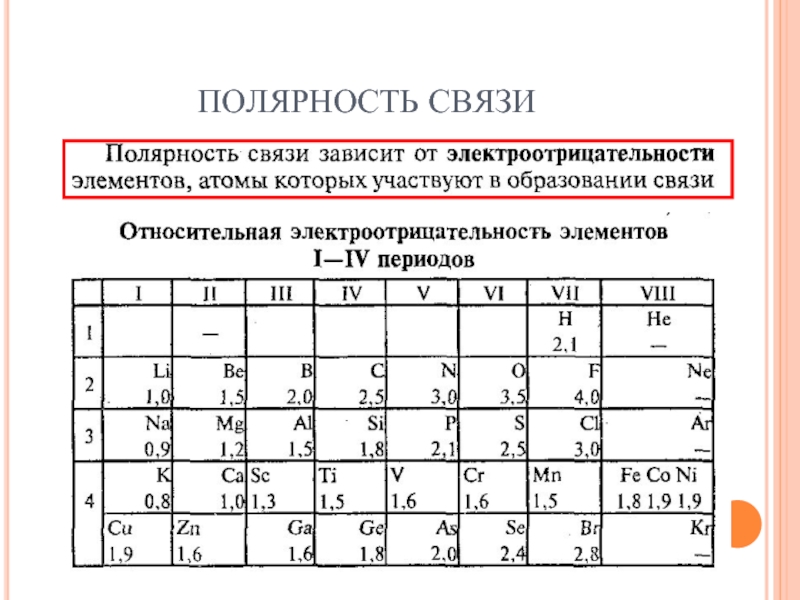
- 14. ПОЛЯРНОСТЬ СВЯЗИ
- 15. ПОЛЯРНОСТЬ СВЯЗИ
- 16. ПОЛЯРНОСТЬ СВЯЗИ
- 17. ПОЛЯРНОСТЬ СВЯЗИ Полярная молекула = диполь
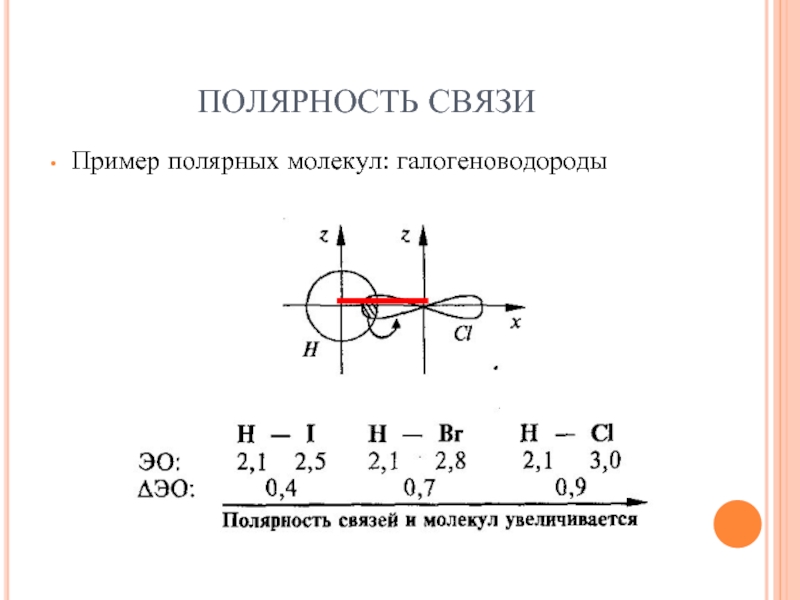
- 18. ПОЛЯРНОСТЬ СВЯЗИ Пример полярных молекул: галогеноводороды
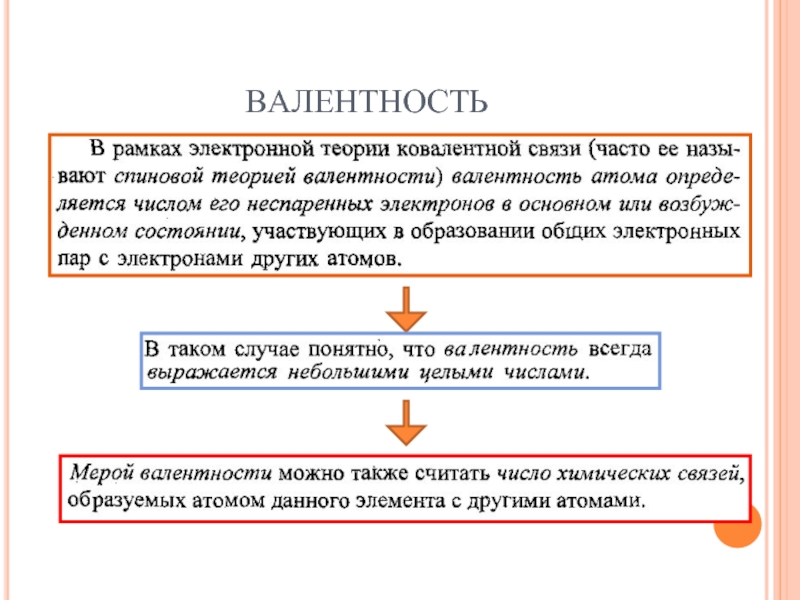
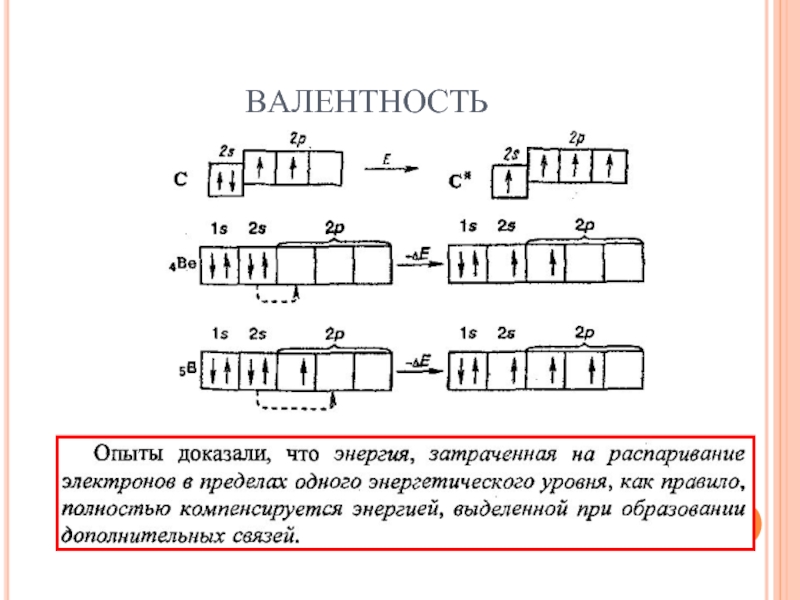
- 19. ВАЛЕНТНОСТЬ
- 20. ВАЛЕНТНОСТЬ Валентность должна Равняться числу неспаренных электронов
- 21. ВАЛЕНТНОСТЬ
- 22. ВАЛЕНТНОСТЬ
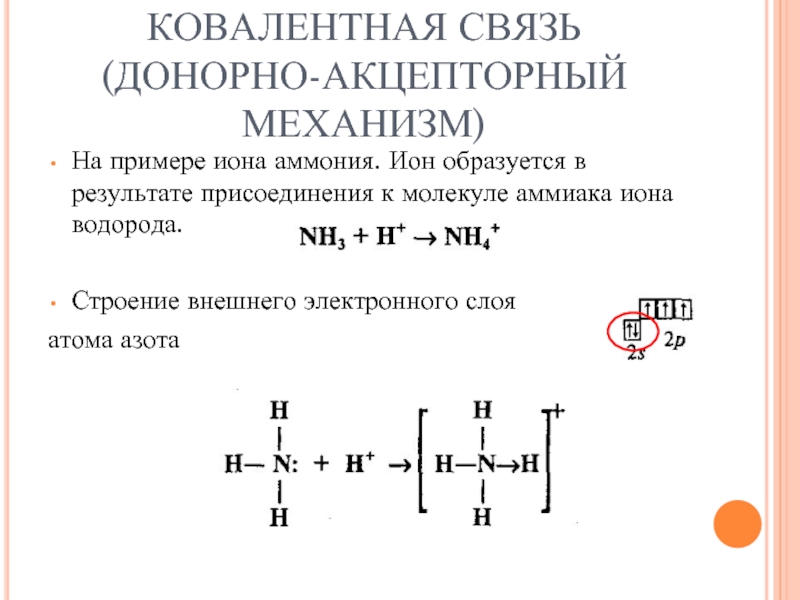
- 23. КОВАЛЕНТНАЯ СВЯЗЬ (ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ) !
- 24. КОВАЛЕНТНАЯ СВЯЗЬ (ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ) На примере иона
- 25. КОВАЛЕНТНАЯ СВЯЗЬ (ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ)
- 26. КОВАЛЕНТНАЯ СВЯЗЬ (ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ)
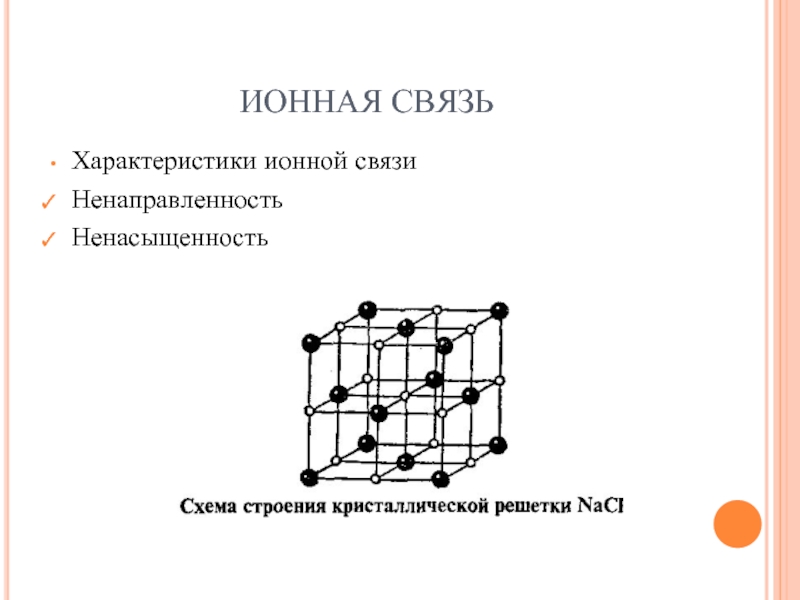
- 27. ИОННАЯ СВЯЗЬ
- 28. ИОННАЯ СВЯЗЬ Ионную связь можно рассматривать как
- 29. ИОННАЯ СВЯЗЬ На примере хлорида натрия
- 30. ИОННАЯ СВЯЗЬ Характеристики ионной связи Ненаправленность Ненасыщенность
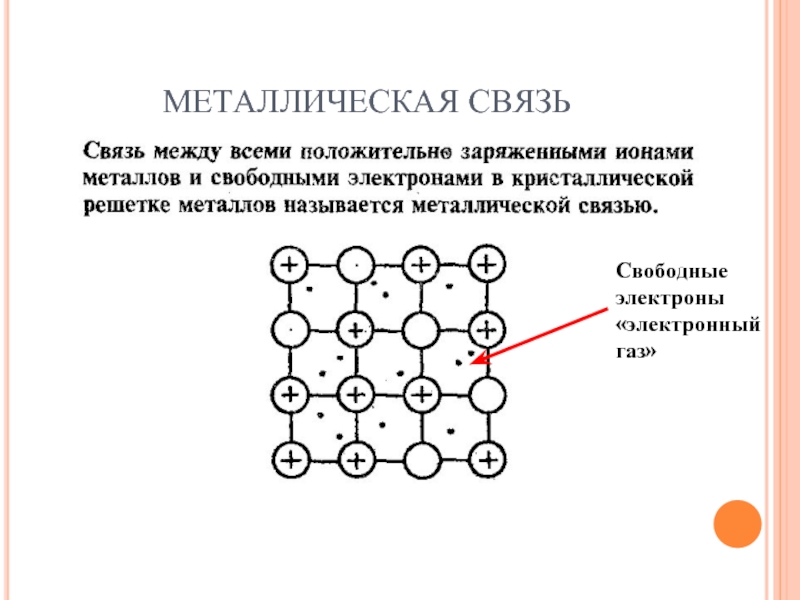
- 31. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ Свободные электроны «электронный газ»
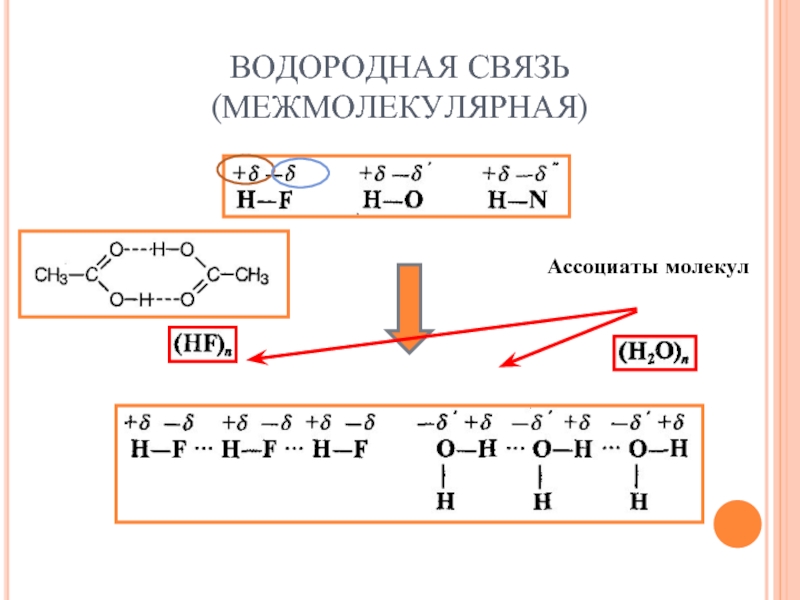
- 32. ВОДОРОДНАЯ СВЯЗЬ (МЕЖМОЛЕКУЛЯРНАЯ) Ассоциаты молекул
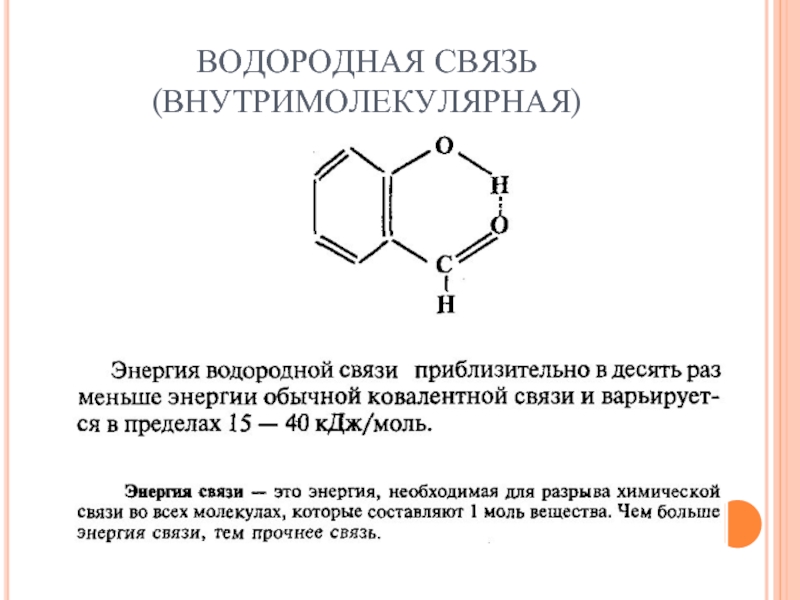
- 33. ВОДОРОДНАЯ СВЯЗЬ (ВНУТРИМОЛЕКУЛЯРНАЯ)
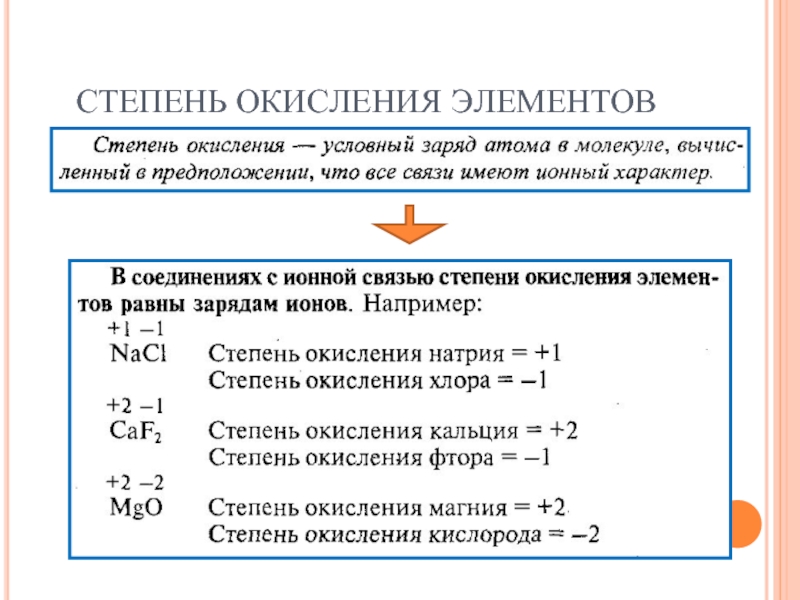
- 39. СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ
- 40. СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ
- 41. СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ Правила:
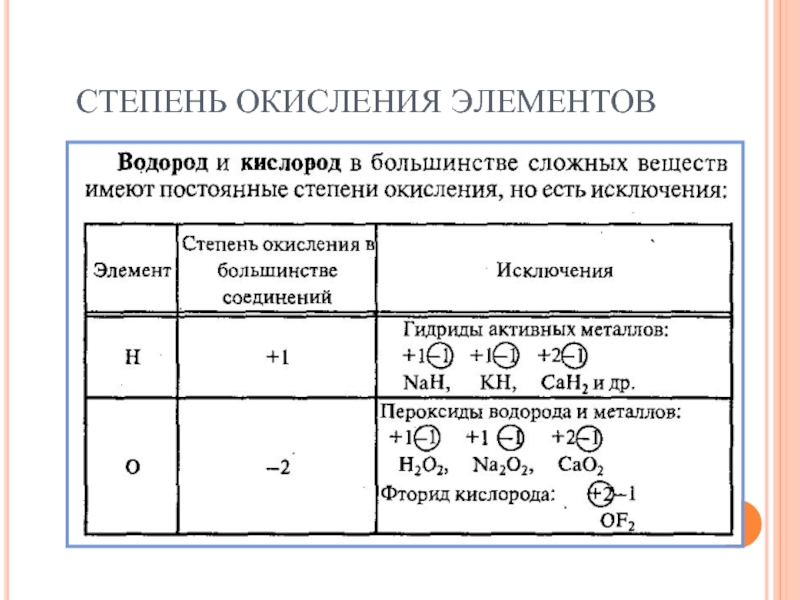
- 42. СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ Элементы с постоянной степенью окисления
- 43. СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ
- 44. СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ
- 45. СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ
Слайд 2ЛЕКЦИЯ №4
Тема:
Химическая связь
Валентность элементов в ковалентных соединениях
Степень окисления элементов
Слайд 6КОВАЛЕНТНАЯ СВЯЗЬ
(ОБМЕННЫЙ МЕХАНИЗМ)
Теория ковалентной связи: «Химическая связь возникает в результате образования
общих электронных пар между взаимодействующими атомами».
Слайд 12
Двойная связь – связь между двумя атомами образована двумя общими электронными
парами
Тройная связь - связь между двумя атомами образована тремя общими электронными парами
Тройная связь - связь между двумя атомами образована тремя общими электронными парами
Слайд 24КОВАЛЕНТНАЯ СВЯЗЬ
(ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ)
На примере иона аммония. Ион образуется в результате присоединения
к молекуле аммиака иона водорода.
Строение внешнего электронного слоя
атома азота
Строение внешнего электронного слоя
атома азота
Слайд 28ИОННАЯ СВЯЗЬ
Ионную связь можно рассматривать как крайний случай ковалентной полярной связи
Наименьшая
ЭО у Ме
Наибольшая ЭО у неметаллов