- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь в кристаллах презентация
Содержание
- 1. Химическая связь в кристаллах
- 2. Что читать? Карапетьянц М. Х., Дракин С.
- 4. Фазовая диаграмма воды Точка O - тройная
- 5. Конденсированное состояние Жидкости и твёрдые вещества имеют
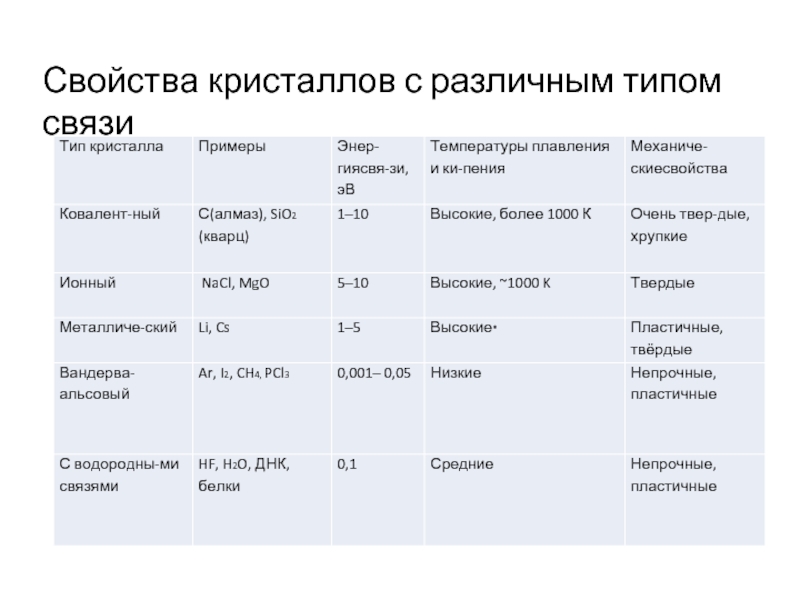
- 6. Таблица связей Взаимодействия, образующие конденсированные тела, (иначе – силы) подразделяют на пять типов:
- 7. Кристаллы и аморфные тела Кристалл – наличие
- 8. Ковалентные кристаллы Если макромолекулы состоят из повторяющихся
- 9. Кристалл = молекула Кварц – трёхмерная полимерная
- 10. Свойства ковалентных кристаллов Природа связи определяет свойства
- 11. Ионные кристаллы Притяжение ионов как разноименно заряженных
- 12. Ионные кристаллы При объединении разноименных ионов образуются
- 13. Поляризация Взаимодействие ионов всегда сопровождается взаимной поляризацией
- 14. Свойства ионных кристаллов Характеристикой для ионных кристаллов служит
- 15. Свойства ионных кристаллов Энергия ионной связи сопоставима
- 16. Молекулярные кристаллы Существуют вещества, молекулы которых сохраняются
- 17. Силы, создающие молекулярные кристаллы диполь-дипольное взаимодействие (иначе
- 18. Вандерваальсовы взаимодействия молекул а – диполь-дипольное взаимодействие
- 19. Вклад отдельных составляющих в энергию молекулярного взаимодействия Вандеваальсовые взаимодействия нельзя назвать химическими.
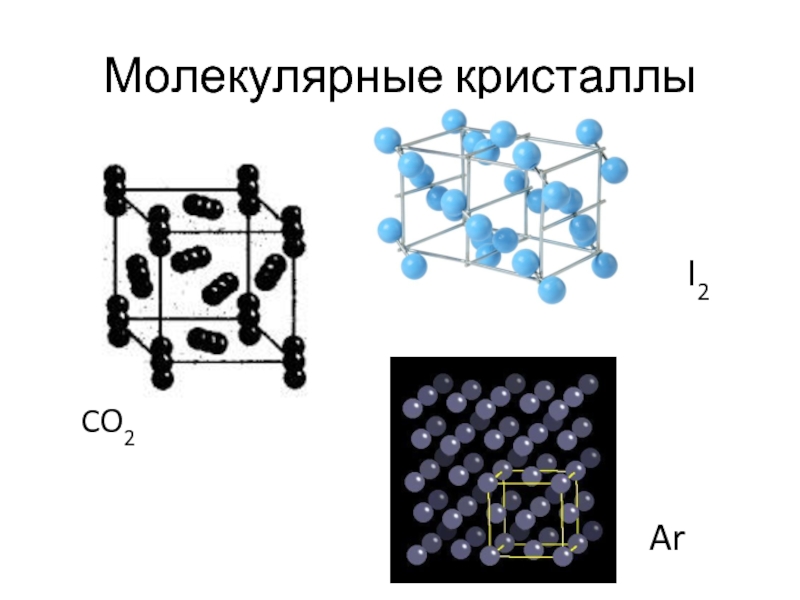
- 20. Молекулярные кристаллы CO2 I2 Ar
- 21. Молекулярные кристаллы При переходе в кристаллическое состояние
- 22. Водородная связь Химическая связь, образованная положительно поляризованным
- 23. Водородная связь Температуры кипения некоторых соединений водорода
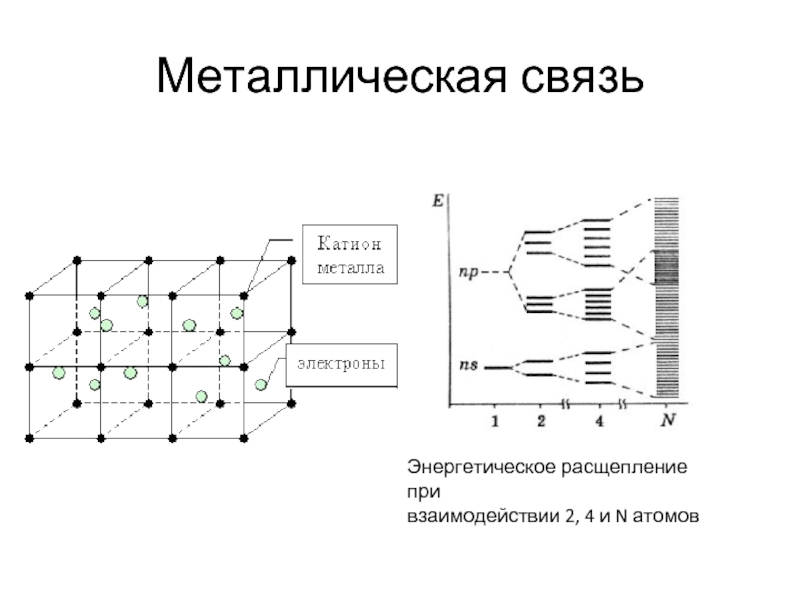
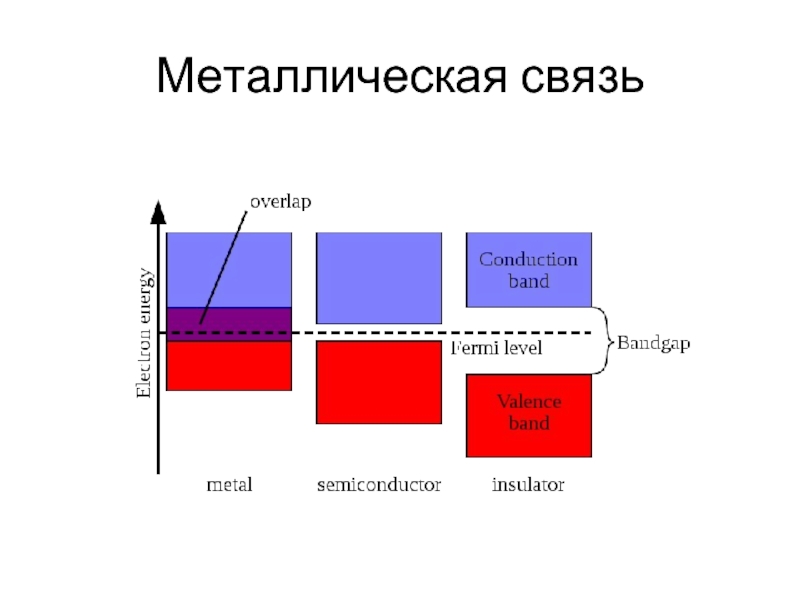
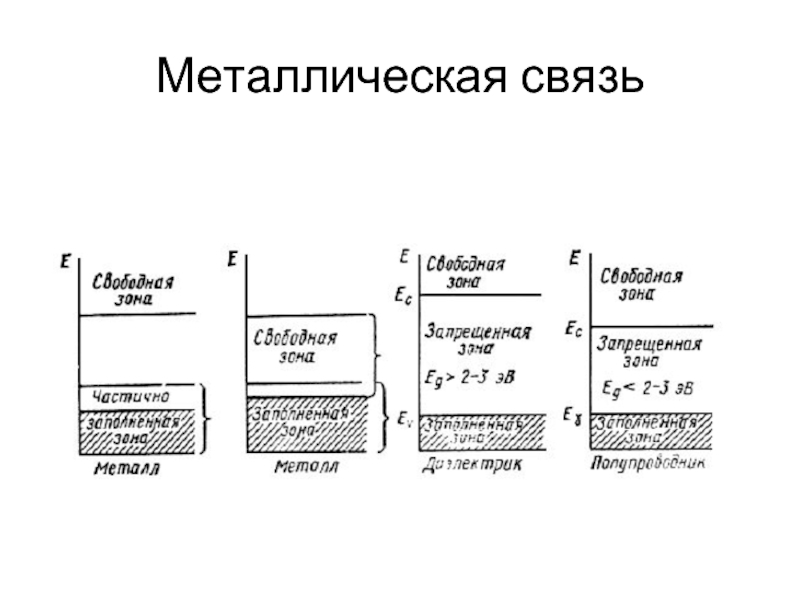
- 24. Металлическая связь Энергетическое расщепление при взаимодействии 2, 4 и N атомов
- 25. Металлическая связь
- 26. Металлическая связь
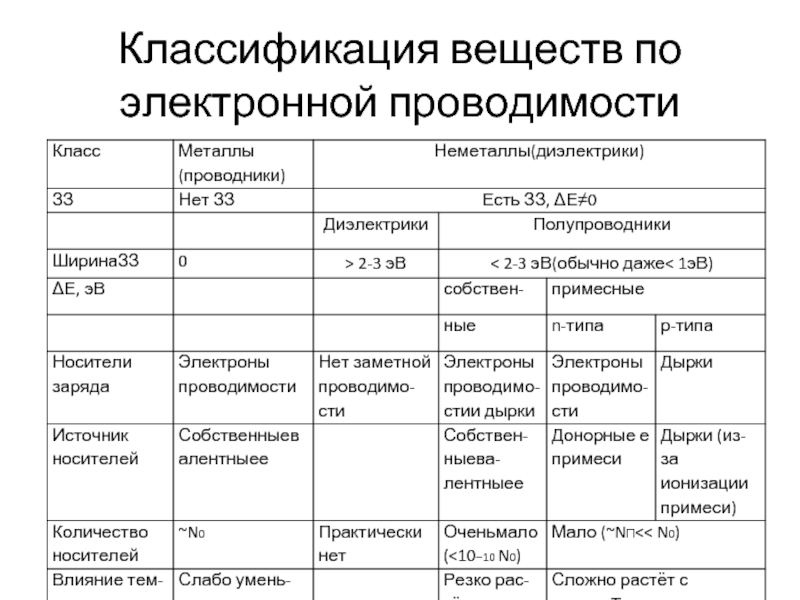
- 27. Классификация веществ по электронной проводимости
- 28. Металлы Природа металлического взаимодействия, как и всех
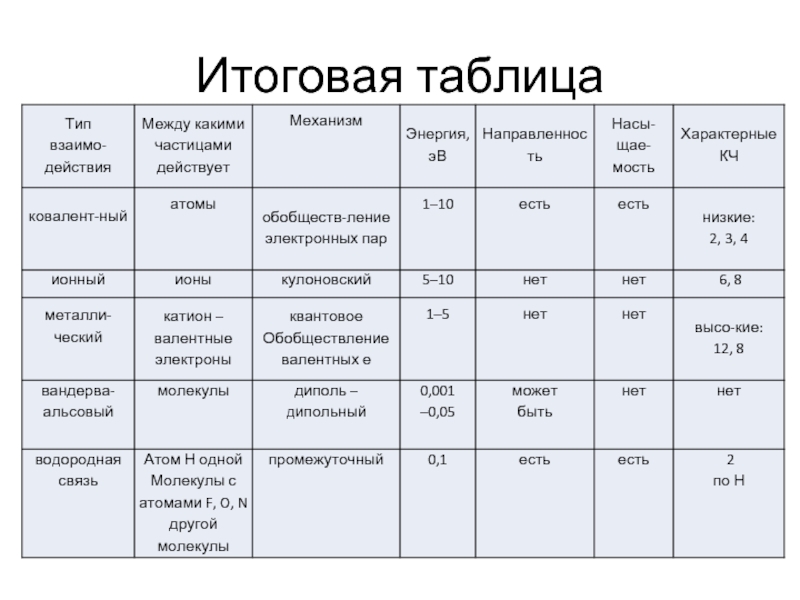
- 29. Итоговая таблица
- 30. Свойства кристаллов с различным типом связи
Слайд 2Что читать?
Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия.
Ахметов Н. С. Общая и неорганическая химия.
Чупахин А. П. Общая химия. Химическая связь и строение вещества.
Глинка Н.Л. Общая химия.
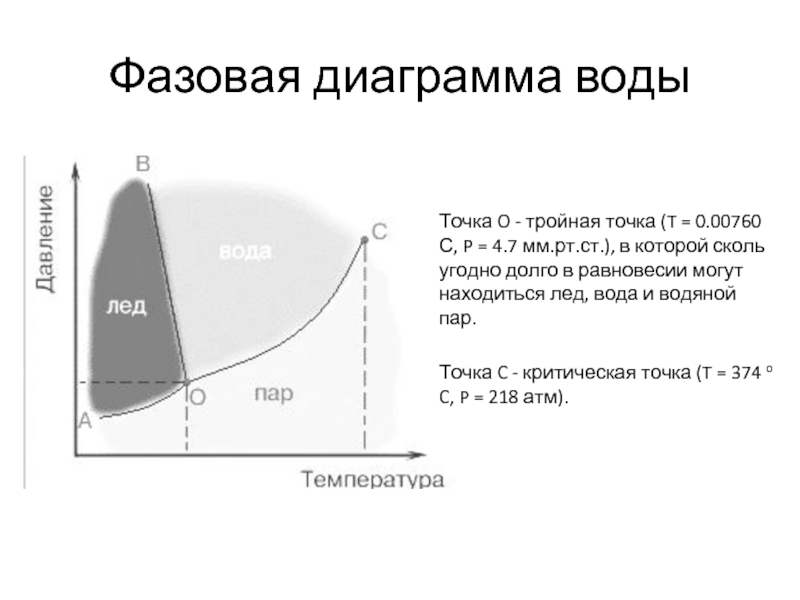
Слайд 4Фазовая диаграмма воды
Точка O - тройная точка (T = 0.00760 С,
Точка C - критическая точка (T = 374 o C, P = 218 атм).
Слайд 5Конденсированное состояние
Жидкости и твёрдые вещества имеют близкие плотности, существенно превосходящие плотности
Что объединяет частицы в конденсированное состояние?
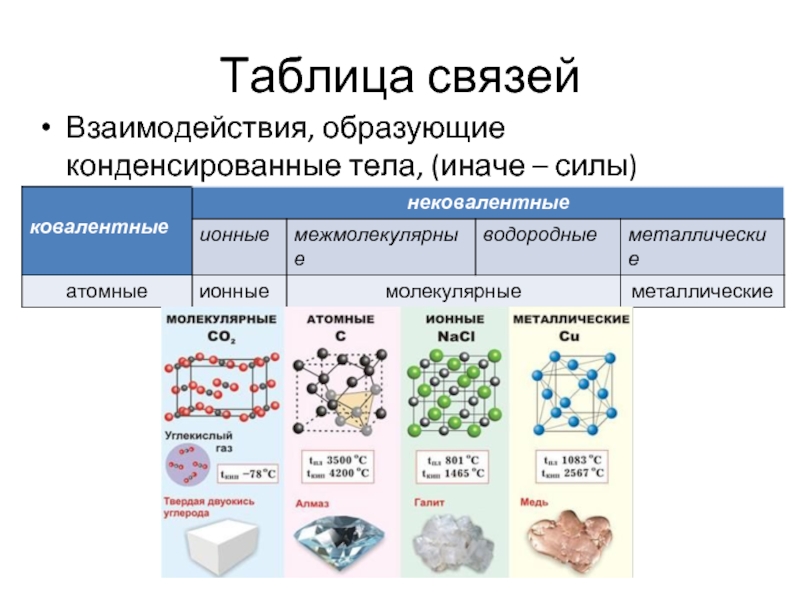
Слайд 6Таблица связей
Взаимодействия, образующие конденсированные тела, (иначе – силы) подразделяют на пять
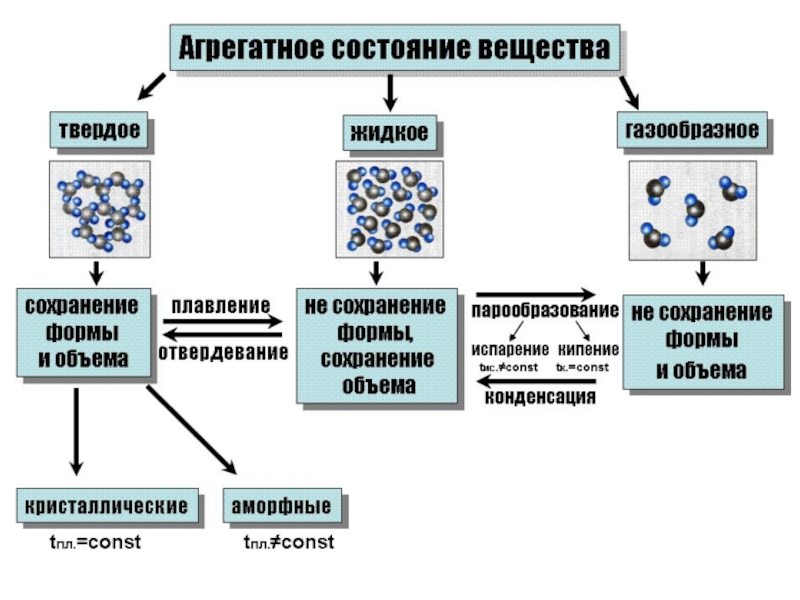
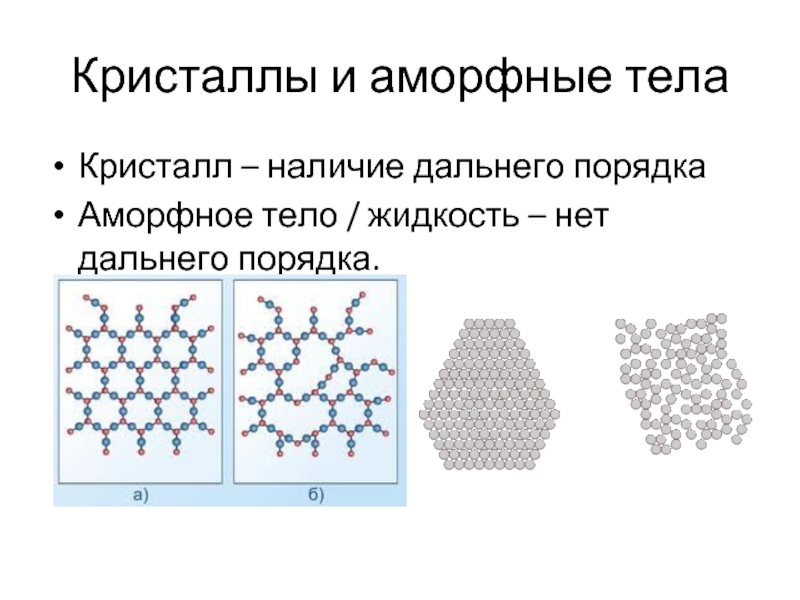
Слайд 7Кристаллы и аморфные тела
Кристалл – наличие дальнего порядка
Аморфное тело / жидкость
Слайд 8Ковалентные кристаллы
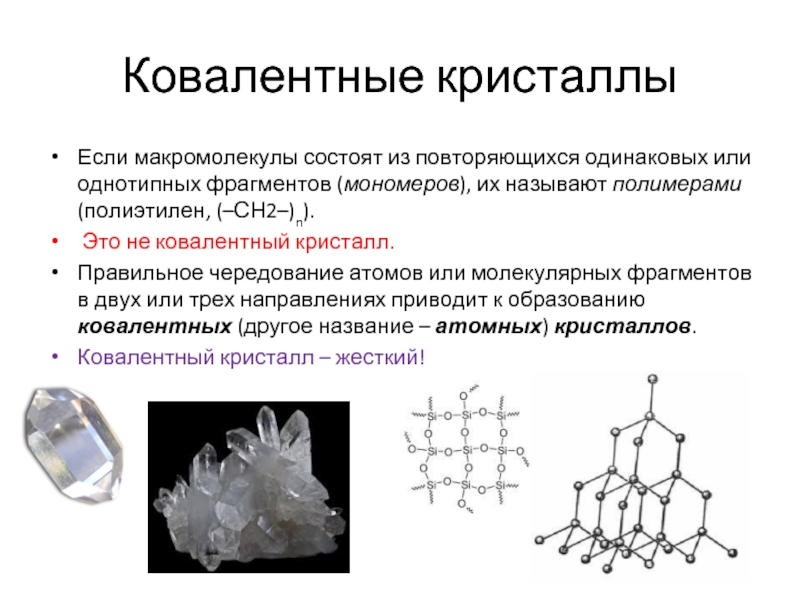
Если макромолекулы состоят из повторяющихся одинаковых или однотипных фрагментов (мономеров),
Это не ковалентный кристалл.
Правильное чередование атомов или молекулярных фрагментов в двух или трех направлениях приводит к образованию ковалентных (другое название – атомных) кристаллов.
Ковалентный кристалл – жесткий!
Слайд 9Кристалл = молекула
Кварц – трёхмерная полимерная макромолекула (–OSiO–)n
В кварце нет молекул
Ковалентные кристаллы, как и все молекулярные соединения, – стехиометрические. (четкое соотношение составляющих элементов)
Одно и тоже соединение может в твёрдом состоянии иметь различные структуры – полиморфные модификации
Слайд 10Свойства ковалентных кристаллов
Природа связи определяет свойства ковалентных кристаллов – физические и
Большая энергия ковалентной связи обуславливает прочность кристаллов, как к термическим, так и к механическим воздействиям. Высокие температуры плавления ( > 1000º С,), и большая твердость (10 у алмаза по Моосу).
Направленность ковалентной связи затрудняет механическую деформацию. Кристаллы обладают низкой пластичностью и высокой хрупкостью.
Слайд 11Ионные кристаллы
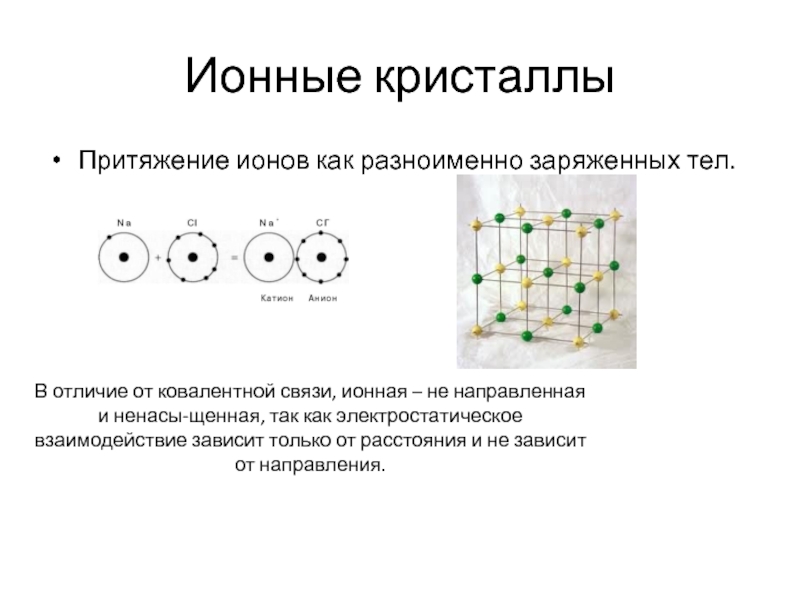
Притяжение ионов как разноименно заряженных тел.
В отличие от ковалентной
Слайд 12Ионные кристаллы
При объединении разноименных ионов образуются ионные кристаллы. Типичные примеры –
Структурные единицы здесь – ионы, объединяемые ионной (кулоновской) связью.
Слайд 13Поляризация
Взаимодействие ионов всегда сопровождается взаимной поляризацией – смещением положительно заряженных ядер
Поляризующее действие иона тем больше, чем больше его заряд и меньше размер.
Величина электронной поляризации (смещения электронного облака), наоборот, возрастает с увеличением размера частицы и удалением электронов от ядра.
Слайд 14Свойства ионных кристаллов
Характеристикой для ионных кристаллов служит хорошая растворимость в полярных растворителях
При растворении подобных соединений, как правило, выделяется энергия.
Слайд 15Свойства ионных кристаллов
Энергия ионной связи сопоставима с ковалентной. Кристаллы прочные –
Не направленность связи обеспечивает достаточно высокую пластичность ионных кристаллов (особенно при повышенных температурах и давлениях; хорошо известно, что подземные соляные пласты могут течь, как реки, конечно, с меньшими скоростями).
Проводят электричество (плохо – реально может перемещаться только незначительная часть ионов, не более ~10–6–10–10 ). Ионная проводимость существенно возрастает с увеличением температуры .
Слайд 16Молекулярные кристаллы
Существуют вещества, молекулы которых сохраняются при переходе в конденсированное состояние.
вода
пластик
«Сухой лед», СО2
Слайд 17Силы, создающие молекулярные кристаллы
диполь-дипольное взаимодействие (иначе – вандерваальсовое, в честь впервые
Ян Дидерик Ван-дер-Ваальс
Johannes Diderik van der Waals
Слайд 18Вандерваальсовы взаимодействия молекул
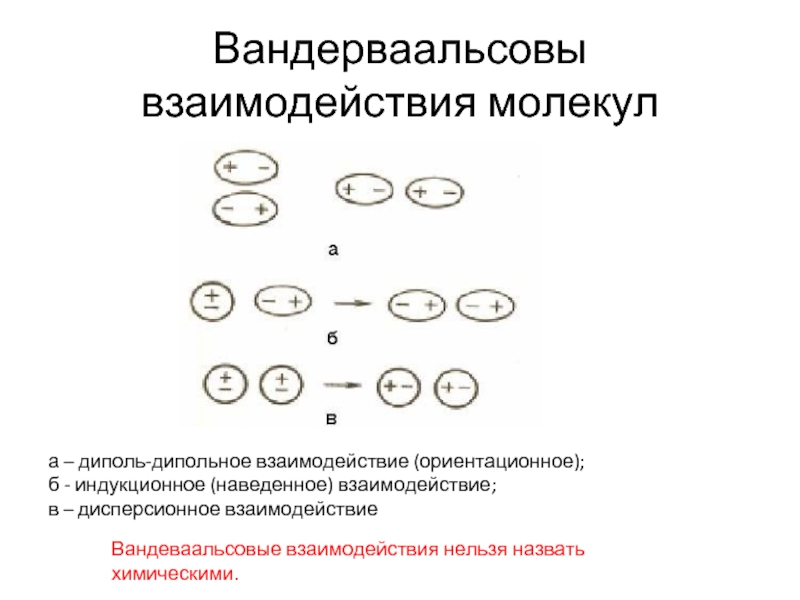
а – диполь-дипольное взаимодействие (ориентационное);
б - индукционное (наведенное) взаимодействие;
в
Вандеваальсовые взаимодействия нельзя назвать химическими.
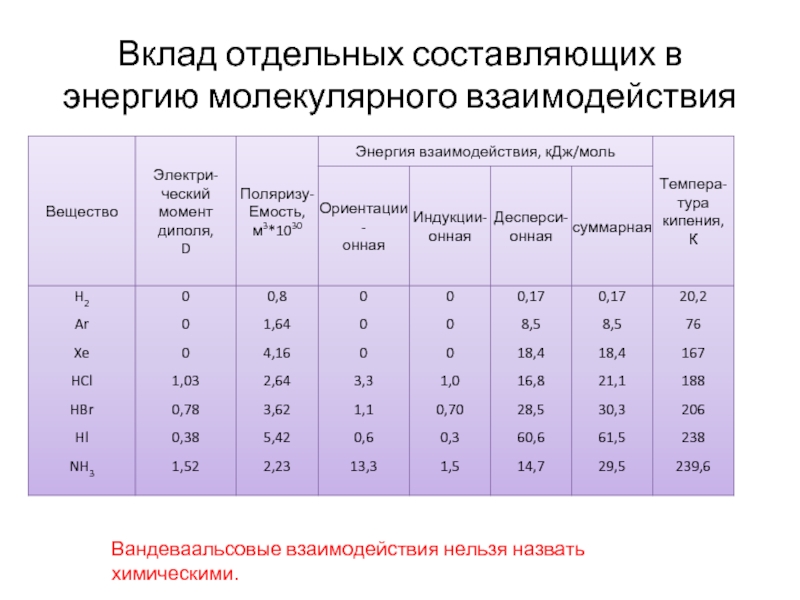
Слайд 19Вклад отдельных составляющих в энергию молекулярного взаимодействия
Вандеваальсовые взаимодействия нельзя назвать химическими.
Слайд 21Молекулярные кристаллы
При переходе в кристаллическое состояние характеристики ковалентных связей (длины, энергии,
Энергия межмолекулярного диполь-дипольного взаимодействия на 2–3 порядка меньше ковалентного, соединяющего атомы внутри молекул.
Вандерваальсовая связь слабая!
Молекулярные кристаллы непрочны термически и механически, температуры их плавления и кипения лежат в диапазоне ~ от 10 до 500 К.
При бóльших температурах энергия тепловых движений частиц превышает энергию слабых межмолекулярных связей, кристаллы плавятся и испаряются, многие такие соединения представляют собой при н. у. газы (H2, Ar, CH4, С2Н4, CO2, Cl2), или жидкости (С5Н12, Br2, PCl3, CHCl3).
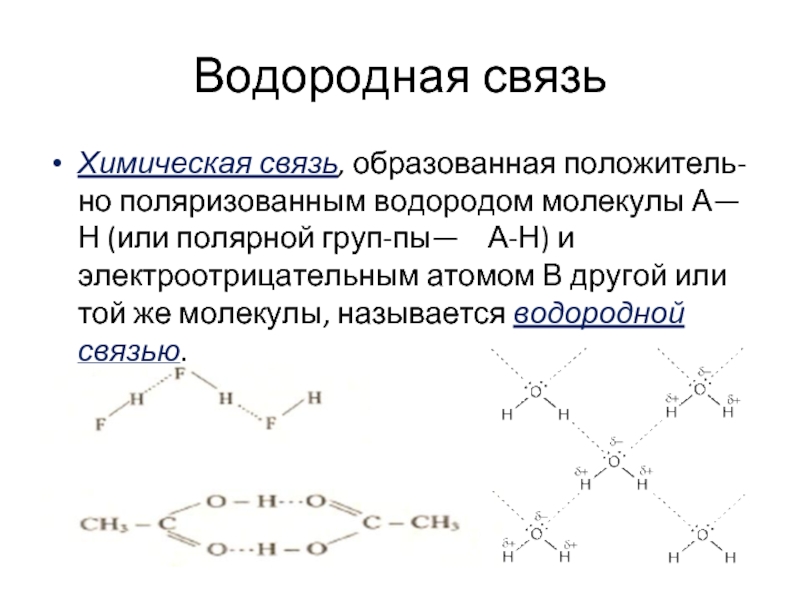
Слайд 22Водородная связь
Химическая связь, образованная положительно поляризованным водородом молекулы А—Н (или полярной группы—
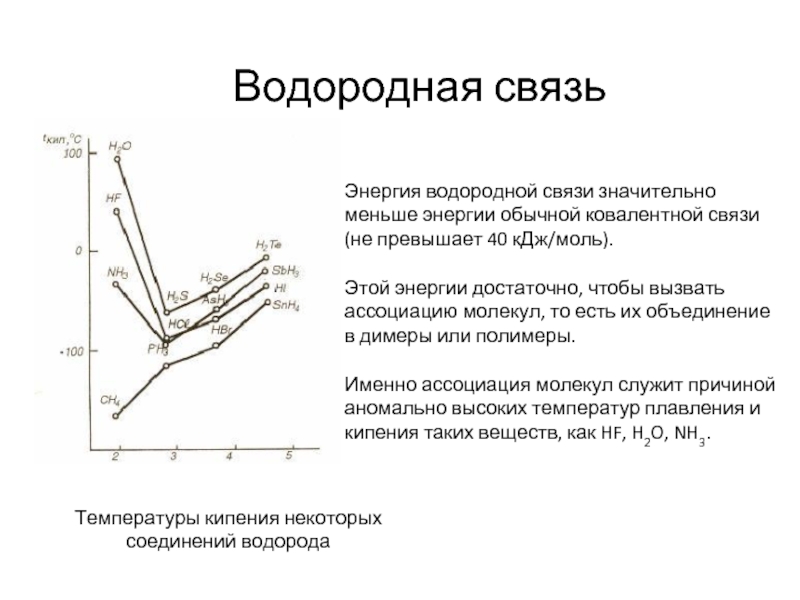
Слайд 23Водородная связь
Температуры кипения некоторых соединений водорода
Энергия водородной связи значительно меньше энергии
Этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры.
Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как HF, H2O, NH3.
Слайд 28Металлы
Природа металлического взаимодействия, как и всех других химических связей,– электромагнитная. Резкой
Большинство простых веществ (более 80 из примерно 100) – металлы, в ПС они находятся слева от диагонали B – Si – As – Te – At (для длинной формы, исключая Gе). Общеупотребительное разделение на «металлы» и «неметаллы» условно.
Энергия металлических связей сопоставима с ковалентными и ионными.
Температура кипения самого «непрочного» металла, Cs, равна 668 °С
В большинстве реальных металлов, особенно для d-и f- элементов, природа связи промежуточная между металлической и ковалентной. (температура плавления W равна 3420 °С, кипения ~5700 °С)
Металлы пластичные, так как связь не направленная.